Повышение эффективности хирургического лечения злокачественных новообразований век эпителиального происхождения при использовании метода аутофлуоресценции
Автор: Бочкарева А.Н., Егоров В.В., Смолякова Г.П., Банщиков П.А.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Глазные болезни
Статья в выпуске: 2 т.16, 2020 года.
Бесплатный доступ
Цель: оценить возможность аутофлуоресцентной диагностики (АФД) для определения границ опухоли и объема операции у пациентов с новообразованиями век эпителиального происхождения. Материал и методы. Исследование включало три части: анализ частоты рецидивов базально-клеточного рака век (БКР); анализ медицинских карт пациентов, которым на первичном приеме с целью дифференциальной диагностики между злокачественным и доброкачественным новообразованием проводилась их АФД; оценка точности определения границ опухоли при использовании визуальной диагностики и АФД на основе изучения морфологических срезов фрагментов опухоли, полученных после резекции века. Результаты. При сроках диспансерного наблюдения 1,5 года после хирургического удаления БКР с визуальной диагностикой его границ у 18% пациентов выявлен рецидив заболевания. Использование АФД для проведения дифференциальной диагностики между злокачественным и доброкачественным новообразованием кожи век и периорбитальной области показало, что метод является эффективным при первичной диагностике эпителиальных новообразований в поликлиническом звене. АФД границ БКР по сравнению с визуальным методом диагностики обладает большей точностью, не требует длительного времени проведения и не вызывает осложнений. Заключение. АФД может быть использована в офтальмоонкологии для раннего исследования кожи век и периорбитальной области, более точного определения границ распространенного патологического процесса, что гарантирует полное удаление опухоли и уменьшает риск ее рецидива.
Аутофлуоресцентная диагностика, базально-клеточный рак, границы опухоли
Короткий адрес: https://sciup.org/149135625
IDR: 149135625 | УДК: 617.77-006.6
Текст научной статьи Повышение эффективности хирургического лечения злокачественных новообразований век эпителиального происхождения при использовании метода аутофлуоресценции
Введение. Злокачественные новообразования кожи век и периорбитальной области являются одними из самых распространенных опухолей и представляют важную социальную проблему. В зависимости от источника развития опухоли выделяют базально-клеточный рак (БКР), сквамозно-клеточный рак, аденокарциному мейбомиевых желез [1, 2].
Наиболее распространенной злокачественной эпителиальной опухолью кожи, состоящей из базалоидных клеток, характеризующейся местно-деструктивным ростом и редким метастазированием, является БКР. Среди всех новообразований век и периорбитальной области БКР составляет 72-95% [1,3].
Многочисленными экспериментальными и эпидемиологическими исследованиями установлено, что возникновению БКР способствуют различные эндогенные и экзогенные факторы. Среди них ведущими считаются: наследственная предрасположенность к канцерогенезу, ультрафиолетовое излучение, воздействие ионизирующих излучений, химических канцерогенов, механические повреждения кожи, вирусные инфекции, а также дисфункции иммунной и эндокринной систем [4].
Максимальный пик выявления опухоли приходится на возрастную группу 60 лет и старше. Чаще поражается кожа век, реже — конъюнктива.
Проблема совершенствования методов диагностики и выбора оптимального хирургического лечения БКР признается актуальной в современной офтальмоонкологии. Это обусловлено, во-первых, неуклонным ростом заболеваемости БКР, во-вторых, частым рецидивированием опухолевого процесса после применения различных методов лечения.
Методики лечения БКР век в настоящее время крайне разнообразны, единого протокола лечения не существует. Однако базовым методом до сих пор остается хирургический с соблюдением основного принципа онкологии: максимально полное удалении опухоли при оптимальном сохранении здоровых тканей, структурного каркаса и основных функций век — защитной, слезоотводящей и косметической [5–8].
Пренебрежение этими принципами, с одной стороны, не дает уверенности в полном иссечении опухоли во время операции, с другой — удаление большого объема здоровой ткани, порой неадекватное, требует сложных и часто неоднократных пластических реконструкций век [3, 8–10].
На основании данных литературы при хирургическом лечении злокачественных новообразований век и периорбитальной области удаление опухоли осуществляют с захватом здоровой ткани, отступив от видимых визуальных границ новообразования 3 мм [3, 8]. Известно, что на дооперационном этапе всем пациентам при осмотре за щелевой лампой производится определение границ новообразований век. Однако этот подход для определения границ опухоли достаточно субъективный, в результате чего нередко возникают рецидивы опухоли, частота которых, по данным литературы, составляет от 1,2 до 42,8% [3,6, 7]. Более того, при многих клинических формах БКР в связи с размытостью границ визуальная их оценка представляется затруднительной. Поэтому изыскание новых, более точных методов диагностики границ БКР век остается весьма актуальной проблемой современной офтальмоонкологии.
Золотым стандартом, обеспечивающим принцип радикальности одновременно с максимальным сохранением здоровых тканей, в онкохирургии является гистологический контроль послойных срезов во время операции, на основе которых базируется объем оперативного вмешательства. Однако из-за возрастания длительности операции (5–6 часов), необходимости в приобретении дорогостоящих инструментов и оборудования, а также специальной подготовки хирургов со знанием патоморфологии такой подход пока не получил широкого распространения в клинической практике [9, 11].
Другим не менее перспективным направлением в реализации основных принципов онкологии, абластики и радикальности является аутофлуоресцентная диагностика (АФД), позволяющая не только проводить дифференциальную диагностику между злокачественными и доброкачественными новообразованиями, но и выявлять границы опухолевого роста, невидимые при визуализации [1, 12–14]. Известно, что опухолевые клетки при БКР способны на этапе роста селективно накапливать эндогенные флуорофоры, в частности НАДФ — пиридиннуклео-тид, флуоресцирующие в спектральном диапазоне 400–500 нм [3, 6].
Исследования в области использования АФД активно проводились в ФГБНУ «Научно-исследовательский институт глазных болезней» в 2006–2012 гг. при определении объема резекции по поводу БКР век и периорбитальной области. Авторы предполагали дополнительно во время диагностики использовать определенные регистрирующие установки с набором светофильтров и созданное специальное программное обеспечение для математического анализа флуоресцентных изображений [4, 9, 10]. Эти исследования привели к позитивным результатам, которые напрямую влияют на функциональный и косметический исход хирургического лечения, однако требовали дополнительных затрат и времени для анализа границ опухоли [2, 15–16].
Несмотря на то что АФД заслуживает широкого применения в офтальмоонкологии при хирургическом удалении БКР век и периорбитальной зоны, исследования, посвященные данной проблеме, остаются пока единичными.
Цель: оценить возможность АФД для определения границ опухоли и объема операции у пациентов с новообразованиями век эпителиального происхождения.
Материал и методы. Для реализации поставленной цели проведено исследование, которое состояло из трех частей.
Для подтверждения медико-социальной значимости проблемы в 1-й части работы проводили анализ частоты возникновения рецидивов БКР век у пациентов, оперированных в 2014–2016 гг. в Хабаровском филиале ФГАУ «НМИЦ “МНТК ‘Микрохирургия глаза’ им. акад. С. Н. Федорова”» Минздрава России. Объектом исследования явились медицинские карты стационарного и амбулаторного лечения 38 пациентов в возрасте от 40 до 75 лет (в среднем 62,4±7,6 года). Размеры новообразования варьировались от 13,7 до 18,9 мм. Всем этим пациентам по поводу БКР выполнили стандартную резекцию век в пределах здоровой ткани, отступив 3 мм от визуальных видимых границ опухоли, с одномоментной пластикой дефекта [3, 8].
Во 2-й части работы проанализирована 41 медицинская амбулаторная карта болезни пациентов за период 2018–2019 гг., которым на первичном приеме с целью дифференциальной диагностики между злокачественным и доброкачественным новообразованием кожи век и периорбитальной области проводилась их АФД. На основании различий в интенсивности флюоресценции при подозрении на злокачественное новообразование для подтверждения диагноза пациентам выполнялось морфологическое исследование материала биопсии в патологоанатомическом отделении КГБУЗ «Краевой клинический центр онкологии» (Хабаровск). В дальнейшем после верификации диагноза выбиралась тактика лечения. Всем пациентам с подтвержденным диагнозом злокачественного новообразования выполнена резекция век в пределах здоровой ткани, пациентам с доброкачественным новообразованием — радиохирургическое удаление с последующим морфологическим исследованием.
В 3-й части работы оценивали точность границ опухоли при использовании визуальной диагностики и АФД на основе изучения морфологических срезов фрагментов опухоли, полученных после резекции века. Объектом исследования явились 20 пациентов (20 глаз), средний возраст которых составил от 53 до 70 лет (в среднем 61,2±7,4 года). У всех пациентов до операции клинически и морфологически верифицирован БКР век. Наиболее часто новообразование локализовалось на нижнем веке (15 чел.), у 5 пациентов на верхнем веке. В зависимости от клинических особенностей БКР был представлен тремя формами: узловой (6 чел.), язвенной (12 чел.), склеродермоподобной (2 чел.).
Клинически для узловой формы БКР характерным был бледно-розовый цвет опухоли, широкое основание с бугристой поверхностью.
При язвенной форме БКР край язвы обычно приподнят, поверхность его покрыта роговыми и геморрагическими чешуйками.
Склеродермоподобная форма БКР была представлена атрофическим рубцом с мелкими опухолевидными узелками по его границам.
Диаметр новообразований БКР при всех его клинических формах варьировался от 11,8 до 17,3 мм.
Все пациенты до операции прошли осмотр онколога, стандартное общеклиническое предоперационное обследование, включая пальпацию регионарных лимфатических узлов, и офтальмологическое обследование (визометрия, тонометрия, биомикроскопия, офтальмоскопия).
В зависимости от метода диагностики границ опухоли пациенты были разделены на две группы. Основную группу наблюдения составили 10 пациентов, у которых идентификацию границ опухоли проводили методом АФД на аппарате «АФС-400» («Полироник», Россия). Прибор включает светодиоды с длиной волны излучения в фиолетовой области спектра (400±10 нм), которое поглощается эндогенными флуорофорами и вызывает их флуоресценцию. По данным В. Г. Лихванцевой (2007), именно свет в этом диапазоне задерживается слоем кожи толщиной до 2 мм [8].
АФД проводили при выключенном освещении с помощью очков с желтым фильтром. Для исключения попадания в глаз пациента светодиодного излучения его закрывали защитой для роговицы. Под действием данного спектра излучения БКР обычно не светится (возникает эффект «темного пятна») в отличие от здоровой кожи, приобретающей светлозеленое свечение. Линия раздела двух зон (темной и светлой) является границей новообразования.
Контрольную группу составили 10 пациентов (10 глаз), которым клиническую оценку границ опухоли осуществляли визуально при осмотре в белом свете, обращая внимание на изменения окраски кожи, наличие зон изъязвления, телеангиоэктазий.
Руководствуясь рекомендациями Я. О. Груша (2012) [7], у пациентов обеих групп наблюдения выполнили полнослойную резекцию века в пределах здоровой ткани, отступив 3 мм от границ опухоли, с одномоментной пластикой образовавшейся колобомы.
Весь фрагмент резецируемой опухоли подвергали стандартному гистологическому исследованию (окраска гематоксилин эозином), которое проводили в патологоанатомическом отделении КГБУЗ «Краевой клинический центр онкологии» (Хабаровск) для подтверждения морфологической структуры опухоли и гистологического контроля на предмет отсутствия опухолевых клеток в области границы удаленной опухоли и за ее пределами: 1, 2 и 3 мм в зоне здоровой ткани.
Полученные в ходе исследований числовые значения статистически обработаны методом вариационной статистики с помощью программного обеспечения Microsoft Office Exсel 2007 и представлены в виде абсолютных и относительных значений (%).
Результаты. Анализ результатов ретроспективного исследования, представленный в 1-й части, показал, что при сроках диспансерного наблюдения 6 месяцев после хирургического удаления БКР с визуальной диагностикой его границ у большего числа пациентов (31 чел., или 82%) получен и сохранялся хороший эстетический результат. У 7 пациентов (18%) к этому сроку наблюдения появились телеангиоэктазии и неровности в зоне операции. При сроке наблюдения 1 год у всех данных 7 пациентов в зоне операции отмечалось уплотнение ткани с формированием небольшого язвенного дефекта, а спустя 1,5 года после операции у них морфологически верифицирован рецидив заболевания, который потребовал повторного оперативного лечения.
Использование АФД для проведения дифференциальной диагностики между злокачественным и доброкачественным новообразованием кожи век и периорбитальной области во 2-й части исследования показало, что у 15 из 41 пациента имелись злокачественные новообразования век, подтвержденные морфологически: у 13 человек БКР, у 2 человек плоскоклеточный рак. У 26 пациентов после радиохирургического удаления новообразования атипичных клеток в морфологическом исследовании операционного материала не выявлено.
Визуальное (с помощью щелевой лампы) и с помощью АФД на аппарате «АФС-400» определение границ опухоли, проведенное в 3-й части исследования, показало следующее: у всех пациентов после операции по размеченным границам осложнений не наблюдалось. По окончании послеоперационного периода (1 месяц после операции) у пациентов обеих групп получен удовлетворительный анатомический и функциональный результат и приемлемый косметический вид.
Ни в одном случае не наблюдалось расхождения краев раны, отторжения и сморщивания трансплантационного лоскута.
При сроках диспансерного наблюдения 24 месяца после хирургического лечения БКР у пациентов основной группы рецидива заболевания не диагностировано, в то время как у 2 пациентов контрольной группы выявлены клинические признаки рецидива новообразования и после морфологического его подтверждения возникла необходимость в проведении повторной операции.
Результаты гистологической диагностики резецируемой опухоли, проведенной у пациентов групп сравнения, отражены на рисунке .
Данные, представленные на рисунке, демонстрируют, что при гистологическом исследовании удаленного во время операции тканевого фрагмента на срезах, изготовленных по клиническим границам новообразования, диагностированы опухолевые клетки только у одного пациента основной группы и у 5 пациентов контрольной группы. Морфологический анализ гистологических срезов здоровой ткани, полученных при отступе 1, 2 и 3 мм от границ опухоли, установил полное отсутствие опухолевых клеток у всех пациентов основной группы. Напротив, в контрольной группе диагностировано наличие опухолевых клеток на гистологических срезах, выполненных с отступом от границ опухоли: на 1 мм (5
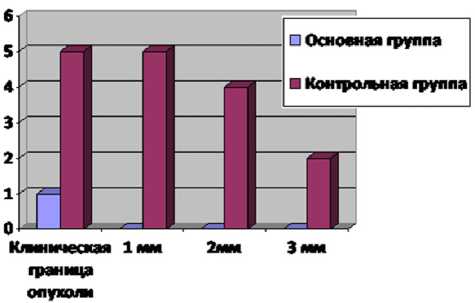
Результаты данных гистологической диагностики фрагментов, резецированных во время операции по удалению новообразования век чел.), на 2 мм (4 чел.), на 3 мм (2 чел.). Полученные результаты указывают, что АФД границ БКР по сравнению с визуальным методом их диагностики обладают большей точностью, не требуют длительного времени для проведения и не вызывают каких-либо осложнений.
Обсуждение. Согласно результатам исследования, после стандартного хирургического удаления БКР в пределах здоровой ткани с использованием визуальной разметки границ опухолей век и периорбитальной области частота рецидивов новообразования составила 18%, что согласуется с результатами других исследователей [3, 6, 7].
Анализ полученных данных после использования метода аутофлуоресценции новообразований эпителиального происхождения с целью их дифференциальной диагностики констатировал полное соответствие результатов АФД результатам морфологических исследований, что сопоставимо с ранее опубликованными работами и подтверждает актуальность метода для первичной диагностики новообразований век и периорбитальной области в поликлиническом звене [12–14].
Выводы :
-
1. Результаты ретроспективного исследования показали, что при использовании визуальной разметки границ опухолей век и периорбитальной области и стандартной резекции БКР в пределах здоровой ткани (3 мм от визуальных границ опухоли) частота рецидивов новообразования составила 18%.
-
2. Метод АФД с применением аппарата «АФС-400» может быть использован в офтальмоонкологии для ранней диагностики кожи век и периорбитальной области, более точного определения границ распространенного патологического процесса, что гарантирует полное удаление опухоли и уменьшает риск ее рецидивирования.
Список литературы Повышение эффективности хирургического лечения злокачественных новообразований век эпителиального происхождения при использовании метода аутофлуоресценции
- Likhvantseva VG, Novikov IA, Osipova EA. Study of spectral component of autofluorescence of skin and mucous membranes is normal and pathological. In: Domestic antitumor drugs: Abstract book of the All-Russian scientific and practical conference, 2007. Moscow, 2007. Russian (Лихванцева В. Г., Новиков И. А., Осипова Е. А. Изучение спектральной составляющей аутофлуоресценции кожи и слизистых оболочек в норме и патологии. В кн.: Отечественные противоопухолевые препараты: сб. материалов Всерос. науч.-практ. конф., 2007. М., 2007.)
- Hanmurzaeva AG. Spectroscopic methods in diagnosis of malignant skin tumors: PhD abstract. Moscow, 2012; 24 p. Russian (Ханмурзаева А. Г. Спектроскопические методы в диагностике злокачественных опухолей кожи: автореф. дис. ... канд. мед. наук. М., 2012; 24 с.).
- Brovkina AF. Ophthalmic oncology: guidelines for doctors. Moscow: Meditsina, 2002; 424 p. Russian (Бровкина А. Ф. Офтальмоонкология: руководство для врачей. М.: Медицина, 2002; 424 с.)
- Bower CP, Lear JT, de Berker DA. Basal cell carcinoma follow-up practices by dermatologists: a national survey. Br J Dermatol 2001; 145 (6): 949-56. DOI: 10.1046/j. 13652133.2001.04488. x.
- Banshchikov PA, Luzianina VV, Smoliakova GP. Possibilities prevention of relapse of malignant epithelial neoplasms of eyelids. In: Evidence-based medicine is the basis of modern healthcare: Abstract book of the VIII International Congress. Khabarovsk, 2010; p. 45-8. Russian (Банщиков П. А., Лузьянина В. В., Смолякова Г. П. Возможности профилактики рецидива злокачественных эпителиальных новообразований век. В кн.: Доказательная медицина — основа современного здравоохранения: сб. материалов VIII Междунар. конгресса. Хабаровск, 2010; c. 45-8).
- Volgin VN, Sokolova TV, Kolbina MS. Basal cell carcinoma of skin: diagnosis, treatment. Vestnik dermatologii i venerologii 2013; (2): 16-23. Russian (Волгин В. Н., Соколова Т. В., Колбина М. С. Базально-клеточный рак кожи: диагностика, лечение. Вестник дерматологии и венерологии 2013; (2): 16-23).
- Grusha YaO, Ismailova DS. Surgical treatment of malignant neoplasms of epithelial origin. Head and Neck Tumors 2012; (2): 24-8. Russian (Груша Я. О., Исмайлова Д. С. Хирургическое лечение злокачественных новообразований эпителиального происхождения. Опухоли головы и шеи 2012; (2): 24-8).
- Likhvantseva VG, Anurova OA. Tumors of the eyelids: clinic, diagnosis, treatment. Moscow: GEOTAR-Media, 2007; 447 p. Russian (Лихванцева В. Г, Анурова О. А. Опухоли век: клиника, диагностика, лечение. М.: ГЭОТАР-Медиа, 2007; 447 c.).
- Piskalkova TP. Comparative characteristics of some methods of treatment of basal cell carcinoma of skin. Almanac of Clinical Medicine 2006; (9): 105-9. Russian (Пискалко-ва Т. П. Сравнительная характеристика некоторых методов лечения базально-клеточного рака кожи. Альманах клинической медицины 2006; (9): 105-9).
- Safronenkova IA. Treatment of patients with malignant epithelial tumors of the eyelid skin with lesion of the anterior part of the orbit. Ophthalmology Journal (Ukraine) 2013; (5): 46-50. Russian (Сафроненкова И. А. Результаты лечения злокачественных эпителиальных опухолей кожи век. Офтальмологический журнал 2013; (5): 46-50).
- Hamada S, Kersey T, Thaller VT. Eyelid basal cell carcinoma: non-Mohs excision, repair and outcome. Br J Ophtalmol 2005; 89 (8): 992-4. DOI: 10.1136/bjo. 2004.058834.
- Novikov IA, Grusha IaO, Kiriushchenkova NP. Autofluorescent diagnostics of skin and mucosal tumors. The Russian Annals of Ophthalmology 2013; 129 (5): 147-54. Russian (Новиков И. А., Груша Я. О., Кирющенкова Н. П. Ау-тофлуоресцентная диагностика новообразований кожи и слизистых оболочек. Вестник офтальмологии 2013; 129 (5): 147-54).
- Betz CS, Mehlmann M, Rick K, et al. Autofluorescence imaging and spectroscopy of normal and malignant in patient with head and neck cancer. Laser Surg Med 1999; 25 (4): 323-34. DOI: 10.1002/(sici) 1096-9101 (1999) 25:4-323::aid-lsm7-3.0. co;2-p.
- Galkina EM, Utz SR. Fluorescence diagnostics in dermatology (review). Saratov Journal of Medical Scientific Research 2013; 9 (3): 566-72. Russian (Галкина Е. М., Утц С. Р. Флуоресцентная диагностика в дерматологии (обзор). Саратовский научный медицинский журнал 2013; 9 (3): 566-72).
- Pobilat AE. Combined use of dermatoscopy and fluorescence contact biomicroscopy in differential diagnostics of basal cell skin cancer: PhD abstract. Novosibirsk, 2010; 24 p. Russian (Побилат А. Е. Сочетанное применение дерматоско-пии и флюоресцентной контактной биомикроскопии при дифференциальной диагностике базально-клеточного рака кожи: автореф. дис. ... канд. мед. наук. Новосибирск, 2010; 24 с.).
- Osipova EA. Fluorescent methods for study of tumors of eyelids and conjunctiva based on endogenous exogenous fluorophores: PhD abstract. Moscow, 2009; 24 p. Russian (Оси-пова Е. А. Флуоресцентные методы исследования опухолей век и конъюнктивы на основе эндогенных экзогенных флуо-рофоров: автореф. дис. ... канд. мед. наук. М., 2009; 24 c.).


