Повышение уровня экспрессии MIR-204-5P в клетках меланомы под воздействием дакарбазина
Автор: Лаврентьев Семен Николаевич, Аксененко Мария Борисовна, Аверчук Антон Сергеевич, Комина Анна Владимировна, Палкина Надежда Владимировна, Рукша Татьяна Геннадьевна
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 3 т.18, 2019 года.
Бесплатный доступ
МикроРНК участвуют в регуляции на эпигенетическом уровне многочисленных критических биологических процессов, включая клеточную пролиферацию, дифференцировку, миграцию и инвазию, функционируя в качестве онкосупрессоров или онкогенов. Ранее было определено, что микроРНК miR-204-5p характеризуется сниженным уровнем при меланоме. Основной целью данного исследования явилось определение эффектов изменения уровня экспрессии микроРНК при воздействии на клетки меланомы цитостатическим агентом дакарбазином in vitro, а также синтетическим аналогом miR-204-5p in vivo. Уровень экспрессии miR-204-5p и miR-211 в клетках меланомы оценивали с помощью ПЦР в реальном времени. Противоопухолевые эффекты in vivo определялись при оценке динамики роста опухолевого узла. Токсические эффекты оценивались по поведению животных, потреблению жидкости, корма, а также по уровню АЛТ, АСТ, креатинина, мочевины. На модели меланомы C57BL6 определено, что введение синтетического аналога miR-204-5p не вызвало значимых изменений исследуемой микроРНК в опухолевых клетках. Вместе с тем противоопухолевый препарат дакарбазин в клетках меланомы in vitro приводил к повышению уровня исследуемой микроРНК более чем в 20 раз. Полученные результаты исследования указывают на возможность восстановления уровня miR-204-5p под воздействием цитостатической терапии. С учетом выявленного нами ранее ингибирующего эффекта miR-204-5p на пролиферацию клеток меланомы стоит предположить, что данная микроРНК может играть роль в поддержании дормантного состояния опухолевых клеток. Полученные данные требуют дальнейшего разъяснения, так как это может иметь значение для понимания развития метастазирования, а также прогнозирования эффективности противоопухолевой терапии при меланоме.
Меланома, дакарбазин, клеточная пролиферация, химиотерапия, культивирование клеток, пцр, биоинформатический анализ, химиорезистентность
Короткий адрес: https://sciup.org/140254261
IDR: 140254261 | УДК: 616-006.81-091.8-08:615.277.3:577.21 | DOI: 10.21294/1814-4861-2019-18-3-45-53
Текст научной статьи Повышение уровня экспрессии MIR-204-5P в клетках меланомы под воздействием дакарбазина
Современные возможности лечения меланомы представлены различными способами, включая хирургическое вмешательство, химиотерапию, иммунотерапию, применение BRAF-ингибиторов [1]. Одним из стандартных вариантов лекарственной терапии меланомы кожи на протяжении более 30 лет является применение дакарбазина [2]. Препарат относится к группе алкилирующих агентов, его действие заключается в прямом повреждении ДНК [3]. Недавнее внедрение в клиническую онкологию противоопухолевых средств, обладающих способностью ингибирования гистоновых деацетилаз [4], позволяет предполагать возможность целенаправленного воздействия на эпигенетические механизмы с терапевтической целью. МикроРНК – это эволюционно консервативные некодирующие РНК длиной 20–22 нуклеотидов, участвующие практически во всех известных физиологических и патологических процессах, включая канцерогенез [5]. Возможность целенаправленного изменения уровней микроРНК является новым направлением в экспериментальной терапии меланомы кожи.
Цель иссдедования – изучение влияния модуляции уровня экспрессии miR-204-5p на модели меланомы in vivo, а также в клетках меланомы in vitro.
Материал и методы
Исследование было одобрено локальным этическим комитетом Красноярского государственного медицинского университета им. проф. В.Ф. Войно-Ясенецкого (протокол № 79/2017 от 22.11.2017). Манипуляции с животными осуществляли в соответствии с правилами, изложенными в Хельсинкской Декларации Всемирной Медицинской Ассоциации (World Medical Association Declaration of Helsinki 1964, 2008 ред.), а также в «Междуна- родных рекомендациях по проведению медикобиологических исследований с использованием лабораторных животных» и приказе Министерства здравоохранения РФ от 01.04.2016 №199н. «Об утверждении Правил надлежащей лабораторной практики».
Эксперимент по воссозданию меланомы кожи проводили на половозрелых мышах-самках линии С57BL/6 в возрасте 8-9 нед со средней массой тела 18,5 г. Животные были предоставлены ФИЦ ИЦиГ СО РАН (г. Новосибирск). Температура воздуха в помещении поддерживалась на уровне 20–22 ºС. Животные содержались в клетках при естественном освещении с неограниченным доступом к корму и воде.
Перевивка культуры клеток меланомы В16 животным производилась путём подкожного введения 0,5 мл взвеси опухолевой ткани в растворе Хенкса (1:10) по стандартной методике. Все животные были разделены на 3 группы случайным образом. Животным контрольной группы (n=3) на 7-е сут после трансплантации опухолевых клеток в латеральную вену хвоста вводился раствор фосфатно-солевого буфера (VWR Radnor, USA). В группе отрицательного контроля (n=6) применялся негативный контроль имитатора (mirvana™ mirna Mimic Negative Control #1, Ambion, Carlsbad, USA). Вещество вводилось на 7-е сут после трансплантации опухолевых клеток однократно в латеральную вену хвоста. Животным опытной группы (n=5) вводился синтетический аналог (имитатор) miR-204-5p (mirVana® miR-204-5p mimic, Ambion, Carlsbad, USA) однократно в боковую вену хвоста на 7-е сут после перевивки опухолевых клеток в дозировке 1,2 мг/кг в виде раствора 7,4 µ M в объеме 200 мкл, в качестве растворителя использовали Invivofectamine® 3.0 Reagent (Invitrogen, Life Technologies, Carlsbad, USA).
Оценка динамики роста опухоли
Линейные размеры опухоли измеряли в двух взаимно перпендикулярных направлениях. Объём опухоли рассчитывали по формуле
V = A×(B)2, где А – больший, а B – меньший линейный размер узла. Торможение роста опухоли (ТРО, %) вычисляли по формуле
ТРО = ((V к –V о )/V к )×100 %, где V к – средний объём опухоли в контрольной группе на определённый срок измерения (мм2), V о – средний объём опухоли в опытной группе на определённый срок измерения (мм2).
Оценка токсического эффекта синтетического имитатора miR-204-5p на организм животных
Токсический эффект имитатора miR-204-5p оценивался по изменению массы тела мышей, потреблению пищи (в граммах) и воды (в миллилитрах). Животных взвешивали каждые трое суток. Изменение внешних признаков фиксировали ежедневно путем балльной оценки изменения окраса шерсти и волосяного покрова: 1 балл – шерстяной покров тусклый, 2 балла – яркий; изменения двигательной активности: 5 баллов – активное движение животного по клетке, выраженные избегательно-оборонительные реакции; 4 балла – медленные активные движения по клетке, избегательно-оборонительные реакции с попытками укусов; 3 балла – реакция на раздражение избегательная, спонтанная двигательная активность угнетена, стимулированная сохранена, животное передвигается на несколько шагов только при подталкивании; 2 балла – реакция на тактильные раздражители угнетена, минимальная стимулированная двигательная активность животного; 1 балл – кома, отсутствие спонтанной и стимулированной двигательной активности; 0 баллов – животное пало. Животных выводили из эксперимента путем декапитации под хлороформным наркозом на 15-е сут после начала эксперимента.
Изучение морфологических изменений в органах животных
Животные после эвтаназии подвергались визуальному осмотру. Во время вскрытия проводилась оценка внутренних органов животных: цвета, формы, консистенции. Определялась масса внутренних органов.
Определение биохимических параметров -маркеров токсического повреждения органов Для оценки маркеров возможного токсического повреждения органов оценивалась концентрация АЛТ (аланинаминотрансферазы), АСТ (аспартатаминотрансферазы), креатинина, мочевины на биохимическом анализаторе Сobasintegra 400 plus (Roche Diagnostics GmbH, Mannheim, Germani).
Выделение РНК
Образцы опухолевых узлов, изъятые при вскрытии, были помещены в криопробирки с раствором для сохранения и фиксации РНК RNAlaterSolutions (Ambion, Carlsbad, USA) и хранились при -80 ºС. После гомогенизации тканей выделяли РНК с применением наборов реагентов Рибо-золь, Рибо-сорб (Амплисенс, Москва, РФ) согласно инструкции производителя.
Культивирование клеток меланомы и воздействие на них дакарбазином
Исследование одобрено локальным этическим комитетом Красноярского государственного медицинского университета имени профессора В.Ф. Войно-Ясенецкого (протокол № 73/2016 от 16.12.2016), а также локальным этическим комитетом Красноярского краевого клинического онкологического диспансера им. А.И. Крыжа-новского (протокол № 8 от 14.06.2017). Образцы меланомы кожи 2303-С, 2303-К, 0404-К были получены от пациентов с меланомой кожи, находившихся на лечении в Красноярском краевом онкологическом диспансере, после оперативного удаления меланомы. Фрагменты опухоли были подвергнуты дезагрегации и перенесены в питательную среду для получения клеточной линии. Клетки культивировали в питательной среде RPMI-1640, L-глутамин (Gibco, Life Technologies, Paisley, UK), содержащей 10 % фетальной бычьей сыворотки (Gibco, Life Technologies, Paisley, UK) и смесь антибиотика-антимикотика (пенициллин, стрептомицин, амфотерицин В) (Gibco, Life Technologies, Paisley, UK), при 37 °C и 5 % CO 2 в CO 2 -инкубаторе (Sanyo MSO-5AC, Osaka, Japan). Смену питательной среды осуществляли один раз в 3 дня. Для проведения исследования клетки рассеивали в 6-луночные планшеты в концентрации 2×105 кл/мл. После 24 ч в лунки, согласно протоколу исследования вносили дакарбазин (Sigma, St. Louis, USA) в концентрации 1000 мкг/мл или DMSO (Panreacquimica s.a., Barcelona, Spain) до конечной концентрации 1 %. Через 72 ч клетки трипсинизировались, после чего из полученных клеток выделяли микроРНК при помощи комплекта реагентов RecoverAllTM Total Nucleic Acid Isolation Kit (Ambion, Life Technologies, Vilnius, Lithuania).
Реакция обратной транскрипции
Реакция обратной транскрипции проводилась с применением набора реагентов MMLV RT kit (Евроген, Москва, РФ). Для определения уровня экспрессии матричных РНК использовался набор случайных праймеров из набора MMLV RT kit (Евроген, Москва, РФ) и специфичные праймеры для каждого вида микроРНК TaqMan Assays hsa-miR-211 (Assay ID 000514, №.4427975, Applied Biosystems, Foster City, USA), TaqMan Assays hsa-
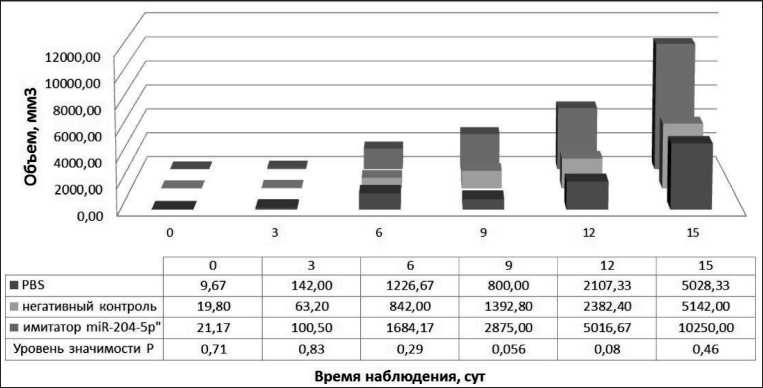
Рис. 1. Динамика объема опухолевых узлов после воздействия имитатором miR-204-5p
miR-204-5p (Assay ID 478491, № A25576, Applied Biosystems, Foster City, USA) TaqManAssays (Applied Biosystems, Foster City, USA).
ПЦР в реальном времени
Реакцию ПЦР в реальном времени проводили на приборе StepOneTMReal-Time PCR-System (Applied Biosystems, Singapore, Singapore). В качестве эндогенных контролей использовали U6 snRNA (Assay-ID 001973, № 4427975, Applied Biosystems, Foster City, USA), SNO 234 (AssayID 001234, № 4427975; Applied Biosystems, Foster City, USA). Эксперимент осуществляли в трех технологических повторах. Анализ данных производили с использованием метода ∆∆Ct. Для определения уровня экспрессии выполняли расчет среднего геометрического от произведения уровней экспрессии.
Биоинформатический анализ
Анализ сигнальных путей, регулируемых miR-204-5 и miR-211, осуществляли при помощи программного обеспечения DIANA miRPath v.3.0 на основе базы данных KEGG (с применением баз данных TargetScan v.7.0, TarBase, microT-CDS).
Статистическая обработка данных
Для статистической обработки данных был использован пакет программного обеспечения Statistica 6.1 (StatSoft, Москва, Россия). Для многогрупповых сравнений применялся непараметрический критерий Краскела – Уоллиса. Результаты считали значимыми при р<0,05. Данные в таблице представлены в виде среднего значения. Данные на рис. 2, 7, 8 представлены в виде среднего значения, его стандартного отклонения и доверительного интервала.
Результаты
С учетом полученных нами ранее [6] и литературных данных о роли miR-204-5p в регуляции пролиферации опухолевых клеток [7] в данном исследовании было осуществлено введение син- тетического имитатора данной микроРНК мышам линии C57BL6 с имплантированной меланомой B16 для последующей оценки противоопухолевых и токсических эффектов вышеуказанного модулятора.
Противоопухолевые эффекты синтетического аналога miR-204-5p, оцениваемые по динамике торможения роста опухоли и объема опухолевого узла под воздействием исследуемого синтетического аналога miR-204-5p, не наблюдались (рис. 1). Уровень miR-204-5p в клетках опухолевого узла в группе животных, получавших имитатор miR-204-5p, не отличался от контрольной группы (рис. 2).
Для определения возможного токсического воздействия используемого мимика на животных были оценены следующие показатели: динамика массы тела, внешний вид и двигательная активность животных в течение эксперимента. Динамика массы тела в исследуемых группах за период эксперимента значимо не различалась (рис. 3). Значимых изменений потребления животными воды и корма за период наблюдения в ходе эксперимента также отмечено не было. Кроме того, в ходе эксперимента все животные характеризовались выраженными
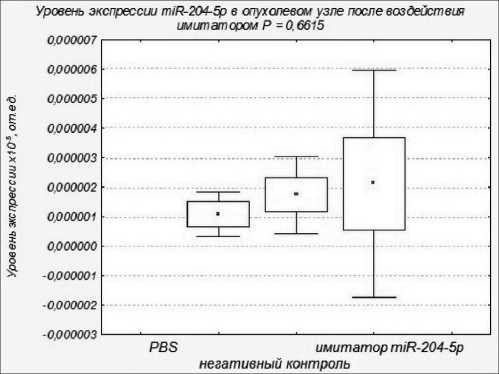
Рис. 2. Уровень экспрессии miR-204-5p в опухолевом узле после воздействия имитатором miR-204-5p
|
25 Гн 20 « 15 л ю 5 5 0 |
||||||||||||||||||||||||
|
1 сут |
3 сут |
6 сут |
9 сут |
12 сут |
15 сут |
|||||||||||||||||||
|
■ PBS |
18,63 |
19,27 |
19,06 |
18,98 |
15,66 |
16,32 |
||||||||||||||||||
|
■ негативый контроль |
21,13 |
21,75 |
20,75 |
18,05 |
18,62 |
19,17 |
||||||||||||||||||
|
■ имитатор miR-204-5p |
18,28 |
18,54 |
17,86 |
17,93 |
17,49 |
18,01 |
||||||||||||||||||
|
Уровень значимости Р |
0,83 |
0,82 |
0,92 |
0,94 |
0,62 |
0,91 |
||||||||||||||||||
Время наблюдения, сут
Рис. 3. Динамика массы тела животных после воздействия имитатором miR-204-5p
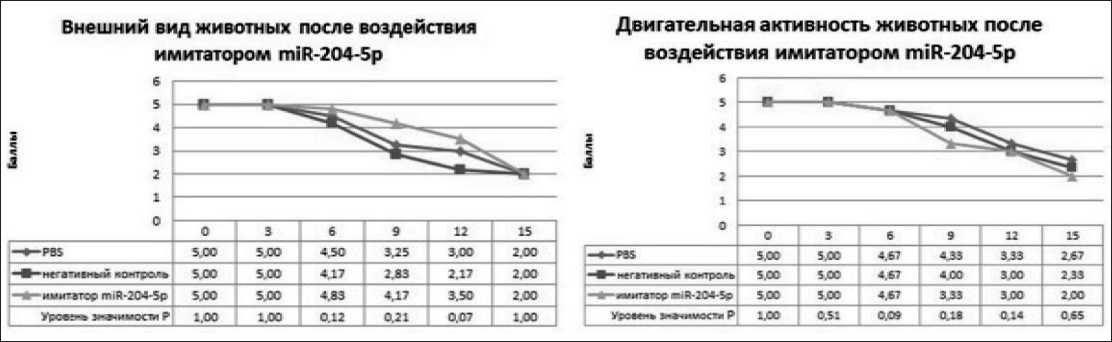
Рис. 4. Внешний вид и двигательная активность животных после воздействия имитатором miR-204-5p
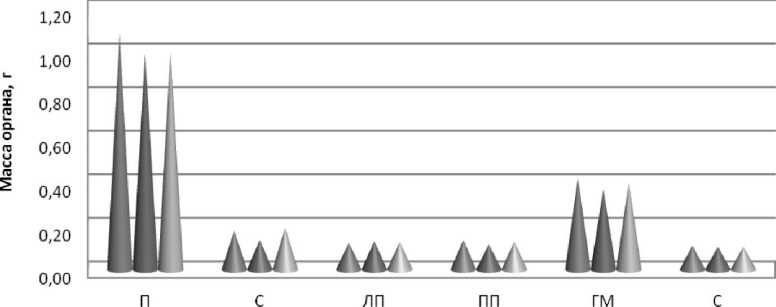
|
П |
С |
ЛП |
ПП |
ГМ |
С |
|
|
■ PBS |
1,08 |
0,18 |
0,12 |
0,14 |
0,42 |
0,11 |
|
■ негативный контроль |
0,99 |
0,14 |
0,13 |
0,12 |
0,37 |
0,10 |
|
■ имитатор miR-204-5p |
1,00 |
0,19 |
0,13 |
0,13 |
0,40 |
0,10 |
П - печень; С - сердце; ЛП -левая почка; ПП -правая почка; ГМ - головной мозг; С - сердце
Рис. 5. Массы органов животных после воздействия имитатором miR-204-5p
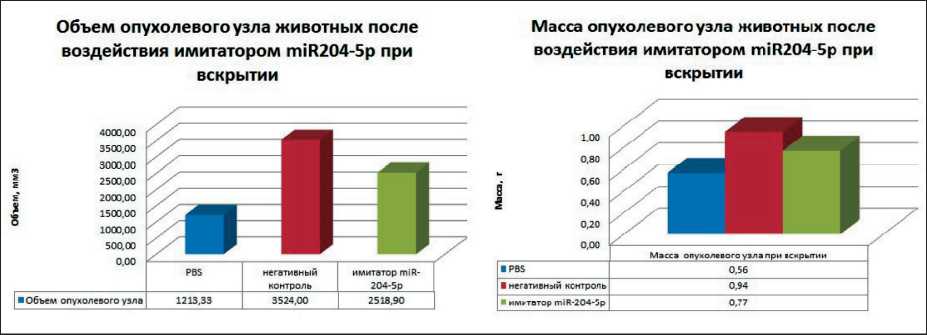
Рис. 6. Объем и масса опухолевых узлов после воздействия имитатором miR-204-5p
избегательно-оборонительными реакциями и нормальной двигательной активностью (рис. 4).
По результатам оценки морфологических изменений внутренних органов (головного мозга, печени, селезенки, почек, сердца, легких) при вскрытии животных всех групп не было отмечено дистрофических изменений. Масса исследуемых органов, объем и масса опухолевых узлов также не различались в исследуемых группах (рис. 5, 6).
Для анализа возможного гепато- и нефротоксичного эффектов используемого имитатора определялись уровни АЛТ, АСТ, креатинина, мочевины, значимых различий которых в исследуемых группах выявлено не было (таблица). Изменений морфологического (головной мозг, печень, селезенка, почки, сердце, легкие), физиологического характера (масса тела, количество потребляемой жидкости и корма), поведенческих реакций выявлено не было.
Таблица Биохимические параметры токсичности после воздействия имитатором miR-204-5p
|
Параметр |
Группа |
Уровень значимости |
||
|
PBS |
Негативный контроль |
Имитатор miR-204-5p |
||
|
АЛТ |
57,63 |
56,48 |
57,01 |
р=0,97 |
|
АСТ |
473,13 |
578,12 |
559,83 |
р=0,59 |
|
Креатинин |
4,00 |
2,40 |
3,40 |
р=0,80 |
|
Мочевина |
9,88 |
7,49 |
8,74 |
р=0,33 |
Для проведения дальнейшего этапа исследования, учитывая литературные данные о позитивной индукции уровня данной микроРНК противоопухолевыми агентами [8], осуществляли модуляцию экспрессии miR-204-5p дакарбазином. С этой целью в клетках меланомы, полученных из первичной опухоли, оценивали уровни miR-204-5p и гомологичной ей miR-211 после воздействия вышеуказанным веществом в течение 72 ч в концентрации 1000 мкг/мл. Регистрировалось 20-кратное и более повышение уровней miR-204-5p, miR-211 (рис. 7, 8) у клеточной культуры, полученной из краевого участка опухоли (2303-К) в отличие от клеточных линий, полученных из центральной части (2303-С и 0404-С).
Следующим этапом был проведен биоинформа-тический анализ генов-мишеней вышеуказанных микроРНК, который определил, что miR-204-5 и miR-211 принимают участие в регуляции сигнальных механизмов, участвующих в процессах жизнеобеспечения клетки, процессов апоптоза и формирования опухоли, таких как сигнальный путь NF-kappa B, сигнальный путь JAK-stat. Полученные результаты согласуются с литературными данными об участии miR-204-5p и miR-211 в канцерогенезе [9, 10].
Обсуждение
Так как микроРНК-гомологи miR-204-5p и miR-211 по результатам нескольких исследований были определены как одни из минимально экспрессирующихся при меланоме, предполагается, что повышение их уровня может иметь значение в терапии [11]. Как было выявлено нами ранее [6] и что также согласуется с другими исследованиями [12], применение имитатора данной микроРНК in vitro снижает пролиферативную активность и жизнеспособность клеток опухоли. В этой связи на первом этапе исследования нами было осуществлено введение имитатора miR-204-5p мышам C57BL6 с имплантированной меланомой B16 с целью оценки противоопухолевого действия, а также токсических эффектов.
Вместе с тем динамика роста опухоли в экспериментальной и опытной группах была идентич-
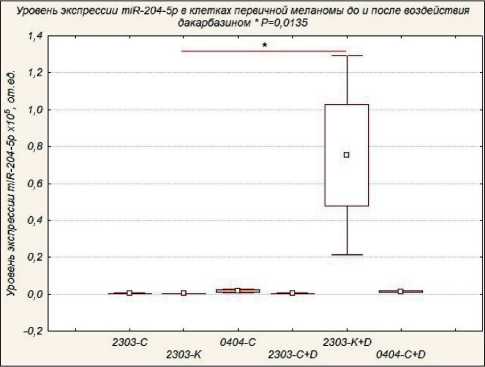
Рис. 7. Уровень экспрессии miR-204-5p в клетках первичной меланомы. Примечание: * – статистически значимые различия до и после воздействия дакарбазином (р=0,0136)

I 0,6
Уровень экспрессии miR-211 в клетках первичной меланомы до и после воздействия дакарбазином *Р=0,0134
1,0
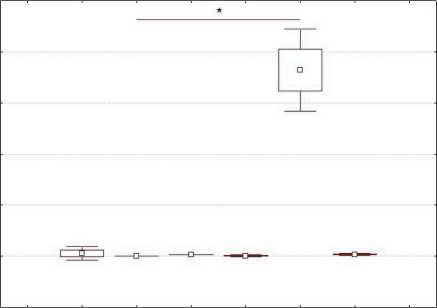
0,2 2303-С 2303-К 0404-С 2303-C+D 2303-K+D 0404-C+D
Рис. 8. Уровень экспрессии miR-211 в клетках первичной меланомы. Примечание: * – статистически значимые различия до и после воздействия дакарбазином (р=0,0134)
ной, что может быть обусловлено недостаточной дозой введенного имитатора, его разрушением под воздействием нуклеаз периферической крови или нивелированием эффектов имитатора факторами, вызывающими снижение экспрессии данных микроРНК в клетках меланомы. Доза препарата определялась согласно рекомендациям производителя (Insert PN 4457172 Rev. C, Ambion by Life Technologies, Carlsbad, USA). Стабильность олигонуклеотидов является одной из ключевых проблем их применения в медицине. Существует множество работ, описывающих проблемы и решение вопросов адресной доставки лекарственных веществ [13, 14]. Выделяют несколько направлений решения, включая в случае опухолей кожи, регионарное введение препарата, а также введение препарата посредством различных решений: связывания с полимером, наночастицами, липосомами, вирусными частицами. Вместе с тем данные способы имеют ограничения в виде токсичности, низкой специфичности, вариабельной биодеградируемости средств доставки [15].
В связи с тем, что одна микроРНК может регулировать сразу несколько генов-мишеней, но также большое количество разновидностей микроРНК могут осуществлять регуляцию экспрессии одного гена, стоит предположить, что при ингибировании/усилении микроРНК одного типа, другие микроРНК могут оказывать регуляторные влияния на ген-мишень. МикроРНК miR-204-5p и miR-211 имеют отличия в строении только на один нуклеотид, в связи с чем предполагается, что большинство генов-мишеней данных микроРНК идентичны. В этой связи стоит предположить, что при воздействии имитатором miR-204-5p супрессивное воздействие на соответствующие гены-мишени может продолжать оказывать miR-211, нивелируя действие имитатора. При этом стоит отметить, что токсических эффектов на фоне введения олигонуклеотидов выявлено не было.
При выполнении полногеномного секвенирования РНК клеток меланомы, в том числе резистентных к BRAF-ингибитору вемурафенибу, Diaz-Martines et al. выявили, что miR-204-5p и miR-211 были в числе четырех микроРНК, различия в уровнях которых были максимальными в двух вышеуказанных группах. Одним из механизмов этого авторы определили изменение уровня транскрипционного фактора STAT. Последний также принимает участие в регуляции чувствительности опухолевых клеток к алкилирующим агентам [16]. В этой связи на следующем этапе исследования клетки меланомы, полученные из первичных опухолей, инкубировались с дакар- базином. Выполнение ПЦР в реальном времени позволило определить более чем 20-кратное увеличение уровня miR-204-5p, miR-211. Можно предположить, что изученные клеточные линии испытывают различную степень деградации генетического материала при действии дакарбазина и, следовательно, проявляют различные механизмы адаптации к нему, что свидетельствует о генетической гетерогенности материнской опухоли.
Список литературы Повышение уровня экспрессии MIR-204-5P в клетках меланомы под воздействием дакарбазина
- Maverakis E., Cornelius L.A., Bowen G.M., Phan T., Patel F.B., Fitz-maurice S., He Y., Burrall B., Duong C., Kloxin A.M., Sultani H., Wilken R., Martinez S.R., Patel F. Metastatic Melanoma - a review of current and future treatment options. Acta Derm Venereol. 2015 May; 95(5): 516-24. DOI: 10.2340/00015555-2035
- Xin Y., Huang Q., Zhang P., Yang M., Hou X.Y., Tang J.Q., Zhang L.Z., Jiang G._Meta-Analysis of the Safety and Efficacy of Interferon Combined With Dacarbazine Versus Dacarbazine Alone in Cutaneous Malignant Melanoma. Medicine (Baltimore). 2016 Apr; 95(16): e3406. 10.1097/ MD.0000000000003406. DOI: 10.1097/MD.0000000000003406
- Hafeez A., Kazmi I. Dacarbazine nanoparticle topical delivery system for the treatment of melanoma. Sci Rep. 2017 Nov 28; 7(1): 16517. DOI: 10.1038/s41598-017-16878-1
- Zwergell C., Giulia, S., Valente S., Mai A. Histone Deacetylase Inhibitors: Updated Studies in Various Epigenetic-Related Diseases. J Clin Epigenet. 2016 Mar; 2(1/7): 1-15. DOI: 10.21767/2472-1158.100015
- Lujambio A., Lowe S.W. The microcosmos of cancer. Nature. 2012 Feb 15; 482(7385): 347-55. DOI: 10.1038/nature10888


