Повышенный уровень Са125 (МUC16) при метастатическом раке желудка - мощный фактор негативного прогноза выживаемости
Автор: Семнов Н.Н., Далгатов К.Д.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Собственные исследования
Статья в выпуске: 1 т.12, 2022 года.
Бесплатный доступ
Введение: СА125 является экстрацеллюлярным доменом гликопротеина MUC16. Клиническое значение сывороточного СА125 наиболее широко изучено при раке яичников. Значение уровня сывороточного СА125 при раке желудка практически не отражено в литературе. Имеются данные о негативном прогнозе в отношении общей выживаемости при гиперэкспрессии MUC16 у больных метастатическим раком желудка. Работ по корреляции уровня сывороточного СА125 и гиперэкспрессии MUC16 в литературе не обнаружено. Цель: целью исследования являлась оценка влияния на отдаленные результаты (время до прогрессирования и общая выживаемость) повышенного уровня СА125 у больных метастатическим раком желудка. Материалы и методы: СА125 определялся в сыворотке до начала I линии химиотерапии у 75 больных метастатическим раком желудка. Возраст составил 61,3 (26,7-84,9) года, мужчины/женщины - 45/30. Синхронные метастазы 85%, локализация: брюшина 57,3%, печень 37,3%, другие локализации 5,4%. Паллиативная гастрэктомия выполнена у 28%, метастазэктомии у 20% больных. Монохимиотерапия использовалась у 6,7%; дублетные режимы у 58,7%; триплетные - у 36% больных. Результаты: при анализе было показано, что повышенный уровень СА125 (>37 МЕ/мл) ассоциировался со значительным уменьшением медианы времени до прогрессирования (3,5 мес. (ДИ 2,87-9,53) против 6,2 мес., р=0,001, ДИ 2,02-4,9) и общей выживаемости (5,1 мес. (ДИ 6,07-28,1) против 17,1 мес. (ДИ 3,5-6,67), р=0,001). При однофакторном анализе показано, что влияние на общую выживаемость имели локализация метастазов (брюшина), тип опухоли (аденокарцинома/перстневидноклеточный рак), проведение паллиативной гастрэктомии и резекции метастазов. При проведении многофакторного анализа было показано, что благоприятными прогностическими факторами в отношении общей выживаемости оказались только нормальный уровень СА125 (HR 0,39 (95% ДИ 0,18-0,84), р=0,001) и выполнение паллиативной гастрэктомии (HR 0,23 (95% ДИ 0,1-0,58), р=0,001). Применение тройных комбинаций позволяло несколько улучшить показатели общей выживаемости в группе больных с повышенным СА125, но различия не были статистически значимыми (6,7 мес. против 4,0 мec., р=0,29). Заключение: Высокий уровень СА125, в известной степени отражающий гиперэкспрессию MUC16, является мощным независимым фактором негативного прогноза при метастатическом раке желудка. В настоящее время возможным фактором преодоления негативного влияния остается, вероятно, интенсификация режимов химиотерапии. Однако в будущем решение проблемы лежит в поисках адекватных мишеней и способах нейтрализации негативного влияния гиперэкспрессии МUС16 у больных метастатическим раком желудка.
Са125, рак желудка, muc16, химиотерапия, гастрэктомия, метастазы
Короткий адрес: https://sciup.org/140293846
IDR: 140293846
Текст научной статьи Повышенный уровень Са125 (МUC16) при метастатическом раке желудка - мощный фактор негативного прогноза выживаемости
CA125 был открыт в 1981 году, когда Bast RC et al. [1] обнаружили моноклональное антитело ОС125, которое селективно определялось на поверхности клеток яичников. Далее было определено, что этот антиген может обнаруживаться в сыворотке большинства больных раком яичников [2]. Однако точная биохимическая характеристика СА125 была неизвестна до 2001 года, когда Yin BW [3] секвенировали первый клеточный клон ДНК и определили, что он соответствует экстарцеллюлярному домену нового муцинового протеина, который они назвали MUC16.
Дальнейшие исследования показали, что эктопическая экспрессия MUC16 может отвечать за резистент- ность к цитостатикам, например, цисплатину, и подавляет процесс апоптоза [4,5], хотя точный механизм до сих пор неизвестен. Также показано, что С-концевой пептид MUC16 взаимодействует с Sгс-семейством киназ, и это ведет к дерегуляции В-катенина и Е-кадгерина [6], что может способствовать развитию отдаленных метастазов.
В целом, муцины, кодируемые MUC генами, представляют собой гликопротеины и могут быть подразделены на 4 категории: образующие муцинозные структуры (MUC 2, -5АС, -5В, -6, и -19), образующие немуцинозные структуры (MUC7, -8, и -9), трансмембранные (MUC1, -ЗА, -ЗВ, -4, -12, -13, -14, -15, -16, -17, -20, и -21) и неклассифи-цируемые (MUC 11) [7]. Трансмембранные муцины обнаруживаются на апикальных отделах эпителиальных клеток и подслизистой оболочки респираторного и гастроинтестинального тракта [8]. Также исследования показали, что мезотелий (брюшина, плевра. перикард) сам может является существенным источником СА125 [9,10,11].
Гиперэкспрессия муцинов выявляется в злокачественных опухолях ЖКТ, и считается, что она может быть ответственна за рост и выживаемость опухолевых клеток [12], а также за подавление противоопухолевого иммунитета [13]. В частности, MUC16 показал способность оказывать негативное влияние на формирование иммунного ответа против клеток рака яичников путем прямого подавления функции NK-клеток [14,15].
Таблица 1. Характеристика больных, вошедших в оценку
Материалы и методы
Из представленных данных очевидно, что большинство больных имели синхронные метастазы, в основном в печень и брюшину, диссеминация распространялась на 1–2 зоны (включая и первичную опухоль), чаще всего при аденокарциноме, подавляющее большинство с низко-и недифференцированной формами. Части больных (28%) при достижении хорошего клинического эффекта было выполнено паллиативное удаление первичной опухоли.
Повышенным уровнем СА125 считался уровень выше 37 МЕ/мл. Повышенный уровень отмечался у 39 больных (52%), максимально до 7871 Ме/мл.
В качестве химиотерапии I линии применялась монотерапия у 4 больных (у двоих — капецитабин, у одного — паклитаксел еженедельно и у одного — иринотекан), двухкомпонентные режимы использованы у 44 больных (у 39 — FOLFOX/САРОХ, цисплатин + капецитабин/5-ФУ, у 5 — FOLFIRI), трехкомпонентные режимы — у 27 больных (24 FLOT, 3 FOLFIRINOX). Применение неплатиновых режимов в основном было обусловлено ранним прогрессированием после адъювантной химиотерапии. Трастузумаб при HER2/neu 3+ был использован у 3 больных. Распределение режимов химиотерапии в группах больных с повышенным и нормальным СА 125 представлено в табл. 2.
Результаты
При оценке влияния уровня СА125 на время до прогрессирования и общую выживаемость были получены следующие результаты (рис. 1 и 2).
Оказалось, что повышенный уровень СА125 значимо негативно влиял как на медиану времени до прогрессирования (3,5 мес. (ДИ 2,87–9,53) против 6,2 мес.,
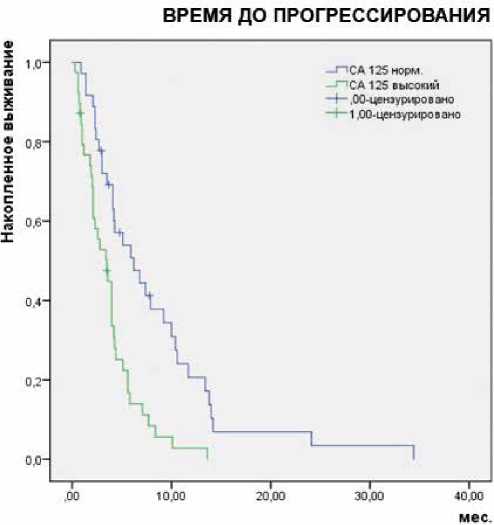
Таблица 2. Режимы химиотерапии в группах больных
|
СА 125 норма (n=36) |
СА 125 повышен (n=39) |
р |
|
|
Монотерапия |
4 (11%) |
1 (2,5%) |
0,8 |
|
|Дублеты |
20 (55,5%) |
22 (56,4%) |
1 |
|
Триплеты |
12 (33,3%) |
16 (38,4%) |
0,63 |
Таким образом, больные в группах получали сходную по интенсивности химиотерапию, в основном двух- и трехкомпонентную.
Статистический анализ
Статистическая обработка проводилась с использованием программ IВМ SPSS Statistics v. 23. Различия в частоте встречаемости оценивались тестом Фишера, время до прогрессирования и общая выживаемость по методу Каплана–Майера, многофакторный анализ и соотношение рисков регрессией Кокса.
ОБЩАЯ ВЫЖИВАЕМОСТЬ
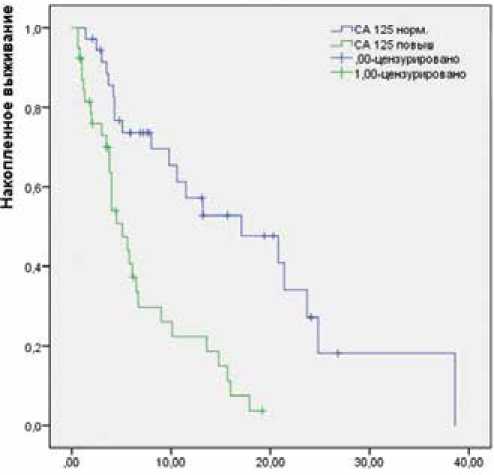
Рисунки 1, 2. Время до прогрессирования и общая выживаемость больных в зависимости от уровня СА125.
р=0,001, (ДИ 2,02–4,9), так и общую выживаемость (5,1 мес. (ДИ 6,07–28,1) против 17,1 мес. (ДИ 3,5–6,67), р=0,001).
Мы провели оценку влияния интенсивности химиотерапии (дублеты или триплеты) в группе больных с повышенным уровнем СА125. Оказалось, что триплетные режимы (FLОТ и FOLFIRINOX) демонстрировали несколько лучшее время до прогрессирования (4,0 против 2,7 мес.) и выживаемость (6,7 мес. против 4,0 мec.) по сравнению с дублетами, однако различия были статистически не достоверными (р=0,29).
При оценке числа больных, получавших 2 и более линии химиотерапии, было показано, что у больных с нормальным (при первичном диагнозе) уровне СА125 химиотерапию II линии получали 18 из 36 больных (50%), в то время как с повышенным уровнем маркера — 11 из 39 (28%), р=0,06.
С учетом того, что повышение СА125 может быть связано с метастазами в брюшину, мы оценили чувствительность и специфичность уровня СА125 для диагностики канцероматоза.
При наличии метастазов в брюшину уровень СА125 был повышен в 62% случаев. При отсутствии —у 39,4% больных. Таким образом, уровень СА125 не продемонстрировал ни чувствительности, ни специфичности в отношении диагностики метастазов в брюшину. Это говорит о том, что основным источником маркера являлась первичная опухоль и метастазы, но не результат связывания MUC16 с мезотелином.
Обсуждение
Значимость СА125 как фактора негативного прогноза в основном изучалась при раке яичников. В качестве попыток преодоления негативного влияния СА125 (МUС16) были разработаны несколько стратегий, направленных на связывание в сыворотке СА125 или индукцию иммунного ответа.
Список литературы Повышенный уровень Са125 (МUC16) при метастатическом раке желудка - мощный фактор негативного прогноза выживаемости
- Bast RC, Jr., Feeney M, Lazarus H, et al. Reactivity of a monoclonal antibody with human ovarian carcinoma. J Clin Invest 1981;68 (5): 1331-7. [PubMed: 7028788]
- Klug TL, Bast RC, Jr., Niloff JM, et al. Monoclonal antibody immunoradiometric assay for an antigenic determinant (CA 125) associated with human epithelial ovarian carcinomas. Cancer Res 1984;44 (3):1048—53. [PubMed: 6198078]
- Yin BW, Dnistrian A, Lloyd KO. Ovarian cancer antigen CA125 is encoded by the MUC16 mucin gene. Int J Cancer 2002;98 (S): 737—40. [PubMed: 11920644]
- S. Das, S. Rachagani, M. P. Torres-Gonzalez et al. Carboxyl-terminal domain of MUC16 imparts tumorigenic and metastatic functions through nuclear translocation of JAK2 to pancreatic cancer cells. Oncotarget. 2015 Mar 20;6 (8):5772-87. doi: 10.18632/oncotarget. 3308.
- M. Boivin, D. Lane, A. Piche CA125 (MUC16) tumor antigen selectively modulates the sensitivity of ovarian cancer cells to genotoxic drug-induced apoptosis. Gynecol Oncol. 2009 Dec;115 (3):407-13. doi:10.1016/j. ygyno. 2009.08.007. Epub 2009 Sep 10.
- C. Theriault, M. Pinard, M. Comamala et al. MUC16 (CA125) regulates epithelial ovarian cancer cell growth, tum-origenesis and metastasis Gynecol Oncol. 2011 Jun 1;121 (3):434-43. doi: 10.1016/j. ygyno. 2011.02.020. Epub 2011 Mar 21.
- S. Senapati, P. Sharma, S. Bafna, et al. The MUC gene family: their role in the diagnosis and prognosis of gastric cancer. Histol Histopathol. 2008; 23:1541-52. [PubMed: 18830939]
- 8. S. Bafna, S. Kaur, S. K. Batra. Membrane-bound mucins: the mechanistic basis for alterations in the growth and survival of cancer cells. Oncogene. 2010; 29:2893-904. [PubMed: 20348949]
- Kabawat, S. E., Bast, R. C., Bahn, A. K. et al. (1983) Tissue distribution of acoelomic-epithelium-related antigen recognized by the monoclonal antibody OC 125. Int.J. Gynecol. Pathol., 2, 275-285.
- Zeillemaker, A. M., Verbrugh, H. A., Hoynck van Papendrecht, A. A. G. M. et al. CA125 secretion by peritoneal me-sothelial cells. J. Clin. Pathol 47, 263-265.
- Zeimet, A. G., Offner, F. A., Muller-Holzner, E. et al. (1998) Peritoneum and tissues of the female reproductive tract as physiological sources of CA125. Tumor Biol., 19, 275-282
- Jonckheere, I. Van Seuningen The membrane-bound mucins: how large O-glycoproteins play key roles in epithelial cancers and hold promise as biological tools for gene-based and immunotherapies. Crit Rev Oncog. 2008: 14:177—96. (PubMed: 19409062]
- RC. Bast Jr, D. R. Spriggs. More than a biomarker: CA125 may contribute to ovarian cancer pathogenesis. Gynecol Oncol 2011, 121:429-430
- Gubbels JA, Felder M, Horibata S, et al. MUC16 provides immune protection by inhibiting synapse formation between NK and ovarian tumor cells. Mol Cancer 2010;9:11. [PubMed: 20089172]
- Belisle JA, Horibata S, Jennifer GA, et al. Identification of Siglec-9 as the receptor for MUC16 on human NK cells, B cells, and monocytes. Mol Cancer 2010;9:118. [PubMed: 20497550]
- M. M. Streppel, A. Vincent, R. Mukherjee, et al. Mucin 16 (cancer antigen 125) expression in human tissues and cell lines and correlation with clinical outcome in adenocarcinomas of the pancreas, esophagus, stomach, and colon. Hum Pathol. 2012 October; 43 (10): 1755-1763. doi:10.1016/j. humpath. 2012.01.005
- Kim DH, Yun HY, Ryu DH et al. Preoperative CA 125 is significant indicator of curative resection in gastric cancer patients. World J Gastroenterol. 2015 Jan 28;21 (4):1216-21. doi: 10.3748/wjg. v21. i4.1216.
- Namikawa T, Kawanishi Y, Fujisawa K, et al. Serum carbohydrate antigen 125 is a significant prognostic marker in patients with unresectable advanced or recurrent gastric cancer. Surg Today. 2018 Apr;48 (4):388-394. doi: 10.1007/ s00595-017-1598-3. Epub 2017 Oct 17.
- A. Perrier, J. Gligorov, G. Lefèvre, The extracellular domain of Her2 in serum as a biomarker of breast cancer. Lab Invest. 2018 Jun;98 (6):696-707. doi: 10.1038/s41374-018-0033-8. Epub 2018 Feb 28.
- K. Moreno-Aspitia, D. W. Hillman, S. H. Dyar et al. Soluble human epidermal growth factor receptor 2 (HER2) levels in patients with HER2-positive breast cancer receiving chemotherapy with or without trastuzumab: results from North Central Cancer Treatment Group adjuvant trial N9831. Cancer. 2013 Aug 1;119 (15):2675-82. doi: 10.1002/cncr. 28130. Epub 2013 Jun 6.
- K. Oyama, S. Fushida, T. Tsukada et al. Evaluation of serum HER2-ECD levels in patients with gastric cancer J Gastroenterol. 2015 Jan;50 (1):41-5. doi: 10.1007/s00535-014-0941-3. Epub 2014 Feb 21.
- H.-Z Shi, Y.-N. Wang, X.-H. Huang et al. Serum HER2 as a predictive biomarker for tissue HER2 status and prognosis in patients with gastric cancer. World J Gastroenterol. 2017 Mar 14;23 (10):1836-1842. doi: 10.3748/wjg. v23. i10.1836.
- M. Saito, K. Yamashita, Y. Arimura et al. Serum HER2 as an adjunct to assess HER2 status for advanced gastric cancer: A prospective multicenter trial (SHERLOCK). Acta Oncol. 2016;55 (3):309-17. doi: 10.3109/0284186X. 2015.1107189. Epub 2016 Jan 12.
- J. Berek, P. Taylor, W. McGuire, et al. Oregovomab maintenance monoimmunotherapy does not improve outcomes in advanced ovarian cancer. J Clin Oncol. 2009 Jan 20;27 (3):418-25. doi: 10.1200/jœ. 2008. 17.8400. Epub 2008 Dec 15.
- P. Sabbatini, P. Harter, G. Scambia, et al. Abagovomab as maintenance therapy in patients with epithelial ovarian cancer: a phase III trial of the AGO OVAR, COGI, GINECO, and GEICO--the MIMOSA study. J Clin Oncol. 2013 Apr 20;31 (12):1554-61. doi: 10.1200/jCO. 2012.46.4057. Epub 2013 Mar 11.


