Поздняя диагностика болезни Данона: морфологическая характеристика LAMP2-кардиомиопатии (клиническое наблюдение)
Автор: Мотина Наталья Владимировна, Веселовская Надежда Григорьевна, Костюченко Геннадий Иванович, Чумакова Галина Александровна, Отт Анна Владимировна, Мотин Юрий Григорьевич
Журнал: Морфологические ведомости @morpholetter
Рубрика: Оригинальные исследования
Статья в выпуске: 3 т.30, 2022 года.
Бесплатный доступ
Болезнь Данона является редким и сложным для диагностики Х-сцепленным наследственным заболеванием, обусловленным дефицитом лизосом-ассоциированного мембранного протеина 2 или LAMP2. Основные клинические симптомы включают поражение миокарда с развитием гипертрофической LAMP2-кардиомиопатии, скелетную миопатию и интеллектуальные нарушения. Заболевание характеризуется быстро прогрессирующим течением, что требует динамического наблюдения пациентов. Наиболее значимым неблагоприятным прогностическим фактором и основной причиной смерти является развитие кардиомиопатии. Однако, лизосомальное накопление гликогена в кардиомиоцитах часто остается не распознанным в качестве причины развития гипертрофической кардиомиопатии. Целью исследования явилось проведение клинико-морфологического анализа случая поздней диагностики LAMP2-кардиомиопатии у пациента-женщины 44 лет. Использовались данные истории болезни, результаты прижизненных лабораторно-инструментальных исследований, качественные и количественные морфологические исследования эндомиокардиальных биоптатов. В результатах исследования представлены клинические признаки, результаты морфологического исследования на светооптическом и электронно-микроскопическом уровнях, показаны особенности структурной перестройки кардиомиоцитов. Обнаружено формирование мультиламеллярных миелиноподобных структур под сарколеммой кардиомиоцитов. Наблюдались признаки повреждения клеток - значительная неравномерная вакуолизация саркоплазмы с выявлением в отдельных вакуолях фрагментов PAS-позитивного содержимого, дисторсия кардиомиоцитов. Отмечалось исчезновение поперечной исчерченности и локальные нарушения целостности сарколеммы. Интерстиций характеризовался рыхлой лимфомононуклеарной инфильтрацией с примесью одиночных сегментоядерных лейкоцитов, явлениями отека, мелкоочаговым склерозом преимущественно по перимускулярному типу. В элементах микроциркуляторного русла на светооптическом уровне наблюдались признаки активации эндотелия. По совокупности клинико-анамнестических данных, результатов молекулярно-генетического, морфологического исследования была установлена метаболическая причина гипертрофии миокарда, ранее клинически не распознанная, с морфологической картиной LAMP2-кардиомиопатии - болезни Данона и выставлен сответствующий диагноз. Авторами представлен редкий случай позднего выявления болезни Данона (LAMP2-кардиомиопатии) с накоплением в саркоплазме кардиомиоцитов аутофагоцитарного материала, гликогена, формированием осмиофильных миелиноподобных структур. Представленный клинический случай наглядно демонстрирует практическую значимость ультраструктурного патоморфологического исследования эндомиокардиального биоптата для определения истинной формы метаболической гипертрофии и оценки степени морфологической перестройки миокарда.
Болезнь данона, гипертрофическая кардиомиопатия, лизосом-ассоциированный мембранный протеин 2, патологическая анатомия, электронная микроскопия
Короткий адрес: https://sciup.org/143178912
IDR: 143178912 | DOI: 10.20340/mv-mn.2022.30(3).638
Текст научной статьи Поздняя диагностика болезни Данона: морфологическая характеристика LAMP2-кардиомиопатии (клиническое наблюдение)
Введение. Болезнь Данона – тяжелое метаболическое заболевание, связанное с первичным дефицитом лизосом-ассоциированного мембранного протеина 2 (LAMP2), важного структурного компонента мембран лизосом. Первое описание этой патологии было дано M. Danon в 1981 г., когда он опубликовал результаты морфологического исследования мышечных тканей двух мальчиков, страдающих кардиомиопатией, скелетной миопатией и отставанием в умственном развитии [1]. Позднее была установлена связь между развитием заболевания и мутацией в гене LAMP2 и высказано предположение, что в основе патогенеза лежит нарушение процессов аутофагии [2-3]. Нарушение функции протеина LAMP2 ведет к накоплению в мышечных клетках аутофагоцитарного материала и гликогена, что служит причиной увеличения размеров клеток, их гибели, развития гипертрофических и фиброзных изменений в миокарде [4]. Заболевание наследуется доминантно, сцеп-ленно с Х-хромосомой, поэтому клиническая картина у мужчин и женщин значительно отличается [5-6]. У мужчин наблюдается более тяжелое течение и ранняя манифестация. Клиническая картина болезни у женщин в силу гетерозиготности и поздней пенетрантности часто характеризуется стертой клинической симптоматикой, не полной выраженностью классической триады заболевания – скелетная миопатия и когнитивные нарушения у женщин встречаются гораздо реже, чем у мужчин, что в ряде случаев затрудняет диагностику, особенно при невозможности выполнения генетического исследования.
В отечественной литературе публикации о случаях диагностики болезни Данона встречаются не часто, еще реже публикуются работы с описанием результатов морфологического и ультраструк-турного исследования биопсийного материала миокарда. В связи с редкостью заболевания и сложностью диагностики распространенность болезни Данона в популяции достоверно не известна. По данным разных исследователей LAMP2 мутации обнаруживаются у 2-6% больных с гипертрофической кардиомиопатией [5-6]. В этой связи высказано предположение о минимальной распространенности болезни Данона в европейской популяции от 2 до 6 случаев на 100000 населения [7]. Необходимо отметить, что в работах K. Suigie с соавт. указывается на возможную гиподиагностику данного состояния у пациентов с гипертрофической кардиомиопатией, особенно у женщин при стертой клинической картине заболевания [8]. Поэтому мы сочли возможным представить собственный опыт наблюдения гипертрофической кардиомиопатии, связанной с мутацией в гене LAMP2.
Цель исследования: описать структурную перестройку миокарда при исследовании клинического случая поздней диагностики болезни Данона.
Материалы и методы исследования. В настоящей работе клиникоморфологическое исследование образцов биоптата миокарда проведено у пациентки с клиническим подозрением на кардиомиопатию при болезни Данона. В исследовании использованы сведения из истории болезни и результаты лабораторных и инструментальных данных. Пациент – жен- щина, 44 года. В анамнезе с детства беспокоили приступы учащенного сердцебиения, по поводу которых обследовалась у детского кардиолога, в процессе диагностики был исключен синдром Вольфа-Паркинсона-Вайта. Далее не наблюдалась, приступы сердцебиения были кратковременными, беспокоили редко. В возрасте 39 лет наступило ухудшение состояния в виде учащения приступов сердцебиения, при трансторакальном эхокардиографическом обследовании (далее - ЭХОКГ) выявлена гипертрофия миокарда левого желудочка с утолщением межжелудочковой перегородки (далее - МЖП) и задней стенки левого желудочка (далее - ЗСЛЖ) до 13 мм, характер нарушений ритма не верифицирован, генетическое исследование не проводилось. По результатам обследования пациентке выставлен диагноз - гипертрофическая кардиомиопатия без обструкции выходного отдела левого желудочка, назначена медикаментозная терапия □ -блокаторами. В возрасте 43 лет пароксизмы нарушения ритма стали чаще, со слов пациентки, через день. По результатам ЭКГ впервые была верифицирована пароксизмальная форма фибрилляции-трепетания предсердий, по поводу чего проведена радиочастотная аблация (далее - РЧА) устьев правых и левых легочных вен, зоны предсердной тахикардии, перешейка между устьем нижней полой вены и фиброзным кольцом трехстворчатого клапана.
В возрасте 44 лет появилась клиника декомпенсации хронической сердечной недостаточности в виде одышки, ортопноэ. Пациентка была госпитализирована в отделение некоронарогенной патологии миокарда Алтайского краевого кардиологического диспансера. Из анамнеза жизни известно, что отец умер внезапно во сне в возрасте 60 лет, у старшего сына в возрасте 1,5 лет была диагностирована дилатационная кардиомиопатия, далее верифицирована болезнь Данона, мальчик погиб в возрасте 16 лет. Несмотря на очевидную отягощенную наследственность – обследование на генетические аномалии среди родственников первой линии не проводилось. В период госпитализации по результатам трансторакальной ЭХОКГ у пациентки обнаружена расширение ле- вых отделов сердца: расширение левого предсердия до 46 мм, конечнодиастолический размер левого желудочка составил 56 мм. Величина фракции выброса левого желудочка составила 45%, систолическое давление в правом желудочке 48 мм рт. ст. Наблюдались признаки гипертрофии миокарда левого желудочка с толщиной МЖП 11 мм, ЗСЛЖ 11 мм, увеличение индекса массы миокарда левого желудочка до 133 гр/м2. С учетом анамнеза жизни (нарушения ритма с детского возраста, сын страдал болезнью Данона), клинической картины (гипертрофический фенотип по ЭХОКГ в течение 5 лет без явных причин для гипертрофии миокарда с исходом в расширение камер сердца, отсутствие типичных признаков гипертрофической кардиомиопатии по ЭКГ, нарушения ритма, устойчивые к РЧА) образцы биологического материала пациентки были направлены на молекулярно-генетическое исследование и выполнена эндомиокардиальная биопсия с целью исключения болезни накопления миокарда.
После изучения биопсийного материала в диссекционном микроскопе был отобран один фрагмент для электронномикроскопического исследования, два фрагмента для проведения прямого им-мунофлюоресцентного исследования с использованием антител к иммуноглобулинам M, G, C3c, C4d, λ- и k- легким цепям, фибриногену. Оставшийся материал после фиксации в 10% растворе формалина обезвоживали, заливали в парафин. Полученные срезы окрашивали гематоксилином и эозином, по Массону, конго-красным, ставили PAS-реакцию. Для электронно-микроскопического исследования образцы тканей фиксировали в 3% растворе глутарового альдегида, приготовленном на фосфатном буфере (pH 7,2), с дофиксацией в 1% растворе ОsO4, дегидратировали в этиловом спирте возрастающей концентрации и заключали в эпон. Из полученных блоков готовили полутон-кие срезы толщиной 1 мкм, окрашивали толуидиновым синим, изучали под световым микроскопом и выбирали необходимые участки тканей для исследования в электронном микроскопе. Из отобранного материала получали ультратонкие срезы толщиной 55 нм на ультратоме Leica EM UC7, контрастировали насыщенным водным раствором уранилацетата, цитратом свинца и изучали в электронном микроскопе Libra 120 (Carl Zeiss, Германия) при ускоряющем напряжении 120кВ с последующим фотографированием при увеличениях от 1985 до 20000.
Результаты исследования и обсуждение. При гистологическом исследовании эндокард в изучаемых фрагментах тонкий, ровный, в них определялись дистрофические изменения кардиомиоцитов с просветлением перинуклеарной зоны и оттеснением сократительных элементов на периферию, неравномерная гипертрофия отдельных групп кардиомиоцитов с увеличением размеров до 35-40 мкм, перинуклеарное накопление липофусцина. Наблюдались признаки повреждения клеток – значительная неравномерная вакуо- дельных вакуолях фрагментов PAS-позитивного содержимого (рис. 1), дисторсия кардиомиоцитов. Отмечалось исчезновение поперечной исчерченности и локальные нарушения целостности сарколеммы. Интерстиций характеризовался рыхлой лимфомононуклеарной инфильтрацией с примесью одиночных сегментоядерных лейкоцитов, явлениями отека, мелкоочаговым склерозом преимущественно по перимускулярному типу (рис. 2). В элементах микроциркуляторного русла на светооптическом уровне наблюдались признаки активации эндотелия.
Прямое иммунофлюоресцентное исследование биоптатов показало картину схожую с аутоиммунным повреждением миокарда: фиксацию IgM и C3 c мелкогранулярного характера в зоне до 20-30% капилляров, фиксацию С3 с субэндокардиаль-но очагово по сарколемме и саркоплазме отдельных групп кардиомиоцитов [9].
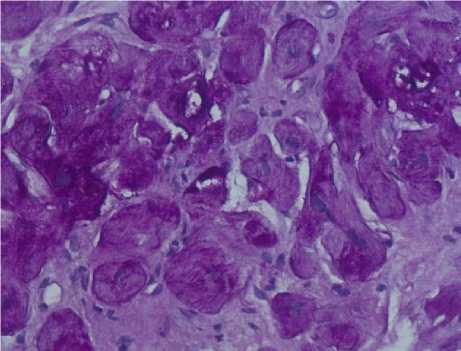
Рис. 1. Микрофото препарата миокарда пациентки. В саркоплазме гипертрофированных кардиомиоцитов определяются многочисленные различного размера вакуоли, часть из которых содержит неоднородное PAS-позитивное содержимое. Окр.: PAS-реакция. Ув.: ×400
лизация саркоплазмы с выявлением в от-
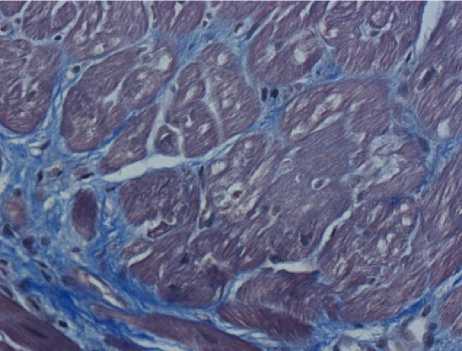
Рис. 2. Микрофото препарата миокарда пациентки. Мелкоочаговый склероз ин-терстиция. Неоднородная вакуолизация саркоплазмы кардиомиоцитов. Окр.: по Массону. Ув.: ×400
При электронномикроскопическом исследовании в кардиомиоцитах определялись многочисленные включения гликогена, располагающиеся преимущественно в периферических участках саркоплазмы и под сарколеммой. Наблюдалось расширение элементов саркоплазматической сети, аппарата Гольджи, вакуо- лизация цитоплазмы, скопление включений липофусцина. Отмечалось оттеснение сократительных элементов на периферию, участки дисторсии миофибрилл, их дезорганизации. Определялись группы митохондрий с явлениями набухания, снижением плотности матрикса, нарушением ориентации крист, их отеком и ва- куолизацией, фрагментацией, деструкцией мембран с высвобождением липидов и формированием одиночных мелких липидных капель в саркоплазме. Преимущественно в периферических участках саркоплазмы наблюдались многочисленные различные по размеру вакуоли, содержащие аутофагоцитарые элементы, гранулы гликогена (рис. 3). Между миофиламентами располагались многочисленные рибосомы, одиночные вторичные лизосомы с электронно-контрастным неоднородным содержимым. В периферических участках саркоплазмы отмечалось формирование электронноплотных образований, представленных концентрически расположенными мембранными элементами по типу миелиноподобных структур (рис. 4). Локально определялось нарушение целостности сарколеммы, разволокнение, нечеткость структуры базальной мембраны.
В результате молекулярногенетического исследования образцов биологического материала пациентки методом прямого секвенирования по Сэнгеру был обнаружен генетический вариант NM_002294.3:c.893_923del(p.E298Afs*38) в гетерозиготном состоянии последовательности гена LAMP2.
Основным морфологическим проявлением болезни Данона является развитие гипертрофической кардиомиопатии вследствие отложения в кардиомиоцитах и их лизосомах аномальных продуктов метаболизма. При этом по клиническим проявлениям болезнь Данона практически не отличается от других форм гипертрофических кардиомиопатий. В типичных случаях LAMP2-кардиомиопатия проявляется концентрической симметричной гипертрофией миокарда со значительным увеличением толщины стенки левого желудочка, по данным литературы до 29-65 мм [7].
Однако в описанном нами случае наблюдается поздний дебют заболевания, стертая клиническая картина с отсутствием выраженной гипертрофии миокарда левого желудочка по результатам ЭХОКГ, отсутствие скелетной миопатии и когнитивных нарушений, что вероятно связано с полом пациента и может объяснять позднюю диагностику заболевания.
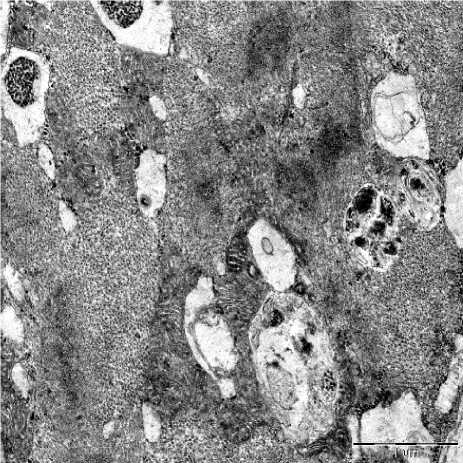
Рис. 3. Ультрамикрофото препарата миокарда пациентки. В саркоплазме кардиомиоцита содержатся многочисленные аутофагоцитарные включения. Электронная микроскопия. Ув.: ×6300
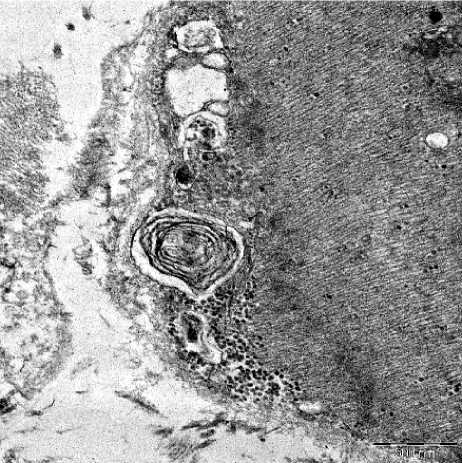
Рис. 4. Ультрамикрофото препарата миокарда пациентки. Формирование муль-тиламеллярной миелиноподобной структуры в периферических участках саркоплазмы кардиомиоцита. Участки разволокнения базальной мембраны. Электронная микроскопия. Ув.: ×10000
При этом морфологически в тканях миокарда наблюдались типичные признаки LAMP2-кардиомиопатии с выраженной гипертрофией кардиомиоцитов, наличием цитоплазматических вакуолей различного размера и фиброзом интер-стиция. При проведении ультраструктур-ного исследования в саркоплазме кардиомиоцитов были выявлены многочисленные включения аутофагоцитарного материала и гликогена, признаки дезорганизации миофибрилл, что также соответствует морфологической картине болезни Данона. Однако в большинстве исследований не описывается наличие миелиноподобных структур, которые обнаруживались нами под сарколеммой кардиомиоцитов. Вероятно, формирование этих образований можно связать с имевшими место процессами развивающегося аутофагоцитоза вследствие частичного сохранения функций мутантных LAMP2 белков, что подтверждается обнаружением в саркоплазме вторичных лизосом [12].
По совокупности клиникоанамнестических данных, результатов молекулярно-генетического, морфологического исследований, включавшего имму-
Список литературы Поздняя диагностика болезни Данона: морфологическая характеристика LAMP2-кардиомиопатии (клиническое наблюдение)
- Danon MJ, Oh SJ, DiMauro S, et al. Lysosomal glycogen storage disease with normal acid maltase. Neurology. 1981;31(1):51-7. https://doi.org/10.1212/wnl.31.1.51
- Nishino I, Fu J, Tanji K, Yamada T, et al. Primary LAMP-2 deficiency causes X-linked vacuolar cardiomyopathy and myopathy (Danon disease). Nature. 2000;406(6798):906-10. https://doi.org/10.1038/35022604
- Tanaka Y, Guhde G, Suter A, et al. Accumulation of autophagic vacuoles and cardiomyopathy in LAMP-2-deficient mice. Nature. 2000;406(6798):902-6. https://doi.org/10.1038/35022595
- Roos JCP, Daniels MJ, Morris E, et al. Heterogeneity in a large pedigree with Danon disease: Implications for pathogenesis and management. Mol Genet Metab. 2018;123(2):177-183. https://doi.org/10.1016/j.ymgme.2017.06.008
- Boucek D, Jirikowic J, Taylor M. Natural history of Danon disease. Genet Med. 2011;13(6):563-8. https://doi.org/10.1097/GIM.0b013e31820ad795
- Cheng Z, Fang Q. Danon disease: focusing on heart. J Hum Genet. 2012;57(7):407-10. https://doi.org/10.1038/jhg.2012.72
- Vaykhanskaya TG, Sivitskaya LN, Danilenko NG i dr. Bolezn' Danona: redko vyyavlyaemoe sistemnoe zabolevanie s lamp2-kardiomiopatiey. Ros-sysky kardiologichesky zhurnal. 2017;10(150):93-99. In Russian
- Sugie K, Komaki H, Eura N, et al. A Nationwide Survey on Danon Disease in Japan. Int J Mol Sci. 2018;19(11):3507. https://doi.org/10.3390/ijms19113507
- Blagova OV, Nedostup AV, Kogan EA. Bolezni miokarda i perikarda. Ot sindromov k diagnozu i lecheniyu.- Moskva: Gyeotar-Mediya; 2019.- 884s. In Russian.
- Taylor MRG, Ku L, Slavov D et al. Familial Cardiomyopathy Registry. Danon disease presenting with dilated cardiomyopathy and a complex phenotype. J Hum Genet. 2007;52(10):830-835. https://doi.org/10.1007/s10038-007-0184-8
- Maron BJ. A phenocopy of sarcomeric hypertrophic cardiomyopathy: LAMP2 cardiomyopathy (Danon disease) from China. Eur Heart J. 2012;33(5):570-2. https://doi.org/10.1093/eurheartj/ehr438
- Hariri M, Millane G, Guimond MP, et al. Biogenesis of multilamellar bodies via autophagy. Mol Biol Cell. 2000;11(1):255-68. https://doi.org/10.1091/mbc.11.1.255
- Cheng Z, Fang Q. Danon disease: focusing on heart. J Hum Genet. 2012;57(7):407-10. https://doi.org/10.1038/jhg.2012.72


