Прагматический подход к выявлению фибрилляции предсердий, определение программы вторичной профилактики у пациентки с эмболическим криптогенным инсультом: представление клинического случая с учетом современного состояния проблемы
Автор: Мехряков С.А., Сыромятникова Л.И., Кулеш А.А.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические случаи
Статья в выпуске: 3 т.37, 2022 года.
Бесплатный доступ
Представлен клинический пример использования диагностического алгоритма выявления критериев предсердной кардиопатии (ПК) у пациентки с криптогенным инсультом (КИ), что определило необходимость выполнения продленного мониторирования электрокардиограммы (ЭКГ), обнаружения субклинической фибрилляции предсердий (ФП) и последующего коллегиального установления показаний для инициации антикоагулянтной терапии с учетом высокого риска повторного инсульта.
Фибрилляция предсердий, криптогенный инсульт, предсердная кардиопатия, антикоагулянтная терапия
Короткий адрес: https://sciup.org/149141429
IDR: 149141429 | УДК: 616.12-008.313.2-07-08-039.71:616.831-005.1-06 | DOI: 10.29001/2073-8552-2022-37-3-136-143
Текст научной статьи Прагматический подход к выявлению фибрилляции предсердий, определение программы вторичной профилактики у пациентки с эмболическим криптогенным инсультом: представление клинического случая с учетом современного состояния проблемы
Своевременная диагностика фибрилляции предсердий (ФП) является краеугольным камнем как первичной, так и вторичной профилактики ишемического инсульта (ИИ). Понимание феномена предсердной кардиопатии (ПК) как причины тромбообразования в левом предсердии (ЛП), предтечи клинической манифестации ФП, определяет необходимость активного поиска субклинической ФП у пациентов с криптогенным инсультом (КИ) для своевременного начала терапии оральными антикоагулянтами (ОАК) [1]. Ожидаемо, что частота выявления ФП прямо пропорциональна продолжительности мониторинга. Так, в исследовании M. Grond и соавт. [2] у пациентов с ИИ продемонстрировано преимущество диагностической чувствительности 3-суточного холтеровского мониторирования электрокардиограммы (ХМ-ЭКГ) над 24-часовым (4,3 против 2,6%), при 7-дневном – 5,8% [3]. В метаанализе 2019 г. [4], посвященном изучению выявляемости ФП при использовании имплантируемых устройств кардиомониторинга, выявлено, что при продолжительности мониторинга менее полугода частота регистрации ФП составила 5%, при длительности скрининга свыше 2 лет – 34%. Несет ли столь длительный мониторинг, выполнение которого требует значительных ресурсов, значительную клиническую пользу? Анализ рандомизированных клинических исследований CRYSTAL-AF [5] и FIND-AF [6] показал, что проведение пролонгированного кардиомониторинга ассоциировано с более частым назначением антикоагулянтов, а также с меньшей частотой повторных инсультов [4]. Однако в рутинной клинической практике единственным доступным методом пролонгированного кардиомониторинга остается 72-часовое ХМ-ЭКГ с частотой выявляемости скрытой ФП при его использовании не более 5% [2].
Очевидным становится вопрос использования дополнительных маркеров, позволяющих кардиологу таргет-но назначать трехсуточный ЭКГ-мониторинг у пациента с КИ. Представляется целесообразным использование маркеров ПК для определения модели пациента со скрытой ФП. К таким маркерам относятся: пароксизмальная наджелудочковая тахикардия, вариабельность зубца Р в отведении V1, увеличение размеров ЛП, феномен спонтанного эхоконтрастирования в полости и ушке ЛП, снижение скорости изгнания из ушка ЛП по данным эхокардиографии, фиброз ЛП при магнитно-резонансной томографии (МРТ), а также уровень про-натрийуретического N-концевого пептида В-типа [7–10].
Клинический пример
Согласно данным проведенных наблюдений, в 33% этиология ИИ по критериям TOAST остается неизвестной, при этом эмболический КИ определяется у 6,2% пациентов [10]. Пациентам с КИ проводится развернутое обследование, а именно дуплексное сканирование брахиоцефальных артерий (БЦА), трансторакальная эхокардиография (ТТЭхоКГ), транскраниальная допплерография с пузырьковой пробой (пациентам в возрасте до 65 лет), 24-часовое ХМ-ЭКГ, магнитно-резонансная ангиография, компьютерная (КТ) ангиография или селективная диги-тальная ангиография с оценкой проходимости экстра- и интракраниальных артерий. На основании проведенного обследования формируется подгруппа пациентов с признаками ПК, высокой вероятностью наличия ФП, которым требуется продленное ХМ-ЭКГ для установления показаний к назначению полнодозовой терапии ОАК с целью вторичной профилактики инсульта.
В данном клиническом примере продемонстрирована целесообразность таргетного назначения пролонгированного 72-часового ХМ-ЭКГ для выявления скрытой ФП у пациентки с КИ и эхокардиографическими признаками ПК и последующего «раннего» назначения ОАК на основании установленного высокого риска повторного ИИ.
В неврологическое отделение Регионального сосудистого центра с подозрением на острое нарушение мозгового кровообращения (ОНМК) доставлена пациентка 79 лет. Накануне вечером она общалась с дочерью по телефону, каких-либо жалоб не предъявляла. Утром следующего дня появились нарушения речи при отсутствии двигательного дефицита, в связи с чем была вызвана бригада скорой медицинской помощи. Из анамнеза известно, что пациентка длительное время страдает гипертонической болезнью, принимает антигипертензивные препараты.
В неврологическом статусе при поступлении отмечалась умеренная сенсомоторная афазия; результат шкалы инсульта Национального института здоровья (NIHSS) составил 9 баллов. Незамедлительно выполнена КТ головного мозга, по результатам которой выявлен инфаркт правой височной доли с геморрагической трансформацией (ГТ) 1 типа (рис. 1 А–В). Так как время от развития симптомов было достоверно неизвестно, а по КТ сформировался указанный очаг с ГТ, реперфузионная терапия не проводилась.
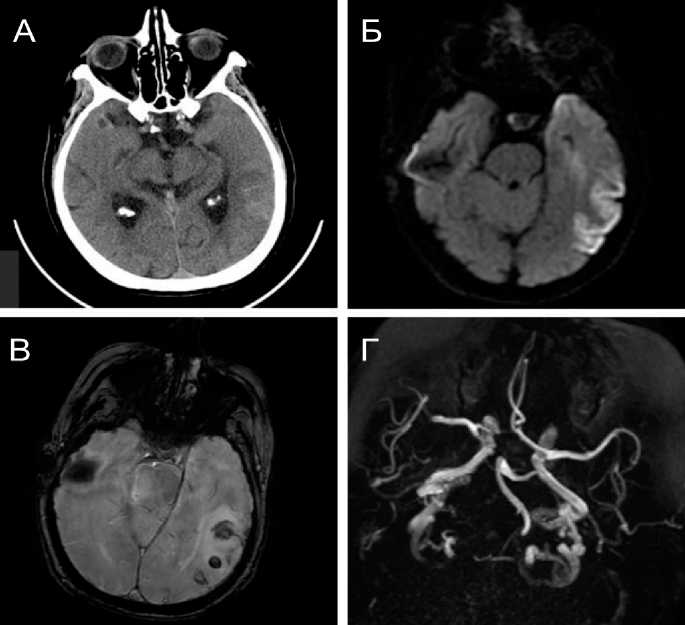
Рис. 1. Результаты нейровизуализации. А – КТ головного мозга, геморрагический инфаркт левой височной доли, Б – МРТ DWI – ограничение диффузии в левой височной доле, соответствующее острому инфаркту, В МРТ SWI – геморрагическая трансформация инфаркта, Г – МРТ 3D-TOF – магистральные артерии головного мозга проходимы
Fig. 1. Neuroimaging results. А – brain computed tomography scan with signs of hemorrhagic infarction of the left temporal lobe, Б – diffusion-weighted magnetic resonance imaging (MRI) showing restricted diffusion in the left temporal lobe corresponding to an acute infarction, В – susceptibility weighted imaging with the signs of hemorrhagic transformation of infarction, Г – three-dimensional time-of-flight MRI demonstrating patent major cerebral arteries
Инициирован поиск причины развития инсульта, на основании которого рутинная ЭКГ не зарегистрировала специфических изменений, по данным дуплексного сканирования БЦА зафиксированы признаки нестенозирующего атеросклероза без признаков нестабильности бляшек. Проведенная ТТЭхоКГ не выявила источников кардиоэм- болии, фракция выброса оценена как удовлетворительная (65% по методу Simpson), линейные размеры камер сердца соответствовали критериям нормы. Однако при прицельном изучении ЛП зарегистрировано увеличение индекса объема ЛП (ИОЛП) до 36 мл/м2 (при критериях нормы до 34 мл/м2). В связи с этим дополнительно рас- считаны показатели, позволяющие оценить функцию ЛП LAEF и LAFI, значения которых составили 50% и 0,27 ед. соответственно, что указывало на некоторое снижение функциональной способности ЛП [11]. По данным первичного 17-часового ХМ-ЭКГ регистрировался синусовый ритм, наджелудочковая экстрасистолия в количестве 248, в том числе групповые и парные, а также 4 эпизода наджелудочкового ускоренного ритма. В связи с выявлением эхокардиографических признаков ПК целесообразным представлялось проведение продленного 72-часового ХМ-ЭКГ, которое, несмотря на отсутствие зарегистрированных эпизодов ФП, позволило зафиксировать 61 эпизод ускоренного наджелудочкового ритма с частотой сердечных сокращений (ЧСС) до 108 ударов в минуту, а также 6 пароксизмов наджелудочковой тахикардии с ЧСС до 156 ударов в минуту с общей продолжительностью (бремя аритмии) за период мониторирования, не превышающего 10 мин. На 4-е сут проведена МРТ головного мозга, результат которой подтвердил данные КТ. Магистральные артерии головного мозга, по данным МРТ-ангиографии, были проходимы (рис. 1 Г), таким образом, на основании дополнительного обследования установлен диагноз эмболического криптогенного инсульта (ЭКИ).
К моменту завершения первого этапа реабилитации состояние пациентки улучшилась, однако сохраня- лась умеренная акустико-мнестическая афазия с амнестическим компонентом, результат NIHSS составил 1 балл, по модифицированной шкале Ренкина (mRS) – 1 балл. С целью вторичной профилактики ИИ назначена ацетилсалициловая кислота в дозе 75 мг в сутки, аторвастатин в дозе 20 мг в сутки, а также антигипертензивная терапия. На 16-й день от момента заболевания с учетом наличия реабилитационного потенциала, 2 баллов по шкале реабилитационного маршрута, пациентка направлена в отделение медицинской реабилитации.
Первоначальные данные ХМ-ЭКГ не позволили выявить ФП, однако сохранение подозрения на ее наличие определило целесообразность проведения повторного 72-часового ХМ-ЭКГ, по результатам которого зафиксирована преимущественно дневная предсердная эктопическая активность в виде предсердной экстрасистолии в количестве 284 комплексов, 68 наджелудочковых эпизодов ускоренного ритма, а также пароксизм ФП длительностью 6 с (рис. 2) при суммарном бремени предсердной аритмии за 72 ч – 9,5 мин. Важно отметить, что расчетный риск повторного инсульта по шкале CHA2DS2-VASc у пациентки был очень высоким и составил 6 баллов (артериальная гипертензия, перенесенный ИИ, возраст более 75 лет, женский пол).
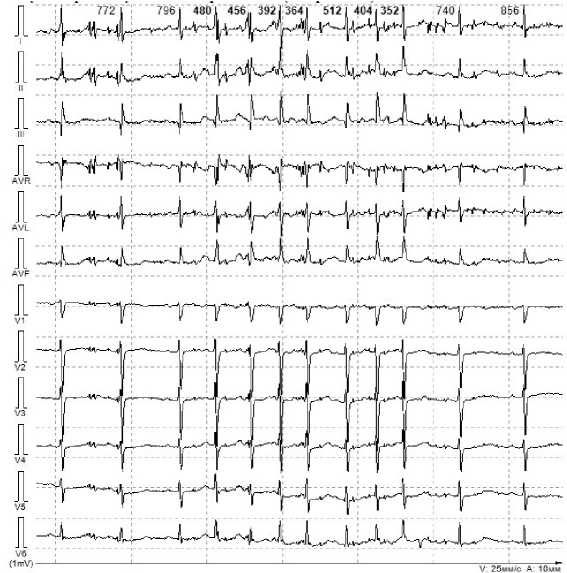
Рис. 2. Пароксизм фибрилляции предсердий, зарегистрированный у пациентки при повторном 72-часовом холтеровском мониторировании электрокардиограммы
Fig. 2. Paroxysm of atrial fibrillation recorded in a patient during repeated 72-hour Holter ECG monitoring
Обсуждение
Проведение углубленного ультразвукового исследования сердца с расчетом ИОЛП, LAEF и LAFI у пациентки с КИ и кардиоэмболическим нейровизуализационным паттерном определило необходимость продленного мо- ниторирования ЭКГ, что позволило зарегистрировать субклиническую ФП. Современное понимание ПК как патогенетического субстрата для тромбообразования и эмболии (рис. 3), маркерами которой являются предсердные пароксизмы высокой частоты/субклиническая ФП, ультразвуковые параметры, отражающие дисфункцию
ЛП в сочетании с высоким риском повторного инсульта по шкале CHA2DS2-VASc, определили коллегиальное клиническое решение о необходимости начала антикоагулянтной терапии. Сочетание выявленных ЭКГ и ультразвуковых маркеров ПК с нейровизуализационным паттерном, характерным для кардиоэмболического ИИ, определило снятие диагноза КИ, установление кардиоэмболического подтипа ИИ. Пересмотрена программа вторичной профилактики в аспекте антитромботической терапии, на основании решения консилиума отменен ан-тиагрегант, с учетом высокого риска тромбоэмболических событий назначен прямой ОАК.
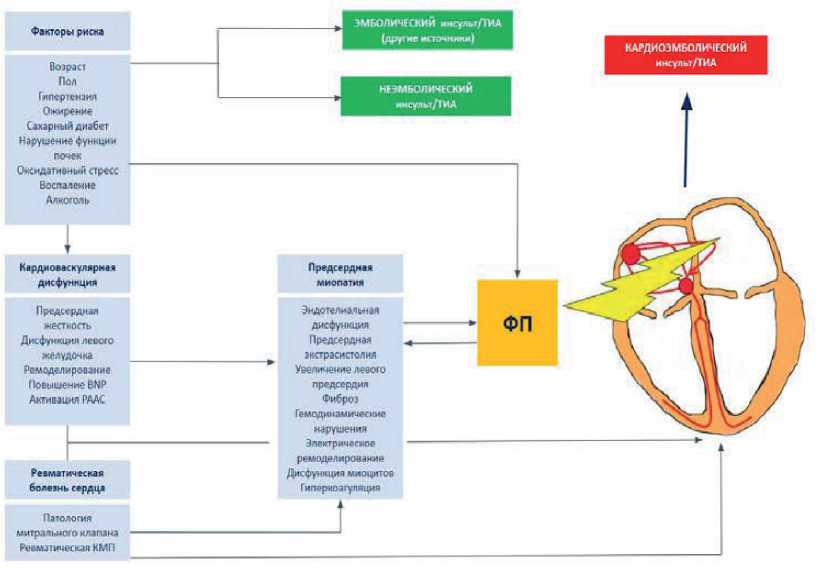
Патология митрального клапана Ревматическая КМП
Предирдн.» миопатия
Эндотелиальная дисфункция Предсердная экстрасистолия Увеличение левого предсердия Фиброз Гемодинамические нарушения Электрическое ремоделирование Дисфункция миоцитов Г илеркоагуляция
Факторы риска
Возраст Пол Гипергснзия Ожирение Сахарный диабет Нарушение функции
Оксидатиеный стресс Воспаленно Алкоголь
К а рди овес к ул я риа я дисфункция
Нарди о вас к улярна я дисфункция
Предсердная жесткость Дисфункция лсьото желудочка
Ремоделирование Повышение BNP Активация РАА<
Ревматическая болеянь сердца
КАГДИОЭМбОЛИЧККИЙ ижультДИА
ЭМБОЛИЧЕСКИЙ имсультДИА (другие источники!
НЕ ЭМБОЛИЧЕСКИЙ инсулы/ТИА
Рис. 3. Конкурирующие и синергетические механизмы предсердной кардиопатии и фибрилляции предсердий при ишемическом инсульте
Fig. 3. Competing and synergistic mechanisms of atrial cardiopathy and atrial fibrillation in ischemic stroke
Правильность данного клинического решения подтверждена дальнейшим амбулаторным наблюдением пациентки. При выполнении повторного ХМ-ЭКГ через 6 мес. выявлены пароксизмы ФП длительностью от 10 с до 3–5 мин. Терапия прямым ОАК ривароскабаном продолжена. От интервенционного лечения ФП пациентка воздерживается, принято решение о медикаментозной стратегии контроля ритма (метопролола сукцината в сочетании с аллапинином). Возможно предположить, что стратегия «раннего назначения» ОАК в данном клиническом случае была обоснованной и своевременной, позволила предупредить повторный ИИ.
Согласно современным российским (ID:КР382/1 2020 г.) и европейским клиническим рекомендациям по ФП [1], критерием клинически подтвержденного диагноза ФП является регистрация данного нарушения ритма в течение 30 и более секунд по данным носимого монитора ЭКГ или наличие ФП во всех отведениях при записи ЭКГ покоя одноканальным электрокардиографом, что по длительности эквивалентно 30-секундному интервалу. Короткие эпизоды ФП менее 10–20 с в день не рассматриваются как клинически значимые, так как они не ассоциированы с длительными эпизодами ФП, увеличением риска ИИ или системной эмболии [12]. Однако продолжительная нагрузка эпизодами предсердного частого ритма и/или субклинической ФП (минимум 4–5 мин/ч) ассоциирована с повышением риска клинически значимой ФП [13, 14], ИИ [13], сердечно-сосудистых осложнений [15] и сердечно-сосудистой смерти [16].
Длительное мониторирование ЭКГ основной метод диагностики субклинической ФП. Рассмотрение повышенной предсердной эктопической активности (пароксизмы наджелудочковой тахикардии, субклиническая ФП) как проявление ПК позволяет на основании эхокардиографической оценки ПК – морфологических (объем ЛП, ИОЛП) и функциональных (LAEF и LAFI) параметров ЛП определить целевую категорию для продленного мониторирования ЭКГ среди пациентов с КИ.
Наличие клинически подтвержденной ФП является показанием для оценки шкал CHA2DS20VASc и HASBLED и решения вопроса о назначении ОАК. Менее продолжительные пароксизмы ФП обозначаются как субклинические, и их предикторная эмбологенная роль в настоящее времени не определена. Однако подход «раннего назначения» антикоагулянтной терапии у пациентов с высокой предсердной аритмогенной активностью, субклинической ФП отражен в современных рекомендациях по ведению пациентов с ФП (рис. 4 [1]) и, с нашей точки зрения, особенно необходим к рассмотрению у пациентов с КИ с кардиоэмболическим паттерном, по данным нейровизуализации, высоким риском повторного инсульта по шкале CHA2DS2-VASc.
Риск инсульта/ повторная оценка регулярно

Высокий риск CHA2OS2-VASC 22 (м) ИЛИ 23 (ж)
е
Н и зкий риск CHA2DS2-VASC О (м) или 1 (ж)
Единственный фактор риска CHA2DS2-VASC
1 (м) или 2 (ж)
Короткие и редкие ПЭВЧ/СФП Низкая дневная нагрузка
Невинные пробежки
Наблюдение за:
Увеличение нагрузки ПЭВЧ/СФП или развитие КПФП

Продленные ПЭВЧ/СФП (21 часа, но <24часов): особенно при ™“ бремени
Длительные пзвм/сФП [224 часов): особенно при высокой месячной нагрузке
Наблюдение за:
т::™: -ткипзач/соп или развитие КПФП Изменение индивидуального риска инсульта
Рассматривать назначение ОАК у избирательной категории пациентов при высоком/очень высоком риске "нс?™*™ 2 а отсутствуют сомнения а диагнозе ФП при анализе данных записывающих устройств), когда клиническая выгода может быть ожидаемой (совместное решение)
Рис. 4. Алгоритм ведения пациента с предсердными эпизодами высокой частоты и/или субклинической фибрилляцией предсердий
Примечание: КПФП – клинически подтвержденная фибрилляция предсердий, ПЭВЧ – предсердный эпизод высокой частоты, ОАК – оральный антикоагулянт, СФП – субклиническая фибрилляция предсердий, ФП – фибрилляция предсердий, м – мужской пол, ж – женский пол.
Клинически подтвержденная ФП
THE RISK OF STROKE (re-assess regularly)
|
.^^^^^^^^^^^*, |
|||||
|
Low risk Single risk factor CHA2DS2-VASc CHA2DS2-VASc 0 (m) or 1 (f) 1 (m) or 2 (f) |
High risk CHA2DS2-VASc >2 (m) or >3 (f) |
||||
|
Short, rare ^K AF low dailу burden |
An "innocent bystander" |
Observe lor: CAP birdenor clinical AF development |
|||
|
Longer AHREs/SCAF (>1 h to <24 h) especially if high burden Long AHREs/SCAF (a24h) especially if high monthly burden |
Observe for: • increase in AHREs/SCAF burden or clinical AF development •Change in individual stroke risk |
Consideration for О AC use in selected patients at highfvery high risk of stroke" (where there are no doubts on AF diagnosis at device tracings analysis) when a positive net clinical benefit can be anticipated (shared decision-making) |
|||
Fig. 4. Algorithm of management of patient with atrial high-rate episodes and/or subclinical atrial fibrillation
Note: AF – atrial fibrillation, AHRE – atrial high-rate episode, OAC – oral anticoagulant, CKD – chronic kidney disease, SCAF – subclinical atrial fibrillation, f – female, m – male.
Clinical AF
Заключение
Дополнительное использование эхокардиографических маркеров ПК у пациентов с КИ в рутинной практике позволяет сузить диагностический поиск, выявить подгруп- пу пациентов, которым необходимо назначение пролонгированного ХМ-ЭКГ с целью обнаружения ФП и последующей коррекции мер вторичной профилактики, принятия коллегиального решения кардиолога и невролога о «раннем назначении» ОАК при высоком риске повторного ИИ.
Список литературы Прагматический подход к выявлению фибрилляции предсердий, определение программы вторичной профилактики у пациентки с эмболическим криптогенным инсультом: представление клинического случая с учетом современного состояния проблемы
- Hindricks G., Potpara T., Dagres N., Arbelo E., Bax J.J., Blomström-Lund-qvist C. et al. 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association of Cardio-Thoracic Surgery (EACTS): The Task Force for the diagnosis and management of atrial fibrillation of the European Society of Cardiology (ESC) Developed with the special contribution of the European Heart Rhythm Association (EHRA) of the ESC. Eur. Heart J. 2021;42(5):373-498. DOI: 10.1093/euheart/ehaa612.
- Grond M., Jauss M., Hamann G., Stark E., Veltkamp R., Nabavi D.G. et al. Improved detection of silent atrial fibrillation using 72-hour Holter ECG in patients with ischemic stroke a prospective multicenter cohort study. Stroke. 2013;44(12):3357-3364. DOI: 10.1161/STROKEA-HA.113.001884.
- Haeusler K.G., Kirchhof P., Heuschmann P.U., Laufs U., Busse O., Kunze C. et al. Impact of standardized MONitoring for Detection of Atrial Fibrillation in Ischemic Stroke (MonDAFIS): Rationale and design of a prospective randomized multicenter study. Am. Heart J. 2016;172:19-25. DOI: 10.1016/j.ahj.2015.10.010.
- Tsivgoulis G., Katsanos A.H., Köhrmann M., Caso V., Perren F., Palaiod-imou L. et al. Duration of implantable cardiac monitoring and detection of atrial fibrillation in ischemic stroke patients: A systematic review and meta-analysis. J. Stroke. 2019;21(3):302-311. DOI: 10.5853/ jos.2019.01067.
- Sanna T., Diener H.C., Passman R.S., Di Lazzaro V., Bernstein R.A., Morillo C.A. et al. Cryptogenic stroke and underlying atrial fibrillation. N. Engl. J. Med. 2014;370(26):2478-2486. DOI: 10.1056/NEJMoa1313600.
- Wachter R., Gröschel K., Gelbrich G., Hamann G.F., Kermer P., Liman J. et al. Holter-electrocardiogram-monitoring in patients with acute isch-aemic stroke (find-AF RANDOMISED): An open-label randomised controlled trial. Lancet Neurol. 2017;16(4):282-290. DOI: 10.1016/S1474-4422(17)30002-9.
- Kamel H., Bartz T.M., Elkind M.S.V., Okin P.M., Thacker E.L., Patton K. et al. Atrial cardiopathy and the risk of ischemic stroke in the CHS (Cardiovascular Health Study). Stroke. 2018;49(4):980-986. DOI: 10.1161/ strokeaha.117.020059.
- Tandon K., Tirschwell D., Longstreth W.T. Jr., Smith B., Akoum N. Em-bolic stroke of undetermined source correlates to atrial fibrosis with-out atrial fibrillation. Neurology. 2019;93(4):e381-e387. DOI: 10.1212/ WNL.0000000000007827.
- Meisel K., Yuan K., Fang Q., Bibby D., Lee R., Schiller N.B. Embolic stroke of undetermined source: A population with left atrial dysfunction. J. Stroke Cerebrovasc. Dis. 2019;28(7):1891-1896. DOI: 10.1016/j. jstrokecerebrovasdis.2019.04.004.
- Мехряков С.А., Кулеш А.А., Сыромятникова Л.И., Собянин К.В. Биомаркеры предсердной кардиопатии у пациентов с разными патогенетическими подтипами ишемического инсульта. Неврология, нейропсихиатрия, психосоматика. 2020;12(6):33-41. DOI: 10.14412/2074-2711-2020-6-33-41.
- Кулеш А.А., Голосова Ю.А., Сыромятникова Л.И., Шестаков В.В. Дополнительные клинические и инструментально-лабораторные маркёры основных патогенетических вариантов ишемического инсульта. Клиническая медицина. 2018;96(3):240-247. DOI: 10.18821/0023-2149-2018-96-3-240-247.
- Swiryn S., Orlov M.V., Benditt D.G., DiMarco J.P., Lloyd-Jones D.M., Karst E. et al. Clinical implications of brief device-detected atrial tachyar-rhythmias in a cardiac rhythm management device population: Results from the Registry of Atrial Tachycardia and Atrial Fibrillation Episodes. Circulation. 2016;134(16):1130-1140. DOI: 10.1161/circulationa-ha.115.020252.
- Mahajan R., Perera T., Elliott A.D., Twomey D.J., Kumar S., Munwar D.A. et al. Subclinical device-detected atrial fibrillation and stroke risk: A systematic review and meta-analysis. Eur. Heart J. 2018;39(16):1407-1415. DOI: 10.1093/eurheartj/ehx731.
- Boriani G., Glotzer T.V., Ziegler P.D., De Melis M., Mangoni di S.S.L., Sepsi M. et al. Detection of new atrial fibrillation in patients with cardiac implanted electronic devices and factors associated with transition to higher device-detected atrial fibrillation burden. Heart Rhythm. 2018;15(3):376-383. DOI: 10.1016/j.hrthm.2017.11.007.
- Pastori D., Miyazawa K., Li Y., Szekely O., Shahid F., Farcomeni A. et al. Atrial high-rate episodes and risk of major adverse cardiovascular events in patients with cardiac implantable electronic devices. Clin. Res. Cardiol. 2020;109(1):96-102. DOI: 10.1007/s00392-019-01493-z.
- Gonzalez M., Keating R.J., Markowitz S.M., Liu C.F., Thomas G., Ip J.E. et al. Newly detected atrial high rate episodes predict long-term mortality outcomes in patients with permanent pacemakers. Heart Rhythm. 2014;11(12):2214-2221. DOI: 10.1016/j.hrthm.2014.08.019.


