Практические инструменты, облегчающие выбор адъювантной лекарственной терапии у больных операбельным люминальным HER2-негативным раком молочной железы
Автор: Тюляндин С.А., Стенина М.Б., Фролова М.А.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Обзоры и аналитика
Статья в выпуске: 2 т.14, 2024 года.
Бесплатный доступ
Люминальный HER2-негативный рак молочной железы составляет около 60-70 % всех случаев этого заболевания. Выбор тактики адъювантной лекарственной терапии при лечении больных первично-операбельным люминальным HER2-негативным раком молочной железы, особенно назначение адъювантной химиотерапии и овариальной супрессии, является одним из наиболее сложных и дискутабельных вопросов. Причинами этого являются выраженная гетерогенность люминального рака молочной железы, отсутствие четких маркеров химиочувствительности, а также гормонорезистентности опухоли у части больных. За рубежом большим подспорьем при решении данного вопроса стали генетические тесты, позволяющие в каждом конкретном случае оценить риск рецидива заболевания и необходимость назначения более агрессивной адъювантной лекарственной терапии, однако пока они не доступны для российских онкологов. Вместе с тем, даже в отсутствие возможности пользоваться подобными тестами, у нас имеются инструменты, которые могут существенно облегчить принятие решения об объеме адъювантной лекарственной терапии первично операбельного люминального HER2-негативного рака молочной железы. В качестве альтернативных инструментов в статье обсуждаются калькулятор для оценки риска рецидива на основании клинико-патологических характеристик опухоли, предоперационная тестовая гормонотерапия ингибиторами ароматазы для больных в постменопаузе и композитный индекс риска прогрессирования для больных в пременопаузе. Все эти инструменты доступны и могут быть использованы для определения тактики адъювантного лечения.
Рак молочной железы, химиотерапия, тестовая гормонотерапия, генетический тест
Короткий адрес: https://sciup.org/140306979
IDR: 140306979 | DOI: 10.18027/2224-5057-2024-003
Текст обзорной статьи Практические инструменты, облегчающие выбор адъювантной лекарственной терапии у больных операбельным люминальным HER2-негативным раком молочной железы
Хорошо известно, что наиболее бурные дискуссии на мультидисциплинарных консилиумах вызывает вопрос о выборе адъювантной терапии больных с люминальными типами HER2-негативного рака молочной железы (РМЖ). Спор обычно идет между сторонниками химиотерапии (ХТ) и теми, кто хотел бы избежать ее назначения в пользу только адъювантной гормонотерапии (ГТ). Желание избежать назначения адъювантной ХТ в значительной степени базируется на информации об отдаленных последствиях ХТу больных, вылеченных от РМЖ: это повышение риска сердечно-сосудистых заболеваний, в т. ч. острой смерти, развития метаболического синдрома, бесплодия, снижения либидо, депрессии и многих других отсроченных медицинских проблем [1]. Кроме того, сегодня появляется все больше научных данных о том, что назначение адъювантной ХТ этой категории больных во многих случаях является избыточным и не улучшает долгосрочных резуль- татов лечения. Крупные многоцентровые исследования, проведенные в последние годы, пытались определить кандидатов, выигрывающих от добавления адъювантной ХТ к адъювантной ГТ на основании клинических данных и генетических тестов. Так, в исследованиях TAILORx и Rх-PONDER, в которых назначение ХТ больным с опухолями T1–2N0–1 стадий определялось величиной риска прогрессирования RS (RS, Recurrence Score) по данным генетического теста Oncotype Dx, лишь больные с высоким значением RS (> 25) выигрывали от назначение ХТ [2,3]. Оказалось, что доля таких больных составила лишь 17% (из 10273 больных) в исследовании TAILORx и 11 % (из 9383 больных) в исследовании Rх-PONDER, в то время как у остальных больных, которые составили подавляющее большинство в этих исследованиях, добавление адъювантной ХТ к адъювантной ГТ не давало никакого выигрыша в долгосрочной перспективе. Поэтому сегодня в развитых странах выбор объема адъювантной терапии у больных люминальным HER2-негативным РМЖ
Тест OncotypeDx
RS 0-10
RS 11 15
RS 16-20 RS 21-25
RS >26
Постменопауза
N1
NO
Пременопауза
N1
▲ 3.9% (RS 0-13)

NO
Низкий риск (MINDACT)
Низкий клинический риск
Высокий клинический риск
|
▲ 0.2% |
▲ 6.4% |
||
|
А 6.5% |
А 8.7% |
ГТ (ИА) +OC
■ XT -ГТ
T< 1CM + G3
Т< 2CM + G2
▲ выигрыш в 9-летней иБРВ при добавлении XT
Т< Зсм + GI
RS — шкала риска рецидива (Recurrence Score); ГТ — гормонотерапия; ХТ — химиотерапия; ИА — ингибиторы ароматазы; ОС — овариальная супрессия; G — степень злокачественности; иБРВ — выживаемость без инвазивного рака
Рисунок 1. Алгоритм выбора адъювантной системной терапии у больных люминальным HER2-негативным РМЖ
Т1–2N0–1 стадий в зависимости от риска прогрессирования (Oncotype DX)
Figure 1. Algorithm for choosing adjuvant systemic therapy in patients with luminal HER2‑negative breast cancer T1–2N0–1 stages depending on the risk of progression (Oncotype DX)
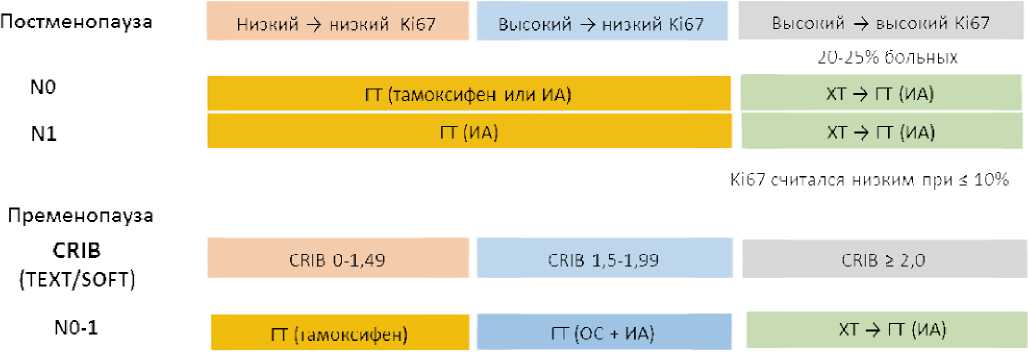
T1–2N0–1 стадий базируется на величине RS по данным геномного теста Oncotype Dx [4,5]. На рисунке 1 представлен алгоритм выбора адъювантной системной терапии у больных люминальным HER2-негативным РМЖ Т1– 2N0–1 стадий в зависимости от риска прогрессирования (Oncotype DX). Выполнение теста Oncotype DX для определения прогноза и выбора метода адъювантной терапии поддерживается всеми международными клиническими рекомендациями, что привело к существенному сокращению частоты назначения ХТ в этой популяции больных [6,7].
Каковы же возможности российских онкологов, не имеющих доступа к широкому использованию геномных тестов, которые выступают своеобразным арбитром для наших зарубежных коллег при решении вопроса об объеме адъювантной лекарственной терапии? Мы по-прежнему базируем свои решения о назначении адъювантной ХТ на наличии клинико-патологических факторов неблагоприятного прогноза, к которым относятся наличие метастазов в регионарных лимфоузлах (N +), высокая степень злокачественности (Grade 3), низкая экспрессия рецепторов эстрогенов (РЭ) и/или отсутствие экспрессии рецепторов прогестерона (РП), высокий Ki-67, молодой возраст пациентки. Однако сложность заключается в том, что каждый из этих признаков, взятый в отдельности, свидетельствует лишь о возможном риске прогрессирования, равном примерно 20% в течение 5 лет. При этом мы не можем отделить больных, имеющих высокий шанс попасть в эти 20%, от тех 80% пациенток, которые с большей долей вероятности избегут этой участи. Очень часто мы субъективно переоцениваем риск прогрессирования, базируясь на вышеперечисленных клинико-морфологических факторах неблагоприятного прогноза. Например, для многих онкологов наличие метастазов в подмышечных лимфоузлах независимо от их количества является показанием к обязательному назначению ХТ. Порочность такого подхода сегодня подтверждается результатами исследования Rx-PONDER. Несомненно, наличие у пациентки нескольких негативных прогностических факторов риска облегчает выбор в пользу ХТ, но не снимает необходимости иметь более четкие критерии оценки во избежание принятия субъективного решения. Рассмотрим возможности объективизации решения о выборе адъювантной системной терапии, доступные для использования в России.
КАЛЬКУЛЯТОР ОЦЕНКИ РИСКА ПРОГРЕССИРОВАНИЯ НА ОСНОВАНИИ РУТИННЫХ КЛИНИКО
ПАТОЛОГИЧЕСКИХ ХАРАКТЕРИСТИК
Анализ риска рецидива РМЖ у конкретной пациентки с использованием теста Oncotype DX является дорогостоящим и проводится примерно у 1/3 пациентов с гормонозависимым РМЖ в США и менее чем у 20% больных в ряде европейских стран. В России и многих других странах рутинное использование этого теста является недо- ступным. В такой ситуации помочь в определении риска прогрессирования может удобная модель суррогатного прогнозирования высокого или низкого риска рецидива, основанная на рутинных клинико-патологических признаках [8]. Для построения номограмм были использованы результаты тестирования с помощью Oncotype DX опухолей 65754 больных гормонозависимым HER2-негативным РМЖ с N0 и размером опухоли от 6 до 50 мм (2010–2014 гг.), взятые из национальной базы данных (NCDB, National Cancer Data Base); для внешней валидации были использованы результаты тестирования с помощью Oncotype DX опухолей 18585 пациентов (2015 г.). Для построения номограмм прогнозирования риска рецидива использовались данные исследования TAILORx, согласно которым низкому риску соответствуют 0–25 баллов, а высокому — 26–100 баллов (пациенты промежуточного риска (11–25 баллов) включены в группу низкого риска). Для построения номограмм использовалась модель симультанной логистической регрессии. Были оценены 5 клинико-патологических переменных: размер опухоли, возраст пациентки, гистологический вариант, степень злокачественности, экспрессия РП. Степень злокачественности и экспрессия РП обладали самым высоким прогностическим потенциалом предсказания высокого/низ-кого риска рецидива, за ними следовали гистологический тип, размер опухоли и возраст. На основании полученных данных был создан калькулятор оценки риска рецидива, доступный в режиме on line на веб-сайте UTMCK/Shiny по ссылке Номограмма применима для женщин с опухолями, положительными по РЭ (≥ 1% положительных клеток), отрицательным HER2 статусом (0–1 + по данным иммуногистохимического исследования или отрицательный статус по данным гибридизации in situ), N0 и размером опухолевого узла от 6 мм до 50 мм. Номограмма применима для пациентов женского пола старше 50 лет; для пациентов моложе 50 лет номограмма применима только для оценки вероятности попадания в группу высокого риска рецидив по шкале Oncotype DX (26–100 баллов). Модель в целом правильно относит 86,8% случаев к категории Oncotype DX низкого или высокого риска и, в отсутствие доступности Oncotype DX, может помочь при определении тактики адъювантной лекарственной терапии в группе больных обозначенной выше категории.
ТЕСТОВЫЙ КУРС ГОРМОНОТЕРАПИИ ПРИ ЛЮМИНАЛЬНОМ
HER2-НЕГАТИВНОМ РАКЕ МОЛОЧНОЙ ЖЕЛЕЗЫ T1–2N0–1 СТАДИЙ
У ПОСТМЕНОПАУЗАЛЬНЫХ БОЛЬНЫХ
У большинства больных люминальным HER2-нега-тивным РМЖ клетки опухоли демонстрируют высокую чувствительность к ГТ; такие больные не нуждаются в проведении адъювантной ХТ. В то же время у части больных, в первую очередь, у больных с люминальным B фенотипом, имеется относительная резистентность к гормонональным препаратам, и в этом случае ХТ улучшает результаты адъювантной терапии. Однако выбор адъювантной терапии только на основании фенотипа очень неточен, так как и при люминальном А, и при люминальном В (HER2-негативном) фенотипах имеются больные с чувствительными как к ГТ, так и к ХТ опухолями. Кроме того, мы имеем возможность лишь суррогатного определения люминального А и люминального В подтипов, что далеко не всегда соответствует истинным молекулярным подтипам. Можно ли более точно оценить чувствительность опухоли к ГТ?
Отчасти ответ на этот вопрос дают работы наших коллег из Великобритании по изучению влияния короткого (2–3 нед.) предоперационного тестового курса ГТ ингибиторами ароматазы на динамику Ki-67 у постменопаузальных больных (старше 50 лет) операбельным РМЖ с наличием рецепторов стероидных гормонов в опухоли. В исследовании POETIC было показано, что значение Ki-67 после проведения этой своеобразной гормональной биологической пробы в большей степени отражает прогноз, чем исходное значение Ki-67 в материале биопсии первичной опухоли [9]. На основании оценки динамики Ki-67 в материале биопсии (при постановке диагноза) и в удаленном материале (после тестового курса ГТ) авторы исследования разделили всех больных на три группы: 1) низкий → низкий Ki-67 (величина Ki-67 в биопсийном и послеоперационном материале < 10%); 2) высокий → низкий Ki-67 (величина Ki-67 в биопсийном материале была > 10%, а в послеоперационном материале стала < 10%) и 3) высокий → высокий Ki-67 (величина Ki-67 была и осталась > 10% после проведения теста). Сценарий «низкий → высокий» был отмечен лишь у единичных больных, и эти пациенты были исключены из анализа. При сроке наблюдения более 5 лет риск рецидива составил 4,3%, 8,4% и 21,5% соответственно в группах 1, 2 и 3 (рис. 2). У 73% больных с изначально высоким Ki-67 зарегистрировано снижение этого показателя до уровня < 10% после короткого тестового курса ГТ.
В этом исследовании только 26% пациентов получали адъювантную ХТ согласно стандартной практике, и большинство из них принадлежали к группе «высокий → высокий» Ki-67. На основании этих данных можно считать, что исследование POETIC определило популяцию пациенток с низким значением Ki-67 в послеоперационном материале (группы «низкий → низкий» и «высокий → низкий»), которые имеют низкий риск прогрессирования при проведении только адъювантной ГТ, в то время как пациентки с высоким Ki-67 после тестового курса ГТ имеют высокий шанс прогрессирования (по-видимому вследствие недостаточной чувствительности к ГТ) и могут нуждаться в комбинированной адъювантной лекарственной терапии (ГТ и ХТ). В отсутствие доступных генетических тестов результат короткого предоперационного тестового курса ГТ может оказать помощь в выборе адъювантной терапии у постменопаузальных больных, значительно сократив частоту назначения малоэффективной и токсичной адъювантной ХТ. Стоит отметить, что в отличие от генетических сигнатур, оценивающих риск рецидива болезни, тестовый курс ГТ скорее отражает потенциальную чувствительность к ГТ, т. е. является предиктивным.
Таким образом, на основании тестового курса ГТ ингибиторами ароматазы мы можем определить популяцию больных, чувствительных к ГТ и имеющих низкий риск прогрессирования, у которых можно безболезненно отказаться от проведения адъювантной ХТ. Последняя может быть рассмотрена у 20–25% больных, у которых уровень Ki-67 не снизился менее 10% и/или имеются другие факторы неблагоприятного прогноза. Интересно, что частота недостаточной чувствительности к ГТ по результатам тестовой ГТ и частота определения высокого риска с помощью геномного теста у больных с люминальным фенотипом РМЖ сопоставимы. Рекомендация по проведению тестовой ГТ была включена в Консенсус конференции по раннему РМЖ в С.-Галлене уже в 2021 году и сохранилась в рекомендациях 2023 года [5,10].


Низкий -) низкий
Высокий -> низкий
Высокий -> высокий
Количество больных (п)
Частота рецидивов в течение 5 лет
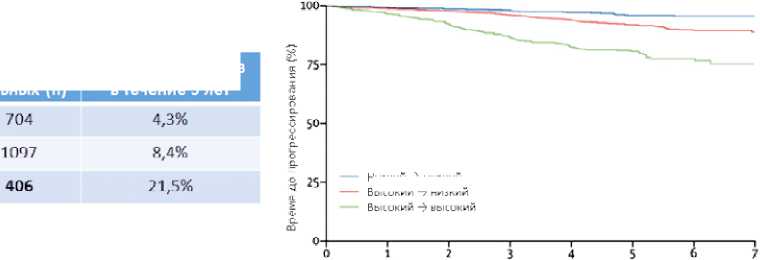
Рисунок 2. Исследование POETIC: ассоциация между результатами тестового курса гормонотерапии (динамика Ki-67) и прогнозом при люминальном HER2-негативном РМЖ у постменопаузальных больных [9]
Низкий -? низким
Высокий 4 низкий
Figure 2. POETIC study: association between the results of a test course of hormone therapy (Ki ‑ 67
dynamics) and prognosis in luminal HER2 ‑ negative breast cancer postmenopausal patients [9]
КОМПОЗИТНЫЙ ИНДЕКС
РИСКА ПРОГРЕССИРОВАНИЯ ПРИ ЛЮМИНАЛЬНОМ РАКЕ МОЛОЧНОЙ ЖЕЛЕЗЫ T1–2N0–1 СТАДИЙ У ПРЕМЕНОПАУЗАЛЬНЫХ БОЛЬНЫХ
В исследовании Rx-PONDER в целом был показан небольшой выигрыш (∆5,2%) при назначении ХТу больных в пременопаузе по сравнению с постменопаузальными пациентками. Вместе с тем нельзя говорить, что опухоли молодых пациенток менее чувствительны к ГТ, и им в обязательном порядке необходима адъювантная ХТ. До сих пор идет спор о механизме противоопухолевого эффекта химиопрепаратов у пременопаузальных больных. Считается, что значительная часть этой активности определяется одним из частых побочных эффектов ХТ — овариальной супрессией (ОС), т. е. гормональным эффектом, а не прямым цитотоксическим воздействием химиопрепарата. Таким образом, часть больных молодого возраста могут нуждаться в эскалации адъювантной лекарственной терапии именно за счет подавления функции яичников (с помощью аналогов гонадотропин-рилизинг гормона), а не назначения им ХТ. Есть ли возможность объективизации выбора адъювантной системной терапии в этой популяции больных?
Важнейшими исследованиями роли ОС в составе адъювантной ГТ у пременопаузальных больных являются исследования TEXT и SOFT, в которых изучена эффективность тамоксифена (в сочетании с ОС или без нее) в сравнении с эксеместаном (в сочетании с ОС) у больных молодого возраста с документированным пременопаузальным статусом, в т. ч. после нео- и/или адъювантной ХТ; в связи со сходством дизайна эти исследования анализируются совместно [11]. Кроме того, в исследовании SOFT изучена непосредственная роль ОС при добавлении к тамоксифену или ИА (в сравнении с монотерапией тамоксифеном). Было показано, что добавление ОС к тамоксифену улучшает результаты лечения в сравнении с монотерапией тамоксифеном: 8-летняя безрецидивная выживаемость (БРВ) составила 78,9% и 83,2% в группах монотерапии тамоксифеном и терапии тамоксифеном в сочетании с ОС соответственно (ОР 0,76; 95% ДИ 0,62–0,93; р = 0,009). Наиболее результа- тивной оказалась комбинация эксеместана с ОС: во всей группе 12-летняя БРВ составила 80,5% и 75,9% в группах эксеместана (+ ОС) и тамоксифена (+ ОС) соответственно; (ОР 0.79; 95% ДИ 0.70–0.90, р < 0.001). Однако выигрыш в БРВ в абсолютных значениях был небольшим (∆4.6%; 95 % ДИ 2.0–7.2%). Молодой возраст (< 35 лет), размер опухоли > 2 см, наличие N2 и Grade 3 увеличивали выигрыш от использования ингибитора ароматазы в сочетании с ОС. Но даже при наличии этих неблагоприятных факторов прогрессирование развивалось лишь у небольшой части больных (20–25%) [12].
Для объективизации индивидуального риска на основании возраста, стадии, степени злокачественности, экспресcии РЭ и РП, Ki-67, потребности в адъювантной ХТ и ОС был рассчитан композитный индекс риска прогрессирования (CRIB, Composite Risk Index Breast Cancer) [13]. Было показано, что этот индекс играет прогностическую роль, и с увеличением его значения повышается и риск прогрессирования. Но оказалось, что этот индекс имеет и предсказывающее значение у больных, которые не получали ХТ. При CRIB менее 1,5 (рис. 3А) 5-летняя безрецидивная выживаемость была сопоставимой (94– 95%) для больных, получавших в качестве адъювантной ГТ только тамоксифен, тамоксифен (+ ОС) или ингибитор ароматазы (+ ОС), т. е. в этой группе больных, по-видимому, нет необходимости в назначении ОС и можно ограничиться только назначением тамоксифена. При значении CRIB от 1,5 до 1,99 (рис. 3B) отмечено улучшение БРВ при использовании ингибитора ароматазы (+ ОС). У больных с CRIB 2 и более (рис. 3С) отмечено существенное увеличение частоты прогрессирования заболевания независимо от варианта адъювантной ГТ, что может свидетельствовать о необходимости назначения ХТ в составе нео-/адъювант-ной лекарственной терапии [13].
Таким образом, CRIB представляет собой относительно объективный показатель прогноза пациентки, сбалансированный по нескольким факторам риска: возраст, размеры первичной опухоли и число метастазов в регионарных лимфоузлах, степень дифференцировки, величина экспрессии РЭ и РП, экспрессия Ki-67. Именно эти факторы мы и учитываем для выбора адъювантной системной терапии
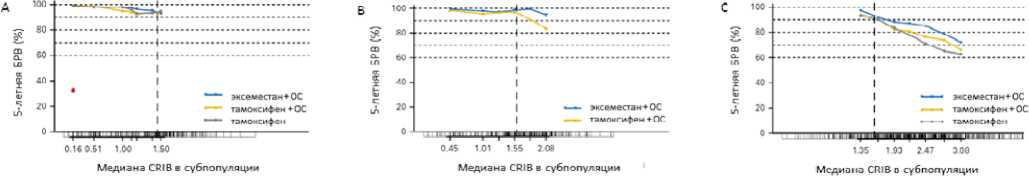
CRIB — композитный индекс риска прогрессирования; ОС — овариальная супрессия
Рисунок 3. 5-летняя безрецидивная выживаемость пременопаузальных больных люминальным HER2-негативным РМЖ после адъювантной гормонотерапии в зависимости от композитного индекса риска прогрессирования
Figure 3. 5‑year disease‑free survival of premenopausal patients with luminal HER2‑negative breast cancer after adjuvant hormone therapy depending on the composite progression risk index
ГТ — гормонотерапия, ИА — ингибиторы ароматазы; CRIB — композитный индекс риска прогрессирования; ОС — овариальная супрессия
Рисунок 4. Алгоритм выбора адъювантной системной терапии у больных люминальным HER-негативным РМЖ T1–2N0–1 стадий
Figure 4. Algorithm for choosing adjuvant systemic therapy in patients with luminal HER‑negative breast cancer of T1–2N0–1 stages у больных РМЖ молодого возраста. Для определения CRIB существует удобный и простой в использовании калькулятор (доступен на сайте RUSSCO). На рисунке 4 представлен алгоритм выбора адъювантной системной терапии у больных люминальным HER-негативным РМЖ T1–2N0–1 стадий, составленный с учетом CRIB.
ЗАКЛЮЧЕНИЕ
Результаты приведенных выше исследований просты в использовании и могут облегчить выбор адъювантной системной терапии у значительной части больных люминальным HER2-негативным РМЖ T1–2N0–1 стадий. Представленный в данной статье алгоритм может быть полезным помощником для объективизации выбора такого лечения в ходе мультидисциплинарного консилиума в условиях, когда генетические панели определения риска прогрессирования, рекомендованные для назначения адъювантной терапии, недоступны. Уже сегодня тестовая ГТ включена в практические рекомендации RUSSCO, планируется ее включение в рекомендации Минздрава по лечению РМЖ для определения гормоночувствительности у постменопаузальных больных РМЖ с люминальными фенотипами. Призываем использовать эту простую и удобную методику в своей клинической практике. Накопление собственного опыта и его анализ с учетом отдаленных результатов позволит оценить клиническую ценность тестовой ГТ в реальной клинической практике. Для пременопаузальных больных люминальным HER2-негативным РМЖ определение индекса CRIB носит рекомендательный характер и может использоваться наряду с другими факторами риска. Индекс CRIB объединяет и суммирует все основные клинико-морфологические факторы риска в зависимости от их влияния на прогноз больной, что позволяет уменьшить степень субъективизма при принятии решения. Будет полезным оценить использование данного индекса в нашей реальной клинической практике, к чему авторы и призывают.
Список литературы Практические инструменты, облегчающие выбор адъювантной лекарственной терапии у больных операбельным люминальным HER2-негативным раком молочной железы
- Ferreira A.R., Di Meglio A., Pistilli В., et al. Differential impact of endocrine therapy and chemotherapy on quality of life of breast cancer survivors: a prospective patient-reported outcomes analysis. Ann Oncol 2019;30(11):1784-1795. https://doi.org/10.1093/annonc/mdz298
- Sparano J.A., Gray R.J., Makower D.F., et al. Adjuvant chemotherapy guided by a 21-gene expression assay in breast cancer. N Engl J Med 2018;379(2):111-121. https://doi.org/10.1056/NEJMoal804710
- Kalinsky K., Barlow W.E., Gralow J.R., et al. 21-Gene assay to inform chemotherapy benefit in node-positive breast cancer. N Engl J Med 2021;385(25):2336-2347. https://doi.org/10.1056/NEJMoa2108873
- Kalinsky K., Barlow W.E., Meric-Bernstam F., et al. First results from a phase III randomized clinical trial of standard adjuvant endocrine therapy (ET) +/- chemotherapy (CT) in patients (pts) with 1-3 positive nodes, hormone receptor-positive (HR+) and HER2-negative (HER2-) breast cancer (ВС) with recurrence score (RS) < 25: SWOG S1007 (RxPonder). Cancer Research 2021;81(4_Supplement):GS3-00-GS3-00. https://doi.org/10.1158/1538-7445.SABCS20-GS3-00
- Sparano J. A., Gray R.J., Ravdin P.M., et al. Clinical and genomic risk to guide the use of adjuvant therapy for breast cancer. N Engl J Med 2019;380(25):2395-2405. https://doi.org/10.1056/NEJMoal904819
- Fabrice A., Ismaila N., Kimberly H. A., et al. Biomarkers for adjuvant endocrine and chemotherapy in early-stage breast cancer: ASCO Guideline Update. J Clin Oncol 2022;40(16):1816-1837. https://doi.org/10.1200/jc0.22.00069
- Curigliano G., Burstein H.J., Gnant M., et al. Understanding breast cancer complexity to improve patient outcomes: The St Gallen International Consensus Conference for the primary therapy of individuals with early breast cancer 2023. Ann Oncol 2023;34(ll):970-986. https://doi.Org/10.1016/j.annonc.2023.08.017
- Orucevic A., Bell J.L., King M., et al. Nomogram update based on TAILORx clinical trial results - Oncotype DX breast cancer recurrence score can be predicted using clinicopathologic data. Breast 2019;46:116-125. https://doi.org/10.1016/j. breast.2019.05.006
- Smith I., Robertson J., Kilburn L., et al. Long-term outcome and prognostic value of Ki67 after perioperative endocrine therapy in postmenopausal patients with hormone-sensitive early breast cancer (POETIC): an open-label, multicentre, parallel-group, randomised, phase 3 trial. Lancet Oncol 2020;21(11):1443-1454. https://doi.org/10.1016/ S1470-2045(20)30458-7
- Burstein H.J., Curigliano G., Thurlimann B., et al. Customizing local and systemic therapies for women with early breast cancer: the St. Gallen International Consensus Guidelines for treatment of early breast cancer 2021. Ann Oncol 2021;32(10):1216-1235. https://doi.Org/10.1016/j.annonc.2021.06.023
- Francis P.A., Pagani O., Fleming G.F., et al. Tailoring adjuvant endocrine therapy for premenopausal breast cancer. N Engl J Med 2018;379(2):122-137. https://doi.org/10.1056/NEJMoal803164
- Pagani O., Walley B.A., Fleming G.F., et al. Adjuvant exemestane with ovarian suppression in premenopausal breast cancer: long-term follow-up of the combined TEXT and SOFT trials. J Clin Oncol 2023;41(7):1376-1382. https://doi. org/10.1200/jc0.22.01064
- Regan M.M., Francis P. A., Pagani O., et al. Absolute benefit of adjuvant endocrine therapies for premenopausal women with hormone receptor-positive, human epidermal growth factor receptor 2-negative early breast cancer: TEXT and SOFT trials. J Clin Oncol 2016;34(19):2221-2231. https://doi.org/10.1200/jc0.2015.64.3171


