Практические рекомендации по лечению анемии при злокачественных новообразованиях
Автор: Р. В. Орлова, О. А. Гладков, Н. В. Жуков, М. В. Копп, И. А. Королева, В. Б. Ларионова, В. М. Моисеенко, И. В. Поддубная, В. В. Птушкин
Журнал: Злокачественные опухоли @malignanttumors
Статья в выпуске: 3S2-2 т.10, 2020 года.
Бесплатный доступ
Поддерживающая терапия, анемия, эритропоэтин, железодефицитная анемия, анемия онкологических больных
Короткий адрес: https://sciup.org/140254666
IDR: 140254666 | DOI: 10.18027/2224-5057-2020-10-3s2-36
Текст статьи Практические рекомендации по лечению анемии при злокачественных новообразованиях
Анемия при злокачественных новообразованиях (АЗН) определяется как снижение концентрации Hb ниже нормального значения (обычно 120 г/л) или более чем на 20 г/л от исходного значения и может быть обусловлена как наличием самой опухоли, так и её лечением. Слабая степень анемии представляет собой снижение концентрации Hb в диапазоне от 100 до 119 г/л, анемия средней степени — концентрация Hb от 80 до 99 г/л, тяжёлая анемия — концентрация Hb ниже 80 г/л.
Согласно Common Terminology Criteria for Adverse Events (CTCAE) v 5.0 выделяют 5 степеней тяжести анемии (табл. 1).
Таблица 1. Классификация анемии по критериям CTCAE v 5.0
|
Степень тяжести (grade) |
Уровень Hb (г / л) |
Комментарии |
|
1 |
< 100 г / л |
— |
|
2 |
80–100 г / л |
— |
|
3 |
< 80 г / л |
Показана гемотрансфузия |
|
4 |
Жизнеугрожающее состояние, необходимо срочное медицинское вмешательство |
— |
|
5 |
Смерть |
— |
Клиническая значимость анемии определяется:
-
• отрицательным влиянием на качество жизни онкологических больных с развитием слабости;
-
• отрицательным влиянием на продолжительность жизни при большинстве типов опухолей;
-
• снижением эффективности противоопухолевого лечения (отдельных цитотоксических препаратов и ЛТ).
1 Цитирование: Орлова Р. В., Гладков О. А., Жуков Н. В., Копп М. В., Королева И. А., Ларионова В. Б. и соавт. Практические рекомендации по лечению анемии при злокачественных новообразованиях. Злокачественные опухоли: Практические рекомендации RUSSCO #3s2, 2020 (том 10).36
1. ДИАГНОСТИКА 1.1. Анамнез
При сборе анамнеза у больных с анемией необходимо оценить:
-
• возможность наследственной анемии или гемоглобинопатии;
-
• характер и длительность предшествующей противоопухолевой терапии (вид лекарственной терапии, количество курсов, миелотоксичность, включение препаратов платины);
-
• наличие острого или хронического кровотечения;
-
• хронические воспалительные заболевания почек;
-
• наличие аутоиммунных заболеваний.
-
1.2. Лабораторные показатели
• Общий анализ крови с определением концентрации Hb, количества эритроцитов и ретикулоцитов, гематокрита (Hct), среднего объёма эритроцита (MCV), среднего содержания Hb в эритроците (MCH), средней концентрации Hb в эритроците (MCHC), среднего содержания Hb в ретикулоците;
• исследование костного мозга — по показаниям;
• оценка показателей обмена железа: содержание сывороточного ферритина с поправкой на содержание С-реактивного белка (повышение ферритина как белка острой фазы при воспалении), насыщение сывороточного трансферрина железом, содержание в крови фолатов и витамина В12;
• оценка возможности скрытого кровотечения из ЖКТ (пробы на скрытую кровь в кале, эндоскопическое исследование), почечной недостаточности (клиренс креатинина <60 мл/мин.) с нарушением продукции эндогенного эритропоэтина;
• проба Кумбса (при хроническом лимфолейкозе, неходжкинских лимфомах, аутоиммунных заболеваниях в анамнезе);
• определение концентрация эндогенного эритропоэтина (при подозрении на миелодиспластический синдром).
2. ЛЕЧЕНИЕ
2.1. Гемотрансфузии2.2. Лекарственная терапия
2.2.1. Эритропоэз-стимулирующие препараты
2.2.1.1. Показания
2.2.1.2. Противопоказания
Диагностику анемии и выявление причин необходимо проводить до проведения заместительных трансфузий эритроцитов (если нет экстренных показаний) или назначения эритропоэз-стимулирующих препаратов (ЭСП) и препаратов железа. Алгоритм диагностики анемии у онкологического больного представлен на рис. 1.
Традиционным методом коррекции сниженного Hb и жизнеугрожающих ситуаций, связанных с острой кровопотерей (обширные операции), являются заместительные трансфузии эритромассы. Однако для лечения анемии, связанной с опухолевым процессом (распад опухоли, интоксикация) и противоопухолевым лечением, гемотрансфузии не являются безопасным и эффективным методом. Переливания эритромассы могут сопровождаться гемолитическими реакциями, в том числе фатальными (частота — 1 : 1000), трансфузионными поражениями лёгких (частота — 1 : 5000), бактериальной контаминацией, в том числе фатальным сепсисом (частота — 1 : 10000), передачей вирусов гепатита В (частота — 1 : 30000), гепатита С и вируса иммунодефицита человека (частота — 1 : 1000000). Кроме того, многие потенциально опасные вирусные инфекции в настоящее время у доноров не тестируются. Наряду с вышесказанным, иммунодепрессия, вызванная переливанием эритроцитов, приводит к повышению риска тромбозов, инфекционных осложнений и снижением безрецидивной и общей выживаемости при ряде опухолевых заболеваний (колоректальный рак, рак мочевого пузыря). Повышение концентрации Hb после гемотрансфузий является кратковременным, и для поддержания его нормального значения их необходимо повторять. В связи с этим ВОЗ рекомендует максимально регламентировать заместительные гемотрансфузии у онкологических больных и использовать альтернативные методики коррекции Hb.
Согласно приказу Министерства Здравоохранения Российской Федерации от 03.06.2013 г. № 348Н, гемотрансфузии при снижении концентрации Hb <70–80 г/л показаны только в случае острых постгеморрагических анемий при одномоментном снижении гематокрита до ≤25%. При хронических анемиях главной задачей является устранение причины, вызвавшей анемию, и гемотрансфузии назначаются только для коррекции клинически значимых симптомов, обусловленных гипоксией вследствие снижения Hb и не поддающихся патогенетической терапии.
Альтернативным методом коррекции АЗН является назначение ЭСП в монотерапии или в комбинации с препаратами железа. Их применение показано при симптомной анемии и Hb < 100 г / л и всем пациентам с анемией тяжелой степени. В случае отсутствия эффекта (увеличение Hb менее, чем на 10 г/л при исходном уровне Hb <100 г/л) лечение ЭСП должно быть прекращено через 8 недель. Использование ЭСП позволяет повысить продукцию эритроцитов костным мозгом и увеличить содержание Hb без переливания донорских эритроцитов. Результаты контролируемых исследований показали, что применение ЭСП при АЗН, а также при анемии, вызванной ХТ, повышает концентрацию Hb в 60–70% случаев и сопровождается существенным снижением потребности в заместительных гемотрансфузиях (относительный риск 0,64; 95 % ДИ 0,6–0,68). У больных с солидными опухолями и больных, получающих платиносодержащую ХТ, применение ЭСП более эффективно, чем при других типах опухолей и других видах ХТ. В ряде исследований продемонстрировано улучшение качества жизни при применении ЭСП. Однако в других исследованиях различия в показателях качества жизни признаны незначимыми.
Применение ЭСП повышает вероятность венозных тромбоэмболических осложнений (ВТЭО), относительный риск которых увеличивается на 67% по сравнению с плацебо (ОР 1,67; 95 % ДИ: 1,35–2,06). Однако назначение эритропоэтинов не требует дополнительной профилактики ВТЭО. Влияние ЭСП на выживаемость онкологических больных изучается, однако результаты исследований неоднозначны. Данные трёх мета-анализов показали негативное влияние ЭСП на общую выживаемость, а результаты двух других мета-анализов подобного влияния не выявили. Однако во всех мета-анализах не было выявлено значимого негативного влияния ЭСП у больных, получающих ХТ. В связи с этим большинство экспертов считает нецелесообразным применение ЭСП у больных, не получающих ХТ или ХЛТ, за исключением пациентов с миелодиспластическим синдромом.
-
• Известная гиперчувствительность к ЭСП или их компонентам;
-
• неконтролируемая АГ;
-
• высокий риск тромбоэмболических осложнений (тромбоз в анамнезе, обширное хирургическое вмешательство, длительная иммобилизация или ограничение активности, лечение талидомидом или леналидомидом в комбинации с доксорубицином и ГКС; данные о роли профилактического использования антикоагулянтов или аспирина отсутствуют);
-
• хроническая почечная недостаточность (возможны случаи истинной эритроцитарной аплазии, вызванной нейтрализующими антиэритропоэ-тиновыми антителами; случаев истинной эритроцитарной аплазии среди онкологических больных не описано).
-
2.2.1.3. Осложнения
-
• Редкие аллергические реакции, включая удушье, кожную сыпь и крапивницу;
-
• артралгии;
-
• периферические отёки;
-
• незначительная и преходящая боль в месте инъекции.
-
2.2.2. Препараты железа
Рекомендуемые дозы ЭСП и принципы их коррекции у взрослых онкологических больных, получающих ХТ, представлены в табл. 2.
У части больных на фоне терапии ЭСП быстро развивается абсолютный или функциональный дефицит железа, в связи с чем необходимо исходное и периодическое измерение насыщения железом сывороточного трансферрина, содержания сывороточного ферритина и С-реактивного белка. Показателями нарушения обмена железа являются содержание сывороточного ферритина < 100 нг/мл и насыщения железом сывороточного трансферрина <20%. Cодержание сывороточного ферритина < 100 нг / мл у онкологического больного свидетельствует об абсолютном дефиците железа и необходимости терапии препаратами железа; предпочтительны в/в лекарственные формы, т. к. при приёме внутрь железо плохо всасывается. Более высокое содержание сывороточного ферритина (100–800 нг/мл) и насыщение железом сывороточного трансферрина <20% свидетельствует о функциональном дефиците железа.
У больных с анемией и дефицитом железа парентеральное введение препаратов железа приводит к значительно большему повышению концентрации Hb, чем без применения железосодержащих препаратов или при назначении препаратов железа внутрь. Поддержка препаратами железа уменьшает также число больных, нуждающихся в трансфузиях эритроцитов.
В связи с возможным взаимодействием железа и некоторых цитостатиков (антрациклины, препараты платины) необходимо воздерживаться от введения препаратов железа в дни введения противоопухолевых препаратов.
Рекомендуемые дозы и режим введения препаратов железа представлены в табл. 3.
В табл. 4 представлена сводная информация о лекарственных препаратах, рекомендуемых для лечения анемии у онкологических больных.
Таблица 2. Рекомендуемые дозы эритропоэз-стимулирующих препаратов и принципы их коррекции у взрослых онкологических больных, получающих химиотерапию
|
Параметры |
Эпоэтин альфа1 |
Эпоэтин бета1 |
Эпоэтин тета1 |
Дарбэпоэтин альфа1 |
|
Начальная доза |
150 МЕ / кг × 3 раза в нед. 12 000 ME × 3 раза в нед. 40 000 МЕ × 1 раз в нед. |
30 000 МЕ × 1 раз в нед. |
20 000 МЕ × 1 раз в нед. |
2,25 мкг / кг × 1 раз в нед. 500 мкг × 1 раз в нед. |
|
Снижение дозы при достижении целевого уровня гемоглобина2 |
25–50 % дозы |
|||
|
Остановка в лечении |
При Нb > 130 г / л следует приостановить введение препарата до снижения Hb до уровня < 120 г/л |
|||
|
Отмена препарата |
Окончание ХТ или отсутствие эффекта после 8 нед. лечения (сохраняется потребность в гемотрансфузиях) |
|||
1 Все эритропоэтины вводятся п / к.
2 Достижение уровня Hb 120 г / л или увеличение уровня Hb более, чем на 20 г / л за 2 нед.

Таблица 3. Рекомендуемые режимы внутривенного введения препаратов железа
|
Препарат |
Способ введения и дозировка |
Тест-доза |
|
Железа [III] гидроксид сахарозный комплекс 1 |
|
В / в медленно (в течение 1–2 мин.) 20 мг — для взрослых и детей весом более 14 кг, для детей весом менее 14 кг — 1,5 мг / кг; ожидание — 15 мин., при отсутствии нежелательных явлений возможно введение полной дозы с рекомендованной скоростью |
|
Железа карбоксимальтоза 1 |
|
Нет |
|
Железа [III] гидроксид декстран 1 |
Зависит от точного типа декстрана, см. инструкцию по применению. Минимальное время инфузии 240–360 мин. (4–6ч.). |
В / в медленно (в течение 1–2 мин.) 25 мг или 0,5 мл препарата; время ожидания — 15 мин., при отсутствии нежелательных явлений возможно введение полной дозы с рекомендованной скоростью |
|
Железа [III] гидроксид олигоизомальтозат 1 |
|
Нет |
1 Препараты железа не должны вводиться в дни введения противоопухолевых препаратов.
Таблица 4. Препараты, рекомендованные для лечения анемии у онкологических больных
|
Группа |
Препарат, начальная доза |
|
Эритропоэз-стимулирующие препараты |
Эпоэтин альфа 150 МЕ / кг × 3 раза в нед. п / к 12 000 МЕ × 3 раза в нед. п / к 40 000 МЕ × 1 раз в нед. п / к Эпоэтин бета 30 000 МЕ × 1 раз в нед. п / к Эпоэтин тета 20 000 МЕ × 1 раз в нед. п / к Дарбэпоэтин альфа 2,25 мкг / кг × 1 раз в нед. п / к 500 мкг × 1 раз в 3 нед. п / к |
|
Препараты железа |
Железа [III] гидроксидисахарозный комплекс 200 мг × 3 раза в нед. в / в струйно 7 мг железа на кг массы тела, в однократной дозе не более 500 мг железа × 1 раз в неделю, в / в инфузия не менее 3,5 часов Железа карбоксимальтозат 200 мг железа × 3 раза в нед. в / в струйно 20 мг максимального железа на кг массы тела в однократной дозе не более 1000 мг, × 1 раз в неделю в / в капельно не менее 15 мин. Железа [III] гидроксид декстран зависит от точного типа декстрана, см. инструкцию по применению. Минимальное время инфузии 240–360 мин. (4–6ч.) Железа [III] гидроксид олигоизомальтозат до 500 мг × 3 раз в нед. в / в струйно со скоростью до 250 мг железа / мин.; максимально 20 мг / кг массы тела. В дозах выше 1000 мг вводят строго в течение более 30 мин. |
|
Витамины |
Цианкобаламин (Витамин В12) 0,5 мг / мл — 1,0 мл, п / к через день Фолиевая кислота 2 мг / сут. внутрь |
Гемоглобин ≤120 г/л или снижение на ≥20 г/л от базового уровня
ДИФФЕРЕНЦИАЛЬНЫЙ ДИАГНОЗ АНЕМИИ
-
• общий анализ крови с определением концентрации Hb, гематокрита (Hct), количества эритроцитов и ретикулоцитов, среднего объема эритроцитов (MCV), среднего содержания Hb в эритроците (MCH) и средней концентрации Hb в эритроците (MCHC); кровотечение (кал на скрытую кровь, эндоскопическое обследование);
-
• гемолиз (проба Кумбса, ДВС-панель, гаптаглобин, непрямой билирубин, ЛДГ);
-
• алиментарная анемия (сывороточное железо, ОЖСС, ферритин, витамин В12, фолиевая кислота);
-
• наследственность (семейный анамнез);
-
• почечная дисфункция (клубочковая фильтрация);
-
• миелосупрессия, вызванная противоопухолевой терапией (ЛТ, ХТ);
-
• метастатическое поражение костного мозга
ЛЕЧЕНИЕ АНЕМИИ В ЗАВИСИМОСТИ ОТ ДОМИНИРУЮЩЕЙ ПРИЧИНЫ
Рисунок 1. Рекомендуемый алгоритм обследования онкологического больного с анемией.
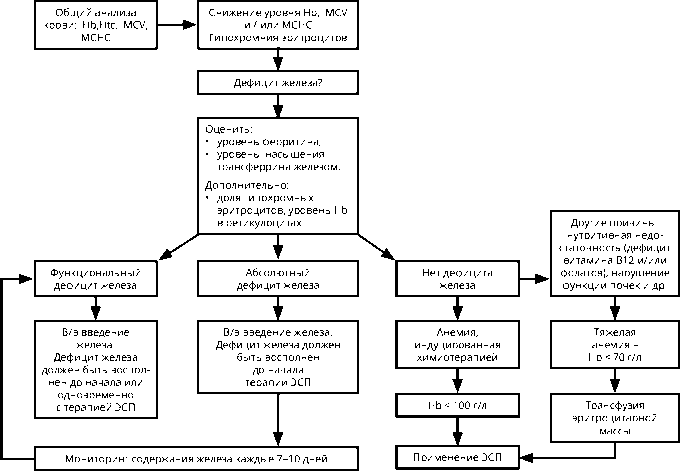
Рисунок 2. Рекомендуемый алгоритм лечения анемии у онкологических больных.


