Практические рекомендации по лечению злокачественных опухолей головы и шеи
Автор: Л. В. Болотина, Л. Ю. Владимирова, Н. В. Деньгина, А. В. Новик, И. С. Романов
Журнал: Злокачественные опухоли @malignanttumors
Статья в выпуске: 3S2-1 т.10, 2020 года.
Бесплатный доступ
Опухоли головы и шеи, плоскоклеточный рак, рак носоглотки, рак щитовидной железы, химиотерапия, лучевая терапия
Короткий адрес: https://sciup.org/140254633
IDR: 140254633 | DOI: 10.18027/2224-5057-2020-10-3s2-06
Текст статьи Практические рекомендации по лечению злокачественных опухолей головы и шеи
К опухолям головы и шеи (ОГШ) относят рак полости рта, различных отделов глотки и гортани и околоносовых пазух. В силу анатомического расположения часть таких опухолей распространяется на структуры основания черепа с инвазией как костных структур, так и оболочек, и реже — вещества головного мозга. Факторами риска развития этих опухолей являются употребление табака, алкоголя, а также инфицирование ВПЧ 16-го типа и вирусом Эпштейн–Барра для рака носоглотки.
1. КЛАССИФИКАЦИЯ И ОПРЕДЕЛЕНИЕ СТАДИИ
Классификация TNM опухолей головы и шеи имеет свои особенности, связанные с объединением в единую локализацию опухолей нескольких анатомических областей и различных типов. При стадировании заболевания должна быть использована обновленная классификация TNM (8-е издание, 2018 г.), которая имеет ряд отличий от предыдущего 7 издания 2010 г. Три основных изменения в стадировании включают добавление глубины инвазии для опухолей полости рта, внедрение патоморфологической и клинической системы стадирования для опухолей орофарингеальной зоны высокого риска, ассоциированных с папилломовирусной инфекцией (ВПЧ+), и учет выхода опухоли за пределы капсулы лимфоузла при ВПЧ-негативных опухолях орофарингеальной зоны высокого риска и плоскоклеточном раке головы и шеи других локализаций, за исключением рака носоглотки.
Градация категории Т различается для отдельных анатомических структур и описывает взаимоотношения опухоли с прилежащими тканями и органами. Категория N определяется для всех ОГШ единообразно, за исключением опухолей носоглотки и щитовидной железы. Поражение лимфатических узлов надключичной области при раке носоглотки относят к категории N3.
1 Цитирование: Болотина Л. В., Владимирова Л. Ю., Деньгина Н. В., Новик А. В., Романов И. С. и соавт. Практические рекомендации по лечению злокачественных опухолей головы и шеи. Злокачественные опухоли: Практические рекомендации RUSSCO #3s2, 2020 (том 10).06
2. ДИАГНОСТИКА
Регионарными лимфатическими узлами для опухолей щитовидной железы являются лимфатические узлы шеи и лимфатические узлы верхнего средостения. В последней версии TNM классификации произведено разделение опухолей ротоглотки на р16-позитивные и р16-негативные. При T1–2N0–1M0 р16-позитивных опухолей устанавливается I стадия; при распространенности T1–2N2M0 и T3N0– 2 диагностируется II стадия, а при T1–3N3M0 и T4N0–3M0 — III стадия. Для р16-по-зитивных опухолей IV стадия заболевания устанавливается только при наличии отдаленных метастазов. Категория М для всех ОГШ определяется единообразно; IV стадия для всех локализаций (за исключением р16-позитивных опухолей ротоглотки) подразделяется на IVA, IVB, IVC. Наличие отдаленных метастазов соответствует IVC стадии процесса, за исключением папиллярной и фолликулярной карциномы щитовидной железы.
Дополнительные особенности стадирования предусмотрены для карциномы щитовидной железы, при которой помимо размеров опухоли и состояния лимфатических узлов учитывается морфологическая структура опухоли и возраст пациента. Так при папиллярной и фолликулярной карциноме щитовидной железы у пациентов младше 55 лет без отдаленных метастазов устанавливается I стадия, а при их наличии — II стадия. Все анапластические карциномы щитовидной железы относят к IV стадии. Категория Т включает в себя только символы Т4а и Т4b.
Диагноз основывается на данных осмотра, результатах инструментальных методов обследования и патоморфологическом заключении. Первичное обследование должно быть проведено до всех видов лечебных воздействий и включает в себя:
• сбор анамнеза и осмотр хирурга, специализирующегося в области лечения опухолей головы и шеи;
• общий анализ крови с определением формулы (количество лимфоцитов позволяет оценить нутритивный статус);
• биохимический анализ крови с определением показателей функции печени, почек, уровня общего белка и альбумина (два последних показателя позволяют оценить нутритивный статус);
• эндоскопическое исследование верхних дыхательно-пищеварительных путей;
• УЗИ шейных лимфатических узлов и печени;
• КТ / МРТ головы и шеи (предпочтительно выполнять КТ с контрастированием магистральных сосудов, а не МРТ, так как изображение при МРТ чаще искажается при данной локализации опухоли);
• R-графия / КТ органов грудной клетки;
• ЭГДС;
• биопсия опухоли и тонкоигольная аспирационная биопсия измененных лимфатических узлов;
• гистологическое исследование (90 % опухолей представляют собой плоскоклеточный рак);
• определение ВПЧ или р16 при раке полости рта, ротоглотки и гортаноглотки;
• определение вирусной нагрузки вируса Эпштейн – Барра в плазме или мембранного белка LMP1 в образце опухолевой ткани при раке носоглотки;
• определение уровня экспрессии PD-L1;
• при железистом раке у больных с метастатическим процессом или обширным нерезектабельным местным рецидивом — определение экспрессии HER2;
• при секреторных аденокарциномах слюнных желез у больных с метастатическим процессом или обширным нерезектабельным местным рецидивом при возможности — определение мутаций в генах NTRK (gene fusion);
• при железистом раке у больных с метастатическим процессом или обширным нерезектабельным местным рецидивом — определение экспрессии рецепторов андрогенов;
• при железистом раке у больных с метастатическим процессом или обширным нерезектабельным местным рецидивом при возможности — определение MSI;
• при высокодифференцированном и медуллярном раке щитовидной железы при возможности — определение RET мутаций;
• при анапластическом раке щитовидной железы при возможности — определение BRAF мутации.
3. ЛЕЧЕНИЕ3.1. Резектабельные опухоли
Несмотря на визуальную локализацию большинства ОГШ, а также характерные первые симптомы заболевания, более 50% больных на момент установления диагноза не подлежат радикальному хирургическому лечению. Особое место среди ОГШ занимает рак носоглотки, который имеет особенности течения и отличается высокой чувствительностью к консервативным методам лечения (ЛТ и ХТ). Его лечение рассмотрено в разделе 3.5.
К плоскоклеточному раку, не подлежащему локальным методам лечения, относят некоторые опухоли, имеющие на момент диагностики обширную местную распространенность T4b (M0), нерезектабельный массив пораженных лимфоузлов, обычно N3, отдаленные метастазы (M1), рецидивный/продолженнный рост опухоли после ранее проведенного лечения. Для некоторых клинических ситуаций при впервые установленном местно-распространенном, но нерезектабельном процессе лечебной целью может являться излечение. Для рецидивных опухолей радикальное лечение может быть основной целью в случае возможности хирургического или лучевого лечения, а для пациентов, которым не могут быть предложены локальные методы, целью является паллиативная помощь. Для больных с метастатическим процессом основная цель терапии — паллиативная или симптоматическая для улучшения качества жизни. Варианты лечения зависят от общего функционального статуса — пациентам в удовлетворительном общем состоянии могут быть предложены разнообразные лечебные опции в отличие от больных с функциональным статусом по ECOG>2 баллов. Методы локального лечения (операция, ЛТ, различные аблативные методики) могут быть рассмотрены в индивидуальном порядке при наличии олигометастазов.
Стандартным подходом является хирургическое лечение с последующей ЛТ или ХЛТ (при высоком риске прогрессирования). В случае изначально ре-зектабельных опухолей ряда локализаций (губа, слизистая оболочка щеки и дна полости рта, подвижная часть языка, альвеолярные отростки верхней и нижней челюстей, ретромолярное пространство, твердое небо, околоносовые пазухи) предпочтительно начать лечение с радикальной операции с удалением первичной опухоли и ипсилатеральной либо билатеральной шейной лимфодиссекцией, а затем рассмотреть необходимость адъювантного лучевого или химиолучевого лечения (при наличии факторов неблагоприятного прогноза, см. ниже). Для опухолей, располагающихся в области основания черепа и/или сопровождающихся инвазией структур основания черепа и интракраниальных анатомических образований, решение об объеме хирургического вмешательства рекомендовано принимать на консилиуме с участием нейрохирургов. Для реализации комбинированного лечения оптимальный срок начала лучевой/химиолучевой терапии не должен превышать 6 нед. после операции. Факторами риска рецидива, требующими применения адъювантного химиолучевого лечения, для этой группы опухолей, являются экстракапсулярное распространение метастатического процесса, позитивные края резекции, лимфоваскулярная инвазия, pT3 или pT4, pN2или pN3, глубина инвазии > 1 см для опухолей полости рта. При локализации первичной опухоли в ротоглотке (корень языка, задняя стенка глотки, небные миндалины, мягкое небо) T1–2N0–1 целесообразно проведение лучевой или одновременной химиолучевой терапии. В отдельных случаях возможно проведение хирургического лечения на первом этапе с последующей лучевой или химиолучевой терапией. При раке ротоглотки, соответствующей по степени распространенности T3-T4N0–1 и TлюбаяN2–3, особенно при р16-позтитивных типах, у больных с хорошим функциональным статусом лечение предпочтительно начинать с индукционной ХТ с последующей ХЛТ. В случае невозможности проведения индукционной ХТ лечение должно быть начато с ХЛТ.
При опухолевых процессах гортани и гортаноглотки целесообразно начать лечение с лучевой/химиолучевой терапии. При раке гортани с распространенностью опухоли T1–2N0 хирургическое органосохраняющее лечение может рассматриваться как альтернатива ЛТ. Неоадъювантная (индукционная) ХТ (с последующей ХЛТ или хирургическим лечением) может применяться при локальных и местно-распространенных опухолях, соответствующих T2–4aN любое, в случае если основной целью лечения является сохранение гортани у больных в хорошем функциональном статусе при отсутствии стеноза гортани. Индукционная ХТ может также назначаться больным с меньшей распространенностью опухоли (T3N0–1), у которых невозможно выполнение органосохраняющей операции на первом этапе, а проведение ХЛТ представляется недостаточным (табл. 1). Решение вопроса о применении трехмодального подхода (индукционная ХТ, ХЛТ/операция) принимается мультидисциплинарной командой до начала лечения. Такой подход может быть реализован в специализированных центрах, которые имеют в своей структуре все необходимые отделения, специалисты которых задействованы в проведении каждого из этапов лечения. Основная цель — сохранение органа (гортани) при отсутствии риска ухудшения онкологических результатов. Проведение предоперационной ХЛТ/ЛТ при резектабельных опухолях не показано.
Таблица 1. Рекомендуемый режим индукционной химиотерапии опухолей головы и шеи 1
|
Название режима |
Схема проведения |
|
DCF (TPF2) |
Доцетаксел 75 мг / м2 в / в в 1-й день + цисплатин 75 мг / м2 в / в в 1-й день + 5-фторура-цил 1000 мг / м2 / сут. в / в 96-часовая инфузия в 1–4-й дни, каждые 3 нед., 3 цикла |
1 Индукционная ХТ рекомендована только для пациентов в хорошем функциональном состоянии (ECOG 0–1).
2 Возможная аббревиатура в литературе.
-
3.2. Нерезектабельные местно-распространенные опухоли
-
3.3. Рецидивы
-
3.4. Метастатический процесс
-
3.4.1. Плоскоклеточный рак
Стандартным лечебным подходом при плоскоклеточном раке головы и шеи является одновременная ХЛТ. Стандартной схемой ХЛТ является введение цисплатина 100 мг/м2 каждые 3 нед. в процессе ЛТ. Модификация режима с введением цисплатина в дозе 40 мг/м2 еженедельно (в сочетании с ЛТ) позволяет снизить токсичность, но при этом ухудшает общую продолжительность жизни (данная схема введения цисплатина рекомендована к использованию только при раке носоглотки). Применение карбоплатина AUC 1,5–2,0 еженедельно в процессе ЛТ рекомендуется только при противопоказаниях к лечению цисплатином или после индукционной ХТ по схеме DCF. Еще одним вариантом ХЛТ терапии может быть использование двухкомпонентного режима цитостатиков: цисплатин 70 мг/м2 и 5-фторурацил 600 мг/м2 в 1–4-й дни каждые 3 нед. Однако такая методика ХЛТ сопряжена с высокой частотой токсических реакций, среди которых преобладают мукозиты. Альтернативным вариантом может быть одновременное с ЛТ назначение цетуксимаба (400 мг/м2 — за неделю до начала ЛТ, далее — по 250 мг/м2 еженедельно в процессе ЛТ), что обеспечивает увеличение общей продолжительности жизни и улучшает ло-корегионарный контроль в сравнении с ЛТ, но не увеличивает токсичность. По данным последних исследований такой вариант одновременного лечения является равноценной заменой ЛТ с одновременным введением цисплатина или карбоплатина в схемах последовательной ХЛТ после индукционной ХТ. Однако замена цисплатина на цетуксимаб полжна производится только при наличии противопоказаний к применению цисплатина, а также после индукционной полихимиотерапии с использованием цисплатина. Рекомендуемый алгоритм лечения резектабельных и местнораспространенных опухолей головы и шеи представлен на рис. 1.
При резектабельном рецидиве рекомендуется хирургическое лечение. При нерезектабельном процессе и в случае, если пациент ранее не получал ЛТ, в зависимости от общего состояния рекомендуется ХЛТ. Для пациентов с рецидивами, которые не подлежат хирургическому лечению или ЛТ, рекомендуется лечение, аналогичное тому, которое проводят при метастатическом процессе. При возможности целесообразно включение пациента в клинические исследования.
При невозможности проведения локальной терапии (ЛТ уже проводилась, а хирургическое вмешательство не показано в связи с местной распространенностью процесса или наличием отдаленных метастазов) назначается паллиативная ХТ. Возможность повторного проведения ЛТ при рецидиве заболевания может рассматриваться у ограниченной категории больных с учетом ранее подведенных доз, общего состояния, осложнений заболевания.
Схемы ХТ, рекомендуемые для лечения плоскоклеточного рака головы и шеи, представлены в табл. 2. При прогрессировании (рецидиве или метастатическом процессе) во время или после предшествующей терапии на основе препаратов платины больных в удовлетворительном общем состоянии (ECOG 0–1) необходимо рассмотреть вопрос о назначении МКА, блокирующих рецептор PD1. Несмотря на то, что использование анти-PD1 препаратов при ОГШ по регистрационным показаниям не имеет ограничений в зависимости от уровня экспрессии лиганда, заранее запланированный исследовательский анализ при назначении ниволумаба выявил достоверный выигрыш в общей выживаемости у больных с экспрессией PD-L1 ≥1 %. При PD-L1 <1 % преимущества в отношении общей выживаемости отмечено не было. Аналогичная зависимость была обнаружена в исследовании при терапии пембролизумабом. Предшествующая терапия цетуксимабом не снижает эффективность ниволумаба и пембролизумаба. Среди других противоопухолевых препаратов могут быть использованы любые, не применявшиеся ранее. Некоторое преимущество более выражено в отношении частоты объективного ответа при применении препаратов таксанового ряда. Частота объективных эффектов при монотерапии колеблется от 15% до 35%. Платино-содержащий дуплет (циспла- тин +5-фторурацил) в сравнении с монотерапией демонстрирует более высокую частоту объективных эффектов при сопоставимой общей выживаемости, но при большей токсичности (табл. 2).
Таблица 2. Рекомендуемые режимы химиотерапии плоскоклеточного рака головы и шеи
|
Название режима |
Схема проведения |
|
PF+ Cet |
Цисплатин 75–100 мг / м2 в / в в 1-й день + 5-фторурацил 1000 мг / м2 / сут. в / в 96-часовая инфузия в 1–4-й дни, каждые 3 нед. + цетуксимаб 400 мг / м2 (нагрузочная доза), далее — 250 мг / м2 в / в еженедельно. После 6 циклов ХТ в случае отсутствия прогрессирования рекомендовано продолжить поддерживающую терапию цетуксимабом 250 мг / м2 в / в еженедельно |
|
DС+ Cet |
Доцетаксел 75 мг / м2 в / в в 1-й день + цисплатин 75 мг / м2 в / в в 1-й день, каждые 3 нед. + цетуксимаб 400 мг / м2 (нагрузочная доза) в / в, далее — 250 мг / м2 в / в еженедельно. После завершения 4 циклов ХТ в случае отсутствия прогрессирования рекомендовано продолжить поддерживающую терапию цетуксимабом 500 мг / м2 в / в 1 раз в 2 недели |
|
Цисплатин + Cet |
Цисплатин 75–100 мг / м2 1 раз в 3 недели+ цетуксимаб 400 мг / м2 (нагрузочная доза) в / в, далее — 250 мг / м2 в / в еженедельно |
|
Pacli + Carbo + Cet |
Паклитаксел 100 мг / м2 в / в + карбоплатин AUC 2,5 в / в в 1-й и 8-й дни + цетуксимаб 400 мг / м2 в / в (2-часовая инфузия) в 1-й день 1-го цикла (нагрузочная доза), далее — 250 мг / м2 в / в (1-часовая инфузия) в 8-й и 15-й дни 1-го цикла и 1-й день последующих циклов. Длительность цикла 21 день. После завершения 6 циклов ХТ в случае отсутствия прогрессирования рекомендовано продолжить поддерживающую терапию цетуксимабом 250 мг / м2 в / в еженедельно |
|
Pacli + Carbo + Cet 1 |
Паклитаксел 80 мг / м2 в / в еженедельно + карбоплатин AUC 2,0 в / в еженедельно + цетуксимаб 400 мг / м2 в / в (2-часовая инфузия) в 1-й день 1-го цикла, далее — 250 мг / м2 в / в еженедельно. После завершения ХТ в случае отсутствия прогрессирования рекомендовано продолжить поддерживающую терапию цетуксимабом 250 мг / м2 в / в еженедельно. Количество введений цитостатиков определяется индивидуально |
|
PF 2 |
Цисплатин 75–100 мг / м2 в / в в 1-й день + 5-фторурацил 1000 мг / м2 / сут. в / в 96-часовая инфузия в 1–4-й дни, каждые 3 нед. Карбоплатин AUC- 5 в / в в 1-й день + 5-фторурацил 1000 мг / м2 в / в 96-часовая инфузия в 1–4-й дни, каждые 3 нед. |
|
Pacli +Carbo 2 |
Паклитаксел 175 мг / м2 в / в в 1-й день + карбоплатин AUC- 5–6 в / в в 1-й день каждые 3 нед. Паклитаксел 60–80 мг / м2 в / в еженедельно + карбоплатин AUC- 2 в / в еженедельно до прогрессирования или неприемлемой токсичности |
|
DС 2 |
Доцетаксел 75 мг / м2 в / в в 1-й день + цисплатин 75 мг / м2 в / в в 1-й день, каждые 3 нед. |
|
Ниволумаб 3 |
Ниволумаб 3 мг / кг в / в 1 раз в 2 нед. или 240 мг 1 раз в 2 нед. или 480 мг 1 раз в 4 нед. 60-минутная инфузия (первое введение), далее — 30-минутная инфузия до прогрессирования или неприемлемой токсичности, но не более 2 лет |
|
Пембролизумаб 3 |
Пембролизумаб 200 мг в / в 1 раз в 3 нед. (30-минутная инфузия) или 400 мг 1 раз в 6 нед. до прогрессирования или неприемлемой токсичности, но не более 2 лет |
|
PF + Пембролиз-умаб 4 |
Пембролизумаб 200 мг + карбоплатин AUC 5 или цисплатин 100 мг / м2 + 5-ФУ 1000 мг / м2 1–4 дни 1 раз в 3 недели (6 циклов), далее пембролизумаб 200 мг 1 раз в 3 недели или 400 мг 1 раз в 6 нед. Максимум — до 35 введений в целом |
|
Монотерапия для пациентов в общем состоянии по ECOG> 2 баллов |
|
|
Цисплатин 60–70 мг / м2 в / в 1 раз в 3 нед. |
|
|
Карбоплатин AUC 5–6 в / в 1 раз в 3 нед. или карбоплатин AUC 2 в / в еженедельно |
|
|
Паклитаксел 175 мг / м2 в / в 1 раз в 3 нед. или паклитаксел 80 мг / м2 в / в еженедельно |
|
|
Доцетаксел 70–75 мг / м2 в / в 1 раз в 3 нед. |
|
|
Капецитабин 2000 мг / м2 внутрь в 2 приема в 1–4-й дни, перерыв 1 неделя или 2000 мг / сут. внутрь ежедневно в метрономном режиме |
|
|
Метотрексат 40 мг / м2 в / в еженедельно |
|
|
Цетуксимаб 400 мг / м2 в / в (2-часовая инфузия) в 1-й день 1-го курса, далее — 250 мг / м2 в / в еженедельно |
|
-
1 Для пациентов в общем состоянии по ECOG 2 балла.
-
2 Неоптимальные режимы лечения; возможны к применению только в случае абсолютных противопоказаний к назначению анти-EGFR МКА.
-
3 В качестве 1 линии при наличии экспрессии PD-L1 (CPS > 1). Максимальная эффективность отмечена при CPS > 20. При прогрессировании на фоне или после ХТ, включающей препараты платины, рекомендуемая длительность применения соответствует дизайну регистрационных исследований.
-
4 В качестве 1 линии независимо от уровня экспрессии PD-L1. Для особых морфологических типов, встречающихся при опухолях околоносовых пазух (мелкоклеточный, сино-назальный нейроэндокринный, сино-назальный недифференцированный, эстезионейробластома), могут использоваться комбинации цис-платин/карбоплатин + этопозид или циклофосфамид + доксорубицин + винкристин.
-
3.4.2. Железистый рак
Рекомендуемый алгоритм лечения рецидива плоскоклеточного рака головы и шеи представлен на рис. 2. Лечение рака носоглотки представлено в разделе 3.5.
Железистый рак головы и шеи составляет не более 5–10% всех ОГШ. Злокачественные опухоли слюнных желез развиваются в больших слюнных железах (околоушных, поднижнечелюстных, подъязычных) или в малых слюнных железах, которые располагаются в различных местах дыхательного и пищеварительного трактов. Эти опухоли могут иметь различную гистологическую структуру, включая мукоэпидермоидный рак, ацинарную аденокарциному, аденокистозную карциному, злокачественные миоэпителиальные опухоли. При данном морфологическом варианте сохраняется принцип приоритета хирургического вмешательства при резектабельных процессах. Однако, в связи с большой агрессивностью железистых раков, ХТ, несмотря на невысокую эффективность, часто применяется как один из этапов лечения нерезекта-бельных опухолей (табл. 3). Рекомендуемый алгоритм лечения железистого рака головы и шеи представлен на рис. 3. При метастатическом процессе или обширном нерезектабельном местном рецидиве целесообразно исследование экспрессии HER2. При наличии экспрессии возможно рассмотреть на врачебной комиссии вопрос о назначении трастузумаба в сочетании с таксан-содержащей ХТ. Значимое число метастатических форм опухолей слюнных желез имеют позитивную экспрессию рецепторов андрогенов. При наличии экспрессии возможно рассмотреть на врачебной комиссии вопрос о назначении антиандрогенов (например, бикалутамида). У пациентов с наличием мутаций в генах NTRK и наличием отдаленных метастазов отмечен высокий объективный ответ (75–100%) на терапию ингибиторами тирозин-киназ, которые пока доступны в РФ к применению только в рамках программ расширенного доступа. Имеются сведения об эффективности ленватиниба при аденокистозном раке. В связи с недостаточностью лечебных опций может быть рассмотрено назначение ленватиниба при нерезектабольном рецидиве или метастатическом аденокистозном раке по решению врачебной комиссии.
Таблица 3. Рекомендуемые режимы терапии железистого рака головы и шеи
Доксорубицин 1 60 мг / м2 в / в в 1-й день + цисплатин 40 мг / м2 в / в в 1-й день, каждые 3 нед.
Доксорубицин 1 30 мг / м2 в / в в 1-й и 8-й дни + цисплатин 50 мг / м2 в / в в 1-й и 8-й дни, каждые 3 нед.
Паклитаксел 175 мг / м2в / в в 1-й день + карбоплатин AUC- 5–6 в / в в 1-й день, каждые 3 нед.
Паклитаксел 60–80 мг / м2 в / в еженедельно + карбоплатин AUC- 2 в / в еженедельно до прогрессирования или неприемлемой токсичности
Доксорубицин 1 50 мг / м2 в / в в 1-й день + блеомицин 15 мг в / в в 1-й день + цисплатин 20 мг / м2 в / в в 1-й день, каждые 3 нед.
Доксорубицин 1 60 мг / м2 в / в в 1-й день + блеомицин 10 мг в / в в 1–5-й дни + винкристин
-
1,4 мг / м2 в / в в 1-й и 8-й дни, каждые 3 нед.
Цисплатин 50 мг / м2 в / в + доксорубицин 50 мг / м2 в / в + циклофосфамид 500 мг / м2 в / в в 1-й день каждые 4 нед.
Цисплатин 80 мг / м2 в / в + винорелбин 25 мг / м2 в / в в 1-й и 8-й дни каждые 3 нед. 2
Пембролизумаб 200 мг в / в 1 раз в 3 нед. 3
-
1 Кумулятивная доза доксорубицина не должна превышать 450–500 мг / м2
-
2 Данный режим может быть назначен при ацинарных аденокарциномах головы и шеи по решению врачебной комиссии.
-
3 При опухолях с MSI-H/dMMR.
-
3.5. Рак носоглотки
Хирургический метод рекомендуется только с целью выполнения лимфодис-секции при поражении лимфатических узлов после реализации всего объема консервативного лечения. Проведение ЛТ рекомендовано при распространенности опухоли T1N0M0. При опухолях, соответствующих T1N1–3, T2–4Nлюбая, начало лечения возможно с проведения ХЛТ с последующей адъювантной ХТ с включением цисплатина (2–3 цикла PF) или индукционной ХТ с последующей ХЛТ с еженедельным введением цисплатина или карбоплатина (в случае невозможности использования цисплатина) (табл. 4). В 2019 г. опубликованы результаты международного рандомизированного исследования, продемонстрировавшие преимущество индукционной ХТ у больных раком носоглотки T3–4N+ в отношении 3-летней безрецидивной и общей выживаемости.
Таблица 4. Рекомендуемый режим одновременной химиолучевой терапии рака носоглотки
|
Вид воздействия |
Режим |
|
Химиотерапия |
Цисплатин 100 мг / м2 в / в в 1-й, 22-й и 43-й дни |
|
Цисплатин 40 мг / м2 или карбоплатин AUC 2 в / в еженедельно, до 7 введений или карбоплатин AUC 2 после индукционной ХТ |
|
|
Лучевая терапия |
РОД 2,0 Гр, СОД 68–72 Гр — на видимый объём опухоли, 56–60 Гр — на зоны высокого риска, 50–54 Гр — на зоны низкого риска |
При метастатическом раке носоглотки или обширном распространении, втом числе при наличии интракраниального роста, не позволяющего применить ЛТ, используется ХТ (табл. 5). При достижении эффекта в результате ХТ целесообразно повторно рассмотреть вопрос о ХЛТ или ЛТ на втором этапе на зону первичной опухоли и шейных лимфатических узлов. При рецидиве заболевания рекомендуется использование режимов, не применявшихся ранее. Возврат к ранее использованному режиму возможен при длительном безрецидивном периоде и отсутствии токсичности.
Таблица 5. Рекомендуемые режимы терапии рака носоглотки
|
Название режима |
Схема проведения |
|
Индукционная химиотерапия |
|
|
DCF |
Доцетаксел 75 мг / м2 в / в в 1-й день + цисплатин 75 мг / м2 в / в в 1-й день + 5-фто-рурацил 1000 мг / м2 / сут. в / в 96-часовая инфузия в 1–4-й дни, каждые 3 нед. |
|
Epi + Pacli + Cis |
Эпирубицин 75 мг / м2 в / в в 1-й день + паклитаксел 175 мг / м2 в / в 3-часовая инфузия в 1-й день + цисплатин 75 мг / м2 в / в во 2-й день каждые 3 нед. |
|
GemCis |
Гемцитабин 1000 мг / м2 в / в в 1-й и 8-й дни + цисплатин 80 мг / м2 в / в в 1-й день, каждые 3 нед. |
|
Другие режимы |
|
|
PF |
Цисплатин 100 мг / м2 в / в в 1-й день + 5-фторурацил 1000 мг / м2 / сут. в / в 96-часовая инфузия в 1–4-й дни, каждые 3 нед., 6–8 циклов |
|
Pacli + Carbo |
Паклитаксел 175 мг / м2 в / в в 1-й день + карбоплатин AUC- 5–6 в / в в 1-й день, каждые 3 нед., 6–8 циклов |
|
DС |
Доцетаксел 75 мг / м2 в / в в 1-й день + цисплатин 75 мг / м2 в / в в 1-й день, каждые 3 нед., 6–8 циклов |
|
Пембролизумаб 1 |
Пембролизумаб 200 мг в / в (30-минутная инфузия) 1 раз в 3 нед. или 400 мг 1 раз в 6 нед. до прогрессирования или неприемлемой токсичности, но не более 2 лет. |
-
1 При прогрессировании на фоне или после ХТ, включающей препараты платины, при наличии экспрессии PD-L1 (по решению врачебной комиссии).
-
2 При прогрессировании могут назначаться цитостатики, не использовавшиеся ранее и указанные в табл. 2, в режиме монотерапии.
-
3.6. Рак щитовидной железы
Рекомендуемый алгоритм лечения рака носоглотки представлен на рис. 4. При метастатическом поражении лимфоузлов шеи без выявленного первичного очага (после исчерпывающего поиска в объеме фиброскопии носо-, рото-, гортаноглот- ки, гортани, ПЭТ/КТ) при плоскоклеточном раке рекомендовано исследование наличия ВПЧ (или проведение ИГХс определением р16) и вируса Эпштейн–Барра. Выявление ВПЧ предполагает последующее лечение согласно алгоритму лечения рака ротоглотки. При выявлении вируса Эпштейн–Барра лечение проводится согласно принципам лечения рака носоглотки. При р16-позитивных лимфоузлах, соответствующих распространенности N2, при общем удовлетворительном состоянии пациента лечение может быть начато с индукционной ХТ. В остальных случаях рассматривается выполнение шейной лимфодиссекции с последующей лучевой/химиолучевой терапией. При аденокарциноме выполняется шейная лимфодиссекция с последующей ЛТ при наличии показаний.
Основным методом лечения рака щитовидной железы является хирургический. В зависимости от стадии заболевания при папиллярном и фолликулярном раке дополнительно решается вопрос о проведении диагностики/лечения радиоактивным йодом. Радиойодтерапия (радиоактивным йодом131) является основным методом лечения больных высокодифференцированным раком щитовидной железы с отдаленными метастазами, позволяя у 90% больных достичь 10-летней выживаемости без прогрессирования. Однако у 25–66% больных высокодифференцированным раком щитовидной железы с отдаленными метастазами имеется первичная или развившаяся в процессе лечения частичная или полная резистентность к терапии радиоактивным йодом131, 10-летняя выживаемость в этой подгруппе составляет около 10 %.
Под высокодифференцированным раком щитовидной железы, резистентным к терапии радиоактивным йодом, понимается присутствие опухолевого очага, который не накапливает радиоактивный йод при радиоактивном сканировании, выполненном на фоне обедненной йодом диеты и адекватного уровня ТТГ либо на фоне стимуляции рекомбинантным человеческим ТТГ. В настоящее время в Российской Федерации приняты следующие критерии рефрактерности к радиойодтерапии высокодифференцированного рака щитовидной железы, которые совпадают с рекомендациями Американской и Европейской тиреои-дологических ассоциаций:
-
• наличие ≥ 1 очага высокодифференцированного рака щитовидной железы, не подлежащего хирургическому удалению, визуализируемого на КТ/МРТ/18F-ФДГ-ПЭТ, не накапливающего терапевтическую активность радиоактивного йода при условии адекватно выполненной радиойодтерапии и постлечебной сцинтиграфии всего тела, желательно с использованием однофотонной эмиссионной КТ / КТ;
-
• доказанное согласно системе RECIST 1.1 прогрессирование опухолевого процесса через ≤ 12 мес. на фоне радиойодтерапии активностями не менее 3,7 ГБк при условии полноценной абляции остатка щитовидной железы;
-
• отсутствие регрессии очагов опухоли при суммарной лечебной активности радиоактивного йода более 22 ГБк (600 мКи).
Дополнительно важно выделить группу пациентов с местнораспространенным опухолевым процессом, которым по каким-либо причинам невозможно выполнить тиреоидэктомию, при этом проведение радиойодабляции также противопоказано. Тактику лечения таких больных нужно выбирать по тем же принципам, что и у пациентов с радиойодрефрактерным высокодифференцированным раком щитовидной железы.
Важно отметить, что часть пациентов с радиойодрефрактерным высокодифференцированным раком щитовидной железы имеют латентное течение опухолевого процесса и могут длительное время не иметь клинических симптомов прогрессирования опухолевых очагов по данным радиологических методов исследования. Пациентам с радиойодрефрактерным высокодифференцированным раком щитовидной железы без признаков прогрессирования (при стабилизации опухолевого процесса) показано динамическое наблюдение с соответствующей ТТГ-супрессивной терапией и контрольными обследованиями каждые 3–12 мес. При выявлении клинических симптомов прогрессирования заболевания или прогрессирования опухолевых очагов по данным радиологических методов исследования (увеличение размеров по шкале RECIST 1.1 более чем на 20%) рекомендуется проведение одного из следующих вариантов системной терапии:
-
• таргетной терапии в качестве I линии лечения;
-
• участия в клиническом исследовании;
-
• химиотерапии.
Химиотерапия с включением доксорубицина и цисплатина обладает низкой эффективностью, а кратковременный эффект зачастую сопровождается выраженной токсичностью. Для лечения нерезектабельного местнораспространенного или метастатического папиллярного или фолликулярного рака щитовидной железы при развитии радиойодрезистентности рекомендуется назначение ленватиниба 24 мг/сут. или сорафениба 800 мг/сут. С учетом показателей выживаемости без прогрессирования и частоты объективных ответов применение ленватиниба в первой линии предпочтительно. Для лечения нерезектабельного местнораспространенного или метастатического медуллярного рака щитовидной железы показано назначение вандетаниба 300 мг/сут. Длительность лечения определяется достигнутым эффектом, терапию следует продолжать до прогрессирования или неприемлемой токсичности. Рекомендуемые режимы паллиативной ХТ анапластического рака щитовидной железы представлены в табл. 6. При анапластическом раке щитовидной железы в случае наличия BRAF мутации при неэффективности режимов цитотоксической терапии по решению врачебной комиссии может быть рассмотрено назначение тирозинкиназных ингибиторов.
Таблица 6. Рекомендуемые режимы паллиативной химиотерапии анапластического рака щитовидной железы
|
Название режима |
Схема проведения |
|
Рacli +Сarbo |
Паклитаксел 135 мг / м2 в / в в 1-й день + карбоплатин AUC- 5 в / в в 1-й день, каждые 3 нед. Паклитаксел 60–80 мг / м2 в / в еженедельно + карбоплатин AUC- 2 в / в еженедельно до прогрессирования или неприемлемой токсичности |
|
AD (AT) 1 |
Доксорубицин 60 мг / м2 в / в в 1-й день + доцетаксел 60 мг / м2 в / в в 1-й день, каждые 3 нед. Доксорубицин 20 мг / м2 в / в в 1-й, 2-й, 3-й дни + доцетаксел 20 мг / м2 в / в в 1-й, 2-й, 3-й дни, каждые 3 нед. |
|
Паклитаксел |
Паклитаксел 60–90 мг / м2 в / в еженедельно до прогрессирования Паклитаксел 135–175 мг / м2 в / в в 1-й день, каждые 3 нед. |
|
Доксорубицин1 |
Доксорубицин 20–25 мг / м2 в / в еженедельно, до прогрессирования Доксорубицин 60 мг / м2 в / в в 1-й день, каждые 3 нед. |
1 Кумулятивная доза доксорубицина не должна превышать 450–500 мг / м2
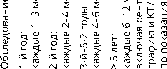
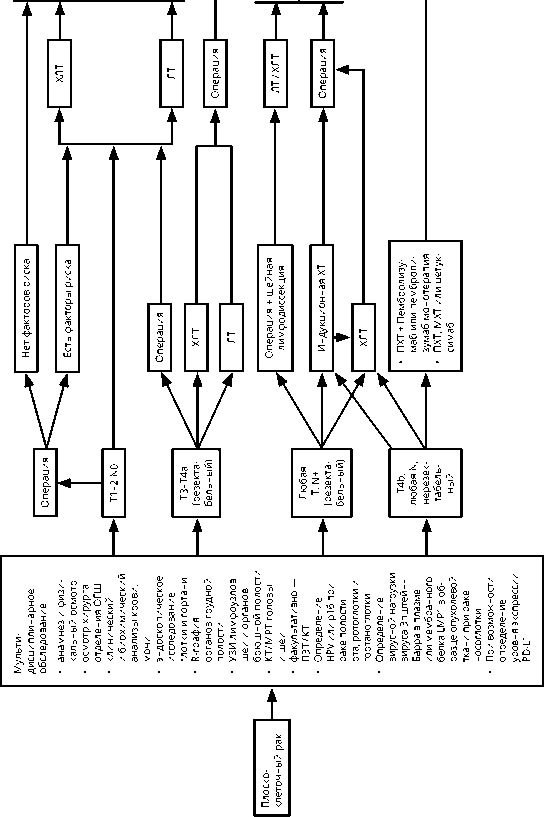
Рисунок 1. Рекомендуемый алгоритм обследования и лечения резектабельных и местнораспространенных опухолей головы и шеи.
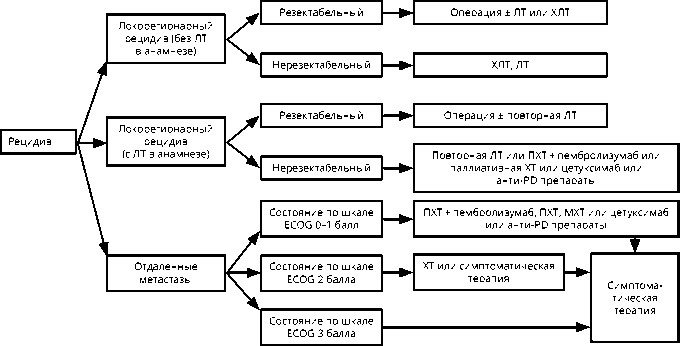
Рисунок 2. Рекомендуемый алгоритм лечения рецидива плоскоклеточного рака головы и шеи.
Железистый рак (аденокарцинома)
-
• у больных с метастатическим процессом или при обширном нерезектабельном местном рецидиве рекомендовано исследование экспрессии HER2 / neu
-
• при секреторных аденокарциномах слюнных желез у больных с метастатическим процессом или обширным нерезектабель-ным местным рецидивом при возможности — определение мутаций в генах NTRK (gene fusion);
-
• при железистом раке у больных с метастатическим процессом или обширным нерезектабель-ным местным рецидивом — определение экспрессии рецепторов андрогенов;
-
• при железистом раке у больных с метастатическим процессом или обширным нерезектабель-ным местным рецидивом при возможности — определение MSI;
-
• при высокодифференцированном и медуллярном раке щитовидной железы при возможности — определение RET мутаций;
-
• при анапластическом раке щитовидной железы при возможности — определение BRAF мутации.ф
Резектабельная
Операция
ХЛТ при высоком риске
Обследование:
Лекарственная терапия
Рисунок 3. Рекомендуемый алгоритм лечения железистого рака головы и шеи.
1-й год: каждые 1–3 мес.
2-й год: каждые 2–4 мес.
3-й–5-й годы: каждые 4–6 мес.
> 5 лет: каждые 6–12 мес., включая R-графию и КТ / МРТ —по показаниям
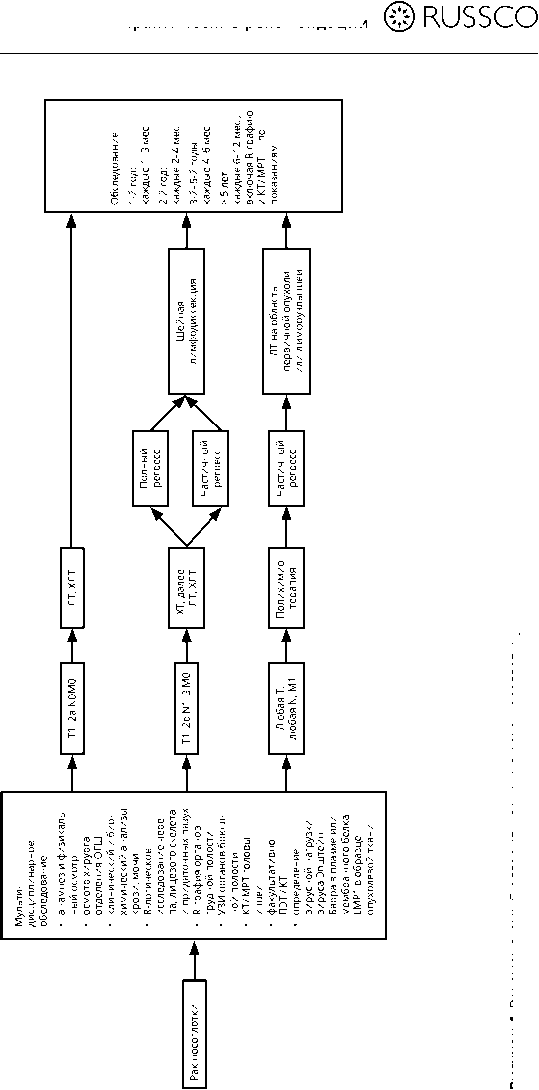
Рисунок 4. Рекомендуемый алгоритм лечения рака носоглотки.


