Практические рекомендации по лекарственному лечению метастатических опухолей головного мозга
Автор: Д. Р. Насхлеташвили, С. М. Банов, А. Х. Бекяшев, Т. Н. Борисова, Е. Р. Ветлова, А. В. Голанов, А. М. Зайцев, Г. Л. Кобяков, А. В. Смолин
Журнал: Злокачественные опухоли @malignanttumors
Статья в выпуске: 3S2-1 т.10, 2020 года.
Бесплатный доступ
Метастатические опухоли головного мозга, таргетная терапия, химиотерапия, иммунотерапия, лучевая терапия, стереотаксическая лучевая терапия, хирургическое лечение
Короткий адрес: https://sciup.org/140254635
IDR: 140254635 | DOI: 10.18027/2224-5057-2020-10-3s2-08
Текст статьи Практические рекомендации по лекарственному лечению метастатических опухолей головного мозга
По данным популяционных канцер-регистров, частота метастазов в головном мозге (МГМ) составляет 8–10 % всех случаев онкологических заболеваний. Частота МГМ различается в зависимости от локализации первичного очага и составляет при раке легкого — 19,9%, меланоме — 6,5%, раке почки — 6,5%, раке молочной железы — 5,1 % и 1,8% — в случае колоректального рака. Подавляющее большинство МГМ обусловлено гематогенным распространением опухолевых клеток из первичного очага. В головном мозге метастазы локализуются преимущественно на границе между серым и белым веществом, а также на стыке бассейнов средней мозговой и задней мозговой артерий. Среди злокачественных опухолей наиболее высокий метастатический потенциал имеют меланома и мелкоклеточный рак легкого, при которых МГМ развиваются ко 2-му году наблюдения у 50–80% пациентов с диссеминированным процессом. Метастазы меланомы имеют наихудший прогноз опухолевого контроля и выживаемости. По данным аутопсии, у 25–40% онкологических пациентов имеются не диагностированные при жизни МГМ. Метастатическое поражение головного мозга проявляется в виде солитарного очага приблизительно у 37–50% пациентов, а у 50–63% пациентов метастазы имеют множественный характер и могут локализоваться в различных анатомических образованиях мозга: в паренхиме, в твердой или в мягкой мозговой оболочках, в субарахноидальном пространстве и желудочках мозга. Супратенториальные метастазы составляют 80–85 %, метастазы в мозжечке — 10–15 %, в стволе мозга — 3–5 %, в мозговых оболочках — 1–2%. Такое распределение, вероятно, зависит от кровоснабжения мозга.
В связи с увеличением продолжительности жизни онкологических больных увеличивается и частота МГМ. Возникновение МГМ является фактором неблагоприятного прогноза: медиана продолжительности жизни у больных с нелечеными МГМ составляет 51 день. В связи с этим эффективная терапия
1 Цитирование: Насхлеташвили Д. Р., Банов С. М., Бекяшев А. Х., Борисова Т. Н., Ветлова Е. Р., Голанов А. В. и соавт. Практические рекомендации по лекарственному лечению метастатических опухолей головного мозга. Злокачественные опухоли: Практические рекомендации RUSSCO #3s2, 2020 (том 10).08
и локальный контроль МГМ имеют первостепенное значение для прогноза и качества жизни пациентов.
1. ФАКТОРЫ ПРОГНОЗА
Общая выживаемость больных с МГМ и планирование лечения зависят от клинических факторов (возраст пациента, общее состояние (по шкале Карнов-ского), неврологический дефицит), биологических факторов опухоли, объема поражения головного мозга (количество и объем метастазов и их локализация), наличия масс-эффекта и активности экстракраниального опухолевого процесса.
В настоящее время общепринятой шкалой для оценки прогноза больных с МГМ являются шкала прогноза общей выживаемости GPA (онлайн калькулятор на сайте
2. КЛАССИФИКАЦИЯ И ОПРЕДЕЛЕНИЕ СТАДИИ
Метастатическое поражение головного мозга — это всегда IV стадия опухолевого процесса, по классификации TNM соответствует М1 независимо от значения индексов «Т» и «N». В зависимости от количества очагов в головном мозге выделяют:
• одиночные метастазы: один метастаз в головном мозге, в т. ч. солитарный метастаз (предполагает отсутствие других отдаленных метастазов);
• олигометастатическое поражение головного мозга: 2–4 очага в головном мозге;
• множественные метастазы: ≥ 5 очагов в головном мозге.
3. ДИАГНОСТИКА
В зависимости от макроструктуры метастазы в головном мозге могут быть cолидной, кистозной и кистозно-солидной структуры.
Обследование включает в себя:
• осмотр, сбор анамнеза болезни, семейного анамнеза;
• неврологический осмотр;
• офтальмологический осмотр с оценкой симптомов внутричерепной гипертензии;
• МРТ головного мозга с контрастным усилением: Т1 (± контраст, шаг — 1–3 мм) и Т2 диффузно-взвешенные изображения, режим FLAIR;
• КТ головного мозга с в / в контрастированием (шаг — 1 мм) — при невозможности МРТ или при поражении костных структур;
• R-графия органов грудной клетки;
• УЗИ органов брюшной полости, забрюшинного пространства, малого таза, периферических лимфоузлов;
• сцинтиграфию костей скелета;
• клинический анализ крови;
• биохимический анализ крови с показателями функций печени, почек;
• КТ органов грудной клетки, брюшной полости, малого таза с в / в контрастированием;
• ПЭТ / КТ всего тела или диффузионная МРТ всего тела.
4. ЛЕЧЕНИЕ
При метастазах опухоли не выявленной первичной локализации — см. соответствующий раздел практических рекомендаций.
Для лечения пациентов с МГМ используются:
-
• нейрохирургическое лечение;
-
• ЛТ;
-
• стереотаксическая ЛТ (гипофракционирование / радиохирургия)
-
• облучение всего головного мозга;
-
• противоопухолевая лекарственная терапия;
-
• комбинация вышеперечисленных вариантов лечения.
-
4.1. Локальный контроль метастазов в головном мозге(нейрохирургическое лечение, ЛТ)
-
4.1.1. Пациенты с ограниченным метастатическим поражением головного мозга (1–4 метастаза)
-
4.1.1.1. Пациенты с благоприятным прогнозом общей выживаемости: общее состояние по шкале Карновского≥ 70%, по шкале ECOG — 0–2 балла, отсутствие или ограниченное количество экстракраниальных метастазов, контролируемые экстракраниальные проявления болезни, имеются резервы системного лечения, GPA — 2–4 балла:
-
-
-
• при наличии очага с максимальным диаметром > 2,5 см или при очаге любых размеров с наличием неврологической симптоматики рекомендуется нейрохирургическое лечение с последующим проведением стереотаксической ЛТ ложа удаленного метастатического очага. В случае невозможности проведения нейрохирургического лечения (высокий риск развития послеоперационного неврологического дефицита) рекомендуется проведение стереотаксической ЛТ в режиме радиохирургии или гипофракционирования;
-
• при наличии 1–4 метастатических очагов с максимальными размерами ≤ 2,5 см рекомендуется проведение стереотаксической ЛТ в режиме радиохирургии. Не рекомендуется проведение облучения всего головного мозга в этой клинической ситуации, поскольку оно не обеспечивает увеличение общей выживаемости и повышает риск когнитивных расстройств.
-
4.1.1.2. Пациенты с неблагоприятным прогнозом общей выживаемости: общее состояние по шкале Карновского < 70 %, по шкале ECOG — 3–4 балла, множественные экстракраниальные метастазы и/или неконтролируемые проявления экстракраниальной болезни, отсутствуют резервы системного лечения, GPA — 0–1,5 балла:
-
• облучение всего головного мозга в самостоятельном варианте лечения; • симптоматическое лечение;
-
4.1.2. Множественное метастатическое поражение
-
4.1.2.1. Пациенты с благоприятным прогнозом общей выживаемости: общее состояние по шкале Карновского ≥ 70 %, по шкале — ECOG 0–2 балла, отсутствие или ограниченное количество экстракраниальных метастазов, контролируемые экстракраниальные проявления болезни, имеются резервы системного лечения, GPA — 2–4 балла:
-
4.1.2.1.1. Наличие от 5 до 10 метастатических очагов в головном мозге:
-
Рекомендуемый алгоритм локального контроля при ограниченном метастатическом поражении головного мозга (1–4 метастаза) представлен на рис. 1.
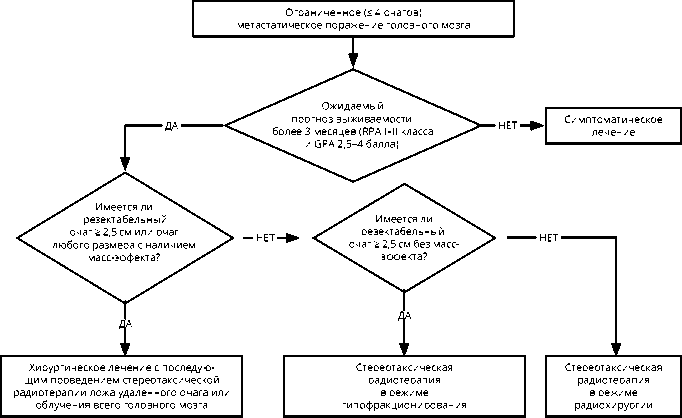
Рисунок 1. Алгоритм локального контроля при ограниченном метастатическом поражении головного мозга (1–4 метастаза в головном мозге).
головного мозга (≥ 5 метастазов)
-
• при наличии очага с максимальным диаметром > 2,5 см или очага любых размеров с наличием неврологической симптоматики рекомендуется
нейрохирургическое лечение с последующим проведением стереотаксической ЛТ ложа удаленного метастатического очага и оставшихся очагов. В случае невозможности проведения нейрохирургического лечения (высокий риск развития послеоперационного неврологического дефицита) рекомендуется проведение стереотаксической ЛТ в режиме радиохирургии или гипофракционирования всех визуализируемых очагов в головном мозге;
-
• при размерах очагов < 2,5 см в диаметре рекомендуется проведение стереотаксической ЛТ всех очагов в головном мозге;
-
• альтернативными вариантом ЛТ в этой клинической ситуации может быть комбинация стереотаксической ЛТ и облучения всего головного мозга или проведение облучения всего головного мозга в самостоятельном варианте лечения;
-
• включение облучения всего головного мозга в схему лечения улучшает интракраниальной контроль метастатических очагов, но не обеспечивает увеличение общей выживаемости и повышает риск когнитивных расстройств;
-
• для снижения риска развития когнитивных расстройств облучение всего головного мозга рекомендуется проводить с исключением из объема облучение гиппокампа и/или на фоне приема акатинола мемантина в дозе до 20 мг/сут. во время облучения и в течение 3–4 мес. после его окончания.
-
4.1.2.1.2. Наличие 11 и более метастатических очагов в головном мозге:
-
• при наличии очага с максимальным диаметром > 2,5 см или очага любых размеров с наличием неврологической симптоматики рекомендуется нейрохирургическое лечение с последующим проведением стереотаксической ЛТ ложа удаленного метастатического очага и оставшихся очагов. В случае невозможности проведения нейрохирургического лечения (высокий риск развития послеоперационного неврологического дефицита) рекомендуется проведение облучения всего головного мозга в самостоятельном варианте лечения;
-
• рекомендуется проведение облучения всего головного мозга в самостоятельном варианте лечения;
-
• возможно проведение стереотаксической ЛТ как компонента комбинированного лечения или в самостоятельном варианте лечения в отдельных клинических ситуациях и в центрах, имеющих опыт проведения стереотаксической ЛТу пациентов с множественным метастатическим поражением головного мозга.
-
4.1.2.2. Пациенты с неблагоприятным прогнозом общей выживаемости: общее состояние по шкале Карновского < 70 %, по шкале ECOG — 3–4 балла, множественные экстракраниальные метастазы и/или неконтролируемые проявления экстракраниальной болезни, отсутствуют резервы системного лечения, GPA — 0–1,5 балла:
-
• симптоматическое лечение;
-
• облучение всего головного мозга у отдельных категорий пациентов.
Рекомендуемый алгоритм локального контроля при множественном метастатическом поражении головного мозга (≥ 5 метастазов) представлен на рис. 2.
Множественное (≥ 5 очагов) метастатическое поражение головного мозга
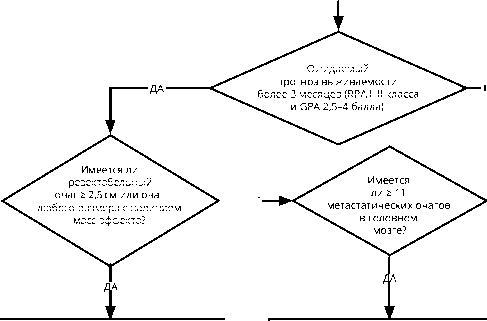
Имеется
Имеется ли резектабельный очаг ≥ 2,5 см или очаг любого размера с наличием масс-эффекта?
метастатических очагов в головном мозге?
Ожидаемый прогноз выживаемости более 3 месяцев (RPA I–II класса и GPA 2,5–4 балла)
НЕТ
НЕТ
Хирургическое лечение с последующим проведением облучения всего головного мозга и / или стереотаксической радиотерапии в отдельных клинических случаях
Облучение всего головного мозга или стереотаксическая радиотерапия в отдельных клинических случаях
НЕТ
Симптоматическое лечение
Облучение всего головного мозга и / или стереотаксическая радиотерапия
Рисунок 2. Алгоритм локального контроля при множественном метастатическом поражении головного мозга (≥ 5 очагов в головном мозге).
-
4.2. Противоопухолевая лекарственная терапия
-
4.2.1. Рекомендуется проведение системной противоопухолевой терапии (ХТ, таргетная терапия, иммунотерапия) в самостоятельном варианте лечения у пациентов с наличием небольших по размеру, бессимптомных МГМ при наличии в арсенале лечения препаратов с установленной эффективностью в головном мозге (табл. 2). Системная противоопухолевая терапия (ХТ, таргетная терапия, иммунотерапия) на первом этапе лечения возможна в следующих случаях:
-
4.2.2. В случае выявления МГМ на фоне отсутствия, стабилизации (или регрессии) экстракраниальных метастазов вследствие эффективной противоопухолевой лекарственной терапии целесообразно проведение локального лечения МГМ в соответствии с текущими клиническими рекомендациями и сохранение режима проводимой противоопухолевой лекарственной терапии.
-
4.2.3. В случае выявления МГМ (или появления новых (дистантных) метастатических очагов в головном мозге) и прогрессирования экстракраниальных метастазов на фоне проведения противоопухолевой лекарственной терапии рекомендуется изменение режима противоопухолевого лекарственного лечения. Предпочтение отдается препаратам с установленной противоопухолевой эффективностью в головном мозге.
-
4.2.4. Оценка эффективности лечения МГМ проводится по критериям RANO (табл. 1). Оценка эффективности лечения экстракраниального опухолевого процесса проводится по критериям RECIST. Оценка эффекта лекарственного лечения проводится каждые 2–3 цикла ХТ или каждые 2–3 мес. таргетной терапии / иммунотерапии.
Противоопухолевое лекарственное лечение у пациентов с впервые выявленными МГМ является базисным лечением. Цель противоопухолевого лекарственного лечения пациентов с МГМ заключается в обеспечении контроля экстракраниальных очагов, снижении риска развития новых МГМ, а также лечении интракраниальных очагов в отдельных клинических ситуациях. Противоопухолевое лекарственное лечение МГМ проводится по схемам, рекомендованным для лечения соответствующего первичного опухолевого очага с учетом биологических характеристик опухоли.
бессимптомное метастатическое поражение головного мозга; потенциальная чувствительность опухоли к системному лечению (рак молочной железы с гиперэкспрессией HER2, немелкоклеточный рак легкого с мутациями EGFR, транслокацией ROS1 или транслокацией ALK, мелкоклеточный рак легкого, меланома с мутацией BRAF, рак яичников, в т. ч. с мутациями BRCA1 и BRCA2).
Таблица 1. Клинико-рентгенологические критерии оценки эффективности лечения метастатических опухолей головного мозга
|
Полная регрессия |
Частичная регрессия |
Стабилизация |
Прогрессирование болезни |
|
|
Измеряемые очаги (> 1,0 см) |
Нет |
Уменьшение на ≥ 30 % суммы наибольших размеров измеряемых очагов в сравнении с исходными данными |
Уменьшение на < 30 % или увеличение на ≤ 20 % суммы наибольших размеров измеряемых очагов в сравнении с исходными данными |
Увеличение на ≥ 20 % суммы наибольших размеров измеряемых очагов в сравнении с исходными данными |
|
Неизмеряемые очаги (< 1,0 см) |
Нет |
Стабильны или уменьшаются |
Стабильны или уменьшаются |
Появление новых очагов (если ранее не выявлялись и стали определяться как минимум в двух проекциях) |
|
Новые очаги |
Нет |
Нет |
Нет |
Появление новых очагов |
|
ГКС |
Нет |
Доза стабильна или снижается |
Доза стабильна или снижается |
Не оцениваются |
|
Неврологическое состояние |
Стабильно или улучшилось |
Стабильно или улучшилось |
Стабильно или улучшилось |
Ухудшилось |
|
Полная регрессия |
Частичная регрессия |
Стабилизация |
Прогрессирование болезни |
|
|
Критерии оценки эффекта |
Сочетание всех факторов |
Сочетание всех факторов |
Сочетание всех факторов |
Наличие любого из указанных факторов |
В случае изолированных МГМ или при прогрессировании интракраниального процесса возможно продолжение проводимой таргетной терапии или иммунотерапии (если эти виды лечения контролируют экстракраниальный процесс) с подключением методов локального контроля МГМ (нейрохирургическое лечение, стереотаксическая ЛТ, ЛТ всего головного мозга). При хирургическом удалении МГМ рекомендуется изучение морфологических и биологических характеристик удаленной ткани с целью коррекции противоопухолевой лекарственной терапии при необходимости. При выборе варианта лекарственной терапии, помимо морфологической и биологической характеристик опухоли, необходимо учитывать общее состояние пациента, в т. ч. неврологический статус, сопутствующую патологию. Рекомендуемые режимы противоопухолевой лекарственной терапии с учетом установленной эффективности препаратов при МГМ представлены в табл. 2.
Таблица 2. Противоопухолевая лекарственная терапия у пациентов с МГМ с учетом установленной эффективности препаратов в головном мозге
|
Меланома |
|
|
Вемурафениб + кобиметиниб |
Вемурафениб 960 мг внутрь × 2 раза в сутки внутрь ежедневно в комбинации с кобиметинибом 60 мг / сут. внутрь с 1-го по 21-й дни каждые 4 нед., до прогрессирования или неприемлемой токсичности |
|
Дабрафениб + траметиниб |
Дабрафениб 150 мг × 2 раза в сутки внутрь ежедневно + траметиниб 2 мг / сут. внутрь ежедневно, до прогрессирования или неприемлемой токсичности |
|
Ипилимумаб ± ниволумаб |
Ипилимумаб 3 мг / кг в / в в 1-й день 1 раз в 3 нед. (4 введения) + ниволумаб 1 мг / кг в / в в 1-й день 1 раз в 3 нед. (4 введения), далее — ниволумаб 240 мг в / в каждые 2 нед. (или 480 мг в / в каждые 4 нед.) до прогрессирования или развития неприемлемой токсичности |
|
Темозоломид ± цисплатин (при отсутствии BRAF мутации, при симптомных метастазах в головном мозге) |
Темозоломид 150 мг / м² / сутки внутрь в 1–5-й дни + цисплатин 20 мг / м² / сут. в / в в 1–5-й дни каждые 4 нед., до 6 циклов |
|
Комментарии:
|
|
|
|
|
Рак легкого |
|
|
Мелкоклеточный рак |
|
|
Этопозид + карбоплатин |
Этопозид 100 мг / м² в / в в 1-й, 2-й, 3-й дни + карбоплатин AUC 5 в / в в 1-й день каждые 3 нед., до 6 циклов |
|
Этопозид + цисплатин |
Этопозид 120 мг / м² в / в в 1-й, 2-й, 3-й дни + цисплатин 80 мг / м2 в / в в 1-й день каждые 3 нед., до 6 циклов |
|
Иринотекан + цисплатин |
Иринотекан 65 мг / м² в / в в 1-й и 8-й дни + цисплатин 75 мг / м2 в / в в 1-й день каждые 3 нед., до 6 циклов |
|
Топотекан |
Топотекан 1,5 мг / м² / сут. в / в в 1–5-й дни каждые 3 нед., до 6 циклов |
|
Комментарии:
|
|
|
Немелкоклеточный рак легкого (НМРЛ): аденокарцинома с отсутствием активирующих мутаций (EGFR / ALK / ROS1 негативный) |
|
|
Противоопухолевая лекарственная терапия проводится в соответствии с клиническими рекомендациями по лечению пациентов с НМРЛ + локальное лечение МГМ в соответствии текущими клиническими рекомендациями по лечению пациентов с МГМ |
|
|
НМРЛ: аденокарцинома с наличием активирующих мутаций (EGFR / ALK / ROS1 позитивный) |
|
|
Осимертиниб (EGFR позитивный рак) |
Осимертиниб 80 мг / сут. внутрь ежедневно до прогрессирования или неприемлемой токсичности (I или II линии лечения при прогрессировании на фоне ингибиторов EGFR (гефитиниб, эрлотиниб, афатиниб) и наличии в опухоли мутации T790M) |
|
Гефитиниб (EGFR позитивный рак) |
Гефитиниб 250 мг / сут. внутрь ежедневно до прогрессирования или неприемлемой токсичности |
|
Эрлотиниб (EGFR позитивный рак) |
Эрлотиниб 150 мг / сут. внутрь ежедневно до прогрессирования или неприемлемой токсичности |
|
Афатиниб (EGFR позитивный рак) |
Афатиниб 40 мг / сут. внутрь ежедневно до прогрессирования или неприемлемой токсичности |
|
Алектиниб (ALK позитивный рак) |
Алектиниб 1200 мг / сут. внутрь ежедневно до прогрессирования или неприемлемой токсичности (I или II линии лечения при прогрессировании на фоне ингибиторов ALK (кризотиниб, церитиниб) |
|
Церитиниб (ALK позитивный рак) |
Церитиниб 450 мг / сут. внутрь ежедневно до прогрессирования или неприемлемой токсичности |
|
Кризотиниб (ALK / ROS1 позитивный рак) |
Кризотиниб 250 мг / сут. внутрь ежедневно до прогрессирования или развития неприемлемой токсичности |
|
Комментарии:
|
|
|
НМРЛ: плоскоклеточный рак |
|
|
Противоопухолевая лекарственная терапия проводится в соответствии с клиническими рекомендациями по лечению НМРЛ + локальное лечение МГМ в соответствии текущими клиническими рекомендациями по лечению пациентов с МГМ |
|
|
Рак молочной железы |
|
|
Люминальный A и B, HER2-негативный фенотипы |
|
|
Лечение в соответствии с клиническими рекомендациями по лечению рака молочной железы + локальное лечение МГМ в соответствии текущими клиническими рекомендациями по лечению пациентов с МГММе-сто для ввода текста. |
|
|
HER2-позитивный фенотип (люминальный или нелюминальный) |
|
|
Лечение в соответствии с клиническими рекомендациями по лечению рака молочной железы + локальное лечение МГМ в соответствии текущими клиническими рекомендациями по лечению пациентов с МГМ. |
|
|
Капецитабин + лапатиниб |
Капецитабин 2000 мг / м² / сут. внутрь в 1–14-й дни каждые 3 нед. + ла-патиниб 750–1000 мг / сут. внутрь ежедневно до прогрессирования или неприемлемой токсичности |
|
Тройной негативный фенотип |
|
|
Лечение в соответствии с клиническими рекомендациями по лечению рака молочной железы + локальное лечение МГМ в соответствии текущими клиническими рекомендациями по лечению пациентов с МГМ |
|
|
Рак почки |
|
|
Сунитиниб |
Сунитиниб 50 мг / сут. внутрь ежедневно в 1–28-й дни, интервал между циклами 2 нед., до прогрессирования или неприемлемой токсичности |
|
Комментарии:
|
|
|
Колоректальный рак |
|
|
Лечение в соответствии с клиническими рекомендациями по лечению метастатического колоректального рака + локальное лечение МГМ в соответствии текущими КР по лечению МГМ |
|
|
Комментарии:
|
|
4.3. Стероидная, противоотечнаяи противосудорожная терапия
4.3.1. Целью стероидной терапии является временное облегчение клинической симптоматики, связанной с повышением внутричерепного давления вследствие перифокального отека вокруг метастатических очагов.
4.3.2. Не рекомендуется проведение стероидной терапии у пациентов с МГМ без клинической симптоматики и проявлений масс-эффекта.
4.3.3. У пациентов с МГМ и умеренно выраженными симптомами, связанными с масс-эффектом, рекомендуется проведение стероидной терапии (дексаметазон) для ликвидации или временного облегчения симптомов, связанных с повышением внутричерепного давления и вторичным отеком мозга. Начальная доза дексаметазона составляет 4–8 мг / сут.
4.3.4. У пациентов с МГМ и сильно выраженными симптомами, связанными с масс-эффектом, рекомендуется назначение стероидной терапии (дексаметазон) для временного облегчения симптомов, связанных с повышением внутричерепного давления и вторичным отеком мозга. Начальная доза дексаметазона — от 12 мг / сут.
4.3.5. Назначение и прием стероидных гормонов рекомендуется в 1–3 приема внутрь (при суточных дозах менее 4 мг) или в / м с максимальными дозами в утренние часы и последним приемом не позднее 16–17 часов.
4.3.6. Дозу дексаметазона необходимо снижать постепенно, в течение 2 недель и более, основываясь на клинических симптомах и степени выраженности побочных эффектов стероидной терапии; прием ГКС необходимо сочетать с приемом гастропротекторов, контролем гликемии.
4.3.7. Осмотические диуретики (с контролем водно-электролитного баланса).
4.3.8. Рекомендуется проведение терапии бевацизумабом при наличии стойкого или нарастающего симптоматического отёка или радионекроза после стереотаксической ЛТ, резистентного к стероидной терапии. Доза бевацизумаба составляет 5–7,5 мг/кг с интервалом 2–3 недели, не менее 3 месяцев лечения, лечение проводится до регресса симптоматики или улучшения рентгенологической картины.
4.3.9. В случае наличия у пациентов эпилептического синдрома (в т. ч. в анамнезе) рекомендуется назначение противосудорожных препаратов.
5. ПРОФИЛАКТИКА И ДИСПАНСЕРНОЕ НАБЛЮДЕНИЕ
Рекомендуется соблюдать следующую периодичность наблюдения после лечения по поводу МГМ: в первые 1–2 года — каждые 3 мес., в 3–5-й годы — 1 раз в 6 мес. При высоком риске рецидива перерыв между обследованиями может быть сокращен. Объем обследования включает выяснение жалоб, физикальное обследование, МРТ головного мозга с контрастным усилением каждые 3 мес. Обследование на наличие экстракраниальных метастазов проводится в соответствии с особенностями первичного заболевания, ставшего источником метастазирования в головной мозг.


