Практические рекомендации по лекарственному лечению мезотелиомы плевры, брюшины и других локализаций
Автор: М. Б. Бычков, А. Г. Абдуллаев, С. Г. Багрова, Т. Д. Барболина, Т. Н. Борисова, Л. Ю. Владимирова, Н. В. Деньгина, Е. В. Левченко, Д. Д. Сакаева
Журнал: Злокачественные опухоли @malignanttumors
Статья в выпуске: 3S2-1 т.10, 2020 года.
Бесплатный доступ
Мезотелиома, канцерогенные факторы, факторы прогноза, химиотерапия, комбинированное лечение, опухолевые плевриты, тримодальная терапия, асцит
Короткий адрес: https://sciup.org/140254631
IDR: 140254631 | DOI: 10.18027/2224-5057-2020-10-3s2-04
Текст статьи Практические рекомендации по лекарственному лечению мезотелиомы плевры, брюшины и других локализаций
Мезотелиома — злокачественная агрессивно растущая опухоль, которая возникает при трансформации мезотелиальных клеток, выстилающих естественные полости организма, и характеризующаяся поражением плевры, брюшины, перикарда и оболочек яичка. Заболеваемость мезотелиомой плевры (МП) значительно варьирует от 8 случаев на 100 000 населения в Англии до 3,1 — в Австралии, 1 — в США, Испании, Польше. Частота МП увеличивается в последние годы в России, странах Западной Европы, Китае, Индии. Пик заболеваемости ожидается в 2020–2025 гг. Мужчины болеют чаще в соотношении 6:1. В РФ вопросу эпидемиологии мезотелиом не уделяется должного внимания. Статистических данных по заболеваемости и смертности нет.
В этиологии МП основное значение (80% случаев) имеет контакт с асбестом, применяемым в строительной практике. Проследить связь между развитием болезни и контактом с асбестом подчас очень трудно, так как существует большой латентный период возникновения опухоли — до 40 лет. Кроме асбеста в развитии мезотелиомы плевры также имеют значение другие химические канцерогены (силикаты, бериллий, жидкий парафин), ионизирующее излучение (описаны случаи развития мезотелиомы через 20–30 лет после ЛТ лимфогранулематоза). Имеет значение генетическая предрасположенность (мутации BRCA1 ассоциированного белка BAP- 1, позитивный PD–L1), вирус SV- 40, гены которого экспрессируются у 60% больных МП. Для мезотелиом других локализаций наличие таких причинно-следственных связей не доказано.
1. ОПРЕДЕЛЕНИЕ СТАДИИ
Для стадирования заболевания используется классификация, предложенная Международной группой по изучению мезотелиомы (IMIG), (AJCC, 8 издание, 2017 г.). Стадирование по TNM применимо только к МП (табл. 1 и 2). Несмотря
-
1 Цитирование: Бычков М. Б., Абдуллаев А. Г., Багрова С. Г., Барболина Т. Д., Борисова Т. Н., Владимирова Л. Ю. и соавт. Практические рекомендации по лекарственному лечению мезотелиомы плевры, брюшины и других локализаций. Злокачественные опухоли : Практические рекомендации RUSSCO #3s2, 2020 (том 10) – 04
на то, что выпот в плевральной полости при МП встречается у40–70% больных, при стадировании наличие плеврита не учитывается.
Таблица 1. Определение категорий TNM при мезотелиоме плевры
|
Первичная опухоль |
|
|
Тх |
Первичная опухоль не может быть оценена |
|
Т0 |
Первичная опухоль не определяется |
|
Т1 |
Опухоль ограничена париетальной плеврой на стороне поражения в сочетании или без вовлечения висцеральной, медиастинальной, диафрагмальной плевры |
|
Т2 |
Опухоль прорастает любую поверхность париетальной плевры на стороне поражения. Присутствует одна из следующих характеристик:
|
|
Т3 |
Опухоль локально распространенная, но потенциально резектабельна, прорастает любую поверхность париетальной плевры на стороне поражения. Присутствует одна из следующих характеристик:
|
|
Т4 |
Местно-распространенный, но технически не резектабельный процесс. Опухоль прорастает все поверхности париетальной плевры на стороне поражения. Присутствует одна из следующих характеристик:
|
|
Регионарные лимфатические узлы 1,2 |
|
|
Nх |
Региональные лимфатические узлы не могут быть оценены |
|
N0 |
Нет метастазов в региональных лимфатических узлах |
|
N1 |
Метастазы в бронхопульмональных лимфатических узлах (узле) и / или лимфатических узлах (узле) корня легкого на стороне поражения, медиастинальных лимфатических узлов, включая внутренние маммарные, перидиафрагмальные, перикардиальной клетчатки и интеркостальные на стороне поражения |
|
N2 |
Метастазы в надключичных лимфатических узлах (узле) на стороне поражения или противоположной стороне, контралатеральных медиастинальных лимфатических узлах |
|
Отдаленные метастазы |
|
|
М0 |
Нет отдаленных метастазов |
|
М1 |
Есть отдаленные метастазы (печень, паренхима легких, кости, головной мозг) |
1 Для мезотелиомы брюшины регионарными являются забрюшинные лимфатические узлы;
2 Для мезотелиомы оболочек яичка регионарными являются паховые и подвздошные лимфатические узлы.
2. ДИАГНОСТИКА
Таблица 2. Группировка мезотелиомы плевры по стадиям
|
Стадия |
T |
N |
M |
|
Ia |
Т1 |
N0 |
М0 |
|
Ib |
Т2–3 |
N0 |
М0 |
|
II |
Т1–2 |
N1 |
М0 |
|
IIIА |
Т3 |
N1 |
М0 |
|
IIIВ |
Т1–3 |
N2 |
M0 |
|
Т4 |
N любая |
М0 |
|
|
IV |
Т любая |
N любая |
М1 |
Торакоскопия или лапароскопия обязательны в диагностическом алгоритме, т. к. помогают визуально оценить степень диссеминации, операбельность и выполнить биопсию с ИГХ исследованием для точного определения гистологического типа опухоли. Мезотелиальные клетки отличаются от фибробластических и эпителиальных только при электронной микроскопии и иммуно-фенотипировании. ИГХ-панель выполняется в позитивном и в негативном окрашивании. Характерно наличие кальретинина, виментина, мезотелина и антигена WT- 1. Не рекомендуется устанавливать диагноз только на основании цитологического исследования, так как при этом методе точный диагноз устанавливается только в 26% случаев.
Первичное обследование должно проводится до начала лечения для определения распространенности болезни, стадирования и определения тактики лечения. План обследования больных мезотелиомой:
• сбор анамнеза и физикальный осмотр;
• общий анализ крови (гемоглобин, общее число лейкоцитов, лейкоцитарная формула, тромбоциты);
• биохимический анализ крови (креатинин, мочевина, АЛТ, АСТ) и коагулограмма;
• АФП, β-ХГЧ и ЛДГ — при поражении оболочек яичка;
• КТ органов грудной клетки и брюшной полости с в / в контрастированием;
• УЗИ шейно-надключичных, подключичных лимфатических узлов, паховых лимфатических узлов — при мезотелиоме оболочек яичка, органов брюшной полости, забрюшинного пространства и малого таза;
• рентгенологическое исследование органов грудной клетки (лишь для определения уровня гидроторакса); диагноз МП не может быть установлен по обычной рентгенограмме;
• радиоизотопное исследование скелета (при подозрении на поражение костей);
• КТ или МРТ головного мозга с контрастным усилением (при наличии неврологических симптомов или при ранней стадии для исключения поражения). МРТ является методом уточняющей диагностики при оценке местного распространения опухоли. КТ и МРТ играют важную роль в оценке распространенности опухоли по диафрагме, средостению, верхней части грудной клетки. При неинвазивной стадии очень трудно провести различия между Т1 и Т2.
• УЗДГ сосудов шеи и нижних конечностей (при гиперкоагуляции);
• ЭКГ и ЭхоКГ при поражении перикарда;
• торакоскопическая биопсия плевры или перикарда / лапароскопическая биопсия брюшины, биопсия паховых лимфатических узлов при мезотелиоме оболочек яичка;
• ИГХ и / или ИЦХ исследование;
• выполнение ПЭТ-КТ с фтордезоксиглюкозой с целью первичного стади-рования не рекомендуется, но является дополнительным методом в диагностике поражения плевры и в качестве контроля после проведенного лечения и перед планированием ЛТ.
3. ПРОГНОСТИЧЕСКИЕ ФАКТОРЫ
4. ЛЕЧЕНИЕ
4.1. I–IIIА стадии
4.1.1. Хирургическое лечение
Гистологические подтипы мезотелиомы включают в себя 3 формы: эпителиоидную, бифазную и саркоматоидную. Наиболее часто встречается эпителиоидная (50–70% случаев), реже — бифазная (20–25% случаев) и саркоматоидная (7–20% случаев) формы. У больных с эпителиоидной формой отмечаются лучшие отдаленные результаты лечения, чем у пациентов с бифазной и саркоматоидной формами.
К числу прогностических факторов при МП относят возраст, пол, стадию заболевания, гистологический тип опухоли, ответ на лечение, общесоматический статус по шкале ECOG, потерю веса, исходный уровень гемоглобина и лейкоцитов (табл. 3). Экспрессия PD–L1 — прогностический фактор для МП. Отсутствие экспрессии PD–L1 ассоциируется с увеличением выживаемости).
Таблица 3. Прогностические факторы при мезотелиоме плевры
|
Параметр |
Благоприятный прогностический фактор |
Неблагоприятный прогностический фактор |
|
Возраст |
< 75 лет |
≥ 75 лет |
|
Боль в грудной клетке |
Нет |
Есть |
|
Количество тромбоцитов |
<400х109/л |
>400х109/л |
|
Гемоглобин |
≥ 14,6 г / дл |
< 11,2 г / дл |
|
Потеря массы тела |
Нет |
Есть |
|
ECOG |
0 |
1–2 |
|
Гистологический вариант |
Эпителиоидный |
Неэпителиоидный |
|
Пол |
Женский |
Мужской |
|
Лейкоциты |
<8,3 х109/л |
>8,3 х 109/л |
|
Точность диагностики |
Максимальная |
Минимальная |
|
PD–L1 |
Отрицательный< 5 % |
Положительный≥ 5 % |
Хирургический метод лечения предпочтителен для ранних стадий. Объем операции:
-
• экстраплевральная пневмонэктомия (ЭПП)
-
• плеврэктомия или декортикация (ПЭ, ПД)
-
• плевродез как метод лечения рецидивирующего плеврита.
Операция проводится в многопрофильном лечебном учреждении, опытным хирургом.
Требования, предъявляемые к пациентам до операции
-
• удовлетворительное общее состояние
-
• сохранная легочно-сердечная функция
-
• эпителиоидный тип опухоли
-
• N0–1.
Целесообразность хирургического вмешательства при саркоматоидном гистологическом варианте опухоли и поражении лимфатических узлов N2 спорна.
Плеврэктомия или декортикация в сравнении с ЭПП сопровождается лучшими показателями послеоперационной летальности (0–4% против 5–7% соответственно) [Flores R. M., 2008, Weder W. et al, 2011]. Метаанализ, в который включены 2903 оперированных пациентов с МП, подтвердил лучшие непосредственные результаты ПЭ/ПД в сравнении с ЭПП, однако причиной отсутствия статистически значимых различий в 2-х летней выживаемости, по мнению авторов, является геторогенность сравниваемых групп [Taioli E, 2015]. Следует иметь ввиду, что не всем пациентам с МП возможно выполнение ПЭ/ ПД из-за массивной инвазии опухоли в паренхиму легкого или буллезной эмфиземы, при которых удаление висцеральной плевры сопряжено с массивным возду-хоистечением.
Есть данные об адъювантных интраоперационных методах лечения, включая гипертермическую интраоперационную ХТ [Baldini EH, et al. 1997], экспозицию в течение 15 мин. подогретого до 40–41°С раствора Бетадина (PVP-I) [Lang-Lazdunski L, et al. 2012] и ФДТ [Castano AP, et al. 2006], нацеленных на микрометастазы и направленных на улучшение местного контроля. Решение о таких дополнительных методах воздействия должно приниматься на междисциплинарном консилиуме.
Париетальная ПЭ или плевродез показаны для купирования рецидивирующего плеврита. ПЭ не увеличивает выживаемость по сравнению с ЭПП, но сокращает частоту рецидивов накопления плевральной жидкости лучше, чем плевродез тальком. При перикардите, если объем жидкости значителен и при ЭхоКГ исследовании в фазе диастолы расхождение листков перикарда составляет > 20 мм, рекомендуется перикардиоцентез.
При мезотелиоме брюшины рекомендуется комбинированный подход: циторедуктивная операция + интраперитонеальная гипертермическая ХТ (HIPEC, Hyperthermic intraperitoneal chemotherapy), при которой достигается 5-летняя общая выживаемость у 52% больных. При невозможности выполнения HIPEC проводится отсроченная нормотермическая внутрибрюшинная ХТ.
При мезотелиоме оболочек яичка оптимальным объемом операции считается ОФЭ ± паховая лимфодиссекция. Локальная резекция стенки оболочки яичка связана с локальной частотой рецидивов, равной 36%, и для местного контроля часто требуется гемискротэктомия, тогда как местный рецидив после орхидэктомии отмечается у 10,5–11,5% пациентов. Поскольку в большинстве случаев злокачественная мезотелиома диагностируется интраоперационно или в результате патоморфологического исследования удаленных образцов, в случае первоначально выполненной гемискротэктомии на втором этапе объем оперативного вмешательства расширяют до радикального. Вопрос о необходимости пахово-подвздошной лимфодиссекции остается дискутабельным.
Адъювантная химиотерапия показана:
-
• после ЭПП и радикальной ПЭ при МП;
-
• после циторедуктивной перитонэктомии при мезотелиоме брюшины.
-
4.1.2. Комбинированное лечение
Хирургическое лечение может рассматриваться при МП как компонент тримодальной терапии. Если операция R0 сомнительна, настоятельно рекомендуется проводить комбинированную терапию с ХТ и/или ЛТ. Показания к трехкомпонентному лечению определяются индивидуально, исходя из общего состояния пациента, распространенности процесса, ожидаемой эффективности ХТ, технических и кадровых возможностей стационара. С учетом данных рандомизированного исследования MARS в 2011 г. наиболее целесообразным объемом хирургического этапа при комбинированном лечении считается ПЭ/ПД. Алгоритм диагностики и лечения ранних стадий МП представлен на рис. 1.
-
4.2. IIIB–IV стадия
-
4.2.1. Химиотерапия
-
После ОФЭ при мезотелиоме оболочек яичка и после перикардэктомии при мезотелиоме перикарда вопрос об адъювантной ХТ решается индивидуально.
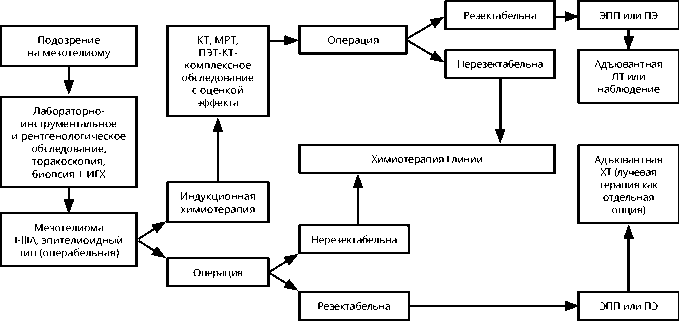
Рисунок 1. Рекомендуемый алгоритм диагностики и лечения локализованной мезотелиомы плевры.
При невозможности оперативного вмешательства при ранней стадии, бифазном или саркоматоидном подтипе и при распространенном опухолевом процессе применяется ХТ. В последние годы выделяют два основных режима ХТ первой линии — это платиносодержащие режимы в комбинации с пеметрекседом или гемцитабином. Стандартов второй и последующих линий лечения нет. Основные и альтернативные режимы лекарственного лечения представлены в табл. 4.
Таблица 4. Режимы химиотерапии, рекомендуемые при мезотелиоме
|
Схема лечения |
Режим химиотерапии |
|
PP1 |
Пеметрексед 500 мг / м2 в 1-й день+ цисплатин 75 мг / м2 в 1-й день, каждые 21 день |
|
PC1 |
Пеметрексед 500 мг / м2 в 1-й день+ карбоплатин AUC- 5 (6) в 1-й день, каждые 21 день |
|
GP |
Гемцитабин 1000–1250 мг / м2 в 1-й и 8-й дни+ цисплатин 75 мг / м2 в 1-й день, каждые 21 день |
|
GC |
Гемцитабин 1000–1250 мг / м2 в 1-й и 8-й дни+ карбоплатин AUC- 5 (6) в 1-й день, каждые 21 день |
|
GemOx |
Гемцитабин 1000 мг / м2 в 1-й и 8-й дни+ оксалиплатин 80 мг / м2 в 1-й и 8-й дни, каждые 21 день |
|
IP |
Иринотекан 65 мг / м2 в 1-й и 8-й дни+ цисплатин 75 мг / м2 в 1-й день, каждые 21 день |
|
CP |
Паклитаксел 175 мг / м2 в 1-й день+ карбоплатин AUC- 5 (6) в 1-й день, каждые 21 день |
|
AP |
Доксорубицин 60 мг / м2 в 1-й день+ цисплатин 60 мг / м2 в 1-й день, каждые 21 день |
|
Винорелбин |
20 мг / м2 в 1-й, 8-й, 15-й дни, каждые 28 дней |
|
Винорелбин |
25–30 мг / м2 в 1-й и 8-й дни, каждые 21 день |
-
1 Оптимальный объем лечения.
-
4.2.2. Плевроцентез или лапароцентез и плевродез как методы лечения рецидивирующего гидроторакса и накопления асцита
-
4.2.2.1. Показания к выполнению
-
Рекомендуется проведение 6 циклов ХТ с последующим динамическим наблюдением. Смена режима ХТ должна проводиться только при доказанном прогрессировании заболевания или в случае непереносимости лекарственного лечения. В случае прогрессирования болезни в течение ≥ 6 мес. от последнего курса ХТ желательна реиндукция режима I первой линии лечения. При раннем прогрессировании на фоне лечения или в ближайшие 6 мес. после завершения ХТ рекомендуется переход на вторую линию. Алгоритм диагностики и лечения диссеминированной мезотелиомы плевры представлен на рис. 2.
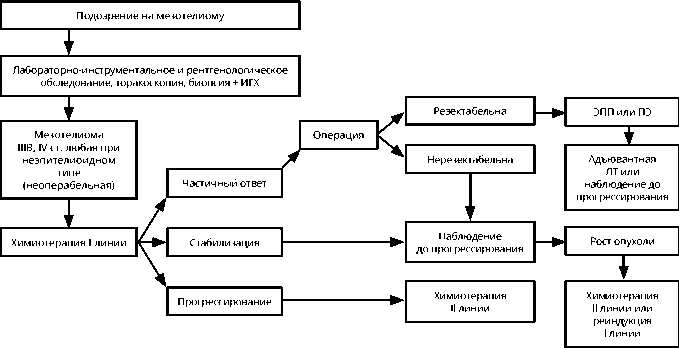
Рисунок 2. Алгоритм диагностики и лечения диссеминированной мезотелиомы плевры.
Для МП характерно развитие гидроторакса, который ухудшает качество жизни пациента и создает угрозу жизни. Эвакуация жидкости из плевральной полости проводится с помощью пункции — плевроцентеза, который представляет собой исключительно симптоматический метод лечения.
Показаниями для плевроцентеза являются:
-
• наличие жидкости в плевральной полости с уровнем выше 2–3 ребра (при счете спереди);
-
• симптомы легочно-сердечной недостаточности (выраженная одышка в покое, приглушенный ритм сердца, распирающая боль в грудной клетке и т. д.).
-
4.2.2.2. Методика выполнения
При отсутствии клинических симптомов выполнение плевроцентеза не показано.
У 70% больных отмечается повторное накопление жидкости. Показанием к проведению плевродеза является постоянное накопление жидкости и необходимость повторных плевральных пункций с частотой 3 раза в мес. Применение плевросклерозирующих средств приводит к облитерации плевральной полости за счет асептического воспаления плевральных листков, их склеивания и последующего сращения париетальной и висцеральной плевры с прекращением продукции плеврального выпота.
Показанием к лапароцентезу является значительное скопление асцитической жидкости в брюшной полости с формированием так называемого напряженного асцита.
При плевроцентезе под местной анестезией в положении больного сидя с опорой вперед на спинку стула для максимального расширения межреберных промежутков выполняют пункцию плевральной полости и ее дренирование (с помощью специального набора, например, плеврокана) и максимально эвакуируют жидкость (пассивно или активно с использованием шприца). Желательна разметка места прокола с помощью УЗИ. Прокол проводится, как правило, в проекции 7–8 ребер по лопаточной линии. Появление болевых ощущений и/или кашля косвенно указывают на расправление легкого и соприкосновение листков плевры. При большом объеме жидкости целесообразно каждые 1,5–2 часа временно перекрывать дренаж во избежание быстрого смещения органов средостения в противоположную сторону. После окончания процедуры выполняют рентгенологическое исследование с целью контроля расправления легкого. При недостаточном расправлении легкого и формировании остаточной полости (вследствие длительного коллапса легкого жидкостью и его фиксации к грудной стенке или к диафрагме) введение склерозирующих препаратов бесперспективно. При эффективном осушении плевральной полости, когда жидкость остается в незначительном количестве только в плевральном синусе, легкое расправлено, признаков пневмоторакса нет, можно вводить склерозирующие препараты. Поскольку введение препаратов может сопровождаться тошнотой, рвотой и болевыми ощущениями вплоть до очень сильных, введение их должно предваряться в/в введением антиэметиков в стандартных дозах и внутриплевральной анестезией (50–100 мл 0,5% раствора новокаина или 0,25% лидокаина). При внутриплевральном введении цисплатина необходима также гипергидратация (1500–2000 мл физиологического раствора в/в). После выполнения этих процедур плеврокан (дренаж) перекрывают на 1–2 часа. По истечении указанного времени дренаж следует открыть для свободного истечения остаточной жидкости. Затем необходимо ввести лекарственный агент через дренажную трубку и удалить дренаж. Неудачи данной методики связаны в основном с недостаточно тщательным дренированием плевральной полости.
Наиболее эффективным склерозирующим агентом признан тальк. Введение его через плевральный катетер в виде суспензии (4–5 г стерильного талька + 20 мл 0,5% раствора лидокаина) эффективно у 90% больных. Возможна также инсуфляция порошка талька при торакоскопии. Препараты, рекомендуемые для проведения плевродеза, представлены в табл. 5.
Таблица 5. Препараты, рекомендуемые для проведения плевродеза
|
Препараты |
Доза, рекомендуемая на одно введение 1 |
|
Тальк |
2–5 г |
|
Блеомицин |
15–30 мг |
|
Цисплатин |
50 мг |
1 Выбор дозы зависит от массы тела пациента. Введение лекарственных средств внутриплеврально рекомендуется осуществлять не чаще 1 раза в неделю, не более 3 введений в общей сложности.
Осложнения внутриплеврального введения лекарственных средств:
-
• болевой синдром
-
• усиление одышки
-
• гипертермия
-
• ателектаз легкого
-
• миелосупрессия
-
• пневмония
-
• эмпиема плевры
-
• легочная и сердечно-легочная недостаточность.
Плевродез является малым хирургическим вмешательством и должен проводиться только в стационаре хирургом с участием химиотерапевта. Следует учитывать системное воздействие цитотоксических веществ, вводимых вну- триплеврально, и по возможности не выполнять эту процедуру одновременно с ХТ во избежание усиления токсичности.
Лапароцентез также проводят в положении больного сидя, пациент должен отклониться назад и облокотиться на руки; на колени больного заранее кладут клеенку (пеленку) в виде фартука. Соблюдение асептики обязательно. Предварительно освобождают кишечник и мочевой пузырь. Под местной инфильтрационной анестезией 0,5% раствором новокаина (лидокаина) на 3 пальца ниже пупка и на 2 см левее белой линии живота выполняют пункцию при помощи плеврокана. Жидкость выпускают без форсирования, ориентируясь на общее состояние больного. При мезотелиоме брюшины характерно, особенно при многократных лапароцентезах, формирование желеобразного состояния асцита, что затрудняет его эвакуацию. В этом случае приходится активно эвакуировать жидкость шприцем. По завершении эвакуации асцитической жидкости извлекают трубку плеврокана и на рану брюшной стенки накладывают давящую асептическую повязку. При подтекании асцита возможно наложение одного шва и марлевой повязки. Живот целесообразно «утянуть» с некоторым натяжением, чтобы сохранить привычное для больного внутри-брюшное давление.
Лапароцентез противопоказан при:
• нарушениях свертываемости крови ввиду риска кровотечения
• тяжелой спаечной болезни брюшной полости
• метеоризме
• вентральной грыже после предыдущих оперативных вмешательств
• риске травмы кишечника, крупной опухоли.
4.2.3. Лучевая терапия
5. ТАРГЕТНАЯ И ИММУНОТЕРАПИЯ
Не рекомендуется проводить лапароцентез близко к области мочевого пузыря, пальпируемого опухолевого образования. Наличие спаек — относительное противопоказание, но сама по себе спаечная болезнь предполагает высокий риск повреждения сосудов и органов брюшной полости, поэтому показания к лапароцентезу в этом случае оцениваются индивидуально.
ЛТ как самостоятельный метод лечения не используется. При адъювантной ЛТ в поле облучения обязательно включает париетальную плевру при декортикации легкого, границы хирургических клипс (после ЭПП) и участки с возможными остаточными проявлениями. ЛТ лимфатических узлов средостения и надключичных зон не рекомендуется. Послеоперационная ЛТ возможна у пациентов в удовлетворительном состоянии (ECOG 0–1), с сохранной легочной функцией, при которой пациент не нуждается в кислородотерапии, без признаков почечной недостаточности, при отсутствии отдаленных метастазов. Лучевая терапия проводится квалифицированными специалистами в специализированных центрах с применением методик IMRT, VMAT, TomoTherapy, которые исключают бóльшую часть легкого из облучения. Рекомендуемые дозы лучевой терапии указаны в табл. 6.
Таблица 6. Рекомендуемые дозы лучевой терапии при мезотелиоме плевры
|
Назначение |
СОД |
РД |
Длительность лечения |
|
После операции |
|||
|
После ЭПП |
50–60 Гр |
1,8–2 Гр |
6–7 нед. |
|
После ПЭ |
45–54 Гр |
1,8–2 Гр |
5–6 нед. |
|
После циторедуктивных (R2) резекций |
50–54 Гр |
1,8–2 Гр |
5–6 нед. |
|
Паллиативная |
|||
|
С обезболивающей целью на грудную клетку |
20–40 Гр |
3–4 Гр |
1–2 нед. |
|
На область асимптомного рецидива |
30–40 Гр |
3–4 Гр |
2 нед. |
|
Метастазы в головном мозге или костях |
Возможны варианты |
||
При мезотелиоме брюшины ЛТ имеет ограниченные возможности. Данных об эффективности ЛТ при мезотелиоме перикарда или оболочек яичка нет.
Единственный таргетный препарат, показавший эффективность в лечении мезотелиомы,— бевацизумаб. Его добавление к основным режимам ХТ помогает получить максимально возможную эффективность и увеличить продолжительность жизни.
В качестве II–III линии лечения возможна иммунотерапия пембролизу-мабом при экспрессии PD–L1 ≥ 1 %, которая помогает достичь объективные ответы в 22% случаев, а контроль роста опухоли — у 76% пациентов, но не увеличивает время до прогрессирования и общую выживаемость. Медиана продолжительности жизни при использовании пембролизумаба достигает 18 мес. при МП. Пембролизумаб зарегистрирован также в РФ для лечения солидных опухолей при наличии MSI-H, а при мезотелиоме брюшины этот маркер встречается в 1–2% случаев. Эффективность пембролизумаба при мезотелиоме перикарда и оболочек яичка не изучалась.
В качестве II–III линии лечения возможно также использование иммунотерапии ниволумабом в сочетании или без ипилимумаба, независимо от уровня экспрессии PD–L1. Режимы иммунотерапии представлены в табл. 7.
Таблица 7. Рекомендуемые режимы таргетной и иммунотерапии при мезотелиоме плевры
|
Препарат |
Режим |
|
Бевацизумаб 1 |
15 мг / кг в / в кап. 1 раз в 3 недели |
|
Пембролизумаб |
200 мг в / в кап. 1 раз в 3 недели |
|
Ниволумаб |
3 мг / кг в / в кап. 1 раз в 14 дней |
|
Ниволумаб |
240 мг в / в кап. каждые 2 нед. не более 2 лет |
|
Ипилимумаб |
1 мг / кг в / в кап. 1 раз в 6 недель |
1 В комбинации с ХТ 6 курсов, далее — в поддерживающем режиме 1 раз в 3 нед. до 1 года или до прогрессирования болезни, что решается индивидуально в каждом конкретном случае. Комбинация ХТ и бевацизу-маба не используется в неоадъювантном лечении.
6. НАБЛЮДЕНИЕ
После завершения лечения динамическое наблюдение проводится каждые 3 мес. в течение первого года, далее — 1 раз в 6 мес. до продолжительности 5 лет. Обязательными диагностическими процедурами являются КТ грудной клетки/брюшной полости с контрастированием (в зависимости от локализации первичной опухоли), УЗИ шейно-надключичных, подключичных, паховых лимфатических узлов, органов брюшной полости, забрюшинного пространства и малого таза.


