Практические рекомендации по лекарственному лечению немелкоклеточного рака легкого
Автор: К. К. Лактионов, Е. В. Артамонова, В. В. Бредер, В. А. Горбунова, Ф. В. Моисеенко, Е. В. Реутова, Д. Д. Сакаева, А. В. Смолин, М. Д. Тер-Ованесов
Журнал: Злокачественные опухоли @malignanttumors
Статья в выпуске: 3S2-1 т.10, 2020 года.
Бесплатный доступ
Немелкоклеточный рак легкого, аденокарцинома, неплоскоклеточный рак легкого, плоскоклеточный рак легкого, мутация EGFR, транслокация ALK, ROS1
Короткий адрес: https://sciup.org/140254629
IDR: 140254629 | DOI: 10.18027/2224-5057-2020-10-3s2-02
Текст статьи Практические рекомендации по лекарственному лечению немелкоклеточного рака легкого
1. КЛАССИФИКАЦИЯ И ОПРЕДЕЛЕНИЕ СТАДИИ
Классификация немелкоклеточного рака легкого (НМРЛ) по системе TNM (8-е издание, 2017 г.) представлена в табл. 1.
Таблица 1. Стадирование рака легкого
|
Стадия |
T |
N |
M |
|
Оккультная |
Tx |
N0 |
M0 |
|
0 |
Tis |
N0 |
M0 |
|
IA |
T1 |
N0 |
M0 |
|
IA1 |
T1mi T1a |
N0 |
M0 |
|
IA2 |
T1b |
N0 |
M0 |
|
IA3 |
T1c |
N0 |
M0 |
|
IB |
T2a |
N0 |
M0 |
|
IIA |
T2b |
N0 |
M0 |
|
IIB |
T1a-c, 2a, b |
N1 |
M0 |
|
T3 |
N0 |
M0 |
|
|
IIIA |
T1a-c, 2a, b |
N2 |
M0 |
|
T3 |
N1 |
M0 |
|
|
T4 |
N0–1 |
M0 |
|
|
IIIB |
T1a-c, 2a, b |
N3 |
M0 |
|
T3, T4 |
N2 |
M0 |
|
|
IIIC |
T3, T4 |
N3 |
M0 |
|
IV |
Любое T |
Любое N |
M1 |
|
IVA |
Любое T |
Любое N |
M1a M1b |
|
IVB |
Любое T |
Любое N |
M1c |
1 Цитирование: Лактионов К. К., Артамонова Е. В., Бредер В. В., Горбунова В. А., Моисеенко Ф. В., Реутова Е. В. и соавт. Практические рекомендации по лекарственному лечению немелкоклеточного рака легкого. Злокачественные опухоли: Практические рекомендации RUSSCO #3s2, 2020 (том 10).02
2. ДИАГНОСТИКА
Диагноз НМРЛ основывается на данных анамнеза, осмотра, результатах инструментальных методов обследования и патоморфологическом заключении, установленном на основании морфологического исследования, материал для которого может быть получен при биопсии или аспирате из первичной опухоли или метастатического очага (или экссудата). Предпочтительна гистологическая (допускается цитологическая) верификация диагноза. Следует стремиться к уточнению морфологической формы рака легкого: аденокарцинома/пло-скоклеточный/крупноклеточный, при возможности с использованием ИГХ исследования.
При выявлении неплоскоклеточного (в том числе, диморфного) НМРЛ рекомендовано проведение молекулярно-генетических исследований (гистологический или цитологический материал) на наличие активирующих мутаций: «обязательный объем тестирования» (мутации гена EGFR (18–21 экзоны), транслокации ALK, транслокации ROS1 и мутации BRAF V600E) и «возможный объем тестирования» (RET, c-MET, HER2 и KRAS) могут быть полезны не только для определения тактики лечения в рамках стандартов, но и для включения пациента в клинические исследования по изучению новых противоопухолевых препаратов, что может обеспечить значимую выгоду для пациента в сравнении со стандартным лечением. Молекулярно-генетическое тестирование может быть оправдано и при затруднении (мало материала) в определении гистологического подтипа или в случаях плоскоклеточного рака у некурящих молодых больных (< 50 лет). С учетом гетерогенности опухолей и появления новых мутаций целесообразны повторные биопсии с целью изменения лечебной тактики.
В редких ситуациях отсутствия гистологического материала и невозможности его получения при наличии веских подтверждений опухолевой природы (например, хирургическое лечение в анамнезе с гистологическим подтверждением и последующей утерей гистологических препаратов), имеющегося неоперабельного заболевания возможно выполнение молекулярно-генетического исследования циркулирующей опухолевой ДНК. Негативный результат циркулирующей опухолевой ДНК при молекулярно-генетическом исследовании не позволяет исключить наличие активирующих мутаций у 22% пациентов.
Выбор объема обследования зависит от объективного состояния больного, распространенности процесса, наличия и выраженности сопутствующей патологии, предполагаемого лечения и включает:
• сбор анамнеза и осмотр;
• клинический анализ крови;
• биохимический анализ крови;
• коагулограмму;
• общий анализ мочи;
• ЭКГ;
• в случае планирования хирургического этапа лечения — оценка функции лёгких: форсированная жизненная емкость лёгких (ФЖЕЛ); ОФВ1 (объем форсированного выдоха за 1 секунду); диффузионный тест (DLCO);
• R-графию органов грудной клетки, оптимально — КТ органов грудной клетки с в/в контрастированием;
• ФБС;
• УЗИ органов брюшной полости и забрюшинного пространства, шейнонадключичных зон (КТ выполняется для уточнения характера изменений, выявленных при УЗИ);
• радионуклидную диагностику костей скелета с R-логическим контролем выявленных изменений;
• КТ / МРТ головного мозга с контрастным усилением;
• биопсию опухоли с определением морфологического типа НМРЛ;
• в отдельных случаях показана ПЭТ / КТ;
• при подозрении на N2 необходима морфологическая верификация (транс-бронхиальная/трансэзофагеальная пункция, медиастиноскопия, торакоскопия); при невозможности получения биопсийного материала показана ПЭТ / КТ для оценки распространенности опухолевого процесса;
• молекулярно-генетическое исследование и определение биомаркеров в опухоли: «обязательный объем» (наличие активирующих мутаций EGFR, транслокации ALK, транслокации ROS1) и «возможный объем» (мутации BRAF V600E, RET, c-MET, KRAS, HER2, экспрессии PD-L1);
• для EGFR-позитивных больных при прогрессировании на фоне таргетной терапии тирозинкиазными ингибиторами 1 и 2 поколений показано выполнение повторных биопсий с определением мутации вторичной резистентности Т790М с помощью молекулярно-генетического исследования.
3. ЛЕЧЕНИЕ
3.1. Лечение больных немелкоклеточным раком легкого3.1.1. Принципы лечения пациентов с 0–IIIА стадиями НМРЛ
Основным методом лечения рака легкого является хирургический. Объем операции определяется распространенностью опухолевого процесса, гистологической формой опухоли и функциональным состоянием пациента. Радикальную операцию удается выполнить только у 10–20 % всех заболевших. 5-летняя выживаемость при всех формах рака легкого составляет 20–25%.
При карциноидных опухолях хирургический метод является основным. Карциноидные опухоли, особенно типичные его формы, обладают менее агрессивным местным инфильтративным ростом и потенциалом отдаленного метастазирования в сравнении с другими, чаще встречающимися формами НМРЛ, такими как плоскоклеточный и железистый. Карциноиды развиваются чаще в крупных бронхах первого, второго и третьего порядка и характеризуются преимущественным экзофитным, внутрипросветным ростом, без распространения опухоли по стенке бронха, что позволяет чаще выполнять органосохраняющие радикальные операции в объеме лоб-, билобэктомии с использованием резекции и реконструкции бронхов и трахеи или изолированные радикальные резекции бронхов, трахеи и её бифуркации с сохранением функции всего легкого. Эндоскопическое, эндобронхиальное удаление карциноидных опухолей могут быть применимы у больных без прорастания всей стенки бронха, у которых по тем или иным причинам нельзя провести радикальную резекцию легкого и бронха открытым или торакоскопическим доступом. При обследовании до операции всегда сложно установить истинную глубину поражения опухолью стенки бронха.
Пациенты с НМРЛ 0–IIIА клинической стадии считаются операбельными с учетом функциональных показателей. При полноценном предоперационном обследовании доля пациентов, у которых интраоперационно процесс призначется как нерезектабельный, не превышает 5–10%.
Мультидисциплинарное обсуждение каждого пациента позволяет выбрать наиболее эффективную и доступную стратегию с учетом современных возможностей лечения, включая комбинированные методы терапии.
Пациентам с НМРЛ 0–IIIA стадии рекомендуется хирургический метод лечения при условии соблюдения требований к радикальной операции. Стандартный объём операции включает анатомическую резекцию легкого (лобэктомия, билобэктомия) с ипсилатеральной медиастинальной лимфодиссекцией. Торакоскопические операции при клинической I стадии рака легкого могут быть рекомендованы как стандартный вариант хирургического лечения наряду с обычными открытыми вмешательствами.
Больным с I стадией адъювантная ХТ и ЛТ не рекомендованы.
Больным со IIа стадией и факторами высокого риска (опухоли> 4 cм, вовлечение висцеральной плевры, сосудистая инвазия, низкая степень дифференцировки, хирургическое лечение в объеме атипичной резекции, Nх, возраст моложе 75 лет) и большими стадиями рекомендована адъювантная терапия.
Пациентам с I стадией НМРЛ при функциональной неоперабельности, высоком риске хирургических осложнений или отказе пациента от хирургического лечения рекомендуется радикальная ЛТ.
При II стадии заболевания в случае невозможности проведения хирургического лечения рекомендуется ХЛТ или ЛТ или ХТ.
Пациентам с НМРЛ II (N1) стадии рекомендована адьювантная лекарственная противоопухолевая терапия. Предоперационное противоопухолевое лечения у данной группы пациентов не рекомендовано.
При T1-2N0 в случае невозможности проведения хирургического лечения возможно проведение стереотаксической гипофракционной ЛТ с использованием крупных доз за фракцию (РОД 10–18 Гр, СОД 50–54 Гр). Лечение проводится с использованием методик контроля над дыханием.
Проведение ЛТ рекомендуется при нерадикальной операции (R+), так как уменьшает риск рецидива.
При исходно не резектабельной опухоли у пациентов в удовлетворительном общем состоянии (по шкале ECOG 0–1 балл) при IIIА стадии заболевания на первом этапе рекомендуется одновременная ХЛТ; при состоянии по шкале ECOG 2 балла предпочтительнее последовательное использование двух методов.
Пациенты с клинической IIIA стадией считаются условно операбельными, им рекомендовано комбинированное лечение с применением ХТ (хирургическое + адъювантная ХТ).
Резектабельными при IIIA стадии считаются:
-
• опухоли T4N0 с N0, доказанным с помощью инвазивных методов диагностики, и технической возможностью резекции R0;
-
• случаи поражения одной зоны лимфатических узлов N2, если поражение остальных лимфатических узлов исключено при биопсии; при мультизонном поражении N2 лимфоузлов хирургическое лечение в объеме пневмонэктомии не дает преимуществ для пациента;
-
• случаи после индукционной ХТ, если произошло «понижение стадии» со стороны лимфоузлов и можно избежать пневмонэктомии.
Неоадъювантная ХТ (2–4 цикла) рекомендуется пациентам с IIIA стадией с N2 (доказанная морфологически или при ПЭТ/КТ) в качестве этапа комбинированного лечения. Операцию рекомендуется выполнять в сроки от 3 до 8 нед. от последнего введения химиопрепаратов.
Адъювантная ХТ и ЛТ терапия рекомендуются во всех случаях N2 при отсутствии противопоказаний.
Послеоперационная ЛТ показана также при R+. Следует учитывать ослабленное состояние пациентов после операции.
Рекомендуемые режимы лекарственной терапии НМРЛ представлены в табл. 2 и 3.
Таблица 2. Рекомендуемые режимы адъювантной и неоадъювантной химиотерапии немелкоклеточного рака легкого
Цисплатин 50 мг/м2 в / в в 1-й и 8-й дни, винорелбин 25 мг/м2 в / в 1-й, 8-й, 15-й, 22-й дни, каждые 4 нед., 4 цикла
Цисплатин 100 мг/м2 в / в в 1-й день, винорелбин 25–30 мг/м2 в / в в 1-й, 8-й, 15-й, 22-й дни, каждые 4 нед., 4 цикла
Цисплатин 80 мг/м2 в/в в 1-й день, винорелбин 25 мг/м2 в/в в 1-й день, 60 мг/м2 внутрь в 8-й день каждые
21 день, 4 цикла
Цисплатин 100 мг/м2 в / в в 1-й день, этопозид 100 мг/м2 в 1–3-й дни, каждые 4 нед., 4 цикла
Цисплатин 75 мг/м2 в / в в 1-й день, гемцитабин 1000–1250 мг/м2 в / в в 1-й и 8-й дни, каждые 3 нед., 4 цикла
Цисплатин 75 мг/м2 в / в в 1-й день, доцетаксел 75 мг/м2 в / в в 1-й день, каждые 3 нед., 4 цикла
Цисплатин 75 мг/м2 в / в в 1-й день, пеметрексед 500 мг/м2 в / в в 1-й день, каждые 3 нед., 4 цикла (для неплоскоклеточного НМРЛ) на фоне премедикации фолиевой кислотой и вит. В12
Карбоплатин AUC 5–6 в / в в 1-й день, паклитаксел 175–200 мг/м2 в 1 день, каждые 3 нед., 4 цикла
Карбоплатин AUC 5 в / в в 1-й день, гемцитабин 1000 мг/м2 в / в в 1-й и 8-й дни, каждые 3 нед., 4 цикла
Карбоплатин AUC 5 в/в в 1-й день, винорелбин 25 мг/м2 в/в в 1-й день, винорелбин 60 мг/м2 внутрь в 8-й день каждые 3 нед., 4 цикла
Карбоплатин AUC 5 в / в в 1-й день, пеметрексед 500 мг/м2 в / в в 1-й день, каждые 3 нед., 4 цикла (для неплоскоклеточного НМРЛ) на фоне премедикации фолиевой кислотой и вит. В12
Осимертиниб 1 80 мг внутрь ежедневно при наличии активирующих мутаций в гене EGFR до 3 лет или развития непереносимой токсичности
1 На момент написания рекомендаций режим / препарат входит в клинические рекомендации, одобренные Минздравом РФ, но не был зарегистрирован на территории РФ.
При выявлении активирующих мутаций гена EGFR (19 и 21 экзоны) адъювантная терапия осимертинибом позволяет увеличить безрецидивную выживаемость независимо от того, была ли проведена адъювантная химиотерапия до назначения осимертиниба, и может быть назначена как после операции, так и после проведения адъювантной химиотерапии.
-
3.1.2. Принципы лечения пациентов с IIIB–IIICстадией НМРЛ
Стадии IIIB и IIIC являются неоперабельными, для данной категории пациентов рекомендуется проведение одновременной ХЛТ в качестве основного метода лечения. Планируемая СОД лучевой терапии в рамках ХЛТ должна составлять 60 Гр (±10%) в течение 6 недель (перерывы в лечении снижают эффективность лечения); рекомендуемые режимы ХТ при одновременной ХЛТ представлена в табл. 3. Одновременная ХЛТ дает более хорошие результаты по сравнению с последовательной у пациентов с НМРЛ IIIB–IIIC стадии, однако, она более токсична и рекомендуется только пациентам в удовлетворительном общем состоянии (по шкале ECOG 0–1 балл). При состоянии по шкале ECOG 2 рекомендуется последовательное применение ХТ и ЛТ. Дистанционная ЛТ:
-
• первичная опухоль, пораженные лимфатические узлы
– конформная ЛТ РОД 2 Гр, СОД 60–66 Гр (КТ, ПЭТ)
-
• регионарные лимфатические узлы
– конформная ЛТ РОД 2 Гр, СОД 40–45 Гр (КТ, ПЭТ)
Пациентам после радикального хирургического лечения с локорегиональ-ными рецидивами возможно проведение ХЛТ.
Таблица 3. Режимы химиотерапии, часто применяемые в лечении IIIА, IIIB стадий НМРЛ в комбинации с лучевой терапией
Паклитаксел 175 мг / м2 в / в в 1-й день + карбоплатин AUC 5 в / в в 1-й день, интервал 3 нед., 3–4 цикла
Этопозид 120 мг / м2 в / в в 1–3-й дни + цисплатин 75–80 мг / м2 (или карбоплатин AUC5) в / в в 1-й день каждые 3нед. 3–4 цикла
Пеметрексед 500 мг / м2 в / в в 1-й день + цисплатин 75 мг / м2 или карбоплатин AUC5 в / в в 1-й день каждые
-
3 нед. 3 цикла одновременно с ЛТ (при неплоскоклеточном НМРЛ)
Этопозид 50 мг / м2 в / в в 1–5-й дни, 29–33-й дни + цисплатин 50 мг / м2 в 1-й, 8-й, 29-й, 36-й дни одновременно с ЛТ
Паклитаксел 50 мг / м2 в / в в 1-й, 8-й, 15-й дни + карбоплатин AUC-2 в / в в 1-й, 8-й, 15-й дни одновременно с ЛТ + 2 курса консолидирующей ХТ (паклитаксел 175–200 мг / м2 в / в в 1-й день + карбоплатин AUC 5–6 в / в в 1-й день, интервал 3 нед.
Индукционная ХТ: цисплатин 80 мг / м2 в / в в 1-й день, винорелбин 60 мг / м2 внутрь в 1-й и 8-й дни каждые 21 день, 2 цикла; сочетанный химиолучевой режим: цисплатин 80 мг / м2 в / в в 1-й день, винорелбин 40 мг / м2 внутрь в 1-й и 8-й дни каждые 3 нед. с ЛТ в дозе 66 Гр 1
-
1 Индукционная и консолидирующая ХТ не увеличивают эффективность стандартной ХЛТ.
-
3.1.3. Принципы лечения пациентов с IV стадией НМРЛ
После завершения ХЛТ больным, не имеющим признаков прогрессирования болезни (КТ обследование целесообразно проводить непосредственно после окончания ХЛТ), рекомендуется поддерживающая иммунотерапия дурвалумабом 10 мг / кг в / в 60-минутная инфузия каждые 2 нед. в течение не менее 12 мес. или до прогрессирования или до развития непереносимой токсичности.
Для достижения максимальной эффективности и безопасности комбинированного лечения (ХЛТ + иммунотерапия) крайне важным является мульти-дисциплинарное планирование стратегии лечения пациентов с III стадией НМРЛ и преемственность между специалистами.
При противопоказаниях к ХЛТ рекомендуется проводить системную ХТ (см. раздел 3.1.3.1), включая молекулярно-направленное лечение, иммунотерапию.
Лечение пациентов с IV стадией НМРЛ следует расценивать как паллиативное, направленное на увеличение продолжительности жизни, улучшение ее качества за счет эффективного контроля симптомов болезни. Раннее начало противоопухолевой, поддерживающей и сопроводительной симптоматической терапии увеличивает продолжительность жизни.
Рекомендуется назначать лечение с учетом предиктивных и прогностических факторов (табл. 4).
При выявлении активирующих мутаций EGFR (в 18–21 экзонах) или транслокаций ALK, ROSI, мутации BRAF, c-MET рекомендуется назначение таргетной терапии (см. раздел 3.1.3.4).
При отсутствии драйверных молекулярно-генетических нарушений рекомендуется ХТ или химиоиммунотерапия в зависимости от ряда клинических и лабораторных параметров, в некоторых случаях — с учетом уровня экспрессии PD-L1 опухолевыми клетками (см. раздел 3.1.3.1).
-
3.1.3.1. Лекарственная терапия первой линии при IV стадии НМРЛ
Рекомендуемые режимы лекарственной терапии первой линии при IV стадии НМРЛ представлены в табл. 4.
Таблица 4. Рекомендуемые режимы лекарственной терапии 1 линии НМРЛ IV стадии
Этопозид 120 мг/м2 в / в в 1–3-й дни в / в + цисплатин 75–80 мг/м2 в / в в 1-й день каждые 3 нед.
Этопозид 100 мг / м2 в / в в 1–3-й дни + карбоплатин AUC-5 в / в в 1-й день каждые 3 нед.
Винорелбин 25–30 мг / м2 в / в (или 60–80 мг / м2 внутрь) в 1-й и 8-й дни + цисплатин 75–80 мг / м2 в / в в 1-й день каждые 3 нед.
Паклитаксел 175–200 мг / м2 в / в в 1-й день + карбоплатин AUC 5–6 в / в в 1-й день каждые 3 нед. ± бевацизу-маб 15 мг / кг в / в 1 раз в 3 нед. до прогрессирования (при аденокарциноме)
Гемцитабин 1000–1250 мг / м2 в / в в 1-й и 8-й дни + цисплатин 80 мг / м2 в / в в 1-й день каждые 3 нед..
Гемцитабин 1000 мг / м2 в / в в 1-й и 8-й дни + карбоплатин AUC5 в 1-й день каждые 3 нед.
Пеметрексед 500 мг / м2 в / в в 1-й день + цисплатин 75 мг / м2 в / в (или карбоплатин AUC 5 в / в) в 1-й день каждые 3 нед. с премедикацией фолиевой кислотой и вит. В12 за 5–7 дней до начала курса ± бевацизумаб 7,5 мг / кг в / в 1 раз в 3 нед. до прогрессирования (при аденокарциноме) 1
Винорелбин 25–30 мг / м2 в / в (или 60–80 мг / м2 внутрь) в 1-й, 8-й, 15-й день каждые 4 нед.
Гемцитабин 1000–1250 мг / м2 в / в в 1-й и 8-й дни каждые 3 нед.
Доцетаксел 75 мг / м2 в / в в 1-й день каждые 3 нед.
Пеметрексед 500 мг / м2 в / в в 1-й день каждые 3 нед. с премедикацией фолиевой кислотой и вит. В12 за 5–7 дней до начала курса (при неплоскоклеточном НМРЛ)
Пембролизумаб 200 мг в / в 30-минутная инфузия каждые 3 нед. для пациентов с экспрессией PD-L1 в ≥ 50 % опухолевых клеток длительно (до 2 лет) при НМРЛ без активирующих мутаций
Пембролизумаб 200 мг в / в 30-минутная инфузия + пеметрексед 500 мг / м2 в / в + цисплатин 75 мг / м2 (карбоплатин AUC 5) в / в 1 раз в 3 нед. 4 цикла, в дальнейшем — поддерживающая терапия пембролизумабом и пеметрекседом до прогрессирования или непереносимой токсичности (пембролизумаб — до 2 лет) только при неплоскоклеточном НМРЛ без активирующих мутаций
Пембролизумаб 200 мг + паклитаксел 200 мг / м2 в 1-й день + карбоплатин AUC6 в 1-й день каждые 3 нед. 4 цикла, в дальнейшем — поддерживающая терапия пембролизумабом до прогрессирования или непереносимой токсичности (до 2 лет) при плоскоклеточном НМРЛ
Пембролизумаб 200 мг в / в 30-минутная инфузия каждые 3 нед. для пациентов с экспрессией PD-L1 в ≥ 1 % опухолевых клеток длительно (до 2 лет) при НМРЛ без активирующих мутаций
Атезолизумаб 1200 мг в / в + паклитаксел 200 мг / м2 в / в (для пациентов монголоидной расы –175 мг / м2) + карбоплатин AUC 6 в / в + бевацизумаб 15 мг / кг в / в 1-й день каждые 3 нед. 4 цикла, в дальнейшем — поддерживающая терапия атезолизумабом и бевацизумабом до прогрессирования или непереносимой токсичности (только при неплоскоклеточном НМРЛ). В случае клинической необходимости перед началом терапии атезо- лизумабом пациенты с EGFR или ALK геномной опухолевой мутацией должны получить таргетную терапию
Атезолизумаб назначается в дозе:
-
• 1200 мг в / в каждые 3 нед;
-
• 840 мг в / в каждые 2 нед;
-
• 1680 мг в / в каждые 4 нед
Для пациентов с гиперэкспрессией PD-L1 (ТС3 или IC3)
Ниволумаб 2 3 мг / кг 1 раз в 2 недели + ипилимумаб 1 мг / кг 1 раз в 6 недель
Продолжительность двойной иммунотерапии — до прогрессирования или непереносимой токсичности, максимально до 2-х лет
-
• Ниволумаб 360 мг 1 раз в 3 недели + ипилимумаб 1 мг / кг 1 раз в 6 недель +
-
• 2 цикла химиотерапии 1 раз в 3 недели (при плоскоклеточном НМРЛ — паклитаксел 200 мг / м2 + карбоплатин AUC 6 в / в капельно 1 раз в 3 недели; для неплоскоклеточного НМРЛ — пеметрексед 500 мг / м2 + цисплатин 75 мг / м2 (карбоплатин AUC 5 или 6) в / в капельно 1 раз в 3 недели)
Продолжительность двойной иммунотерапии — до прогрессирования или непереносимой токсичности, максимально до 2-х лет
Гефитиниб по 250 мг внутрь ежедневно длительно при наличии активирующих мутаций EGFR до прогрессирования или непереносимой токсичности
Эрлотиниб по 150 мг внутрь ежедневно длительно при наличии активирующих мутаций EGFR до прогрессирования или непереносимой токсичности
Рамуцирумаб 10 мг / кг в / в каждые 2 нед. в комбинации с эрлотинибом 150 мг внутрь ежедневно при наличии активирующих мутаций EGFR до прогрессирования или непереносимой токсичности
Афатиниб 40 мг внутрь ежедневно длительно при наличии активирующих мутаций EGFR до прогрессирования или непереносимой токсичности
Осимертиниб 80 мг внутрь ежедневно длительно при наличии активирующих мутаций EGFR до прогрессирования или непереносимой токсичности
Кризотиниб по 250 мг 2 раза / сут. внутрь ежедневно длительно при транслокации ALK, ROS1 и c-MET до прогрессирования или непереносимой токсичности в первой линии терапии
Церитиниб 450 мг / сут. внутрь ежедневно до прогрессирования или непереносимой токсичности (при транслокации ALK) в первой линии терапии, после прогрессирования на фоне терапии кризотинибом или при ее непереносимости
Алектиниб 600 мг 2 раза / сут. внутрь ежедневно длительно до прогрессирования или непереносимой токсичности (при транслокации ALK) в первой линии терапии; при прогрессировании заболевания на фоне терапии кризотинибом или при ее непереносимости
BRAF / MEK ингибиторы: дабрафениб по 150 мг 2 раза / сут. внутрь и траметиниб 2 мг / сут. внутрь; оба препарата принимаются ежедневно до прогрессирования или непереносимой токсичности (при наличии активирующей мутации BRAF V600E)
-
1 Комбинация пеметрекседа с цисплатином у больных неплоскоклеточным НМРЛ в рандомизированном исследовании показала преимущество по сравнению с комбинацией с гемцитабином.
-
2 На момент написания рекомендаций режим / препарат входит в клинические рекомендации, одобренные Минздравом РФ, но не был зарегистрирован на территории РФ.
Рекомендуется у пациентов с контролем роста опухоли (стабилизация, полная или частичная регрессия) проведение 4 циклов комбинированной платиносодержащей ХТ, в случае нарастающего объективного эффекта количество циклов может быть увеличено до 6. Оценку эффективности лечения рекомендуется проводить после каждых 2 циклов ХТ в сроки около 2 нед. от первого дня четного цикла.
Неплатиновые комбинации или монохимиотерапию рекомендуется использовать в том случае, если назначение производных платины противопоказано.
Бевацизумаб рекомендуется назначать в сочетании с ХТ только пациентам неплоскоклеточным НМРЛ в удовлетворительном состоянии, не имеющим противопоказаний для его введения (распад опухоли, кровохарканье, сопутствующая патология). После окончания ХТ при контроле над ростом опухоли и удовлетворительной переносимости бевацизумаб можно продолжить в качестве поддерживающей терапии и применять до прогрессирования болезни.
При стабилизации или частичном/полном регрессе опухоли после 4–6 циклов лечения при хорошей переносимости рекомендуется проведение поддерживающей терапии. В качестве поддерживающей терапии при неплоскоклеточном НМРЛ рекомендуется применение пеметрекседа или бевацизумаба или их комбинации, если эти препараты входили в схему лечения.
Для лечения пожилых пациентов или пациентов, объективное состояние которых оценивается по шкале ECOG 2 балла, в качестве минимального варианта лечения может быть рекомендована монохимиотерапия этопозидом, винорелбином внутрь или в/в, пеметрекседом (неплоскоклеточный НМРЛ), таксанами, гемцитабином или моно-иммунотерапия пембролизумабом при уровне экспрессии PD-L1 > 50 %, PD-L1 > 1 %, если не переносима ХТ; комбинация этих препаратов с производными платины (предпочтительно с карбоплати-ном) — оптимальный вариант.
В случае метастатического поражения костей (литического и смешанного характера) рекомендуется назначать бисфосфонаты или деносумаб (оптимально); при угрозе перелома либо с обезболивающей целью рекомендуется паллиативная ЛТ.
Рекомендуется проводить обследование с использованием методов объективной визуализации (КТ, Р-графия, МРТ, ПЭТ/КТ, сцинтиграфия скелета) проявлений опухолевого процесса для контроля эффективности лечения до начала лечения и далее 1 раз в 1,5–3 мес. с учетом клинических показаний. Рекомендуется применять один и тот же метод оценки, использованный до начала лечения.
-
3.1.3.2. Иммунотерапия диссеминированного НМРЛ
Новым направлением в лекарственном лечении больных диссеминированным НМРЛ является иммунотерапия, в частности — ингибиторы контрольных точек иммунного надзора.
Рекомендуется в качестве иммунотерапии I линии при отсутствии активирующих мутаций в генах EGFR или транслокации ALK/ROS1 при распространенном НМРЛ с экспрессией PD-L1 ≥ 50% опухолевых клеток, оцененной АТ 22С3 анти-PD-1, при отсутствии признаков агрессивного течения, небольшом объеме опухолевой массы и невыраженных симптомах, связанных с опухолевым ростом, МКА пембролизумаб 200 мг в/в 30 мин. каждые 3 нед. В случае агрессивного течения и/или при наличии симптомов, связанных с распространенностью опухолевого процесса, возможно применение химиоиммунотерапии.
При непереносимости ХТ в качестве иммунотерапии I линии при распространенном НМРЛ с экспрессией PD-L1 ≥ 1 % опухолевых клеток при отсутствии активирующих мутаций в генах EGFR, BRAF, транслокации ALK / ROS1 рекомендуется анти-PD-1 МКА пембролизумаб 200 мг в / в 30 мин. каждые 3 нед.
Пациентам с гиперэкспрессией PD-L1 (ТС3 или IC3) без мутаций в генах EGFR или транслокации ALK / ROS1 при распространенном НМРЛ может быть рекомендовано назначение атезолизумаба в качестве иммунотерапии 1-й линии. Атезолизумаб назначается в одной из следующих доз
-
• 1200 мг в / в каждые 3 нед;
-
• 840 мг в / в каждые 2 нед;
-
• 1680 мг в / в каждые 4 нед.
Рекомендуется комбинированная иммунотерапия + ХТ у больных распространенным неплоскоклеточным НМРЛ с любым (или неизвестным) статусом PD-L1 с использованием одного из двух режимов:
-
1) Пембролизумаб 200 мг в / в +пеметрексед 500 мг / м2 в / в + цисплатин 75 мг/м2 в/в (карбоплатин AUC 5 в/в) 1 раз в 3 нед. 4 цикла, в дальнейшем — поддерживающая терапия пембролизумабом и пеметрекседом до
прогрессирования или непереносимой токсичности (пембролизумаб — до 2 лет) только при неплоскоклеточном НМРЛ без активирующих мутаций. Данная комбинация применяется у пациентов без активирующих мутаций EGFR или ALK.
-
2) Атезолизумаб 1200 мг в / в + паклитаксел 200 мг / м2 в / в (для пациентов монголоидной расы — 175 мг/м2) + карбоплатин AUC6 в/в + бевацизумаб 15 мг / кг в / в в 1-й день каждые 3 нед. 4 цикла, в дальнейшем — поддерживающая терапия атезолизумабом и бевацизумабом в прежних дозах до прогрессирования или непереносимой токсичности (только при неплоскоклеточном НМРЛ). Перед началом использования данной комбинации пациенты с EGFR или ALK геномной опухолевой мутацией должны получить таргетную терапию.
-
3.1.3.3. Лекарственная терапия второй линии при IV стадии НМРЛ
Больным распространенным плоскоклеточным раком легкого с любым (или неизвестным) статусом PD-L1 может быть рекомендована комбинированная иммунотерапия + ХТ в режиме пембролизумаб 200 мг в/в + паклитаксел 200 мг/м2 в/в в 1-й день + карбоплатин AUC6 в 1-й день каждые 3 нед. 4 цикла, в дальнейшем — поддерживающая терапия пембролизумабом до прогрессирования или непереносимой токсичности (пембролизумаб — до 2 лет).
Пациентам с плоскоклеточным и неплоскоклеточным НМРЛ с любым (или неизвестным) статусом PD-L1 может быть рекомендована двойная иммунотерапия ниволумаб 3 мг / кг капельно 1 раз в 2 недели + ипилимумаб 1 мг / кг в / в капельно 1 раз в 6 недель до прогрессирования или непереносимой токсичности максимально до 2-х лет или двойная иммунотерапия ниволумаб + ипилимумаб в сочетании с двумя циклами химиотерапии — ниволумаб 360 мг в/в капельно 1 раз в 3 недели + ипилимумаб 1 мг / кг в / в капельно 1 раз в 6 недель в сочетании с двумя циклами двухкомпонентной химиотерапии на основе препаратов платины (при плоскоклеточном НМРЛ –паклитаксел 200 мг/м2+карбоплатин AUC 6 в/в капельно 1 раз в 3 недели, всего два цикла; для неплоскоклеточного НМРЛ — пеметрексед 500 мг/м2+цисплатин 75 мг/м2 (или карбоплатин AUC 5 или 6) в / в капельно 1 раз в 3 недели, всего два цикла) до прогрессирования заболевания или непереносимой токсичности, максимально до 2-х лет.
Вторая линия ХТ рекомендуется к назначению только при прогрессировании опухолевого процесса. При выборе варианта лечения следует учитывать возможное влияние на качество жизни с учетом сопутствующих заболеваний. ХТ второй линии может уменьшать выраженность симптомов рака легкого и увеличивать продолжительность жизни отдельных пациентов.
Предпочтительным после первой линии платиносодержащей (или моно-) ХТ является назначение ингибиторов контрольных точек иммунитета анти-PD-(L) 1 МКА, если они не назначались в первой линии — ниволумаба или атезолизумаба (независимо от уровня PD-L1) или пембролизумаба при экспрессии PD-L1 ≥ 1 % опухолевых клеток. Эффективность ингибиторов контрольных точек иммунитета возрастает (по сравнению с ХТ) с увеличением уровня экспрессии. Повторное назначение препаратов этого класса возможно во второй-третьей линиях, если первая линия иммунотерапии была завершена без признаков прогрессирования опухоли и / или без непереносимой токсичности. Лечение проводится непрерывно до прогрессирования или непереносимой токсичности.
Рекомендуется ниволумаб у больных плоскоклеточным и неплоскоклеточным НМРЛ при любом уровне экспрессии PD-L1 (в том числе и при неизвестном статусе PD-L1) 60-минутная или 30-минутная инфузия в одном из трех дозовых режимов:
-
• ниволумаб 3 мг / кг в / в каждые 2 нед.
-
• ниволумаб 240 мг в / в каждые 2 нед.
-
• ниволумаб 480 мг в / в каждые 4 нед.
Можно менять режим дозирования и интервал введения ниволумаба с 3 мг/кг или 240 мг 1 раз в 2 недели на 480 мг 1 раз в 4 недели и наоборот следующим образом:
-
• если пациент получал ниволумаб в дозе 3 мг / кг или 240 мг 1 раз в 2 нед., то первую дозу 480 мг нужно вводить через 2 нед. и далее продолжить лечение в дозе 480 мг 1 раз в 4 нед.
-
• если пациент получал ниволумаб в дозе 480 мг 1 раз в 4 нед., то первую дозу 3 мг/кг или 240 мг нужно вводить через 4 нед. и далее продолжить лечение в дозе 3 мг / кг или 240 мг 1 раз в 2 нед.
Пембролизумаб рекомендуется в дозе 200 мг в/в каждые 3 нед. у больных с плоскоклеточным и неплоскоклеточным НМРЛ с экспрессией PD-L1 в ≥ 1 % опухолевых клеток.
Атезолизумаб рекомендуется для лечения больных плоскоклеточным и неплоскоклеточным НМРЛ независимо от уровня экспрессии PD-L1в одном из трех дозовых режимов:
-
• атезолизумаб 1200 мг в / в каждые 3 нед.
-
• атезолизумаб 840 мг в / в каждые 2 нед.,
-
• атезолизумаб 1680 мг в / в каждые 4 нед.
У пациентов с аденокарциномой и прогрессированием в течение 6 мес. от начала ХТ первой линии предпочтительным является назначение доцетаксела (если он не применялся ранее) в комбинации с нинтеданибом: доцетаксел 75 мг/м² в/в в 1-й день + нинтеданиб 200 мг внутрь 2 раза/сут. со 2-го по 21-й дни; цикл 21 день. В отдельных случаях при отмене доцетаксела из-за побочных эффектов возможно продолжить нинтеданиб в монотерапии до прогрессирования (только в случае объективного ответа или стабилизации болезни).
Назначение доцетаксела (если он не применялся ранее) в комбинации с нинтеданибом также может рассматриваться в качестве терапевтической опции у пациентов с аденокарциномой после неудачи первой линии ХТ и второй линии иммунотерапии, в первую очередь — при коротком интервале после ее окончания или при прогрессировании на ее фоне.
Возможно назначение платиновых комбинаций пациентам в общем удовлетворительном состоянии (по шкале ECOG 0–1 балл) с НМРЛ без активирующих мутаций при длительном интервале без прогрессирования после первой платино-содержащей линии лечения. После платиносодержащих режимов первой линии НМРЛ (без предшествующей или с предшествующей иммунотерапией) возможно также назначение терапии рамуцирумабом в комбинации с доцетакселом вплоть до прогрессирования заболевания. Рекомендуемая доза рамуцирумаба составляет 10 мг/кг в/в каждые 3 нед.
Ослабленным пациентам (объективное состояние по шкале ECOG 2 балла) рекомендуется монотерапия пеметрекседом, доцетакселом, гемцитабином, винорелбином или иммунотерапия до клинического прогрессирования, если эти препараты не использовались в первой линии.
Назначение третьей и последующих линий терапии рекомендовано пациентам в удовлетворительном общем состоянии (по шкале ECOG 0–1 балл) при наличии не использованных ранее опций терапии с принципиально другим механизмом противоопухолевого эффекта.
Эрлотиниб или афатиниб могут быть рекомендованы пациентам без активирующих мутаций в гене EGFR, если имеются противопоказания для иммуно- и ХТ.
Замена одного иммуноонкологического препарата на другой не рекомендуется.
-
3.1.3.4. Молекулярно-направленная терапия НМРЛ IV стадии: EGFR+, ALK/ROS1+, BRAF(+), c-MET(+)
Рекомендуется молекулярно-направленная терапия всем пациентам, имеющим в опухоли соответствующую молекулярную мишень для ее применения. Молекулярно-направленная (таргетная) терапия проводится непрерывно до появления клинических признаков прогрессирования процесса, однако, при локальном прогрессировании (олигометастатический процесс, например, в головном мозге) рекомендуется продолжение лечения ингибиторами тиро-зинкиназ с одновременной ЛТ (стереотаксической или на весь объем головного мозга) или хирургическим удалением солитарного очага.
Обследование с целью контроля эффективности лечения рекомендуется проводить 1 раз в 3 мес. или по клиническим показаниям.
Для пациентов с мутациями гена EGFR в 19 или 21 экзонах в качестве терапии первой линии рекомендуются ингибиторы тирозинкиназы EGFR ге-фитиниб, эрлотиниб, афатиниб, осимертиниб или комбинированный режим бевацизумаба/рамуцирумаба с эрлотинибом. Осимертиниб по сравнению с ингибиторами тирозинкиназы первого поколения улучшает общую выживаемость. Комбинация ингибиторов VEGF (бевацизумаб 15 мг/кг каждые 3 нед. или рамуцирумаб 10 мг/кг в/в каждые 2 нед.) и эрлотиниба 150 мг внутрь ежедневно увеличивает время до прогрессирования заболевания, но не влияет на общую выживаемость.
Назначение афатиниба при делеции в 19 экзоне гена EGFR в первой линии лечения позволяет увеличить общую выживаемость в сравнении с ХТ.
Афатиниб и осимертиниб являются препаратами выбора при редких мутациях в гене EGFR, в том числе в 18-ом и некоторых вариантах мутаций в 20-ом экзонах. Если мутация EGFR выявлена после начала ХТ первой линии, ХТ рекомендуется завершить (при эффективности — после 4 циклов) и перейти на ингибиторы тирозинкиназы EGFR. Поддерживающая терапия после 4 циклов нецелесообразна.
При системном прогрессировании на фоне первой линии таргетной терапии рекомендуется оценить возможность ребиопсии или исследование плазмы (с определением мутаций в циркулирующей опухолевой ДНК) с целью уточнения механизма резистентности для определения дальнейшей тактики лечения. При выявлении мутации EGFR T790M рекомендовано назначение осимертиниба.
В качестве альтернативы (при невозможности своевременного назначения осимертиниба, а также при отсутствии мутации Т790М) рекомендуется ХТ с включением платиносодержащих дуплетов (см. раздел 3.1.3.1) или химиоиммунотерапия по схеме: атезолизумаб 1200 мг в/в + паклитаксел 200 мг/м2 в/в (для пациентов монголоидной расы — 175 мг/м2) + карбоплатин AUC6 в/в + бева-цизумаб 15 мг/кг в/в в 1-й день каждые 3 нед. 4 цикла, в дальнейшем — поддерживающая терапия атезолизумабом и бевацизумабом в прежних дозах до прогрессирования или непереносимой токсичности.
У пациентов с активирующими мутациями EGFR назначение во второй линии монотерапии ингибиторами контрольных точек иммунитета не увеличивает общую выживаемость по сравнению с доцетакселом, однако эти данные получены из подгрупповых анализов, включавших небольшое количество пациентов; иммунотерапия препаратами анти-PD-1 не уступает по эффективности монотерапии доцетакселом и имеет преимущества по переносимости в этой подгруппе. Таким образом, ингибиторы контрольных точек иммунитета этим пациентам могут быть рекомендованы в третьей-четвертой линиях терапии.
При выявлении транслокации ALK в качестве первой линии лечения НМРЛ рекомендуется один из трех препаратов: алектиниб или церитиниб или кри-зотиниб. Лечение проводится до клинического прогрессирования или непереносимой токсичности
-
• алектиниб 600 мг внутрь 2 раза / сут.
-
• церитиниб 450 мг / сут внутрь.
-
• кризотиниб по 250 мг внутрь 2 раза / сут.
-
3.1.3.5. Лечение при метастазировании в головной мозг
Согласно результатам исследования, доложенным на ASCO 2020 г., отношение рисков по общей выживаемости в сравнительном исследовании алектиниба против кризотиниба достигло статистически значимой разницы: ОР= 0,67 (95% ДИ: 0,46–0,98), p= 0,0376.
При выявлении транслокации ALK после начала первой линии ХТ рекомендовано завершить запланированный объем лечения (при отсутствии прогрес- сирования) и перейти на таргетную терапию. У пациентов с транслокацией ALK при прогрессировании на фоне терапии кризотинибом оптимальной является вторая линия таргетной терапии церитинибом или алектинибом. При невозможности своевременного назначения ингибиторов ALK второго поколения показана ХТ или химиоиммунотерапия по схеме: атезолизумаб 1200 мг в/в + паклитаксел 200 мг/м2 в/в (для пациентов монголоидной расы — 175 мг/м2) + карбоплатин AUC6 в/в + бевацизумаб 15 мг/кг в/в в 1-й день каждые 3 нед. 4 цикла, в дальнейшем — поддерживающая терапия атезолизумабом и бе-вацизумабом в прежних дозах до прогрессирования или непереносимой токсичности. Если в первой линии применялся церитиниб или алектиниб, показана ХТ или химиоиммунотерапия по схеме: атезолизумаб 1200 мг в/в + паклитаксел 200 мг/м2 в/в (для пациентов монголоидной расы — 175 мг/м2) + карбоплатин AUC6 в/в + бевацизумаб 15 мг/кг в/в в 1-й день каждые 3 нед. 4 цикла, в дальнейшем — поддерживающая терапия атезолизумабом и бе-вацизумабом в прежних дозах до прогрессирования или непереносимой токсичности.
При выявлении транслокации в гене ROS1 или мутации в 14 экзоне c-MET рекомендована таргетная терапия кризотинибом. При прогрессировании на фоне таргетной терапии кризотинибом может быть рекомендована платиносодержащая ХТ или таргетная терапия ROS1-ингибиторами последующих поколений.
При мутации BRAF V600E возможным режимом первой линии является комбинация BRAF/MEK ингибиторов дабрафениба 150 мг внутрь 2 раза/сут. ежедневно и траметиниба 2 мг/сут. внутрь ежедневно до клинического прогрессирования или непереносимой токсичности. При выявлении мутации BRAF V600E после начала первой линии ХТ целесообразно ее продолжение до 4 циклов, при прогрессировании возможно назначить таргетную терапию. В отдельных случаях при невозможности определения активирующих мутаций гена EGFR в опухоли или в плазме как при аденокарциноме, так и плоскоклеточном НМРЛ может быть рекомендована молекулярно-направленная терапия эрлотинибом. При эффективности/стабилизации рекомендуется продолжение лечения до клинического прогрессирования.
Это частое проявление прогрессирования рака легкого, в основном — аденокарциномы (до 30%). Рекомендуется локальное лечение при выявлении в головном мозге единичных метастазов без выраженных клинических проявлений: оперативное удаление и/или стереотаксическая ЛТ. Добавление к локальному лечению ЛТ на весь объем головного мозга улучшает интракраниальный контроль. При множественном церебральном метастатическом поражении рекомендуется ЛТ всего объема головного мозга (РОД 2,5 Гр, СОД 37,5 Гр; РОД 3 Гр, СОД 30 Гр).
При бессимптомном метастатическом поражении вещества головного мозга у пациентов с высоким (более 50 % клеток) уровнем экспрессии PD-L1 в I линии терапии рекомендуется применение пембролизумаба.
При бессимптомном метастатическом поражении вещества головного мозга у пациентов с активирующими мутациями EGFR, транслокации ALK, ROS-1 рекомендуется начинать лечение с ингибиторов тирозинкиназ.
Осимертиниб, алектиниб, церитиниб обладают преимуществом в отношении интракраниального контроля и выживаемости без прогрессирования по сравнению с ингибиторами тирозинкиназ 1-го поколения при классических мутациях в первой линии терапии. Кумулятивная частота прогрессирования в ЦНС через 12 мес. при применении осимертиниба в три раза ниже по сравнению с ингибиторами тирозинкиназы EGFR 1-го поколения (8% против 24%). Афатиниб демонстрирует эффективность у пациентов с метастазами в головном мозге, а также снижает риск возникновения метастазов в ЦНС de novo. Кумулятивная частота прогрессирования в ЦНС через 12 мес. при применении афатиниба, согласно объединенным данным исследований LuxLung 3,6,7, составила 24,5%, что сопоставимо с эффективностью ингибиторов тирозинкаиназ 1-го поколения. При симптомных метастазах в головном мозге рекомендуется назначение высоких доз ГКС (дексаметазон до 24 мг/сут.) для уменьшения отека вещества мозга; при неэффективности ГКС в рекомендованной дозе дальнейшее повышение дозы не рекомендуется; это свидетельствует о неблагоприятном прогнозе.
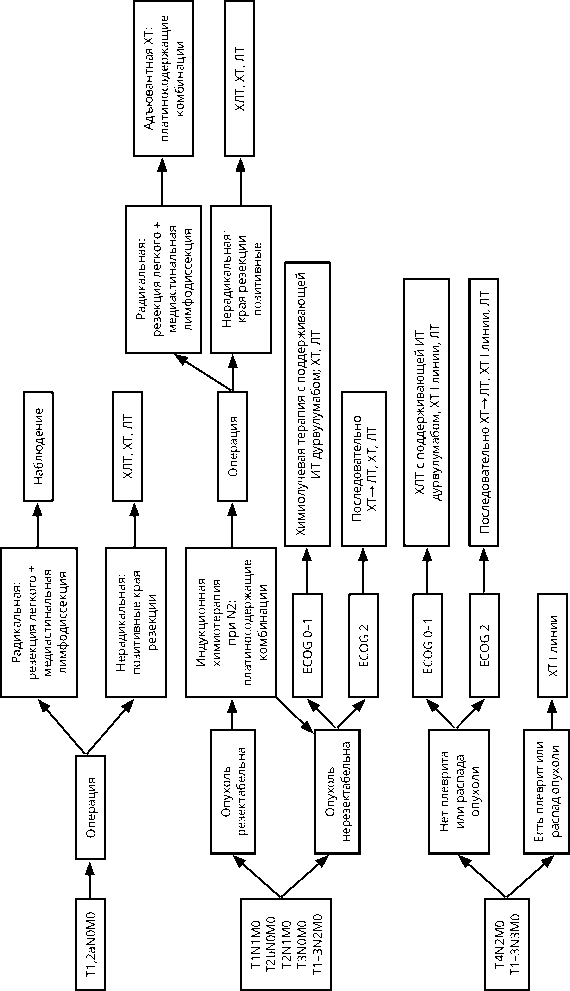
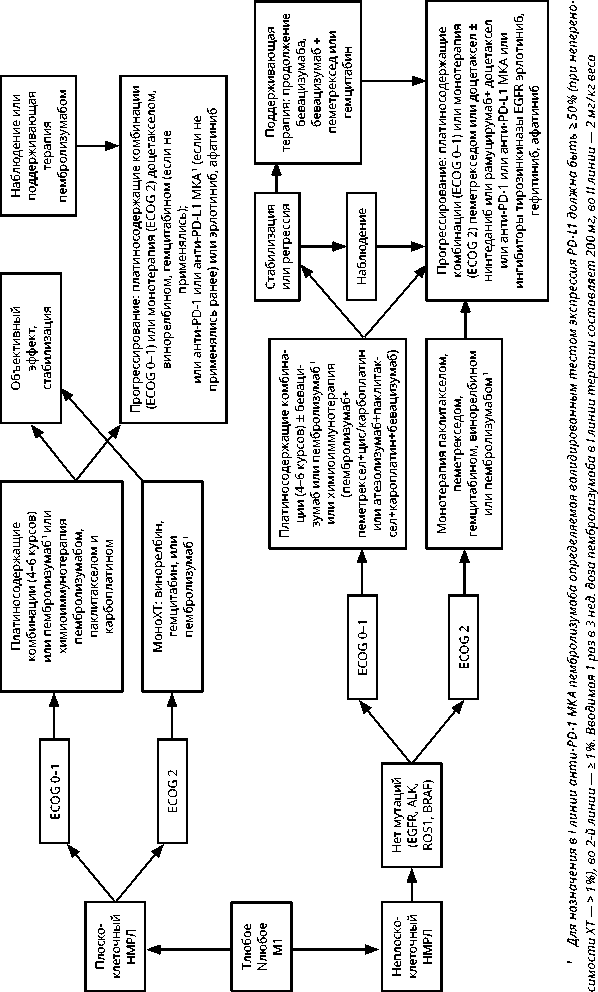

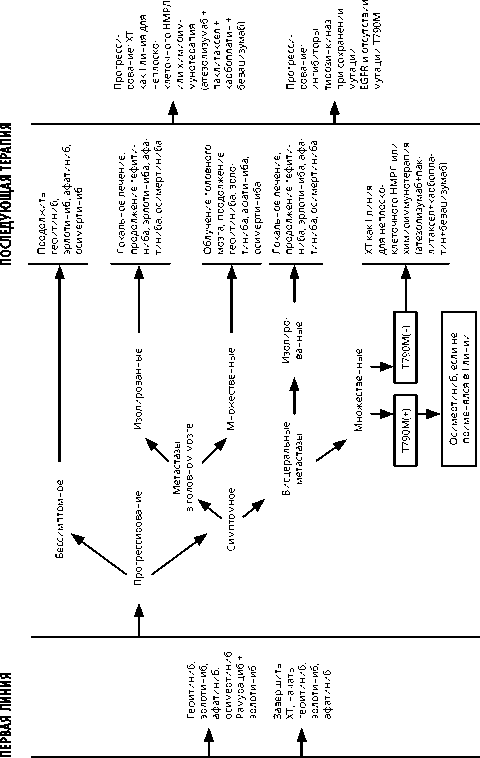

Рисунок 3. Рекомендуемый алгоритм лечения немелкоклеточного рака лёгкого IV стадии при EGFR(+) мутации.
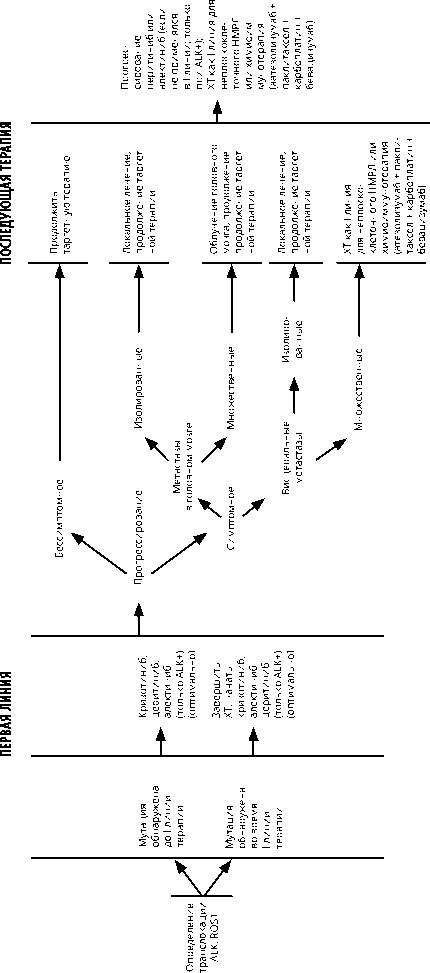
Рисунок 4. Рекомендуемый алгоритм лечения немелкоклеточного рака лёгкого IV стадии при транслокации ALK, ROS1.


