Практические рекомендации по лекарственному лечению опухолей вилочковой железы (тимомы и рака тимуса)
Автор: Т. Д. Барболина, М. Б. Бычков, А. К. Аллахвердиев, Т. Н. Борисова, Л. Ю. Владимирова, С. С. Герасимов, Н. В. Деньгина, Н. А. Козлов, К. К. Лактионов, Е. В. Левченко, Д. В. Малютина, О. В. Пикин
Журнал: Злокачественные опухоли @malignanttumors
Статья в выпуске: 3S2-1 т.10, 2020 года.
Бесплатный доступ
Тимома, рак тимуса, тимиче
Короткий адрес: https://sciup.org/140254662
IDR: 140254662 | DOI: 10.18027/2224-5057-2020-10-3s2-35
Текст статьи Практические рекомендации по лекарственному лечению опухолей вилочковой железы (тимомы и рака тимуса)
Опухоль вилочковой железы — редкое заболевание, которое относится к опухолям средостения. Частота новообразований средостения в структуре онкологических заболеваний составляет не более 1 %. Около 50% первичных опухолей переднего средостения являются тимомами. Это группа органоспецифичных эпителиальных опухолей вилочковой железы, обладающих сходным гистологическим строением, ИГХ профилем и вариабельной степенью злокачественности.
Опухоли тимуса подразделяются на 3 подгруппы: тимомы, тимические карциномы (син.— рак тимуса), нейроэндокринные новообразования. Заболеваемость тимомами составляет 1,5 случая на 1 млн. человек, а раком тимуса еще ниже. Тимомы чаще возникают в диапазоне от 40 до 70 лет и крайне редко — в детском и подростковом возрасте. Одинаково часто заболевают мужчины и женщины. Этиология неизвестна. Клиническая картина неспецифична. У некоторых пациентов болезнь протекает бессимптомно, и обнаружение опухоли средостения является случайной рентгенологической находкой. Симптомы болезни и прогноз зависят от размеров первичной опухоли, наличия паранеопластических симптомов, морфологического типа, степени вовлеченности окружающих органов и структур и наличия или отсутствия отдаленных метастазов. Болезнь может проявляться такими симптомами как: кашель, одышка, боли в грудной клетке, дисфагия, проявления медиастинального компрессионного синдрома (чаще — симптомы сдавления верхней полой вены), нарушения сердечного ритма. Приблизительно от 30 до 50% пациентов с тимомами имеют симптомы миастении гравис, которая проявляется в виде птоза, диплопии, мышечной слабости, дисфагии, афонии или тяжелого миастенического криза с развитием генерализованного тетрапареза и резко нарастающей слабости дыхательных мышц.
1 Цитирование: Барболина Т. Д., Бычков М. Б., Аллахвердиев А. К., Борисова Т. Н., Владимирова Л. Ю., Герасимов С. С. и соавт. Практические рекомендации по лекарственному лечению опухолей вилочковой железы (тимомы и рака тимуса). Злокачественные опухоли: Практические рекомендации RUSSCO #3s2, 2020 (том 10).35
1. ОПРЕДЕЛЕНИЕ СТАДИИ
Для стадирования наиболее широко используется классификация Masaoka-Koga, которая подходит как для тимом, так и для рака тимуса. Современная TNM система стадирования тимом и рака тимуса основана на объединенных данных Международной группы по изучению опухолей вилочковой железы (ITMIG — International Thymic Malignancy Interest Group) и Международной ассоциации по изучению рака легкого (IASLC — International Association for the study Lung Cancer). В клинической практике возможно использование обеих классификаций (табл. 1, 2, 3).
Таблица 1. Определение категорий TNM при тимомах и раке тимуса (8-е издание AJCC, 2018 г.)
|
Первичная опухоль 1 |
|
|
Тх |
Первичная опухоль не может быть оценена |
|
Т0 |
Первичная опухоль не определяется |
|
Т1 |
Опухоль не вышла за пределы вилочковой железы или распространяется на медиастинальную клетчатку; может вовлекать медиастинальную плевру |
|
Т1а |
Медиастинальная плевра не вовлечена |
|
Т1b |
Медиастинальная плевра поражена |
|
Т2 |
Опухоль врастает в перикард (либо частично, либо на всю толщину) |
|
Т3 |
Опухоль вовлекает легкое, брахиоцефальную вену, верхнюю полую вену, диафрагмальный нерв, грудную клетку или распространяется экстраперикардиально на легочную артерию или вену |
|
Т4 |
Опухоль вовлекает аорту, интраперикардиально легочную артерию, миокард, трахею, пищевод |
|
Регионарные лимфатические узлы |
|
|
Nх |
Региональные лимфатические узлы не могут быть оценены |
|
N0 |
Нет метастазов в региональных лимфатических узлах |
|
N1 |
Наличие метастазов в передних (претимических) лимфатических узлах |
|
N2 |
Наличие метастазов в глубоких лимфатических узлах грудной клетки и шейных лимфатических узлах |
|
Отдаленные метастазы |
|
|
М0 |
Нет отдаленных метастазов |
|
М1 |
Есть отдаленные метастазы |
|
М1а |
Изолированное поражение плевры или перикарда |
|
М1b |
Внутрипаренхиматозные узлы в легком и отдаленные метастазы (печень, кости, головной мозг) |
1 Уровень инвазии для определения категории Т должен быть подтвержден микроскопически.
Таблица 2. Группировка тимом и рака тимуса по стадиям
|
Стадия |
Т |
N |
M |
|
I |
Т1а, b |
N0 |
M0 |
|
II |
T2 |
N0 |
M0 |
|
IIIА |
T3 |
N0 |
M0 |
|
IIIВ |
T4 |
N0 |
M0 |
|
IVА |
T любая |
N1 |
M0 |
|
T любая |
N0–1 |
M1a |
|
|
IV B |
T любая |
N2 |
M0-M1a |
|
T любая |
N любая |
M1b |
Таблица 3. Группировка тимом и рака тимуса по стадиям Masaoka-Koga
|
Стадия |
Критерий |
TNM стадия (эквивалент) |
|
I |
Микроскопически и макроскопически подтвержденное отсутствие выхода опухоли за капсулу железы |
T1N0M0 |
|
II |
(А) Микроскопическая транскапсулярная инвазия |
T2N0M0 |
|
(В) Макроскопическая инвазия в прилежащую жировую ткань без вовлечения медиастинальной плевры и перикарда |
T2N0M0 |
|
|
III |
(А) Макроскопическая инвазия в соседние органы: перикард, легкое, без инвазии в крупные сосуды |
T3N0M0 |
|
(В) Макроскопическая инвазия в соседние органы: перикард, легкое с инвазией в крупные сосуды |
T4N0M0 |
|
|
IV |
(А) Плевральная или перикардиальная диссеминация |
T любaя N0-1M0-1a |
|
(В) Отдаленные лимфогенные и гематогенные метастазы |
Тлюбая Nлюбая M1b |
2. ДИАГНОСТИКА
Для определения тактики лечения необходимо проведение комплексного инструментального обследования с целью точного клинического стадирова-ния болезни.
План обследования больных с тимомой или раком тимуса:
-
• сбор анамнеза и физикальный осмотр;
-
• общий анализ крови (гемоглобин, общее число лейкоцитов, лейкоцитарная формула, тромбоциты);
-
• биохимический анализ крови (креатинин, мочевина, АЛТ, АСТ) и коагуло-грамма;
-
• антитела к антиацетилхолиновым рецепторам в сыворотке крови для определения риска развития миастении гравис, даже в случае бессимптомного течения болезни;
-
• АФП, β-ХГЧ и ЛДГ — для исключения внегонадной герминогенной опухоли средостения;
-
• КТ органов грудной клетки, брюшной полости и малого таза с в / в контрастированием;
-
• УЗИ шейно-надключичных, подключичных лимфатических узлов, органов брюшной полости и забрюшинного пространства для исключения отдаленных метастазов;
-
• радиоизотопное исследование скелета (при подозрении на поражение костей);
-
• МРТ грудной клетки с контрастным усилением; выполнение МРТ позволяет дифференцировать сосудистые структуры средостения (в том числе сосудистые аномалии) от опухолевого поражения без применения дополнительных методик;
-
• ЭКГ и Эхо-КГ — при поражении перикарда, миокарда
-
• ФБС даёт возможность выявить прорастание и обструкцию (сдавление, смещение) трахеи и бронхов; при наличии экзофитного компонента необходимо произвести биопсию тканей для морфологической верификации; при отсутствии прорастания стенки трахеи или бронха и при наличии деформаций возможна трансбронхиальная (трахеальная) пункционная биопсия;
-
• трансторакальная биопсия опухоли средостения;
-
• видеоторакоскопия проводится при невозможности выполнения и при неэффективности трасторакальной пункции, а также при необходимости исключить лимфому;
-
• ИГХ и / или ИЦХ исследование;
-
• ПЭТ-КТ с ФДГ с целью первичного стадирования не рекомендуется, но является дополнительным методом в диагностике поражения плевры и в качестве контроля после проведенного лечения и перед планированием ЛТ;
-
• МРТ с в / в усилением головного мозга — при подозрении на метастатическое поражение.
Послеоперационное морфологическое заключение имеет фундаментальное значение, так как на этом основывается выбор лечебной тактики. В морфологическом заключении рекомендуется отразить следующие параметры:
• гистологическое строение опухоли;
• размеры опухоли;
• расстояние до проксимального и дистального краёв резекции;
• степень дифференцировки опухоли;
• наличие / отсутствие поражения проксимального края резекции;
• наличие / отсутствие поражения дистального края резекции;
• наличие / отсутствие лимфоваскулярной, периневральной инвазии.
3. ПРОГНОСТИЧЕСКИЕ ФАКТОРЫ
4. ЛЕЧЕНИЕ
4.1. I–II стадии (резектабельные) и местнораспространенная стадия IIIа
4.1.1. Хирургическое лечение
Существовавшая в предыдущих версиях «тимома тип С» в настоящей классификации ВОЗ 2015 г. переименована в собирательную категорию «Рак тимуса». Гистологическая классификация представлена в таблице 4.
Таблица 4. Классификация ВОЗ опухолей вилочковой железы (2015 г.)
|
Подтип |
Критерий (обязательный) |
Критерий (возможный) |
|
Тип А |
Веретеноклеточные или овальные клетки, без атипии или опухолевых лимфоцитов, соответствует медуллярному типу |
Эпителиальные клетки CD20 + |
|
Тип АВ |
Смешанный тип, схож с типом А, но отмечаются единичные очаги опухолевых лимфоцитов |
Эпителиальные клетки CD20 + |
|
Тип В1 |
Медуллярный тип, напоминает нормальный кортикальный слой тимуса с очагами включения клеток медуллярной дифференциации |
Тельца Хассала, периваскулярные пространства |
|
Тип В2 |
Кортикальный тип, содержит рассеянные опухолевые эпителиальные клетки с везикулярными включениями в ядре |
Медуллярные островки, тельца Хассала, периваскулярные пространства |
|
Тип В3 |
Эпителиальный тип, состоит преимущественно из эпителиальных клеток с умеренно выраженной атипией, некоторыми авторами характеризуется как высокодифференцированный рак тимуса |
Тельца Хассала, периваскулярные пространства |
|
Карциномы тимуса |
Рак тимуса:
|
Плеоморфные эпителиальные клетки, актин, кератин |
|
Микронодулярная тимома |
Микронодуллярная тимома с лимфоидной стромой |
Лимфоидные фолликулы, моноклональные В-клетки и / или плазматические клетки |
|
Метапластическая тимома |
Бифазная опухоль, состоящая из эпителиальных и веретенообразных клеток; отсутствуют Т-клетки |
Плейоморфизм эпителиальных клеток, актин-, кератин- или ЕМА-позитив-ные клетки |
|
Нейроэндокринные опухоли |
|
См. соответствующий раздел клинических рекомендаций |
Пятилетняя выживаемость у пациентов с тимомами достигается в 90% случаев, однако этот показатель при раке тимуса не превышает 55%. К числу прогностических факторов относят гистологический тип, радикальность операции, стадию болезни, ответ на лечение, общесоматический статус по шкале ECOG. В случае радикальной операции при I–II стадиях 10-летняя общая выживаемость составляет 90% и 70% соответственно.
Абсолютным показанием к хирургическому лечению является I стадия. При II и более стадиях тактика лечения каждого пациента должна обсуждаться на междисциплинарном консилиуме.
Гистологическая верификация опухоли до хирургического лечения не является обязательной, если по клинико-рентгенологическим данным опухоль абсолютно резектабельна и имеется миастения гравис.
Рекомендована дооперационная или интраоперационная (в случае выбора малоинвазивной методики оперирования) морфологическая диагностика для исключения лимфомы с поражением лимфатических узлов переднего средостение или тимуса. До начала хирургического лечения пациенты должны быть обследованы на предмет возможных симптомов миастении гравис с их медикаментозным контролем. Цель хирургического лечения — удаление опухолевой массы вместе с вилочковой железой. Может потребоваться резекция близлежащих структур: перикарда, плевры, легкого, диафрагмального нерва, крупных магистральных сосудов. Во время тимэктомии необходима ревизия плевры. Радикальная операция должна включать удаление опухоли с обязательным удалением окружающей клетчатки с лимфатическими узлами. В случае сомнений в отношении R0 необходима маркировка краев резекции хирургическими клипсами для последующей возможной ЛТ.
Минимально инвазивная торакоскопическая операция менее травматична, но не рекомендуется широко в рутинной практике. Однако она может использоваться при I–II стадиях в крупных многопрофильных центрах опытным хирургом (при неинвазивной тимоме). При местнораспространенном опухолевом процессе оптимальным доступом является полная продольная стернотомия, которая может быть дополнена торакотомией. Торакотомный доступ не позволяет выполнить радикальное удаление опухоли, характеризуется высокой частотой местных рецидивов, поэтому не рекомендуется.
Алгоритм диагностики и лечения ранних стадий опухолей вилочковой железы представлен на рис. 1.
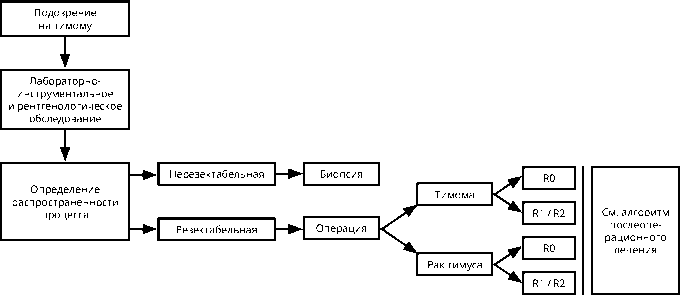
Рисунок 1. Алгоритм диагностики и лечения ранних стадий опухолей вилочковой железы.
-
4.1.2. Послеоперационное лечение
-
4.1.3. Комбинированное лечение
Решение вопроса о послеоперационном лечении зависит от радикальности операции, гистологического типа опухоли и стадии заболевания. Адъювантно используют ЛТ, ХТ или их сочетание. При I стадии, IIА (типах А, АВ, В1, В2) и IIB (типах А, АВ, В1) стадиях после операции R0 адъювантное лечение не рекомендуется. В случае IIA стадии типа В3 и при IIB стадии типов В2-В3 возможно обсуждение адъювантной ЛТ на консилиуме.
При неполных резекциях в послеоперационном периоде рекомендована адъювантная ЛТ. Используется 3D конформная ЛТ, IMRT, VMAT с ограничением доз на критические органы. В объем облучение включается область исходного распространения опухоли, переднее, верхнее и среднее средостение. Профилактическое облучение регионарных лимфоузлов (медиастинальные и надключичные лимфоузлы с двух сторон), медиастинальной и костальной плевры не рекомендуется.
ЛТ должна быть начата не позднее 3 мес. после операции. В иных случаях целесообразность ее применения необходимо обсуждать на консилиуме. Алгоритм послеоперационного лечения представлен на рис. 2.
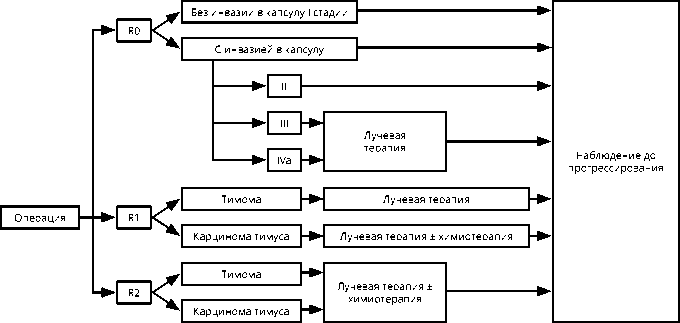
Рисунок 2. Алгоритм послеоперационного лечения опухолей вилочковой железы.
Предоперационная ХТ может проводиться у пациентов с потенциально резектабельной опухолью в случае инвазии в органы средостения при IIIa–IIIb стадиях (например, при Т3–Т4). При достижении резектабельности тактика лечения вновь должна быть обсуждена на междисциплинарном консилиуме для планирования оперативного вмешательства и последующей ЛТ. В среднем проводится 2–4 курса до операции с оценкой эффективности лечения по критериям RECIST 1.1.
Послеоперационная последовательная ХЛТ (этопозид + цисплатин с ЛТ СОД-60 Гр) может быть использована при резекции R2 как при тимоме, так и при раке тимуса.
-
4.2. III–IVа стадии или рецидив заболевания
-
4.2.1. Лучевая терапия
Несмотря на местнораспространенный опухолевый процесс при III–IVа стадиях, в случае рецидива, который встречается в 10–15% случаев, или при прогрессировании заболевания, целесообразно вновь оценить возможности хирургического лечения. Тактика ведения зависит от характера ранее проведенного лечения и зон метастазирования. Следует помнить, что ранее проведенная ЛТ органов средостения повышает риск развития кардиотоксичности ХТ. Алгоритм лечения данной категории пациентов представлен на рис. 3.
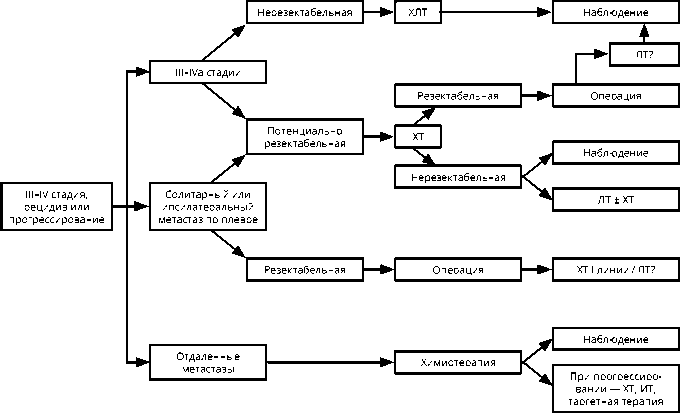
Рис. 3. Алгоритм лечения опухолей вилочковой железы III–IVа стадий, рецидива и прогрессирования.
Объем лучевого воздействия на здоровые ткани должен быть минимальным. Предпочтительно 3D- или 4D-планирование с регуляцией по дыханию. Для адъювантного облучения крайне желательно использовать совмещение полученных изображений с границами опухоли до операции. СОД в случае полной резекции тимомы составляет 50 Гр; при неполных резекциях (R1, R2) — СОД 54 Гр. В случае неполной резекции рака тимуса целесообразна СОД 60 Гр в виде буста на область высокого риска локального рецидива. Технология IMRT обеспечивает лучшее распределение дозы на критические органы. Доза и кратность фракций облучения зависят от цели, объема ранее проведенного оперативного лечения и радикальности операции. Рекомендуемые дозы лучевой терапии указаны в табл. 5.
Таблица 5. Рекомендуемые дозы ЛТ при тимоме и раке тимуса
|
Назначение |
СОД |
РОД |
Длительность лечения |
|
После операции |
|||
|
Резекция R0 |
45–50 Гр |
2 Гр |
Ежедневно 5 дней в неделю |
|
Микроскопически позитивный край резекции R1 |
54 Гр |
2 Гр |
Ежедневно 5 дней в неделю |
|
R2 резекция или ЛТ с радикальной целью |
60–70 Гр |
1,8 Гр |
Ежедневно 5 дней в неделю |
|
Карцинома тимуса |
> 60 Гр |
2 Гр |
Ежедневно 5 дней в неделю |
|
Назначение |
СОД |
РОД |
Длительность лечения |
|
При диссеминированной тимоме |
|||
|
С паллиативной целью для купирования симптомов |
8 Гр |
8 Гр |
Однократно |
|
20 Гр |
4 Гр |
5 сеансов |
|
|
30 Гр |
3 Гр |
10 сеансов |
-
4.3. IVb стадия
-
4.3.1. Химиотерапия
-
Системное лекарственное лечение пациентов с диссеминированной опухолью носит паллиативный характер. Для них ХТ является единственной опцией. К сожалению, карцинома тимуса плохо поддаётся ХТ.
При тимоме IVb стадии в случае ответа на лечение и появления признаков резектабельности опухоли вновь необходимо обсуждать вопросы хирургического и постоперационного лучевого лечения.
Предпочтительными являются цисплатин-содержащие режимы. Эффективность 1 линии составляет не более 35%, а II линии — от 4% до 21 %.
Выбор II и последующих линий зависит от эффективности предшествующего лечения и времени до прогрессирования. При ремиссии ≥6 мес. возможно повторное назначение режима I линии.
Основные и альтернативные режимы лекарственного лечения представлены в табл. 4.
Таблица 4. Режимы химиотерапии, рекомендуемые при опухолях вилочковой железы
|
Тимома |
Рак тимуса |
|
Режимы I линии |
|
|
CAP 1 Цисплатин 50 мг / м2 в / в в 1-й день Доксорубицин 50 мг / м2 в / в в 1-й день Циклофосфамид 500 мг / м2 в / в в 1-й день Цикл каждый 21 день |
ТС 1 Паклитаксел 200 мг / м2 в / в в 1-й день Карбоплатин AUC 5–6 в / в в 1-й день Цикл каждый 21 день |
|
ADOC Доксорубицин 40 мг / м2 в / в в 1-й день Цисплатин 50 мг / м2 в / в в 1-й день Винкристин 0,6 мг / м2 в / в в 3-й день Циклофосфамид 700 мг / м2 в / в в 4-й день Цикл каждые 21–28 дней |
|
|
EP Этопозид 120 мг / м2 в / в в 1–3-й дни Цисплатин 60 мг / м2 в / в в 1-й день Цикл каждый 21 день |
|
|
CAP+ преднизолон Цисплатин 30 мг / м2 в / в в 1–3-й день Доксорубицин 20 мг / м2 в / в в 1–3-й день Циклофосфамид 500 мг / м2 в / в в 1-й день Преднизолон 100 мг в день внутрь в 1–5-й дни Цикл каждый 21 день |
|
|
Тимома |
Рак тимуса |
|
Режимы II линии и последующих линий |
|
|
EP Этопозид 120 мг / м2 в / в в 1–3-й дни Цисплатин 60 мг / м2 в / в в 1-й день Цикл каждые 21 день (возможен назначение этопозида в монорежиме) |
ТС 1 Паклитаксел 200 мг / м2 в / в в 1-й день Карбоплатин AUC 5–6 в / в в 1-й день Цикл каждый 21 день (если этот режим ранее не применялся или период ремиссии более 6 мес.) |
|
GEM–CAP Гемцитабин 1000 мг / м2 в / в в 1-й и 8-й дни Капецитабин 650 мг / м2 внутрь в 1–14-й дни Цикл каждый 21 день (возможно использование гемцитабина в монорежиме) |
GEM–CAP Гемцитабин 1000 мг / м2 в / в в 1-й и 8-й дни Капецитабин 650 мг / м2 внутрь в 1–14-й дни Цикл каждый 21 день (возможно использование гемцитабина в монорежиме) |
|
ПЕМЕТРЕКСЕД Пеметрексед 500 мг / м2 в / в в 1-й день Цикл каждый 21 день |
ПЕМЕТРЕКСЕД Пеметрексед 500 мг / м2 в / в в 1-й день Цикл каждый 21 день |
|
МЕЙО 5-фторурацил 425 мг / м2 в / в стр. в 1–5 дни Кальция фолинат 20 мг / м2 в / в стр. в 1–5 дни Цикл каждые 28 дней |
МЕЙО 5-фторурацил 425 мг / м2 в / в стр. в 1–5 дни Кальция фолинат 20 мг / м2 в / в стр. в 1–5 дни Цикл каждые 28 дней |
|
ОКТРЕОТИД ± преднизолон² Начиная с октреотида короткого действия по 100 мкг 3 р / сут. п / к, 14 дней Далее пролонгированная форма по 20–30 мг в / м каждые 28 дней При комбинации: октреотид 0,5 мг п / к 3 раза в день ежедневно+преднизолон 0,6 мг / кг внутрь 4 раза в день |
ОКТРЕОТИД ± преднизолон² Начиная с октреотида короткого действия по 100 мкг 3 р / сут. п / к, 14 дней Далее пролонгированная форма по 20–30 мг в / м каждые 28 дней При комбинации: октреотид 0,5 мг п / к 3 раза в день ежедневно преднизолон 0,6 мг / кг внутрь 4 раза в день |
|
ПАКЛИТАКСЕЛ Паклитаксел 200 мг / м2 в / в в 1-й день Цикл каждый 21 день |
ПАКЛИТАКСЕЛ Паклитаксел 200 мг / м2 в / в в 1-й день Цикл каждый 21 день |
|
CODE Цисплатин 25 мг / м2 в / в в 1-й день Цикл каждые 7 дней Винкристин 1 мг / м2 в / в в 1-й день Доксорубицин 40 мг / м2 в / в в 1-й день Этопозид 80 мг / м2 в / в в 1–3-й дни Цикл каждые 14 дней |
|
1 Предпочтительный режим.
2 При непереносимости или противопоказаниях кХТ, для пациентов с октреоскан-позитивной тимомой.
5. ТАРГЕТНАЯ И ИММУНОТЕРАПИЯ
Обнаружение повышенной концентрации в плазме VEGF, FGF, мембранной гиперэкспрессии в опухоли PDGF и мутации с-KIT (экзон 9–17) послужило поводом для изучения таргетных препаратов. Мутация в гене с-KIT встречается не более, чем в 10% случаев при раке тимуса, а при тимомах отсутствует.
Новый иммунный препарат пембролизумаб показал свою эффективность во II линии терапии у пациентов с карциномой тимуса с частотой объективных эффектов 22,5%, но данный вид лечения ассоциировался с высоким риском развития аутоиммунных осложнений (15 %). Аутоиммунный миокардит 3–4 ст. встречался в 5–9% случаев. При тимомах пембролизумаб не рекомендуется.
Сунитиниб назначается независимо от c-KIT мутации во II линии терапии рака тимуса и не показан при тимоме. Частота объективных ответов составляет 26%, а контроль роста опухоли 41 %. Наиболее серьезным нежелательным явлением при применении сунитиниба является кардиомиопатия 3 степени у 8 % пациентов.
Эверолимус может использоваться как при рефрактерной тимоме, так и при раке тимуса с частотой объективных эффектов 11 % и контролем роста опухоли в 88% случаев. Следует помнить, что основным серьезным осложнением терапии эверолимусом является развитие пульмонитов 4 степени у 5 % пациентов.
Назначение таргетной и иммунотерапии возможно только по решению врачебной комиссии. Режимы иммунной и таргетной терапии представлены в табл. 6.
Таблица 6. Режимы таргетной и иммунотерапии при тимоме и раке тимуса 1
|
Тимомы |
Рак тимуса |
|
ЭВЕРОЛИМУС 10 мг внутрь ежедневно |
ЭВЕРОЛИМУС 10 мг внутрь ежедневно |
|
ПЕМБРОЛИЗУМАБ 200 мг в / в в 1-й день Цикл каждый 21 день Максимально до 2-х лет |
|
|
СУНИТИНИБ 50 мг / сут. внутрь ежедневно 4 недели с 2-х недельным перерывом Максимальная доза — 87,5 мг / сут. Минимальная доза — 25 мг / сут. |
1 В показаниях для назначения иммунных и таргетных препаратов тимома и рак тимуса отсутствуют.
6. НАБЛЮДЕНИЕ
После завершения лечения динамическое наблюдение проводится каждые 6 мес. в течение первых 2 лет, далее — 1 раз в год до продолжительности 5 лет при раке тимуса и 10 лет — при тимоме. Обязательными диагностическими процедурами являются КТ органов грудной клетки с контрастированием, УЗИ шейно-надключичных зон, органов брюшной полости, забрюшинного пространства и малого таза.


