Практические рекомендации по лекарственному лечению пациентов с метастазами в головном мозге
Автор: Насхлеташвили Д.Р., Банов С.М., Бекяшев А.Х., Голанов А.В., Зайцев А.М., Кобяков Г.Л., Пронин А.И., Смолин А.В.
Журнал: Злокачественные опухоли @malignanttumors
Статья в выпуске: 3S2-1 т.12, 2022 года.
Бесплатный доступ
Метастатические опухоли головного мозга, таргетная терапия, химиотерапия, иммунотерапия, радиотерапия, стереотаксическая радиотерапия, радиохирургия, нейрохирургическое лечение
Короткий адрес: https://sciup.org/140296293
IDR: 140296293 | DOI: 10.18027/2224-5057-2022-12-3s2-141-154
Текст статьи Практические рекомендации по лекарственному лечению пациентов с метастазами в головном мозге
ОБЩИЕ ДАННЫЕ
По данным популяционных канцер-регистров, частота метастазов в головном мозге (МГМ) составляет 10–17% всех случаев онкологических заболеваний.
Ежегодный показатель частота поражения головного мозга зависит от локализации первичного очага и составляет в целом по популяции при локализованных формах мелкоклеточного рака легких (МРЛ) — 15,8%, меланомы — 0,6%, немелкоклеточного рака легких (НМРЛ) — 14,4%, HER2-положительного рака молочной железы (РМЖ) — 1,1%, тройном негативном фенотипе РМЖ — 0,7 %, рака почки — 1,5 %.
При генерализованной форме заболевания частота МГМ составляет при МРЛ — 23,5%, меланоме — 28,2%, НМРЛ — 26,8%, HER2-положительном РМЖ — 11,5%, тройном негативном РМЖ — 11,4%, рак почки — 10,9%.
Метастатическое поражение головного мозга проявляется в виде солитарного очага приблизительно у 37–50% пациентов, а у 50–63% пациентов метастазы имеют множественный характер и могут локализоваться в различных анатомических образованиях головного мозга: в паренхиме, в твердой или мягкой мозговой оболочках, в субарахноидальном пространстве и желудочках головного мозга. Супратенториальные метастазы составляют 80–85%, метастазы в мозжечке — 10–15%, в стволе мозга — 3–5%, в мозговых оболочках — 1–2%.
Скрининг метастазов в головном мозге
-
• Скрининг МГМ следует рассматривать для пациентов с МРЛ любой стадии, НМРЛ (начиная со II стадии) и с меланомой (начиная с IIIC стадии)
-
• МРТ головного мозга следует проводить пациентам с наличием клинических симптомов повышенного внутричерепного давления, судорог или при появлении новых неврологических нарушений.
1. ФАКТОРЫ ПРОГНОЗА
Общая выживаемость пациентов с МГМ и планирование лечения зависят от ряда клинических факторов (возраст пациента, общее состояние, неврологический дефицит), биологических факторов опухоли, объема поражения головного мозга (количество и объем метастазов и их локализация), наличия масс-эффекта и активности экстракраниального опухолевого процесса.
Целесообразно выделять:
• группу благоприятного прогноза общей выживаемости: 6 и более мес. по шкале GPA, отсутствие или стабилизация экстракраниальных метастазов, наличие резервов эффективной лекарственной терапии;
• группу неблагоприятного прогноза общей выживаемости: меньше 6 мес. по шкале GPA, экстракраниальная прогрессия, отсутствие резервов лекарственной терапии.
2. КЛАССИФИКАЦИЯ И ОПРЕДЕЛЕНИЕ СТАДИИ
Метастатическое поражение головного мозга — это всегда IV стадия опухолевого процесса, по классификации TNM соответствует М1 независимо от значения индексов «Т» и «N».
В зависимости от количества очагов в головном мозге выделяют:
• одиночный МГМ, в т. ч. солитарный МГМ (в случае отсутствия других отдаленных метастазов);
• олигометастатическое поражение головного мозга: 2–4 очага в головном мозге;
• множественные метастазы: ≥5 очагов в головном мозге.
3. ДИАГНОСТИКА
В зависимости от макроструктуры МГМ могут быть cолидной, кистозной и кистозносолидной структуры.
Обследование пациентов с МГМ проводится в соответствии с клиническими рекомендациями по лечению первичного опухолевого очага, метастазирующего в головной мозг.
Дополнительно рекомендуется проведение:
• неврологического осмотра;
• офтальмологического осмотра с оценкой симптомов внутричерепной гипертензии;
• МРТ головного мозга с контрастным усилением;
• КТ с контрастированием (с шагом 1 мм) для диагностики метастатического поражения головного мозга рекомендуется только при наличии противопоказаний к проведению МРТ.
4. ЛЕЧЕНИЕ
МРТ головного мозга выполняется в следующих режимах: до в/в введения контрастного вещества в режимах Т1 в аксиальной проекции (толщина среза 1–1,5 мм), Т2, ДВИ, FLAIR (толщина среза 3–5 мм). После в/в введения контрастного вещества: Т1 в аксиальной проекции (толщина среза 1–1,5 мм), 3D T1 взвешенные изображения высокого разрешения в аксиальной (или сагиттальной) плоскости с захватом всей головы с применением технологии изотропного вокселя (1 мм×1 мм×1 мм), режим 3D SPGR c контрастированием.
Алгоритм лечения пациентов с МГМ формируется на мультидисциплинарном онкологическом консилиуме (в соответствии с Приказом Министерства здравоохранения Российской Федерации от 19.02.2021 г. N 116н «Об утверждении Порядка оказания медицинской помощи взрослому населению при онкологических заболеваниях») с участием врача-нейрохирурга, врача-радиотерапевта и врача-онколога, на котором определяется объем и последовательность различных вариантов локального (нейрохирургия и/или радиотерапия) и системного (противоопухолевого, симптоматического, противоотечного и противосудорожного) лечения.
Алгоритм лечения разрабатывается индивидуально с учетом следующих факторов:
-
• распространенность экстракраниальных метастазов, наличие/отсутствие их контроля;
-
• наличие/отсутствие резервов противоопухолевой лекарственной терапии;
-
• биологические характеристики первичной опухоли и МГМ;
-
• размер МГМ: в максимальном измерении до 2 см (небольшие), 2 см и более (крупные);
-
• объем метастатического поражения головного мозга: одиночный метастаз, ограниченное метастатическое поражение (2–4 очага), множественные метастазы (5 и более очагов), диссеминированное поражение головного мозга (поражение по типу милиарного без возможности выделения целевого объема для проведения стереотаксической радиотерапии); лептоменингеальное поражение головного мозга;
-
• функциональный статус пациента, обусловленный опухолевым процессом (индекс Карновского больше/меньше 70%);
-
• прогноз общей выживаемости: больше или меньше 6 мес. по шкале GPA (онлайн калькулятор на сайте https://brainmetgpa.com/ );
-
• локализация МГМ в функционально значимых зонах мозга;
-
• наличие или отсутствие неврологической симптоматики, обусловленной метастатическим поражением головного мозга.
Вариантами лечения пациентов с МГМ являются: нейрохирургическая резекция;
радиотерапия:
-
– СРТ в режиме радиохирургии или гипофракционирования;
-
– ОВГМ;
-
4.1. Нейрохирургия
противоопухолевая лекарственная терапия; стероидная, противосудорожная терапия;
симптоматическое лечение.
Нейрохирургическую резекцию следует рассматривать у пациентов с первично выявленными или рецидивирующими симптоматическими (или асимптомными≥2,0 см в максимальном измерении) МГМ. Нейрохирургическая резекция может быть предложена пациентам с учетом следующих факторов:
-
• наличие МГМ без первично выявленного очага: нейрохирургическая резекция является оптимальным методом верификации диагноза и удаления опухоли;
-
• наличие крупных (более 2,0 см в диаметре) МГМ: нейрохирургическая резекция — оптимальной метод для обеспечения локального контроля;
-
• наличие МГМ любых размеров с симптоматикой внутричерепной гипертензии или масс-эффекта: нейрохирургическое лечение позволяет быстро редуцировать неврологическую симптоматику и улучшить состояние пациента;
-
• наличие клинических ситуаций, контроль которых невозможен с помощью других лечебных мероприятий (локальный рецидив после стереотаксической радиотерапии, симптоматический радионекроз, резистентный к проводимой лекарственной терапии).
-
4.2. Радиотерапия
Необходимым условием проведения нейрохирургической резекции является локализация метастатического очага в зонах мозга, где его удаление не сопровождается развитием/нарастанием неврологического дефицита .
Лучшие показатели общей выживаемости достигаются у пациентов с функциональным статусом по шкале Карновского≥80% и контролем экстракраниального опухолевого процесса.
При наличии первично выявленных или рецидивирующих МГМ целесообразно проводить нейрохирургическую резекцию в комбинации со стереотаксической радиотерапией (предоперационная радиохирургия или послеоперационная СТР ложа удаленного метастатического очага) для снижения риска локального рецидива.
Целесообразно проведение КТ головного мозга в сочетании или без контрастирования в течение 24–48 часов после нейрохирургической резекции для диагностики послеоперационного кровоизлияния.
Радиотерапию следует рассматривать у пациентов с первично выявленными МГМ в самостоятельном варианте лечения или как компонент комбинированного/комплекс-ного варианта лечения, а также у пациентов с интракраниальной прогрессией (локальные рецидивы или развитие новых (дистантных) метастазов) после ранее проведенного лечения.
Вариантами радиотерапии МГМ являются СРТ и ОВГМ. СРТ может быть реализована в режиме радиохирургии (1 фракция) или гипофракционирования (от 3 до 7 фракций) и используется в самостоятельном варианте лечения или в комбинации с ОВГМ или нейрохирургией.
-
• Не рекомендуется проведение радиотерапии у пациентов с бессимптомными МГМ, низким функциональным статусом (индекс Карновского≤50%) или у пациентов
с индексом Карновского<70%, экстракраниальной прогрессией болезни и отсутствием резервов лекарственной противоопухолевой терапии. Проведение радиотерапии противопоказано при наличии симптомов внутричерепной гипертензии, неконтролируемом судорожном синдроме и неконтролируемых психических расстройствах.
Выбор режима фракционирования СРТ зависит от дозовой нагрузки на нормальную ткань мозга, которая определяется количеством и размерами МГМ. СРТ в режиме радиохирургии может быть реализована при условии, что при подведении очаговой дозы 20–24 Гр объем нормальной ткани мозга, облученной дозой 12 Гр, не превышает 10 см 3 (V12Гр≤10 см 3 ). Для любых МГМ, при которых V12Гр>10 см 3 , показано проведение СРТ в режиме гипофракционирования.
У пациентов с наличием от 1 до 4 метастазов в головном мозге и благоприятным прогнозом общей выживаемости (≥6 мес.) рекомендуется:
-
• СРТ в режиме радиохирургии при наличии метастатических очагов в головном мозге максимальным размером 2 см и меньше
СРТ в режиме радиохирургии является оптимальной лечебной опцией у пациентов с очагами<2 см в максимальном измерении и реализуемой очаговой дозой радиации 20–24 Гр. У пациентов с очагами≥2 см в максимальном измерении СРТ в режиме радиохирургии может быть реализована при условии, что при очаговой дозе радиации не ниже 20 Гр, объем нормальной ткани мозга, облученной дозой 12 Гр не превышает 10 см 3 (V 12Гр ≤10 см 3 ) • СРТ в режиме гипофракционирования при наличии: метастатических очагов в головном мозге с максимальным диаметром 2 см и больше и противопоказаний к нейрохирургическому лечению.
СРТ в режиме гипофракционирования является оптимальной опцией у пациентов с наличием очагов≥2 см в максимальном измерении либо при наличии очагов, локализованных в критических структурах мозга (зрительные тракты, ствол головного мозга и пр.). Рекомендуемыми режимами гипофракционирования являются 3 ежедневные фракции по 8 Гр/9 Гр, 5 фракций по 6 Гр и 7 фракций по 5 Гр. При проведении гипофракционирования необходимо учитывать, что объем 10 см3 нормальной ткани мозга не должен быть облучен дозой выше 19,2 Гр (за 3 фракции), 23,4 Гр (за 5 фракций) и 26,5 Гр (за 7 фракций). • У пациентов с наличием от 5 и более МГМ и благоприятным прогнозом общей выжи ваемости рекомендуется СРТ в режиме радиохирургии и/или гипофракционирования и/или ОВГМ.
У пациентов с множественными МГМ, благоприятным прогнозом общей выживаемости СРТ в режиме радиохирургии или радиотерапии в самостоятельном варианте лечения является предпочтительной лечебной опцией. Необходимо регулярное проведение МРТ головного мозга (1 раз в 2–3 месяца) для раннего выявления интракраниальной прогрессии и проведения повторного локального лечения (нейрохирургия и/или радиотерапия).
-
• ОВГМ в самостоятельном варианте лечения рекомендуется проводить у пациентов с прогрессирующим множественным, диссеминированным или лептоменингиальным поражением головного мозга, при котором невозможно проведение СРТ и нейро-
- хирургии, а также в случае неэффективности противоопухолевой лекарственной терапии и отсутствия резервов системного лечения.
Стандартные суммарные дозы ОВГМ — 20 Гр (за 5 ежедневных фракций), 30 Гр (за 10 ежедневных фракций), 37,5 Гр (за 15 ежедневных фракций).
У пациентов с благоприятным прогнозом общей выживаемости рекомендуется ОВГМ на фоне приема мемантина и с дозовой разгрузкой гиппокампа (при условии, что метастазы в пределах 5 мм от гиппокампа отсутствуют).
Для пациентов с неблагоприятным прогнозом ОВ (<6 мес.) и симптоматическими МГМ возможно проведение короткого курса ОВГМ — 20 Гр за 5 фракций.
У пациентов с благоприятным прогнозом общей выживаемости после нейрохирургической резекции рекомендуется послеоперационная СРТ ложа удаленных очагов в режиме радиохирургии или гипофракционирования.
СРТ в режиме радиохирургии или гипофракционирования после нейрохирургической операции проводится в интервале от 4 до 6 недель после операции.
У пациентов, которым планируется нейрохирургическая резекция МГМ, предоперационная радиохирургия может быть альтернативой послеоперационной СРТ в режиме радиохирургии или гипофракционирования.
У пациентов с неблагоприятным прогнозом общей выживаемости рекомендуется проведение симптоматического лечения.
В отдельных клинических ситуациях возможно проведение локального лечения (нейрохирургия и/или радиотерапия) с целью коррекции неврологических расстройств. Решение о проведении локального лечения у пациентов с неблагоприятным прогнозом общей выживаемости должно приниматься на мультидисциплинарном консилиуме сучетом потенциальной клинической эффективности и возможных лечебных рисков для пациента.
У пациентов с крупными МГМ (или очагами любого размера с перифокальным отеком), у которых планируется проведение противоопухолевой лекарственной терапии препаратами с установленной эффективностью в ЦНС, рекомендуется проведение предварительной локальной терапии (нейрохирургия или СРТ).
У пациентов с крупными МГМ (или МГМ любого размера с перифокальным отеком) BRAF позитивной меланомы, требующей назначения стероидной терапии, при отсутствии угрожающих жизни неврологических расстройств и невозможности проведения локального лечения (нейрохирургия, СРТ), возможно проведение комбинированной таргетной терапии BRAF и MEK ингибиторами на первом этапе лечения.
-
4.3. Противоопухолевая лекарственная терапия
Противоопухолевое лекарственное лечение у пациентов с впервые выявленными МГМ является основным лечением, цель которого заключается в обеспечении контроля экстракраниальных очагов, снижении риска развития новых МГМ, а также лечении уже существующих МГМ в отдельных клинических ситуациях. Противоопухолевое лекарственное лечение МГМ проводится по схемам, рекомендованным для лечения соответствующего первичного опухолевого очага с учетом биологических характеристик опухоли.
В случае выявления МГМ на фоне отсутствия, стабилизации (или регрессии) экстракраниальных метастазов вследствие эффективной противоопухолевой лекарственной терапии целесообразно проведение локального лечения МГМ в соответствии с текущими клиническими рекомендациями и сохранение режима проводимой противоопухолевой лекарственной терапии.
В случае выявления МГМ (или появления новых (дистантных) метастатических очагов в головном мозге) и прогрессирования экстракраниальных метастазов на фоне проведения противоопухолевой лекарственной терапии рекомендуется изменение режима системного лечения. Предпочтение отдается препаратам с установленной противоопухолевой эффективностью в головном мозге.
При наличии у пациентов небольших по размеру МГМ (до 2 см в максимальном измерении), без перифокального отека рекомендуется проведение только системной противоопухолевой терапии (ХТ, таргетная терапия, иммунотерапия) в первой линии лечения в следующих клинических ситуациях:
-
• при наличии метастазов НМРЛ с мутацией EGFR: рекомендуется назначение оси-мертиниба;
-
• при наличии метастазов НМРЛ с транслокацией АLK: рекомендуется назначение лорлатиниба, алектиниба, бригатиниба или церитиниба;
-
• при наличии PD-L1 позитивных метастазов НМРЛ (при отсутствии EGFR мутации и ALK транслокации): рекомендуется назначение монотерапии пембролизумабом при условии, что экспрессия PD-L1 ≥50%, и пембролизумаба в комбинации с пеме-трекседом и препаратами платины при наличии экспрессии PD-L1 <50%;
-
• при наличии асимптомных метастазов меланомы в головном мозге рекомендуется назначение комбинации ипилимумаба и ниволумаба (для всех пациентов, независимо от статуса BRAF) или комбинации «дабрафениб+траметиниб» или «атезоли-зумаб+вемурафениб+кобиметиниб» при наличии мутации BRAF-V600Е в опухоли (для пациентов с симптомными метастазами меланомы в головном мозге или с лептоменингеальным поражением);
-
• при наличии метастазов HER2-положительного РМЖ рекомендуется назначение доцетаксела, трастузумаба и пертузумаба в первой линии лечения, трастузумаба эмтанзина (во второй линии лечения). В дальнейшем возможно проведение терапии трастузумабом в сочетании с химиотерапией, или комбинации лапатиниба и капе-цитабина.
В других клинических ситуациях противоопухолевое лекарственное лечение может быть назначено:
-
• у пациентов с МГМ тройного негативного РМЖ, прогрессирующими после локального лечения, рекомендуется назначение капецитабина, эрибулина, карбоплатина, бевацизумаба
-
• у пациентов с МГМ люминального HER-2-негативного рака рекомендуется сочетание гормонотерапии и ингибиторов CDK 4/6 (абемациклиб, палбоциклиб, рибоциклиб).
Упациентов с интракраниальной прогрессией с исчерпанными резервами локального лечения предпочтение отдается препаратам с установленной противоопухолевой эффективностью в головном мозге.
Таблица 1. Рекомендуемые схемы лекарственной терапии с установленной активностью в отношении метастазов в головном мозге.
|
Метастазы меланомы |
|
|
вемурафениб + кобиметиниб |
вемурафениб 960 мг 2 раза в сутки внутрь ежедневно + кобиметини-бом 60 мг/сут. в 1–21-й дни каждые 4 нед., до прогрессирования или неприемлемой токсичности |
|
дабрафениб + траметиниб |
дабрафениб 150 мг 2 раза в сутки внутрь ежедневно + траметиниб 2 мг/сут. внутрь ежедневно, до прогрессирования или неприемлемой токсичности |
|
атезолизумаб + вемурафениб + кобиметиниб |
Первый цикл — вемурафениб 960 мг 2 раза в сутки внутрь ежедневно + кобиметиниб 60 мг/сут. в 1–21-й дни каждые 4 нед., далее — вему-рафениб 720 мг 2 раза в сутки внутрь ежедневно + кобиметиниб 60 мг/сут. в 1–21-й дни каждые 4 нед. + атезолизумаб — 840 мг внутривенно каждые 2 недели, до прогрессирования или неприемлемой токсичности |
|
ипилимумаб + ниволумаб |
ипилимумаб 3 мг/кг в/в в 1-й день 1 раз в 3 нед. 4 введения + ниволумаб 1 мг/кг в/в в 1-й день 1 раз в 3 нед. 4 введения; далее ниволумаб 240 мг в/в каждые 2 нед. (или 480 мг в/в каждые 4 нед.) до прогрессирования или неприемлемой токсичности |
|
темозоломид + цисплатин (при отсутствии BRAF мутации и наличии симптомных МГМ и невозможности проведения СРТ) |
темозоломид 150 мг/м²/сутки внутрь в 1–5-й дни + цисплатин 20 мг/м²/сутки, в/в, в 1–5-й дни, каждые 4 нед., до 6 циклов |
|
В случае одновременного проведения радиотерапии МГМ для снижения риска постлучевых осложнений рекомендуется прервать прием BRAF/MEK ингибиторов не менее чем за 3 дня до начала радиотерапии и возобновить не ранее чем через 3 дня после ее окончания |
|
|
Метастазы МРЛ |
|
|
этопозид + карбоплатин |
этопозид 100 мг/м² в/в в 1–3-й дни + карбоплатин AUC5 в/в в 1-й день каждые 3 нед., до 6 курсов |
|
этопозид + цисплатин |
этопозид 120 мг/м² в/в в 1–3-й дни + цисплатин 80 мг/м 2 в/в в 1-й день каждые 3 нед., до 6 курсов |
|
иринотекан + и цисплатин |
иринотекан 65 мг/м² в/в в 1-й и 8-й дни + цисплатин 75 мг/м 2 в/в в 1-й день каждые 3 нед., до 6 курсов |
|
топотекан |
топотекан 1,5 мг/м²/сутки, в/в в 1–5-й дни каждые 3 нед., до 6 курсов |
|
Топотекан — препарат второй линии терапии. Профилактическое ОВГМ (разовая доза 2,5 Гр 10 фракций) проводится при отсутствии МГМ, после 4–6 курсов противоопухолевой лекарственной терапии, в случае достижения полной или частичной регрессии. |
|
|
Метастазы НМРЛ (аденокарцинома с наличием активирующих мутаций (транслокаций) EGFR/ALK/ROS1) |
|
|
осимертиниб (есть мутация EGFR) |
осимертиниб 80 мг/сут. внутрь ежедневно до прогрессирования или неприемлемой токсичности (I или II линии лечения при прогрессировании на фоне ингибиторов EGFR (гефитиниб, эрлотиниб, афатиниб) и наличии в опухоли мутации T790M) |
|
гефитиниб (есть мутация EGFR) |
гефитиниб 250 мг/сут. внутрь ежедневно до прогрессирования или неприемлемой токсичности |
|
эрлотиниб (есть мутация EGFR) |
эрлотиниб 150 мг/сут. внутрь ежедневно до прогрессирования или неприемлемой токсичности |
|
афатиниб (есть мутация EGFR) |
афатиниб 40 мг/сут. внутрь ежедневно до прогрессирования или неприемлемой токсичности |
|
алектиниб (есть транслокация ALK/ROS1) |
алектиниб 1200 мг/сут. внутрь ежедневно до прогрессирования или неприемлемой токсичности (I или II линии лечения при прогрессировании на фоне ингибиторов ALK (кризотиниб, церитиниб) |
|
лорлатиниб (есть транслокация ALK/ROS1) |
лорлатиниб 100 мг/сут. внутрь ежедневно до прогрессирования или неприемлемой токсичности (I или II линии лечения при прогрессировании на фоне ингибиторов ALK кризотиниба, церитиниба) |
|
церитиниб (есть транслокация ALK/ROS1) |
церитиниб 450 мг/сут. внутрь ежедневно до прогрессирования или неприемлемой токсичности |
|
кризотиниб (есть транслокация ALK/ROS1) |
кризотиниб 250 мг/сут. внутрь ежедневно до прогрессирования или неприемлемой токсичности |
|
НМРЛ с мутациями в 19, 21 экзонах: осимертиниб более эффективен, чем ингибиторы тирозинкиназы EGFR первого поколения в I и II линиях терапии пациентов с метастазами НМРЛ в головном мозге. Афатиниб является препаратом выбора при редких мутациях в гене EGFR, в том числе в 18 экзоне и при некоторых вариантах мутаций в 20 экзоне. Алектиниб и лорлатиниб в исследовании III фазы продемонстрировали более высокую эффективность по сравнению с кризотинибом и является препаратом выбора при ALK-позитивном раке лёгкого с МГМ в I и II линиях терапии. Иммунотерапия ограниченно эффективна у пациентов с наличием активирующих мутаций |
|
|
НМРЛ: плоскоклеточный рак |
|
|
Противоопухолевая лекарственная терапия проводится в соответствии с Клиническими рекомендациями по лечению НМРЛ + локальное лечение МГМ в соответствии с текущими Клиническими рекомендациями по лечению пациентов с МГМ |
|
|
Метастазы РМЖ |
|
|
Лечение в соответствии с Клиническими рекомендациями по лечению РМЖ + локальное лечение МГМ в соответствии текущими Клиническими рекомендациями по лечению пациентов с МГМ |
|
|
Метастазы рака почки |
|
|
Лечение в соответствии с клиническими рекомендациями по лечению рака почки + локальное лечение МГМ в соответствии текущими Клиническими рекомендациями по лечению пациентов с МГМ |
|
-
• Частота объективных ответов при применении сунитиниба в самостоятельном варианте лечения составляет около 12%; применение рецепторных ингибиторов тирозинкиназ VEGF может сопровождаться более высоким риском интракраниальных кровоизлияний
-
• Иммунотерапия обладает ограниченной эффективностью при метастазах рака почки в головном мозге, частота объективных ответов в монотерапии не превышает 11–12%, однако комбинация «ниволумаб + ипилимумаб» демонстрирует более высокую частоту интракраниальных ответов (32%)
-
• Имеются клинические данные об увеличении общей выживаемости пациентов с метастазами рака почки в головном мозге в случае комбинации таргетной терапии и стереотаксической ЛТ.
Метастазы колоректального рака
Лечение в соответствии с Клиническими рекомендациями по лечению метастатического колоректального рака + локальное лечение МГМ в соответствии текущими Клиническими рекомендациями по лечению МГМ
-
• Следует включить в режим противоопухолевой лекарственной терапии МКА (анти-VEGF или анти-EGFR) согласно текущим Клиническим рекомендациям по проведению противоопухолевой лекарственной терапии метастатического колоректального рака
-
• Целесообразно определение HER2-статуса в опухоли с последующим решением вопроса о целесообразности анти-HER2-блокады
-
• Целесообразно определение MSI в опухоли с последующим решением вопроса о целесообразности иммунотерапии (блокаторы PD-1 ± CTLA4).
-
4.4. Стероидная, противоотечная и противосудорожная терапия
Целью терапии ГКС является временное уменьшение степени выраженности симптомов, связанных с повышением внутричерепного давления вследствие перифокального отека вокруг метастатических очагов.
-
• Не рекомендуется проведение терапии ГКС у пациентов с МГМ без клинических симптомов и без проявлений масс-эффекта.
-
• У пациентов с МГМ и умеренно выраженными симптомами, связанными с масс-эффектом, рекомендуется проведение терапии ГКС (дексаметазон) для ликвидации или временного облегчения симптомов, связанных с повышением внутричерепного давления и вторичным отеком мозга. Доза ГКС должна быть минимально достаточной для купирования симптомов и обычно составляет 4–8 мг/сут.
-
• У пациентов с МГМ и выраженными симптомами, связанными с масс-эффектом, рекомендуется назначение ГКС (дексаметазон) для временного облегчения симптомов, связанных с повышением внутричерепного давления и вторичным отеком мозга. Начальная доза дексаметазона — от 8–12 мг/сут.
ГКС рекомендуется принимать внутрь или вводить парентерально (в/м) 1–2 раза в сутки с максимальными дозами в утренние часы и последним приемом не позднее 16–17 часов.
Дозу дексаметазона необходимо снижать постепенно, в течение 2 недель и более, основываясь на клинических симптомах и степени выраженности побочных эффектов стероидной терапии; прием ГКС необходимо сочетать с приемом гастропротекторов, с контролем гликемии. Возможно дополнительное назначение осмотических диуретиков (под контролем водно-электролитного баланса).
Рекомендуется проведение терапии бевацизумабом при наличии стойкого или нарастающего симптоматического отёка и/или радионекроза, резистентного к терапии ГКС.
При проведении иммунотерапии (блокаторы CTLA4, PD1, PD-L1) рекомендуется не превышать дозу дексаметазона 4 мг в сутки. Альтернативным вариантом противо-отечной терапии в этой клинической ситуации является назначение бевацизумаба. Доза бевацизумаба составляет 5 мг/кг каждые 2 недели или 7,5 мг/кг каждые 3 недели, не менее 3 месяцев лечения, лечение проводится до регресса неврологических симптомов или улучшения рентгенологической картины.
В случае наличия у пациентов эпилептического синдрома (в т. ч. в анамнезе) рекомендуется назначение противосудорожных препаратов.
Рекомендуемый алгоритм лечения пациентов с МГМ представлен на рис. 1.

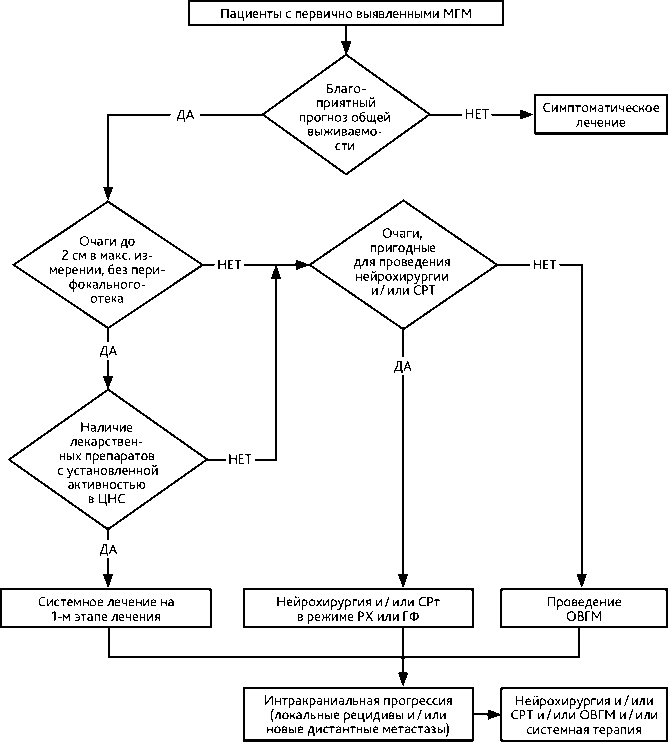
МГМ — метастазы в головном мозге, ЦНС — центральная нервная система, СРТ — стереотаксическая радиотерапия, РХ — стереотаксическая радиотерапия в режиме радиохирургии, ГФ — стереотаксическая радиотерапия в режиме гипофракционирования, ОВГМ — облучение всего головного мозга.
Рисунок 1. Рекомендуемый алгоритм лечения пациентов с метастатическим поражением головного мозга.
5. ЛЕПТОМЕНИНГЕАЛЬНОЕ ПОРАЖЕНИЕ
Метастатическое лептоменингеальное поражение (ЛМП) диагностируется приблизительно у 10% пациентов с распространенным онкологическим заболеванием. Типичными клиническими проявлениями ЛМП у онкологических пациентов являются неврологические симптомы со стороны черепно-мозговых нервов, корешковые боли, синдром конского хвоста, нарушения слуха и зрения, сенсомоторная симптоматика и другие. У пациентов с рентгенологической картиной ЛМП рекомендуется исследование спинномозговой жидкости для цитологического подтверждение диагноза ЛМП.
-
• У пациентов с метастатическим поражением оболочек головного мозга, благоприятным прогнозом общей выживаемости, без выраженного неврологического дефицита рекомендуется проведение ОВГМ.
Возможно проведение СРТ в режиме радиохирургии или гипофракционирования по поводу ЛМП, которое обуславливает неврологическую симптоматику. ОВГМ применяется при прогрессирующем на фоне противоопухолевой лекарственной терапии распространённом ЛМП.
В случае ЛМП вопрос о проведении интратекальной противоопухолевой лекарственной терапии рассматривается на мультидисциплинарном консилиуме у пациентов с метастазами РМЖ в головной мозг (метотрексат).
У пациентов HER-2 положительным раком молочной железы возможно проведение интратекальной терапии трастузумабом (по 150 мг интратекально 1 раз в 3 недели), с частотой объективных ответов до 66,6% и клиническим улучшением состояния у 77,7% пациентов, с увеличением времени до прогрессирования болезни с 6,4 мес. до 11,1 мес.
Схема интратекальной терапии метотрексатом: метотрексат — по 15 мг интра-текально×2 раза в неделю (в первый месяц терапии), далее — по 15 мг интратекально 1 раз в неделю (во второй месяц терапии), далее — поддерживающая терапия (по 15 мг интра-текально 1 раз в 4 недели). Лечение должно проводиться в медицинских центрах, имеющих опыт проведения интратекальной ХТ.
• У пациентов с метастатическим поражением оболочек головного мозга, неблагоприятным прогнозом общей выживаемости, наличием неврологического дефицита и энцефалопатии рекомендуется проведение симптоматической терапии.
6. ПРОФИЛАКТИКА И ДИСПАНСЕРНОЕ НАБЛЮДЕНИЕ
Оценка эффективности лечения МГМ проводится по критериям RANO (табл. 2). Оценка эффекта лекарственного лечения проводится каждые 2–3 цикла ХТ или каждые 2–3 мес. таргетной/иммунной терапии.
Таблица 2. Оценка эффективности лечения пациентов с МГМ.
|
Признак |
Полный ответ |
Частичный ответ |
Стабилизация |
Прогрессия |
|
Измеряемые очаги |
Нет |
Уменьшение на 30% и более суммы наибольших размеров относительно исходного уровня |
Уменьшение менее чем на 30% или увеличение не более чем на 20% суммы наибольших размеров относительно исходного уровня |
Увеличение более чем на 20% суммы наибольших размеров относительно исходного уровня |
|
Неизмеряемые очаги |
Нет |
Стабилизация или уменьшение |
Стабилизация или уменьшение |
Увеличение |
|
Новые очаги |
Нет |
Нет |
Нет |
Есть |
|
Потребность в терапии ГКС |
Нет |
Стабилизация дозы или уменьшение |
Стабилизация дозы или уменьшение |
Не имеет значения |
|
Функциональный статус |
Стабилизация или улучшение |
Стабилизация или улучшение |
Стабилизация или улучшение |
Ухудшение |
|
Требуется для регистрации ответа |
Все признаки |
Все признаки |
Все признаки |
Любой из перечисленных признаков |
-
• Рекомендуется соблюдать следующую периодичность наблюдения после лечения по поводу МГМ: первые 1–2 года — каждые 3 мес., 3–5-й годы — 1 раз в 6 мес.
При высоком риске рецидива перерыв между обследованиями может быть сокращен. МРТ головного мозга с контрастным усилением выполняется каждые 3 мес. Обследование с целью оценки экстракраниального статуса болезни выполняется в соответствии с Клиническими рекомендациями по лечению первичного заболевания, ставшего источником метастазирования в головной мозг.


