Практические рекомендации по лекарственному лечению рака мочевого пузыря
Автор: О. А. Гладков, В. Б. Матвеев, Т. Митин, Д. А. Носов, А. М. Попов
Журнал: Злокачественные опухоли @malignanttumors
Статья в выпуске: 3S2-1 т.10, 2020 года.
Бесплатный доступ
Рак мочевого пузыря, трансуретральная резекция, внутрипузырная терапия
Короткий адрес: https://sciup.org/140254659
IDR: 140254659 | DOI: 10.18027/2224-5057-2020-10-3s2-32
Текст статьи Практические рекомендации по лекарственному лечению рака мочевого пузыря
1. КЛАССИФИКАЦИЯ И ОПРЕДЕЛЕНИЕ СТАДИИ
Стадирование рака мочевого пузыря (РМП) по системе TNM и группировка по стадиям представлены в табл. 1 и 2. Классификация применима только для рака; папиллома исключается. Гистологическое или цитологическое подтверждение диагноза обязательно. Т — первичная опухоль
Индекс (m), добавленный к категории «Т», указывает на множественные опухоли.
Индекс (is) может быть добавлен к любой категории «Т» для указания ассоциации с CIS.
N — регионарные лимфатические узлы. Регионарными лимфатическими узлами являются лимфатические узлы малого таза, расположенные ниже бифуркации общих подвздошных артерий, с включением лимфатических узлов вдоль подвздошных артерий
M — отдаленные метастазы.
Таблица 1. Классификация рака мочевого пузыря по системе TNM (8-е издание, 2017 г.)
|
Категории T, N, M |
Описание распространения опухоли |
|
Та |
Неинвазивная папиллярная карцинома |
|
Tis |
Уротелиальная CIS: «плоская опухоль» |
|
Т1 |
Слизистая до Lamina propria (субэпителиальная соединительная ткань) |
|
Т2 • Т2а • Т2b |
Мышцы мочевого пузыря Поверхностный мышечный слой (внутренняя половина мышц) Глубокий мышечный слой (наружная половина мышц) |
|
ТЗ • ТЗа • ТЗb |
Перивисцеральное распространение Микроскопическое Макроскопическое (экстрапузырная масса) |
1 Цитирование: Гладков О. А., Матвеев В. Б., Митин Т. (США), Носов Д. А., Попов А. М. Практические рекомендации по лекарственному лечению рака мочевого пузыря. Злокачественные опухоли: Практические рекомендации RUSSCO #3s2, 2020 (том 10).32
|
Категории T, N, M |
Описание распространения опухоли |
|
Т4
|
Предстательная железа, семенные пузырьки, матка, влагалище, стенка таза, брюшная стенка Предстательная железа, семенные пузырьки, матка, влагалище Стенка таза, брюшная стенка |
|
N1 |
Одиночный (перивезикальный, запирательный, внутренний и наружный подвздошный или крестцовый) |
|
N2 |
Множественные (перивезикальный, запирательный, внутренний и наружный подвздошный или крестцовый) |
|
N3 |
Общие подвздошные лимфоузлы |
|
M1
|
Отдаленные метастазы Отдаленные метастазы, ограниченные лимфатическими узлами выше уровня общей подвздошной артерии Отдаленные не лимфогенные метастазы |
Степень дифференцировки опухоли (G)
LG — низкая степень
HG — высокая степень
GX — степень дифференцировки опухоли не может быть установлена;
G1 — высокодифференцированная опухоль;
G2 — умеренно дифференцированная опухоль;
G3 — низкодифференцированная/недифференцированная опухоль.
Таблица 2. Группировка рака мочевого пузыря по стадиям
|
Стадия |
T |
N |
M |
|
0a |
Ta |
N0 |
M0 |
|
0is |
Tis |
N0 |
M0 |
|
I |
T1 |
N0 |
M0 |
|
II |
T2a, b |
N0 |
M0 |
|
IIIA |
T3a, b |
N0 |
M0 |
|
T4a |
N0 |
M0 |
|
|
T1–4a |
N1 |
M0 |
|
|
IIIB |
T1–4a |
N2, N3 |
M0 |
|
IVA |
T4b |
Любое N |
М0 |
|
Любое |
Любое N |
M1а |
|
|
IVB |
Любое |
Любое N |
M1b |
2. НЕМЫШЕЧНО-ИНВАЗИВНЫЙ РАК МОЧЕВОГО ПУЗЫРЯ (TA, T1) 2.1. Диагностика
-
• Сбор анамнеза: наличие гематурии
-
• Общий анализ крови с подсчетом лейкоцитарной формулы и количества тромбоцитов
-
• Биохимический анализ крови с определением показателей функции печени, почек, уровня ЩФ
-
• Общий анализ мочи
-
• В / в урография — предпочтительный метод выделительная КТ урография
-
• УЗИ органов брюшной полости, малого таза
-
• Фиброцистоскопия
-
• Цитологическое исследование мочи (позволяет поставить диагноз CIS).
-
2.2 Лечение немышечно-инвазивного рака мочевого пузыря
Диагноз устанавливается на основании данных морфологического исследования биоптата. В гистологическом заключении указываются морфологический подтип опухоли, глубина инвазии, степень злокачественности опухоли по шкале ВОЗ 2004 г. Важно полное и правильное выполнение биопсии. В гистологическом материале обязательно должен присутствовать подлежащий мышечный слой. Его отсутствие будет свидетельствовать о невозможности точного определения стадии заболевания.
Основным методом лечения является ТУР мочевого пузыря. Адъювантная лекарственная терапия проводится в дополнение к ТУР и позволяет снизить риск рецидива болезни. План адъювантной лекарственной терапии основывается на принадлежности опухоли к одной из групп риска (табл. 3).
Таблица 3. Группы риска при раке мочевого пузыря
|
Группы риска |
Характеристики опухоли |
|
Низкий |
Первичная солитарная опухоль Ta, G1 1 (папиллярно-уротелиальная неоплазия с низким злокачественным потенциалом (pUNLMp), папиллярно-уротелиальная карцинома низкой степени (LG)), < 3 cм, без CIS |
|
Промежуточный |
Все опухоли, не попадающие в категории низкого и высокого риска |
|
Высокий |
Наличие любого из следующих факторов:
|
1 Комбинация G1 и G2.
2 Комбинация некоторых G2 и всех G3.
Однократное внутрипузырное введение химиопрепарата проводится у больных с низким и промежуточным риском рецидива с целью предотвращения имплантации опухолевых клеток и, по данным мета-анализов, позволяет снизить риск рецидива на 11,7–13%. В качестве противоопухолевого средства для этой цели предпочтительно использовать митомицин С в дозе 40 мг.
Дополнительная адъювантная внутрипузырная терапия вакциной BCG показана больным промежуточного и высокого риска, что позволяет снизить риск рецидива болезни на 44% по сравнению с ТУР без адъювантной лекарственной терапии (рис. 1).
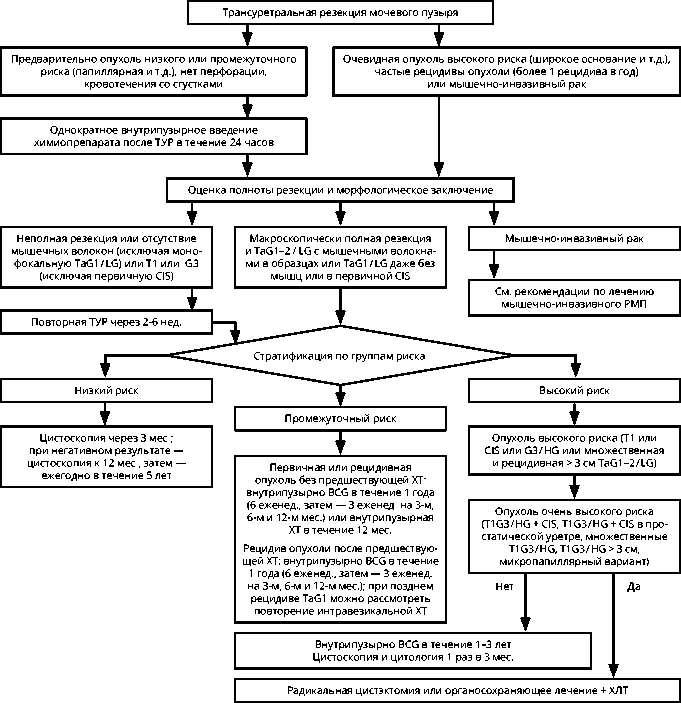
Рисунок 1. Алгоритм лечения и последующего наблюдения больных мышечно-неинвазивным раком мочевого пузыря.
Оптимальным режимом внутрипузырного введения вакцины BCG являются 6 еженедельных инстилляций с последующим переходом на поддерживающую терапию:
-
• при промежуточном риске рецидива: 3 еженедельных введения препарата на 3, 6 и 12-м месяцах;
-
• при высоком риске рецидива: 3 еженедельных введения препарата на 3, 6, 12, 18, 24, 30 и 36-м месяцах.
-
2.3. Наблюдение
Необходимо учитывать возможные осложнения внутрипузырного введения вакцины BCG и дальнейшей лечебной тактики (табл. 4).
Таблица 4. Осложнения, индуцированные внутрипузырной иммунотерапией вакциной БЦЖ
|
Мочеполовые осложнения |
Инициальная терапия |
Вспомогательное лечение |
Адаптация БЦЖ |
|
Цистит (непереносимое или болезненное опорожнение мочевого пузыря > 48 часов) |
Спазмолитики, антихолинергические препараты или НПВС |
Антибактериальные препараты в случае диагностики бактериального цистита |
Воздержаться от введения до разрешения симптомов и завершения антибактериальной терапии |
|
Контрактура мочевого пузыря |
Гидродистенция мочевого пузыря |
Системные стероиды; в исключительных случаях — аугментация мочевого пузыря или цистэктомия |
Прекратить введение для увеличения емкости мочевого пузыря |
|
Изъязвление мочевого пузыря |
Изониазид 300 мг и рифампицин 600 мг ежедневно в течение 6 месяцев |
Нет |
Воздержаться от введения до разрешения очагов в мочевом пузыре и получения БЦЖ-негативной мочи |
|
Гранулематозный баланит |
Различные комбинации изониазида, этамбутола, рифампицина от 6 до 12 месяцев |
Нет |
Воздержаться от введения до разрешения очагов |
|
Туберкулёзный эпидидимоорхит |
Изониазид 300 мг и рифампицин 600 мг ежедневно в течение 3–6 месяцев |
Для изониазид резистентных — фторохинолоны или антитуберкулёзные аминогликозиды. Для очагов, рефрактерных к антитуберкулёзной терапии,— ревизия мошонки и эпидидимо-орхиэктомия |
Полная отмена БЦЖ |
|
Симптоматический простатит |
Изониазид 300 мг и рифампицин 600 мг ежедневно в течение 3–6 месяцев |
Антибиотики (фторхинолоны) по показаниям; хирургическое дренирование абсцессов; биопсия при неэффективности лекарственной терапии |
Полная отмена БЦЖ |
|
Мочеполовые осложнения |
Инициальная терапия |
Вспомогательное лечение |
Адаптация БЦЖ |
|
Уретральная обструкция |
Изониазид 300 мг и рифампицин 600 мг ежедневно в течение 3–6 месяцев |
Установка временного дренажа (уретральное стентирование или чрескожная нефростомия) при развитии гидронефроза несмотря на консервативное лечение |
Прекратить введение в случае появления гидронефроза; можно возобновить после разрешения осложнения |
|
Инфекция почки |
Изониазид 300 мг, рифампицин 600 мг и этамбутол 1200 мг ежедневно в течение 6 месяцев |
Биопсия при отсутствии ответа на лекарственное лечение |
Полная отмена БЦЖ |
Наблюдение после лечения имеет целью раннюю диагностику рецидива и различается в зависимости от степени риска развития рецидива:
• низкий риск рецидива: в первый год после ТУР — цистоскопия через 3 и 12 мес., далее — ежегодно в течение 5 лет, затем — по клиническим показаниям;
• умеренный риск рецидива: в первый год после ТУР — цистоскопия через 3, 6 и 12 мес., во второй год — каждые 6 мес., далее — ежегодно в течение 5 лет, затем — по клиническим показаниям;
• высокий риск рецидива: в первый год после ТУР — цистоскопия через 3, 6 и 12 мес., КТ выделительная урография — через 12 мес., во второй год — цистоскопия каждые 6 мес., далее — ежегодно в течение 5 лет, затем — по клиническим показаниям, ретроградная пиелография — каждые 12–14 мес. в течение 10 лет.
• цитологическое исследование мочи
3. МЫШЕЧНО-ИНВАЗИВНЫЙ ЛОКАЛИЗОВАННЫЙ РАК МОЧЕВОГОПУЗЫРЯ СТАДИИ II (T2N0M0) И СТАДИИ IIIA (T3–T4AN0, T1–T4AN1M0)
3.1. Диагностика
-
• Сбор анамнеза
-
• Общий анализ крови с подсчетом лейкоцитарной формулы и количества тромбоцитов
-
• Биохимический анализ крови с определением показателей функции печени, почек, уровня ЩФ
-
• Общий анализ мочи
-
• В / в КТ урография (при невозможности — в / в урография)
-
• Фиброцистоскопия
-
• УЗИ органов брюшной полости, малого таза; КТ / МРТ органов брюшной полости, малого таза с в/в контрастированием (лимфатические узлы малого таза > 8 мм и абдоминальные узлы > 10 мм при измерении наименьшего диаметра следует относить к патологически увеличенным)
-
• R-графия органов грудной клетки; КТ органов грудной клетки
-
• ТУР мочевого пузыря
-
• Сцинтиграфия костей и МРТ головного мозга выполняются при наличии симптомов, указывающих на возможное наличие опухолевых очагов в этих органах
-
• Рутинное использование ПЭТ-КТ не рекомендуется
-
3.2. Лечение
-
3.2.1. Общие принципы лечения мышечно-инвазивного рака мочевого пузыря
-
КТ и МРТ могут быть использованы для оценки локальной инвазии, но не позволяют точно установить наличие микроскопической инвазии перивези-кальной жировой клетчатки для проведения дифференциальной диагностики между T2 и T3a стадиями. Главной целью КТ или МРТ является диагностика болезни в стадии T3b и выше и оценка состояния тазовых лимфатических узлов, а также других органов для исключения висцеральных метастазов. МРТ исследование обладает более высоким контрастным разрешением для мягких тканей, чем КТ. Точность МРТ при стадировании первичной опухоли выше на 10–33 %, чем КТ.
Радикальная цистэктомия с тазовой лимфодиссекцией в сочетании или без неоадъювантной ХТ является наиболее часто используемым во многих странах вариантом лечения при T2–4aN0M0. Оганосохраняющий подход с сочетанной ХЛТ является опцией для пациентов, которые не являются кандидатами для радикальной цистэктомии или для тех, кто желает сохранить мочевой пузырь и/или избежать эректильную дисфункцию (среди мужчин). Оба метода считаются стандартными альтернативными вариантами лечения. Радикальная цистэктомия и облучение мочевого пузыря с сочетанной ХТ обеспечивают 5-летнюю выживаемость около 50%. Роль адъювантной ХТ не доказана из-за отсутствия крупных валидирующих клинических исследований, однако адъювантная ХТ может быть использована после радикальной цистэктомии при pT3-T4 или pN +у пациентов, которым не была проведена неоадъювантная ХТ, а также после органосохраняющего лечения с сочетанной ХЛТ. Роль адъювантной ЛТ после радикальной цистэктомии не доказана и в настоящее время не рекомендована к использованию. Неоадъювантная ЛТ не влияет на выживаемость и также не должна проводиться перед радикальной цистэктомией. Неоадъювантная ХТ (перед радикальной цистэктомией) улучшает 5-летнюю выживаемость на 5–8% в абсолютном исчислении и снижает риск смерти на 16%. Данные комбинированных исследований показывают, что наилучшие ре- зультаты достигаются в подгруппе пациентов с T2b–T3b. Оптимальным следует считать проведение 3–4 циклов ХТ с использованием платиносодержащих схем (MVAC, CG) при сохранной функции почек (клиренс креатинина > 60 мл/мин.) и общем удовлетворительном состоянии (табл. 5). Рекомендуемые режимы нео- и адъювантной ХТ РМП представлены в табл. 5.
Таблица 5. Рекомендуемые режимы нео- и адъювантной ХТ рака мочевого пузыря
|
Название |
Режим введения химиопрепаратов |
|
CG |
Цисплатин 70 мг / м2 в / в в 1-й день + гемцитабин 1000 мг / м2 в / в в 1-й, 8-й и 15-й дни каждые 4 нед. |
|
MVAC |
Метотрексат 30 мг / м2 в / в в 1-й, 15-й и 22-й дни + винбластин 3 мг / м2 в / в во 2-й, 15-й и 22-й дни + доксорубицин 30 мг / м2 в / в во 2-й день + цисплатин 70 мг / м2 в / в во 2-й день каждые 4 нед. |
|
MVAC (высокие дозы) |
Метотрексат 30 мг / м2 в / в в 1-й день + винбластин 3 мг / м2 в / в во 2-й день + доксорубицин 30 мг / м2 в / в во 2-й день + цисплатин 70 мг / м2 в / в во 2-й день + филграстим 5 мкг / кг п / к в 4–10-й дни каждые 2 нед. |
|
CMV 1 |
Метотрексат 30 мг / м2 в / в в 1-й, 8-й дни + винбластин 4 мг / м2 в / в в 1-й, 8-й дни + цисплатин 100 мг / м2 в / в во 2-й день + кальция фолинат 15 мг в / в или перорально каждые 6 часов № 4 во 2-й и 9-й дни каждые 4 нед. |
1 Режим / препарат зарегистрирован в РФ, но не входит в клинические рекомендации, одобренные Минздравом РФ.
Не рекомендуется проводить неоадъювантную ХТ с карбоплатином, так как в настоящее время отсутствуют данные об эффективности этих комбинаций. Имеются ограниченные ретроспективные данные об эффективности неоадъювантной ХТ у больных не уротелиальной карциномой. Пациенты с нейроэндокринной опухолью имели улучшение общей выживаемости от проведения ХТ цисплатином и этопозидом, в то время как в случаях микро-папиллярной и саркоматоидной дифференциации и аденокарциномы было найдено снижение частоты внеорганных метастазов, но не отмечено улучшения общей выживаемости. Пациенты с плоскоклеточной карциномой не получали пользы от неоадъювантной ХТ.
Органосохраняющий подход на базе ЛТ малого таза является международно принятой альтернативой радикальной цистэктомии. Поскольку после органосохраняющего лечения вероятность местного рецидива достигает 30%, пациенты должны наблюдаться каждые 2–3 мес. с выполнением цистоскопии и радикальной сальважной цистэктомии в случае рецидива мышечно-инвазивного РМП. При таком подходе органосохраняющее лечение не должно увеличить риск смертности от РМП. Минусом сальважной цистэктомии является ограничение формирования ортотопических континентных мочевых резервуаров. Для наибольшей эффективности органосохраняющее лечение включает максимальную ТУР (резекция сквозь уровень мышцы до жирового покрова и максимальная резекция всей видимой опухоли) с последующей сочетанной ХЛТ либо ЛТ с использованием модификаторов гипоксии (кар-боген/никотинамид). С учетом экстраполяции результатов неоадъювантной
ХТ при радикальной цистэктомии, неоадъювантная ХТ также возможна до органосохраняющего лечения с ЛТ/ХЛТ.
Таблица 6. Рекомендуемые режимы одновременной химиолучевой терапии рака мочевого пузыря
|
Режим химиотерапии |
Режим лучевой терапии |
|
5-фторурацил 500 мг / м2 / сут. в / в в 1–5-й и 16–20-й дни + митомицин С 12 мг / м2 в / в в 1-й день 1 |
СОД 55 Гр (20 фракций) или 64 Гр (32 фракции) |
|
Цисплатин 100 мг / м2 в / в в 1-й, 15-й, 29-й дни 1 |
СОД 60–66 Гр (30–33 фракции), 6 нед. |
|
Цисплатин 40 мг / м2 в / в еженедельно, 6 введений 1 |
СОД 60–66 Гр (30–33 фракции), 6 нед. |
|
Гемцитабин 27 мг / м2 в / в 1-й и 4-й дни каждой недели (интервал не менее 72 часов) 1 |
СОД 60–66 Гр (30–33 фракции), более 4 нед. |
|
Паклитаксел 50 мг / м2 в / в в 1-й, 8-й, 15-й дни + цисплатин 15 мг / м2 в / в в 1–3-й, 8–10-й и 15–17-й дни 1 |
ЛТ два раза в день, СОД 64,3 Гр |
|
Цисплатин 15 мг / м2 в / в в 1–3-й, 8–10-й и 15–17-й дни + 5-фторурацил 400 мг / м2 в / в в 1–3-й, 8–10-й и 15–17-й дни 1 |
ЛТ два раза в день, СОД 64,3 Гр |
1 Режим / препарат зарегистрирован в РФ, но не входит в клинические рекомендации, одобренные Минздравом РФ.
Замена цисплатина на карбоплатин не рекомендуется из-за отсутствия доказательств равной эффективности. Режим модификации гипоксии при одновременной ЛТ РМП: карбоген (2% CO 2 и 98% O 2 ) со скоростью 15 л/мин., начинается за 5 мин. до ЛТ и продолжается в течение ЛТ. Никотинамид назначается в дозе 60 мг/кг перорально за 1,5–2 часа до фракции ЛТ. У пациентов, имеющих токсические реакции (тошнота, головные боли), доза никотинамида может быть редуцирована до 40 мг/кг или введение препарата может быть прекращено.
3.3. Наблюдение
3.3.1. После радикальной цистэктомии: клинический осмотр, общий и биохимический анализы крови; КТ органов брюшной полости, малого таза должны проводиться через 3 и 12 мес. в течение 1 года, далее — в течение 5 лет ежегодно, в последующие 5 лет показано ежегодное УЗИ почек.
3.3.2. Для пациентов после органосохраняющего лечения: клинический осмотр, общий и биохимический анализы крови, цистоскопия; КТ органов брюшной полости, малого таза должны проводиться каждые 3 мес. в течение 1 года, далее — в течение 5 лет ежегодно (цистоскопия — каждые 6 мес.), в последующие 5 лет показано ежегодное УЗИ почек.
4. МЕСТНО-РАСПРОСТРАНЕННЫЙ РАК МОЧЕВОГО ПУЗЫРЯ СТАДИЯ IIIB (T1–T4A N2–3 M0) ИЛИ IVA (T4B N0–3 M0, T1–4B N0–3 M1A)
5. МЕТАСТАТИЧЕСКИЙ РАК МОЧЕВОГО ПУЗЫРЯ СТАДИЯ IVB (T1–4B, N0–3, M1B)
5.1. Лечение
Наблюдение после лечения имеет целью раннюю диагностику рецидива и способствует выявлению больных, которым могут быть выполнены «спасительные» варианты терапии.
При РМП IIIB и IVA стадий рекомендуется либо сочетанная ХЛТ, либо ХТ с последующей оценкой ответа с выполнением консолидирующей локальной терапии (радикальной цистэктомии либо ХЛТ при полном либо частичном ответе на ХТ). Выполнение первичной радикальной цистэктомии не рекомендуется. Рекомендуемые режимы ХЛТ представлены в табл. 6.
Лечение диссеминированной болезни является паллиативным и направлено на улучшение качества жизни и увеличение ее продолжительности. Основным методом является лекарственная терапия. В ряде случаев встречается олигометастатическая болезнь, при которой выявляется до 5 метастазов в различных органах, синхронных с первичной опухолью или возникающих как метахронный рецидив болезни. Благоприятными факторами являются солитарное поражение или появление рецидива более чем через 36 месяцев после лечения первичной опухоли. При солитарных метастазах возможно использование метода локального контроля первичной опухоли и метастатических очагов. Методы локального контроля — хирургическая резекция, ЛТ, РЧА — должны определяться на междисциплинарном консилиуме, исходя из экспертизы лечащих врачей и предпочтений пациентов.
Выбор варианта лечения определяется общим состоянием пациента и выделительной функцией почек (рис. 2). Платиносодержащая комбинированная ХТ (MVAC, цисплатин + гемцитабин) является стандартной и способствует увеличению продолжительности жизни больных до 14,8 и 13,8 мес. соответственно. Более низкая токсичность комбинации «цисплатин + гемцитабин» способствует более частому применению ее в качестве стандартного режима. Высокодозный MVAC с использованием Г-КСФ обеспечивает бóльшую плотность дозы, менее токсичен, чем стандартный MVAC, и обеспечивает бóльшую частоту полных ответов и 2-летнюю выживаемость с пограничной статистически значимой редукцией в риске прогрессии и смерти к 5 годам наблюдения.
Инттенсификация лечения за счёт добавления паклитаксела к цисплатину и гемцитабину не привела к значимому улучшению общей выживаемости, однако частота общего ответа опухоли на лечение была выше на 12% в группе трехкомпонентного режима в сравнении со стандартной комбинацией, была отмечена также тенденция к улучшению общей выживаемости (15,8 против 12,7 мес. соответственно). На основании сравнения эффективности и ток- сичности различных режимов стандартными подходами в первой линии ХТ метастатического рака мочевого пузыря признано использование режимов «цисплатин + гемцитабин» и высокодозный MVAC.
Несколько исследований II фазы, посвященных сравнению карбоплатина и цисплатина, указывают на более низкую эффективность режимов с карбо-платином. Карбоплатин-содержащая ХТ не является эквивалентной комбинациям на основе цисплатина и не должна рассматриваться в качестве замены или стандарта (исключение может быть сделано для отдельных клинических ситуаций, при которых лечение цисплатином противопоказано).
После завершения 4–6 циклов ХТ «гемцитабин + цисплатин / карбоплатин» через 4–10 недель в качестве поддерживающей терапии оптимально использование авелумаба 10 мг / кг 1 раз в 2 недели непрерывно длительно до прогрессирования или неприемлемой токсичности. Это позволяет увеличить медиану продолжительности жизни с 14,3 мес. при наилучшей поддерживающей терапии до 21,4 мес. при лечении авелумабом.
Более 50% пациентов с уротелиальным раком не подлежат цисплатин-содержащей ХТ. Причинами отказа от использования цисплатина являются состояние по шкале ECOG > 1 балла; клиренс креатинина < 60 мл/мин.; потеря слуха и периферическая нейропатия > 2 ст.; сердечная недостаточность III класса по NYHA. У больных, которым противопоказано введение цисплатина, могут быть использованы комбинации на основе карбоплатина либо монотерапия гемцитабином или таксанами. При противопоказаниях к введению цисплатина могут быть использованы ингибиторы иммунных контрольных точек (только у пациентов с положительной экспрессией PD-L1): атезолизумаб 1200 мг в / в 1 раз в 21 день при экспрессии PD-L1 ≥ 5 % или пембролизумаб 200 мг в/в 1 раз в 21 день при комбинированном показателе позитивности (Combined Positive Score (CPS)) ≥ 10. Хотя иммунотерапия PD-L1 позитивных пациентов ассоциируется с длительными ремиссиями, частота общего ответа, время до прогрессирования и продолжительность жизни не превосходили аналогичные показатели при проведении ХТ с включением карбоплатина.
При противопоказаниях к введению препаратов платины (цисплатина и карбоплатина) ингибиторы контрольных точек иммунного ответа могут быть использованы без определения уровня экспрессии PD-L1. Данное обновление клинических рекомендаций связано с решением FDA и EMA, предписывающим ограничение показаний к применению ингибиторов иммунных контрольных точек в лечении рака мочевого пузыря.
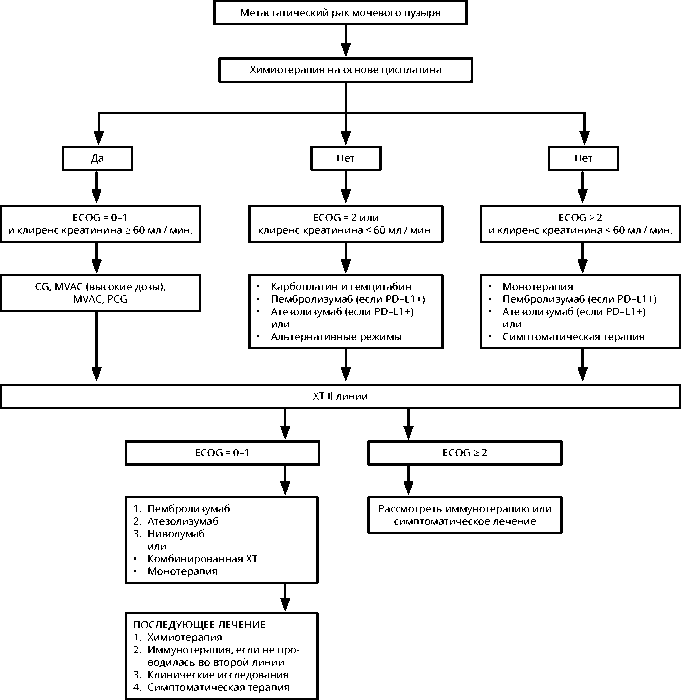
Рисунок 2. Алгоритм лечения пациентов с метастатическим раком мочевого пузыря.
Во II линии приемлемой стратегией может быть повторное назначение ХТ на основе цисплатина у ранее чувствительных к препаратам платины пациентов, если прогрессия наблюдается спустя 6–12 мес. после I линии циспла-тин-содержащей ХТ. Возможно повторное использование гемцитабина, в том числе комбинации «паклитаксел + гемцитабин». Рекомендуемые режимы ХТ метастатического РМП представлены в табл. 7.
Таблица 7. Рекомендуемые режимы химиотерапии метастатического рака мочевого пузыря
|
Название |
Режим введения химиопрепаратов |
|
CG |
Цисплатин 70 мг / м2 в / в в 1-й день + гемцитабин 1000 мг / м2 в / в в 1-й, 8-й и 15-й дни каждые 4 нед. |
|
CarboG |
Карбоплатин AUC-4,5 в / в в 1-й день + гемцитабин 1000 мг / м2 / сут. в / в в 1-й и 8-й дни каждые 3 нед. |
|
MVAC |
Метотрексат 30 мг / м2 в / в в 1-й, 15-й и 22-й дни + винбластин 3 мг / м2 в / в во 2-й, 15-й и 22-й дни + доксорубицин 30 мг / м2 в / в во 2-й день + цисплатин 70 мг / м2 в / в во 2-й день каждые 4 нед. |
|
MVAC (высокие дозы) |
Метотрексат 30 мг / м2 в / в в 1-й день + винбластин 3 мг / м2 в / в во 2-й день + доксорубицин 30 мг / м2 в / в во 2-й день + цисплатин 70 мг / м2 в / в во 2-й день + филграстим 5 мкг / кг в 4–10-й дни каждые 2 нед. |
|
PCG 1 |
Паклитаксел 70 мг / м2 в / в в 1-й и 8-й дни + цисплатин 70 мг / м2 в / в в 1-й день + гемцитабин 1000 мг / м2 / сут. в / в в 1-й и 8-й дни каждые 3 нед. |
|
GP 1 |
Гемцитабин 2500 мг / м2 / сут. в / в в 1-й день + паклитаксел 150 мг / м2 в / в в 1-й день каждые 2 нед. |
|
Винфлунин |
320 мг / м2 в / в в 1-й день каждые 3 нед. |
|
Гемцитабин 1 |
1200 мг / м2 в / в в 1-й, 8-й, 15-й дни каждые 4 нед. |
|
Паклитаксел 1 |
80 мг / м2 в / в в 1-й, 8-й, 15-й дни каждые 4 нед. или 175 мг / м2 в / в кап. 1-й день каждые 3 нед. |
|
Доцетаксел 1 |
75–100 мг / м2 в / в в 1-й день каждые 3 нед. |
|
Пеметрексед 1 |
500 мг / м2 в / в в 1-й день каждые 3 нед. + фолиевая к-та 350–1000 мкг внутрь ежедневно + витамин В12 1000 мкг в / м 1 раз в 9 недель |
|
Ниволумаб |
3 мг / кг в / в в 1-й день каждые 2 нед. или 240 мг × 1 раз в 3 нед. или 480 мг × 1 раз в 4 нед. |
|
Атезолизумаб |
840 мг в / в каждые 2 нед., или 1200 мг в / в каждые 3 нед., или 1680 мг в / в каждые 4 нед., 1200 мг в / в в 1-й день каждые 3 нед. |
|
Пембролизумаб |
200 мг в / в в 1-й день каждые 3 нед. |
|
Авелумаб |
10 мг / кг в / в в 1-й день каждые 2 нед. |
1 Режим / препарат зарегистрирован в РФ, но не входит в клинические рекомендации, одобренные Минздравом РФ.
В качестве II линии ХТ при резистентности к платиносодержащим комбинациям и отсутствии возможности проведения иммунотерапии больным с благоприятными прогностическими характеристиками (состояние по шкале ECOG < 2 баллов, Hb > 10 г/дл, отсутствие метастазов в печени) возможно назначение винфлунина в дозе 280–320 мг / м2 1 раз в 3 нед. В рандомизированном исследовании назначение данного препарата в качестве II линии терапии больным метастатическим РМП с благоприятными прогностическими характеристиками увеличивало медиану продолжительности жизни на 2,5 мес. в сравнении с оптимальной поддерживающей терапией.
Увеличение медианы продолжительности жизни на 3 мес. в сравнении с ХТ по выбору врача в исследовании III фазы было получено при использовании пембролизумаба 200 мг в/в 1 день каждые 3 нед. В нерандомизированных исследованиях II фазы продемонстрирована эффективность ингибиторов иммунных контрольных точек ниволумаба 3 мг / кг в / в 1 раз в 14 дней и атезоли-зумаба 1200 мг в / в 1 раз в 21 день. Объективный ответ наблюдался у 15 и 19 % больных, получавших атезолизумаб и ниволумаб соответственно. Кроме того, ряд исследований II фазы продемонстрировали умеренную эффективность гемцитабина, паклитаксела, доцетаксела, пеметрекседа во II линии у резистентных к платиносодержащей терапии пациентов (13–28% общего ответа на лечение).
При оценке эффективности иммунотерапии необходимо учитывать, что псевдопрогрессия практически не встречается при раке мочевого пузыря.
Ретроспективные данные лечения пациентов, прогрессирующих после иммунотерапии, демонстрируют возможность объективного противоопухолевого ответа при последующем проведении ХТ. В связи с этим при выборе дальнейшей тактики лечения следует ориентироваться в большей степени на ХТ, чем на иммунотерапию.
ЛТ с паллиативной целью может использоваться для уменьшения симптомов, ассоциированных с опухолевым процессом.
-
5.2. Наблюдение в процессе лечения. Оценка эффекта
Наблюдение в процессе лечения проводится с целью оценки эффективности и токсичности и включает периодический осмотр и оценку различных симптомов, лабораторных данных и результатов инструментального обследования. Оценку эффекта рекомендуется проводить после каждых 2–3 циклов ХТ с помощью данных общего осмотра, выяснения жалоб и результатов инструментальных методов обследования, выявивших патологию на этапе первоначальной диагностики. Результаты обследования оцениваются с использованием критериев RECIST 1.1.


