Практические рекомендации по лекарственному лечению рака молочной железы
Автор: Тюляндин С.А., Артамонова Е.В., Жукова Л.Г., Кислов Н.В., Королева И.А., Пароконная А.А., Семиглазова Т.Ю., Стенина М.Б., Фролова М.А.
Журнал: Злокачественные опухоли @malignanttumors
Статья в выпуске: 3S2-1 т.12, 2022 года.
Бесплатный доступ
Рак молочной железы, химиотерапия, гормонотерапия, рецепторы эстрогенов и прогестерона, мутация brca
Короткий адрес: https://sciup.org/140296294
IDR: 140296294 | DOI: 10.18027/2224-5057-2022-12-3s2-155-197
Текст статьи Практические рекомендации по лекарственному лечению рака молочной железы
При планировании и проведении лекарственной терапии следует руководствоваться стремлением обеспечить всех больных максимально качественным и экономически доступным лечением. Лечение должно планироваться при участии нескольких специалистов, включая врача-хирурга, врача-онколога (химиотерапевта) и врача-радиотерапевта, а также по возможности патоморфолога, что позволит наилучшим образом сочетать локальные и системные методы терапии. Больные должны быть информированы о плане лечебно-диагностических мероприятий, целях различных видов помощи, возможных побочных эффектах и влиянии на функциональную, эмоциональную и социальную сферы. При невозможности проведения рекомендованных методов лечения (наличие противопоказаний) необходимо составить индивидуальный план лечения. Общими противопоказаниями являются случаи тяжелых соматических заболеваний в стадии декомпенсации, когда риск возможных осложнений для жизни в процессе лечения выше риска прогрессирования РМЖ.
1. ОПРЕДЕЛЕНИЕ СТАДИИ
Для стадирования РМЖ следует использовать TNM-классификацию AJCC (8-ое издание, 2017 г.). Выделяют клиническую и патоморфологическую стадии РМЖ, которые могут существенно различаться. Клиническое стадирование (обозначается префиксом «с», от англ. «clinical») проводится на основании результатов клинического обследования, патоморфологическое (определяется префиксом «р», от англ. «pathologic») — на основании заключения морфолога после изучения удаленных во время операции тканей. Патоморфологическое стадирование по значимости превосходит клиническое. Категории Т и N, оцениваемые после неоадъювантной терапии, обозначаются префиксом «y»: «ус» — при клиническом стадировании или «yp» — при патоморфологическом стадировании, например, «ypT» или «ypN».
-
1.1. Клинико-патологическая классификация
-
1.1.1. Первичная опухоль (Т) — клиническая и патологическая классификация
Категории Т
Категории Т
Tх
Недостаточно данных для оценки опухоли
Т0
Нет признаков первичной опухоли
Тis (DCIS)
Протоковая карцинома in situ
Тis (Педжета)
Рак Педжета (соска), не ассоциированный с инвазивным раком и/или раком in situ (DCIS) подлежащей паренхимы молочной железы. Опухоль паренхимы молочной железы, ассоциированную с раком Педжета, следует классифицировать на основании ее размеров и характеристик; присутствие рака Педжета в этом случае обязательно должно быть зафиксировано
T1
Опухоль ≤ 20 мм в наибольшем измерении
Т1mic
Mикроинвазия ≤ 1 мм в наибольшем измерении
Т1а
Опухоль > 1 мм, но ≤ 5 мм в наибольшем измерении
Т1в
Опухоль > 5 мм, но ≤ 10 мм в наибольшем измерении
Т1с
Опухоль > 10 мм, но ≤ 20 мм в наибольшем измерении
Т2
Опухоль > 20 мм, но ≤ 50 мм в наибольшем измерении
ТЗ
Опухоль > 50 мм в наибольшем измерении
Т4
Опухоль любого размера с прямым распространением на грудную стенку и/или кожу (изъязвление или макроскопические узелки); изолированная инвазия дермы
не классифицируется как T4 1
Т4а
Распространение на грудную стенку; инвазия или тесное прилегание к грудным мышцам в отсутствие вовлечения в процесс элементов грудной стенки не классифицируется как T4a
Т4b
Изъязвление и/или ипсилатеральные макроскопические сателлитные узелки и/или отек кожи (включая положительный симптом «апельсиновой корочки»), который не соответствует критериям воспалительного рака
Т4с
Признаки T4a и T4b
Т4d
Воспалительный рак
-
1 Грудная стенка включает ребра, межреберные мышцы, переднюю зубчатую мышцу и не включает грудные мышцы.
-
1.1.2. Регионарные лимфатические узлы (N)
-
1.1.2.1. Клиническая классификация (сN)1
Категории cN
Категории cN
cNx
Состояние регионарных лимфатических узлов не может быть оценено (удалены ранее)
cN0
Нет признаков поражения метастазами регионарных лимфатических узлов по данным клинического осмотра и обследования
Категории cN
Категории cN
cN1
Метастазы в смещаемых ипсилатеральных подмышечных лимфатических узлах I, II уровней
cN1mi
Микрометастазы (комплексы около 200 клеток с наибольшим размером более 0,2 мм, но менее 2 мм)
cN2
Метастазы в ипсилатеральных подмышечных лимфатических узлах I, II уровней, спаянные между собой или фиксированные к близлежащим структурам, или метастазы в ипсилатеральных внутренних маммарных (парастернальных) лимфатических узлах в отсутствие клинически явного поражения подмышечных лимфатических узлов
cN2a
Метастазы в ипсилатеральных подмышечных лимфатических узлах I, II уровней, спаянные между собой или фиксированные к близлежащим структурам
cN2b
Метастазы в ипсилатеральных внутренних маммарных (парастернальных) лимфатических узлах в отсутствие клинически явного поражения подмышечных лимфатических узлов
сN3
Mетастазы в ипсилатеральных подключичных (III уровень) лимфатических узлах в сочетании или без вовлечения подмышечных лимфатических узлов (I, II уровни) или метастазы в ипсилатеральных внутренних маммарных (парастернальных) лимфатических узлах и подмышечных лимфатических узлах (I, II уровни) или метастазы в ипсилатеральных надключичных лимфатических узлах (независимо от состояния подмышечных и внутренних маммарных (парастернальных) лимфатических узлов)
cN3a
Mетастазы в ипсилатеральных подключичных (III уровень) лимфатических узлах
cN3b
Метастазы в ипсилатеральных внутренних маммарных (парастернальных) лимфатических узлах и подмышечных лимфатических узлах (I, II уровни)
cN3c
Метастазы в ипсилатеральных надключичных лимфатических узлах
-
-
1 Индексы (sn) или (f) должны быть добавлены к категории N для обозначения способа подтверждения метастатического поражения лимфоузлов — с помощью БСЛУ (sn) или тонкогоигольной аспирационной / core-биопсии (f).
-
1.1.2.2. Патологическая классификация (pN)1
Категории pN
Категории pN
рNx
Состояние лимфатических узлов не может быть оценено (не удалены для патологического исследования или удалены ранее)
pN0
Метастазы в регионарных лимфатических узлах отсутствуют или имеются только изолированные опухолевые клетки
pN0 (i +)
Только изолированные опухолевые клетки (скопления опухолевых клеток не более 0,2 мм в наибольшем измерении) в лимфатических узлах
pN0 (mol+)
Позитивный молекулярный ПЦР тест; изолированные опухолевые клетки не определяются
Категории pN
Категории pN
pN1
Микрометастазы или метастазы в 1–3 подмышечных лимфатических узлах и/или микро- или макрометастазы в клинически негативных внутренних маммарных (парастернальных) лимфатических узлах, выявленные с помощью БСЛУ
pN1mi
Микрометастазы (скопления около 200 клеток более 0,2 мм, но менее 2,0 мм в наибольшем измерении)
pN1a
Метастазы в 1–3 подмышечных лимфатических узлах, один из которых более 2,0 мм в наибольшем измерении
pN1b
Метастазы в ипсилатеральных внутренних маммарных (парастернальных) сентинальных лимфоузлах, исключая изолированные опухолевые клетки
pN1c
Признаки pN1a и pN1b
pN2
Метастазы в 4–9 подмышечных лимфатических узлах или клинически определяемое поражение ипсилатеральных внутренних маммарных (парастернальных) лимфатических узлов при отсутствии поражения подмышечных лимфатических узлов
pN2a
Метастазы в 4–9 подмышечных лимфатических узлах (как минимум одно скопление опухолевых клеток ≥ 2 мм)
pN2b
Клинически определяемое поражение ипсилатеральных внутренних маммарных (парастернальных) лимфатических узлов (± микроскопическое подтверждение) при отсутствии поражения подмышечных лимфатических узлов
pN3
Метастазы в 10 и более подмышечных лимфоузлах или подключичных (III уровень) лимфатических узлах или клинически определяемое поражение ипсилатеральных внутренних маммарных (парастернальных) и подмышечных лимфатических узлов (I, II уровни) или поражение 4 и более подмышечных лимфатических узлов в сочетании с микро- или макроскопическим поражением по данным БСЛУ ипсилатеральных клинически интактных внутренних маммарных (парастернальных) лимфатических узлов или поражение ипсилатеральных надключичных лимфатических узлов
pN3a
Метастазы в 10 и более подмышечных лимфоузлах или подключичных (III уровень) лимфатических узлах
pN3b
pN1a или pN2a в сочетании с cN2b (клинически определяемым поражением внутренних маммарных (парастернальных) лимфоузлов) или pN2a в сочетании с pN1b
pN3c
Метастазы в ипсилатеральных надключичных лимфоузлах
-
1 Индексы (sn) или (f) должны быть добавлены к категории N для обозначения способа подтверждения метастатического поражения лимфоузлов — с помощью БСЛУ (sn) или тонкогоигольной аспирационной / core-биопсии (f) соответственно (без последующего удаления лимфоузлов).
-
1.1.3. Отдаленные метастазы (М)
|
Категории М |
Категории М |
|
|
сМ0 1 |
Нет клинических или радиографических признаков отдаленных метастазов |
|
|
cM0 (i +) |
Нет клинических или радиографических признаков отдаленных метастазов в сочетании с наличием опухолевых клеток или комплексов опухолевых клеток размером не более 0,2 мм, определяемых микроскопически или с помощью молекулярных технологий в крови, костном мозге или иных не регионарных тканях при отсутствии клинических симптомов или признаков метастазов |
|
|
cM1 |
Есть отдаленные метастазы, определяемые клинически или с помощью методов визуализации |
|
|
pM1 |
||
1 Категория сМ0 не требует подтверждения с помощью методов визуализации.
1.2. Клиническая (анатомическая) классификация
Категория T
Категория N
Категория M
Стадия
Tis
N0
M0
0
T1
N0
M0
IA
T0
N1mi
M0
IB
T1
N1mi
M0
T0
N1
M0
IIA
T1
N1
M0
T2
N0
M0
T2
N1
M0
IIB
T3
N0
M0
T0
N2
M0
IIIA
T1
N2
M0
T2
N2
M0
T3
N1
M0
T3
N2
M0
T4
N0
M0
IIIB
T4
N1
M0
T4
N2
M0
Любая Т
N3
M0
IIIC
Любая Т
Любая N
M1
IV
1.3. Гистологическая степень злокачественности опухоли (G)
2. РАННИЙ (ПЕРВИЧНО ОПЕРАБЕЛЬНЫЙ)И МЕСТНОРАСПРОСТРАНЕННЫЙ (ПЕРВИЧНОНЕ ОПЕРАБЕЛЬНЫЙ) РАК МОЛОЧНОЙ ЖЕЛЕЗЫ
2.1. Диагностика
|
Категория G |
Категория G |
|
Gx |
Категория G не может быть определена |
|
G1 |
Низкая степень злокачественности (благоприятный вариант), 3–5 баллов по шкале SBR 1 |
|
G2 |
Умеренная степень злокачественности (промежуточный вариант), 6–7 баллов по шкале SBR |
|
G3 |
Высокая степень злокачественности (неблагоприятный вариант), 8–9 баллов по шкале SBR |
1 SBR — шкала Scarff– Bloom – Richardson, Ноттингемская модификация.
Диагноз РМЖ основывается на данных осмотра, результатах инструментальных методов обследования и патоморфологическом заключении. Первичное обследование должно быть проведено до всех видов лечебных воздействий и включает в себя:
-
• выяснение жалоб и сбор анамнеза с целью выявления клинико-анамнестических особенностей пациента и заболевания, а также факторов, которые могут повлиять на тактику дальнейшего обследования и лечения;
-
• общий осмотр, пальпацию, перкуссию и аускультацию внутренних органов, пальпацию молочных желез и зон регионарного метастазирования (подмышечных, над-, подключичных) с целью оценки общего состояния пациента и определения клинической стадии заболевания;
-
• общий (клинический) анализ крови развернутый;
-
• биохимический общетерапевтический анализ крови, включая показатели функции печени (билирубин, АЛТ, АСТ, ЩФ), почек (мочевина, креатинин), уровень глюкозы, кальция;
-
• исследование свертывающей системы крови (коагулограмма);
-
• общий (клинический) анализ мочи;
-
• билатеральную маммографию+УЗИ молочных желез и регионарных зон; МРТ молочных желез — по показаниям 1 ;
-
• R-графию органов грудной клетки; КТ/МРТ органов грудной клетки — по показаниям 1 ;
-
• УЗИ органов брюшной полости и малого таза; КТ/МРТ органов брюшной полости
и малого таза с контрастированием — по показаниям 1 ;
-
• радиоизотопное исследование скелета+рентгенографию и/или КТ/МРТ зон накоп
ления РФП — по показаниям 1 ;
-
• биопсию опухоли с патоморфологическим исследованием опухолевой ткани, включая определение гистологического варианта опухоли и степени злокачественности;
-
• определение в опухолевой ткани РЭ, РП, HER2 и Ki67;
-
• исследование уровня ФСГ и общего эстрадиола в сыворотке крови для оценки функции яичников 2 (см. раздел 2.2.1.5, «Критерии менопаузы»);
-
• определение герминальных мутаций BRCA1 /2 методом ПЦР при наличии, по крайней мере, одного из следующих факторов:
-
– рак молочной железы в возрасте≤45 лет;
-
– рак молочной железы с тройным негативным фенотипом;
-
– второй (синхронный или метахронный) РМЖ в любом возрасте;
-
– первично множественный рак: РМЖ+эпителиальный рак яичников (включая рак маточных труб и первичный рак брюшины) или экзокринный рак поджелудочной железы в любом возрасте;
-
– РМЖ у мужчин в любом возрасте;
-
– отягощенный семейный анамнез:
-
• (наличие у кровных родственников 1–2 степени родства РМЖ в возрасте≤50 лет, рака яичников, рака поджелудочной железы, рака предстательной железы, РМЖ у мужчины);
-
• наличие у кровных родственников герминальных мутаций BRCA1/2;
-
• неизвестный семейный анамнез у больных РМЖ в возрасте 46–50 лет
Примечание: Больным с выше перечисленными факторами при отсутствии мутаций BRCA1 / 2 по данным ПЦР показано выполнение высокопроизводительного секвенирования (NGS) при наличии такой возможности. Для лиц неславянской этнической группы предпочтительным методом определения мутаций BRCA является высокопроизводительное секвенирование (NGS) при наличии такой возможности.
Патоморфологический диагноз устанавливается с помощью биопсии первичной опухоли, которая должна быть выполнена до всех видов лечебных воздействий (при невозможности биопсии первичной опухоли может быть выполнена биопсия регионарного лимфоузла либо любого доступного для биопсии патологического очага) . Для адекватного клинического стадирования и определения оптимальной тактики лечения в дополнение к верификации опухоли в молочной железе рекомендуется морфологическое исследование подозрительных в отношении метастатического поражения регионарных лимфатических узлов (цитологическое или гистологическое и ИГХ). Биопсию опухоли рекомендуется выполнять, даже если на первом этапе планируется оперативное лечение. В отдельных (исключительных) случаях при невозможности выполнения биопсии опухоли рекомендуется выполнить тонкоигольную аспирационную биопсию (пункцию) опухоли (желательно под навигационным контролем) с цитологическим исследованием микропрепарата для морфологического подтверждения диагноза. При назначении неоадъювантной системной терапии полноценное клиническое стадирование должно быть проведено до начала лечения.
Определение в опухоли уровня экспрессии РЭ, РП, HER2 и Ki67 является обязательным; предпочтение отдается ИГХ методу. Оценку рецепторного статуса предпочтительно проводить по методу Allred, который включает данные не только о процентном содержании клеток, положительных по РЭ и РП, но и об интенсивности их окрашивания. Итоговый показатель по каждому рецептору представляет собой сумму баллов, полученных при определении доли окрашенных ядер клеток и интенсивности их окрашивания. Таким образом, результат может колебаться от 0 до 8, при этом уровень экспрессии 0–2 балла соответствует негативному значению, 3–4 балла — слабоположительному, 5–6 баллов — умеренному и 7–8 баллов — выраженному. Опухоли с содержанием окрашенных на РЭ ядер от 1 до 10% считаются слабоположительными и отличаются низкой чувствительностью к ГТ. Определение РП дополняет прогностическую характеристику опухоли и служит контролем возможного ложноотрицательного результата определения РЭ. Случаи положительных РП при отрицательных РЭ требуют повторного определения РП и исключения фонового окрашивания. Больные с опухолями, положительными по РП и отрицательными по РЭ, могут быть кандидатами для ГТ, однако, данные об эффективности этого метода в данной подгруппе больных ограничены.
Интерпретация морфологом результатов определения РЭ должна включать оценку конкордантности результатов ИГХ и гистологического исследований. Так, например, дольковые и протоковые инвазивные карциномы низкой степени злокачественности, «чистые» тубулярные, крибриформные и муцинозные карциномы, а также инкапсулированная и солидная папиллярные карциномы крайне редко бывают отрицательными по РЭ, в то время как метапластическая карцинома (все типы), аденокистозная карцинома (и другие карциномы, похожие на рак слюнной железы), секреторная карцинома и карцинома с апокринной дифференцировкой, наоборот, крайне редко бывают положительными по РЭ.
При дискордантности данных гистологического и ИГХ исследований клиницист должен обсудить с морфологом возможные причины расхождения в полученных результатах и при необходимости назначить повторное тестирование или получение мнения второго морфолога с целью уточнения иммунофенотипа опухоли.
Определение HER2 должно проводиться только в инвазивном компоненте опухоли. При неопределенном результате ИГХ анализа HER2 (2+) следует провести определение амплификации гена HER2 методом in situ гибридизации (FISH, CISH или SISH).
Заключительные клинический и патоморфологический диагнозы устанавливаются в соответствии с действующими классификациями ВОЗ и TNM после изучения всех удаленных тканей. При патоморфологическом исследовании удаленной опухоли должны быть определены:
-
• гистологический вариант опухоли;
-
• степень злокачественности;
-
• состояние краев резекции;
-
• выраженность лимфоваскулярной инвазии;
-
• состояние подмышечных лимфоузлов;
-
• в случае отрицательных значений РЭ, РП и HER2 по данным ИГХ исследования биопсийного материала рекомендуется повторное определение этих рецепторов в удаленной опухоли и/или метастатических лимфоузлах с учетом возможной гетерогенности опухоли;
-
• выраженность патоморфологического ответа в первичной опухоли и регионарных лимфоузлах (в случае неоадъювантной лекарственной терапии); рекомендуемыми методами оценки степени выраженности патоморфологического ответа являются: – классификация ВОЗ с указанием категорий ypTypN
– система RCB (Residual Cancer Burden; бесплатный онлайн калькулятор доступен на сайте http://www3.mdanderson.org/app/medcalc/index . cfm?pagename=jsconvert3) или https:/ /share.xpractice.ru/rcb-calc/index-temporary . html#
-
2.2. Лечение
Алгоритм лечебно-диагностических мероприятий при различных стадиях РМЖ представлен на рис. 1.
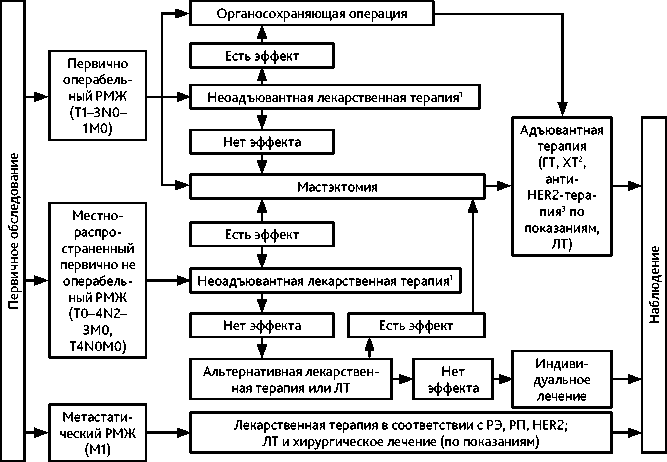
1 Неоадъювантная лекарственная терапия при I стадии рекомендуется только в рамках клинических исследований. Неоадъювантную ХТ рекомендуется проводить с использованием стандарт- ных режимов (табл. 8) и обязательным соблюдением рекомендуемой дозовой интенсивности (стандартные дозы и интервалы между курсами).
-
2 В тех случаях, когда неоадъювантная ХТ по каким-либо причинам не была полностью проведена до операции, рекомендуется проведение недостающих циклов в послеоперационном периоде; больным РМЖ с тройным негативным фенотипом (отрицательные РЭ, РП и HER2), получившим неоадъювантную ХТ антрациклинами и /или таксанами (± платиновые производные) в стандартном объеме, при наличии инвазивной резидуальной опухоли рекомендуется постнеоадъювантная ХТ капецитаби-ном и / или олапарибом при BRCA-ассоциированном раке (показания к назначению капецитабина и ола-париба см. в табл. 4).
-
3 Больным HER2-положительным РМЖ, получившим стандартную неоадъювантную лекарственную терапию антрациклинами и / или таксанами в сочетании с трастузумабом (± пертузумаб), при наличии инвазивной резидуальной опухоли, соответствующей ypT≥ 1b или ypN + или RCB II–III рекомендуется постнеоадъювантная терапия трастузумабом эмтанзином (табл. 5).
-
2.2.1. Ранний (первично операбельный) рак молочной железы (0, I, IIA, IIB, IIIA стадии)
-
2.2.1.1. Стадия 0 (ТisN0М0), протоковый рак in situ
-
Рисунок 1. Алгоритм лечебно-диагностических мероприятий в зависимости от стадии рака молочной железы.
Для профилактики развития вторых опухолей в контралатеральной и резецированной (в случае выполнения органосохраняющей операции) молочной железе при положительных РЭ во внутрипротоковом ( in situ ) раке рекомендуется рассмотреть назначение адъювантной ГТ c использованием одного из следующих режимов:
-
• тамоксифен 20 мг внутрь ежедневно в течение 5 лет у больных в пре- и постменопаузе;
-
• тамоксифен 5 мг внутрь ежедневно в течение 3 лет у больных в пре- и постменопаузе (при плохой переносимости стандартной дозы тамоксифена);
-
• ингибиторы ароматазы (летрозол 2,5 мг или анастрозол 1 мг или эксеместан 25 мг внутрь ежедневно) в течение 5 лету больных в стойкой менопаузе.
-
2.2.1.2. Общие принципы адъювантной лекарственной терапии инвазивного РМЖ
Овариальная супрессия при TisN0M0 не показана. ХТ при TisN0M0 не показана.
Адъювантная лекарственная терапия проводится в дополнение к локальным (хирургическому и лучевому) методам лечения и позволяет снизить риск рецидива болезни и смерти. При планировании адъювантной лекарственной терапии необходимо оценить прогноз, ожидаемую пользу адъювантного лечения, возможные побочные эффекты и сопутствующую патологию, а также учесть предпочтения больной. Возраст сам по себе не является ограничением для лекарственной терапии при отсутствии сопутствующей патологии.
При опухолях небольших размеров (≤0,5 см) в сочетании c N0, являющихся прогностически благоприятными, адъювантная лекарственная терапия обладает минимальной эффективностью. Назначение адъювантной ГТ (при гормонозависимых опухолях) в такой ситуации имеет целью профилактику вторых (контралатеральных) гормонозависимых опухолей.
План адъювантной/постнеоадъювантной лекарственной терапии основывается на принадлежности опухоли к одному из молекулярно-биологических подтипов, стадии заболевания и факторах прогноза (табл. 2, 3). Адъювантная лекарственная терапия должна начинаться с ХТ, если таковая показана. Не рекомендуется одновременное введение антрациклинов и анти-HER2 препаратов ввиду высокого риска кардиотоксичности; адъювантная ХТ таксан-содержащими режимами должна проводиться одновременно с анти-HER2-терапией, если таковая показана. ГТ должна начинаться после завершения ХТ и проводиться одновременно с продолжающейся анти-HER2-терапией, включая постнеоадъювантную терапию трастузумабом эмтанзином (у больных с положительным HER2 статусом опухоли). ЛТ должна начинаться после завершения ХТ и проводиться одновременно с ГТ и анти-HER2-терапией, включая постнеоадъювантную терапию трастузумабом эмтанзином, а также одновременно с постнеоадъювантной терапией капецитабином или олапарибом при тройном негативном РМЖ. Рекомендуемая последовательность различных методов адъювантной/постнеоадъювантной терапии представлена на рис. 2, 3.
Адъювантная ХТ, как правило, не рекомендуется больным, получившим стандартный объем неоадъювантной ХТ (табл. 8); исключение составляют больные тройным негативным и HER2-позитивным РМЖ с резидуальной опухолью (см. разделы 2.2.1.3 и 2.2.1.4 и табл. 4, 5). В тех случаях, когда план неоадъювантной ХТ по каким-либо причинам не был полностью выполнен, рекомендуется проведение недостающих курсов лечения в послеоперационном периоде.

|
Анти-HER2 терапия (трастузумаб ± пертузумаб) при HER2-положительном РМЖ |
|||
|
—► |
Гормонотерапия при люминальном РМЖ |
||
|
Лучевая терапия (по показаниям) |
|||
|
Химиотерапия |
|
|
Антрациклин-содержащий режим |
Таксан-содержащий режим |
Рисунок 2. Рекомендуемая последовательность различных методов адъювантной терапии рака молочной железы.
Таблица 2. Суррогатное определение молекулярно-биологических подтипов рака молочной железы.
|
Молекулярно-биологический подтип |
Клинико-патологическое (суррогатное) определение подтипа |
|
Люминальный А |
Наличие всех факторов: • РЭ положительные
|
|
Люминальный В (HER2 отрицательный) |
|
|
Люминальный В (HER2 положительный) |
|
|
HER2 положительный (не люминальный) |
|
|
Базальноподобный |
• отрицательные РЭ, РП, HER2 (тройной негативный протоковый) |
-
1 Значение Ki67 следует оценивать, исходя из опыта локальной патоморфологической лаборатории: например, если медиана значений Ki67 при гормонозависимом РМЖ составляет в данной лаборатории 20 %, то значение этого показателя, равное ≤ 10 %, следует расценивать как низкое, а ≥ 30 % — как высокое; при уровне Ki67 от 20 до 30 % при решении вопроса о тактике лечения следует учитывать другие, клинико-морфологические факторы прогноза (стадию, степень злокачественности, морфологический вариант и др.).
-
2 Пороговым значением при определении РП считается 20 %.
-
2.2.1.3. Адъювантная/постнеоадъювантная химиотерапия HER2-отрицательного рака молочной железы
Таблица 3. Рекомендуемый алгоритм назначения адъювантной системной терапии в зависимости от молекулярно-биологического подтипа и степени распространенности рака молочной железы.
|
Молекулярно- Рекомендуемая биологический адъювантная подтип системная терапия |
Примечания |
|
Люминальный А Только ГТ в большинстве случаев |
Назначение адъювантной ХТ (в дополнение к адъювантной ГТ) должно быть рассмотрено при поражении метастазами ≥ 4 регионарных лимфатических узлов. В качестве ХТ рекомендуются режимы DC (доцетаксел + циклофосфамид, 4 цикла; предпочтительный режим) или АС/ЕС (4 цикла) (табл. 4, рис. 2) |
|
Молекулярнобиологический подтип |
Рекомендуемая адъювантная системная терапия |
Примечания |
|
Люминальный В (HER2-отри-цательный) |
ХТ в большинстве случаев + ГТ |
При T1a-b (≤ 10 мм) и N0: только адъювантная ГТ Для остальных больных (в дополнение к адъювантной ГТ):
у больных в пременопаузе возможен отказ от адъювантной ХТ в пользу овариальной супрессии (в сочетании с тамоксифеном или ингибиторами ароматазы);
|
|
Люминальный В (HER2-поло-жительный) |
ХТ + анти-HER2-те-рапия + ГТ |
При T1a (≤ 5 мм) и N0: только адъювантная ГТ; ХТ и анти-HER2-терапия не показаны При T1b, с (> 5 мм, но ≤ 20 мм) и N0: возможна ХТ без антрациклинов (паклитаксел 12 еженедельных введений или DC (доцетаксел + циклофосфамид) (4 цикла) в сочетании с трастузумабом в течение 12 мес. (с последующей ГТ) (табл. 5, 7). При Т2–Т3 (> 20 мм) или N + : ХТ по схеме 1) доцетаксел + карбоплатин (6 циклов) + анти-HER2-терапия (трастузумаб ± пертузумаб в течение 12 мес.) или 2) антрациклины + таксаны (4 цикла АС/ЕС ^ 4 цикла доцетаксела/12 еженедельных введений паклитаксела) + анти-HER2-тера-пия (трастузумаб ± пертузумаб в течение 12 мес.) (с последующей ГТ) (табл. 5, 7; рис. 2). После завершения ХТ продолжается анти-HER2-терапия в сочетании с ГТ |
|
Молекулярнобиологический подтип |
Рекомендуемая адъювантная системная терапия |
Примечания |
|
HER2-положи-тельный (не люминальный) |
ХТ + анти-HER2-терапия |
При T1a (≤ 5 мм) и N0: системная терапия не показана. При T1b, с (> 5 мм, но ≤ 20 мм) и N0: возможна ХТ паклитакселом (12 еженедельных введений) или 4 цикла DC (доцетаксел + циклофосфамид) (без антрациклинов) в сочетании с трастузумабом в течение 12 месяцев (табл. 5, рис. 2). При Т2–Т3 (> 20 мм) или N + : ХТ по схеме 1) доцетаксел + карбоплатин (6 циклов) + анти-HER2-терапия (трастузумаб ± пертузумаб в течение 12 мес.) или 2) антрациклины и таксаны (4 цикла АС/ЕС -> 4 цикла доцетаксела/12 еженедельных введений паклитаксела) + анти-HER2-тера-пия (трастузумаб ± пертузумаб в течение 12 мес.) (табл. 5, рис. 2). После завершения ХТ продолжается анти-HER2-терапия |
|
Тройной негативный |
ХТ с включением антрациклинов и таксанов |
При T1a (≤ 5 мм) и N0: системная терапия не показана. При T1b и N0 возможно проведение 4 циклов ХТ DC (доцетаксел + циклофосфамид). При T1c–T3 или N + : ХТ антрациклинами и таксанами (4 цикла АС/ЕС ^ 12 еженедельных введений паклитак-села/4 курса доцетаксела). В связи с отсутствием убедительных данных об увеличении выживаемости больных тройным негативным, в т. ч. BRCA-ассоциированным РМЖ при добавлении производных платины к антрациклинам и таксанам в рутинной практике включение этих препаратов (производных платины) в режимы адъювантной ХТ не рекомендуется. С учетом данных ряда исследований об увеличении частоты полных патоморфологических регрессий и увеличения БРВ при тройном негативном фенотипе может быть рекомендовано включение производных платины в режимы неоадъювантной ХТ (табл. 8, рис. 2) |
Следует использовать стандартные режимы с соблюдением рекомендуемой дозовой интенсивности; необходимо избегать необоснованной (в отсутствие токсичности) редукции доз препаратов и увеличения интервалов между курсами. Рекомендуется последовательное (а не одновременное!) использование антрациклинов и таксанов; при назначении паклитаксела предпочтительно еженедельное введение, особенно при тройном негативном варианте. Адъювантную/постнеоадъювантную ХТ рекомендуется начинать в сроки не позднее 4–6 нед. в отсутствие хирургических осложнений; в случае хирургических осложнений — после их разрешения. Проведение адъювантной ХТ по прошествии 3 и более месяцев после хирургического лечения нецелесообразно.
Больным РМЖ с тройным негативным фенотипом (отрицательные РЭ, РП и HER2), получившим неоадъювантную ХТ антрациклинами и таксанами в стандартном объеме, при наличии инвазивной резидуальной опухоли рекомендуется назначение капецитабина и, в случае мутации BRCA1/2 — олапариба (табл. 4). При наличии показаний к проведению адъювантной ЛТ рекомендуется проводить ее одновременно с приемом капецитабина и олапариба. Рекомендуемые режимы адъювантной/постнеоадъювантной лекарственной терапии HER2-отрицательного РМЖ представлены в табл. 4.
Таблица 4. Рекомендуемые режимы адъювантной/постнеоадъювантной терапии HER2-отрицательного рака молочной железы.
-
5 Режим введения паклитаксела 175 мг /м 2 1 раз в 3 недели является менее эффективным по сравнению с еженедельным, особенно при тройном негативном подтипе РМЖ.
-
6 При противопоказаниях к назначению антрациклинов и таксанов.
-
7 Рекомендуется больным РМЖ с тройным негативным фенотипом (отрицательные РЭ, РП и HER2), получившим неоадъювантную ХТ антрациклинами и таксанами в стандартном объеме, при наличии инвазивной резидуальной опухоли.
-
8 При показании проведения адъювантной химиотерапии капецитабином возможно его назначение как совместно с рекомендованной лучевой терапией, так и после ее окончания.
-
9 В исследовании OlympiA (посвящено оценке эффективности олапариба в адъювантной терапии BRCA-ассоциированного РМЖ) больные тройным негативным РМЖ не получали капецитабин с постнеоадъювантной целью, в связи с этим данных о целесообразности использования и капецтабина, и ола-париба, а также преимуществах того или иного препарата у больных тройным негативным BRCA-ассоциированным РМЖ при резидуальной болезни нет.
-
10 Назначение олапариба с адъювантной целью следует рассмотреть при BRCA-ассоциированном тройном негативном подтипе РМЖ после стандартной неоадъювантной ХТ при наличии инвазивной резидуальной опухоли, соответствующей ypT≥ 1b или ypN + или RCB II–III. Олапариб следует назначать после окончания как лучевой терапии, так и приема капецитабина.
-
2.2.1.4. Адъювантная/постнеоадъювантная терапия HER2-положительного рака молочной железы
Адъювантная/постнеоадъювантная терапия HER2-положительного РМЖ включает ХТ (если она не назначалась неоадъювантно), анти-HER2-терапию и ГТ (при наличии в опухоли РЭ и РП). Больным, получившим неоадъювантную ХТ антрациклинами и/или таксанами и трастузумабом (±пертузумабом) в стандартном объеме, при достижении полного лекарственного патоморфоза (pCR), а также при наличии инвазивной резидуальной опухоли, соответствующей ypT1аypN0 или RCB I, рекомендуется продолжение терапии трастузумабом в дозе 6 мг/кг в/в 1 раз в 3 нед. до общей продолжительности 1 год, включая дооперационный этап (±адъювантная ГТ в зависимости от уровня РЭ).
Больным, получившим неоадъювантную ХТ антрациклинами и/или таксанами и трастузумабом (±пертузумабом) в стандартном объеме, при наличии инвазивной резидуальной опухоли (вне зависимости от ее HER-2 статуса), соответствующей ypT≥1b или ypN+или RCB II–III, рекомендуется постнеоадъювантная терапия трастузумабом эмтанзином 3,6 мг/кг в/в в 1-й день 1 раз в 3 нед., 14 циклов (табл. 5). При наличии показаний к проведению адъювантной ГТ и адьювантной ЛТ рекомендуется проводить их одновременно с введением трастузумаба эмтанзина. При досрочном прекращении введения трастузумаба эмтанзина (например, в связи с токсичностью) следует продолжить введение трастузумаба в стандартной дозе до общей продолжительности анти-HER2 терапии 1 год, включая дооперационный этап. Рекомендуемые режимы адъювантной/постнеоадъювантной лекарственной терапии HER2-положительного РМЖ представлены в табл. 5.
Таблица 5. Рекомендуемые режимы адъювантной/постнеоадъювантной лекарственной терапии HER2-положительного рака молочной железы.
|
(DC + трастузу-маб)×4 1,2,3,4 |
доцетаксел 75 мг/м 2 в/в в 1-й день + циклофосфамид 600 мг/м 2 в/в в 1-й день 1 раз в 3 нед. + трастузумаб 6 мг/кг (нагрузочная доза 8 мг/кг) в/в в 1-й день 1 раз в 3 нед., 4 цикла с первичной Г-КСФ профилактикой; далее — трастузумаб до общей длительности 12 мес. |
|
DCН×6 1,2,4 |
доцетаксел 75 мг/м 2 в/в в 1-й день 1 раз в 3 нед. + карбоплатин AUC6 в/в в 1-й день 1 раз в 3 нед. + трастузумаб 6 мг/кг (нагрузочная доза 8 мг/кг) в/в в 1-й день 1 раз в 3 нед., 6 циклов с первичной Г-КСФ профилактикой; далее — трастузумаб 6 мг/кг в/в 1 раз в 3 нед. до общей длительности 12 мес. |
|
(DCН + пертузу-маб)×6 1,2,4,5,10 |
доцетаксел 75 мг/м 2 в/в в 1-й день 1 раз в 3 нед. + карбоплатин AUC6 в/в в 1-й день 1 раз в 3 нед. + трастузумаб 6 мг/кг (нагрузочная доза 8 мг/кг) в/в в 1-й день 1 раз в 3 нед. + пертузумаб 420 мг (нагрузочная доза 840 мг) в/в в 1-й день 1 раз в 3 нед., 6 циклов с первичной Г-КСФ профилактикой; общая длительность введения трастузумаба и пертузумаба составляет 12 мес. |
|
(Р + трастузу-маб)×12 1,2,3,6 |
паклитаксел 80 мг/м 2 в/в еженедельно, 12 введений + трастузумаб 2 мг/кг (нагрузочная доза 4 мг/кг) в/в еженедельно 12 введений; далее — трастузумаб 6 мг/кг в/в 1 раз в 3 нед. до общей длительности 12 мес. |
|
ACx4 ^ (D + трастузу-маб)×4 1,2,7 |
АС (доксорубицин 60 мг/м 2 в/в в 1-й день + циклофосфамид 600 мг/м 2 в/в в 1-й день) 1 раз в 3 нед., 4 цикла ^ доцетаксел 75 мг/м 2 в/в в 1 -й день 1 раз в 3 нед., 4 цикла + трастузумаб 6 мг/кг (нагрузочная доза 8 мг/кг) в/в в 1-й день 1 раз в 3 нед.; далее — трастузумаб 6 мг/кг в/в 1 раз в 3 нед. до общей длительности 12 мес. |
|
ACx4 ^ (Р + трастузу-маб)×12 1,2,6,7 |
АС (доксорубицин 60 мг/м 2 в/в в 1-й день + циклофосфамид 600 мг/м 2 в/в в 1-й день) 1 раз в 3 нед., 4 цикла -> паклитаксел 80 мг/м 2 в/в еженедельно, 12 введений + трастузумаб 2 мг/кг (нагрузочная доза 4 мг/кг) в/в еженедельно 12 введений, далее — трастузумаб 6 мг/кг в/в 1 раз в 3 нед. до общей длительности 12 мес. |
|
ddACx4 ^ (Р + трастузу-маб)×12 1,2,4,7,6,8 |
АС (доксорубицин 60 мг/м 2 в/в в 1-й день + циклофосфамид 600 мг/м 2 в/в в 1-й день) 1 раз в 2 нед., 4 курса с первичной Г-КСФ профилактикой -> паклитаксел 80 мг/м 2 в/в еженедельно, 12 введений + трастузумаб 2 мг/кг (нагрузочная доза 4 мг/кг) в/в еженедельно 12 введений, далее — трастузумаб 6 мг/кг в/в 1 раз в 3 нед. до общей длительности 12 мес. |
|
ddACx4 ^ (Р + трастузу-маб)×4 1,2,4,7,8 |
АС (доксорубицин 60 мг/м 2 в/в в 1-й день + циклофосфамид 600 мг/м 2 в/в в 1-й день) 1 раз в 2 нед., 4 цикла с первичной Г-КСФ профилактикой -> паклитаксел 175 мг/м 2 в/в в 1-й день 1 раз в 2 нед., 4 цикла с первичной Г-КСФ профилактикой + трастузумаб 2 мг/кг (нагрузочная доза 4 мг/кг) в/в еженедельно; далее — трастузумаб 6 мг/кг в/в 1 раз в 3 нед. до общей длительности 12 мес. |
|
ACx4 ^ (таксаны + трастузумаб + пертузу-маб)×4 1,2,5,7,10 |
АС (доксорубицин 60 мг/м 2 в/в в 1-й день + циклофосфамид 600 мг/м 2 в/в в 1-й день) 1 раз в 3 нед., 4 цикла -> таксаны (доцетаксел 75 мг/м 2 в/в в 1-й день каждые 3 нед. 4 цикла или паклитаксел 80 мг/м 2 в/в еженедельно 12 введений) + трастузумаб 6 мг/кг (нагрузочная доза 8 мг/кг) в/в в 1-й день 1 раз в 3 нед. + пертузумаб 420 мг (нагрузочная доза 840 мг) в/в в 1-й день 1 раз в 3 нед.; общая длительность введения трастузумаба и пертузумаба составляет 12 мес. |
|
трастузумаб эмтанзин ×14 9 |
трастузумаб эмтанзин 3,6 мг/кг в/в в 1-й день 1 раз в 3 нед., до 14 циклов |
-
3 Рекомендуется рассмотреть применение данного режима при T1b, c (> 5 мм, но ≤ 20 мм) и N0.
-
4 Требуется профилактическое назначение Г-КСФ (филграстим 5 мкг/кг п /к через 24–72 часа после окончания введения химиопрепаратов минимум в течение 5 дней или до восстановления нормального числа нейтрофилов после надира; пэгфилграстим 6 мг или эмпэгфилграстим 7,5 мг п /к, через 24– 72 часа после введения химиопрепаратов однократно, принимая во внимание, что следующий курс химиотерапии может быть начат не ранее, чем через 14 дней после их введения).
-
5 Режим рекомендуется больным c N2–3, не получавшим неоадъювантной лекарственной терапии; пертузумаб вводится в сочетании с трастузумабом в течение 12 мес.
-
6 При использовании еженедельных введений паклитаксела объем стандартной премедикации может быть сокращен (на усмотрение лечащего врача) и проводиться по схеме: 1–2-й курсы — дексаметазон 10 мг в /м или внутрь за 12 и 6 часов до введения паклитаксела, блокаторы рецепторов H1 (дифенгидрамин 50 мг или эквивалентные дозы аналогов) в /в струйно за 30–60 мин. до введения паклитаксела, блокаторы рецепторов H2 (фамотидин 50 мг или эквивалентные дозы аналогов) в /в струйно за 30–60 мин. до введения паклитаксела. При отсутствии реакций гиперчувствительности на первых двух курсах в дальнейшем возможно введение дексаметазона 8 мг в /в за 30–60 мин. до введения паклитаксела, а введение блокаторов H1 /H2 гистаминовых рецепторов — только в случае предшествовавших реакций гиперчувствительности. Введение паклитаксела может проводиться при АЧН ≥ 1,0 × 10 9 /л и количестве тромбоцитов ≥ 100,0 × 10 9 /л.
-
7 Доксорубицин может быть заменен на эпирубицин в курсовой дозе 90–100 мг /м 2 (режим ЕС); не рекомендуется одновременное введение антрациклинов (доксорубицина и эпирубицина) и анти-HER2 препаратов (трастузумаба, пертузумаба) ввиду высокого риска кардиотоксичности; до и в процессе терапии антрациклинами и/или трастузумабом необходим контроль ФВлж с помощью ЭхоКГ с частотой 1 раз в 3 мес. (или чаще при наличии показаний).
-
8 Режим с уплотненным введением химиопрепаратов рекомендуется использовать при быстро пролиферирующих (с высоким Ki67 и / или G3) вариантах РМЖ.
-
9 Рекомендуется больным, получившим неоадъювантную ХТ антрациклинами и / или таксана-ми и трастузумабом (± пертузумабом) в стандартном объеме, при наличии инвазивной резидуальной опухоли, соответствующей ypT≥ 1b или ypN + или RCB II–III. В исследовании KATHERINE адъювантная ГТ и адьювантная ЛТ проводились одновременно с введением трастузумаба эмтанзина. При досрочном прекращении введения трастузумаб эмтанзина в связи с токсичностью следует продолжить введение трастузумаба до общей продолжительности анти-HER2 терапии 1 год, включая дооперационный этап.
-
10 Возможно использование лекарственной формы «трастузумаб + пертузумаб» для подкожного введения; нагрузочная доза составляет 1200 мг пертузумаба / 600 мг трастузумаба, далее — 600 мг пертузумаба / 600 мг трастузумаба, вводится через 3 нед. после нагрузочной дозы и повторяется каждые 3 нед.
-
2.2.1.5. Адъювантная гормонотерапия рака молочной железы
Адъювантная ГТ показана всем больным гормонозависимым РМЖ независимо от возраста, функции яичников, стадии заболевания, HER2 статуса, проведения нео-/адъювант-ной ХТ или анти-HER2-терапии. Гормонозависимыми считаются опухоли с определяемой экспрессией РЭ в ≥1% клеток инвазивного РМЖ. Выбор режима ГТ зависит от функции яичников (табл. 6, 7).
Таблица 6. Лекарственные препараты, рекомендуемые для адъювантной гормонотерапии рака молочной железы.
|
антиэстрогены 1 |
тамоксифен 20 мг внутрь ежедневно |
|
ингибиторы ароматазы 2,3 |
летрозол 2,5 мг внутрь ежедневно анастрозол 1 мг внутрь ежедневно эксеместан 25 мг внутрь ежедневно |
|
аналоги ГРГ 4 |
гозерелин 3,6 мг п/к 1 раз в 28 дней трипторелин 3,75 мг в/м 1 раз в 28 дней бусерелин 3,75 мг в/м 1 раз в 28 дней лейпрорелин 3,75 мг в/м 1 раз в 28 дней |
-
1 Могут использоваться независимо от функции яичников; овариальная супрессия в дополнение к антиэстрогенам рекомендуется больным с сохранной функцией яичников при наличии факторов высокого риска рецидива (см. табл. 7); определение мутаций гена CYP2D6 для решения вопроса о назначении тамоксифена в рутинной практике не рекомендуется; следует избегать совместного назначения тамоксифена и ингибиторов CYP2D6.
-
2 Рекомендуется использовать только у больных в постменопаузе, противопоказаны больным с сохранной функцией яичников; у больных с сохранной функцией яичников для назначения ингибиторов ароматазы требуется овариальная супрессия.
-
3 Дольковый рак более чувствителен к ингибиторам ароматазы.
-
4 Рекомендуется использовать только у больных с сохранной функцией яичников при необходимости овариальной супрессии; назначаются в сочетании с антиэстрогенами или ингибиторами ароматазы; аналоги ГРГ рекомендуется вводить 1 раз в 28 дней.
Таблица 7. Рекомендуемые режимы адъювантной гормонотерапии рака молочной железы в зависимости от функции яичников.
|
Режимы гормонотерапии |
Примечания |
|
Пременопаузат |
|
|
тамоксифен 5 лет |
|
|
тамоксифен 2-3 года -> ингибиторы ароматазы 2–3 года (суммарно — 5 лет) |
Для больных, достигших стойкой менопаузы к моменту окончания приема тамоксифена |
|
тамоксифен 10 лет |
При наличии по крайней мере одного фактора неблагоприятного прогноза 1 |
|
тамоксифен 5 лет -> ингибиторы ароматазы 2–3 года |
Для больных, достигших стойкой менопаузы к моменту окончания приема тамоксифена, при наличии по крайней мере одного фактора неблагоприятного прогноза 1 |
|
овариальная супрессия + тамоксифен или ингибиторы ароматазы 5 лет |
При наличии по крайней мере одного фактора неблагоприятного прогноза 1,2,3,4 |
|
Постменопауза |
|
|
тамоксифен 5 лет |
|
|
ингибиторы ароматазы 5 лет |
|
|
Режимы гормонотерапии |
Примечания |
|
ингибиторы ароматазы 2–3 года, далее — тамоксифен 2–3 года |
При использовании режимов переключения предпочтительно на первом этапе использовать ингибиторы ароматазы |
|
тамоксифен 2-3 года -> ингибиторы ароматазы 2–3 года (суммарно — 5 лет) |
|
|
ингибиторы ароматазы 7 лет |
При наличии по крайней мере одного фактора неблагоприятного прогноза 1 |
|
тамоксифен 10 лет |
При наличии по крайней мере одного фактора неблагоприятного прогноза 1 |
|
тамоксифен 5 лет -> ингибиторы ароматазы 2 года |
При наличии по крайней мере одного фактора неблагоприятного прогноза 1 |
1 К факторам неблагоприятного прогноза относятся Т3–4, N +, G3, гиперэкспрессия/амплифика-ция HER2, высокий Ki67, лимфоваскулярная инвазия.
2 Рекомендуемая продолжительность овариальной супрессии составляет 5 лет.
3 Овариальная супрессия необходима в течение всего срока приема ингибиторов ароматазы.
4 При промежуточном прогнозе (T2N0 и G2) в случае назначения овариальной супрессии (в сочетании с тамоксифеном или ингибиторами ароматазы) возможен отказ от адъювантной ХТ.
Терапия ингибиторами ароматазы ассоциируется с меньшей частотой тромбоэмболических осложнений и рака эндометрия и с большей частотой остеопороза (и связанных с ним переломов костей) и осложнений со стороны сердечнососудистой системы по сравнению с тамоксифеном. Ингибиторы ароматазы третьего поколения (летрозол, анастрозол, эксеместан) равно эффективны и сопоставимы по профилю токсичности.
Критериями постменопаузы являются:
-
• билатеральная овариэктомия;
-
• возраст≥60 лет;
-
• возраст<60 лет:
-
– в отсутствие ХТ, терапии тамоксифеном или торемифеном и овариальной супрессии: аменорея в течение≥12 мес. в сочетании с постменопаузальными уровнями ФСГ и эстрадиола;
-
– в процессе терапии тамоксифеном или торемифеном: постменопаузальные уровни ФСГ и эстрадиола.
Аменорея, развившаяся в процессе или по окончании ХТ (нео-/адъювантной), не является достаточным признаком постменопаузы, и для оценки функции яичников необходимо определение ФСГ и эстрадиола.
Для достижения овариальной супрессии могут быть использованы следующие методы:
-
• лекарственный (аналоги ГРГ; см. табл. 6):
– вызывает обратимое подавление функции яичников;
– не всегда обеспечивает полное подавление функции яичников, особенно у женщин молодого возраста; для подтверждения полной овариальной супрессии необходимо определение эстрадиола в сыворотке крови 1 раз в 3–6 мес.; определение ФСГ в период лечения аналогами ГРГ неинформативно; прием ингибиторов
ароматазы следует начинать через 6–8 нед. после первого введения аналогов ГРГ;
– аналоги ГРГ рекомендуется вводить ежемесячно;
-
• хирургический (билатеральная овариэктомия); вызывает необратимое подавление функции яичников;
-
• лучевой; вызывает необратимое подавление функции яичников.
-
2.2.1.6. Остеомодифицирующие препараты в адъювантной терапии
У молодых женщин, особенно не завершивших репродуктивную функцию, для достижения овариальной супрессии рекомендуется назначение аналогов ГРГ, подавляющих функцию яичников обратимо.
Больным гормонозависимым РМЖ в постменопаузе (в т. ч. получающим овариальную супрессию) с целью профилактики остеопороза и снижения риска рецидива болезни рекомендуется назначить:
-
• бисфосфонаты (золедронат 4 мг в/в 1 раз в 6 мес.) в течение 2–3 лет;
-
• колекальциферол 400–800 МЕ/сут. внутрь ежедневно+ кальция карбонат 500– 1000 мг/сут. внутрь ежедневно длительно;
-
• контроль минеральной плотности костей (денситометрия) 1 раз в год.
-
2.2.1.7. Неоадъювантная лекарственная терапия первично операбельного рака молочной железы
Примечание: Оптимальным является начало терапии остеомодифицирующими агентами не позднее 6 мес. после начала адъювантной ГТ.
Очередность лекарственного и хирургического лечения не влияет на безрецидивную и общую выживаемость. Неоадъювантная лекарственная терапия первично операбельного РМЖ позволяет:
-
1) выполнить органосохраняющую операцию и/или улучшить косметический эффект;
-
2) оценить эффект лекарственной терапии и своевременно прекратить ее в случае прогрессирования (с выполнением хирургического лечения);
-
3) оценить выраженность патоморфологического ответа и назначить постнеоадъювантную терапию.
Неоадъювантная лекарственная (химиотерапия±анти-HER2) терапия может быть рекомендована при соблюдении следующих условий:
-
• доказанный инвазивный первично операбельный РМЖ (T0–1N1M0, T2N0M0, T2N1M0, T3N0M0, T3N1M0);
-
– тройной негативный фенотип или HER2-положительный статус с целью выполнения органосохраняющей операции, определения прогноза и индивидаулизации постнеоадъювантной терапии при наличии резидуальной опухоли;
-
– может быть рассмотрена у больных люминальным В раком высокого риска (G3, высокий Ki67) при наличии четких показаний для проведения ХТ данного объема и желании больной выполнить органосохраняющую операцию;
-
• согласие больной на выполнение органосохраняющей операции; с пациенткой должны быть обсуждены необходимость ЛТ в случае выполнения органосохраняющего лечения, а также вероятность повторной операции при обнаружении резидуальной опухоли в краях резекции.
При отсутствии достаточной информации (например, о размерах опухолевого узла, состоянии подмышечных лимфоузлов, наличии инвазивного компонента при внутрипротоковом РМЖ) на первом этапе рекомендуется оперативное лечение с изучением удаленной опухоли и патоморфологическим стадированием.
«Тестовый» курс гормонотерапии
Больным в менопаузе люминальным HER2-негативным РМЖ T1–3N0–1 стадий при планировании на первом этапе хирургического лечения на период выполнения предоперационных обследований и подготовки к операции может быть назначен короткий (в течение 2–3 нед.) «тестовый» курс ГТ ингибиторами ароматазы. Определение Ki67 в динамике (в материале биопсии и в послеоперационном материале первичной опухоли после «тестового» курса предоперационной ГТ) является дополнительным фактором прогноза и предсказывающим фактором чувствительности к ГТ (табл. 3). Клинически значимым является уровень Ki67 в послеоперационном материале<10%, что позволяет отнести данный клинический случай к прогностически благоприятному и при отсутствии факторов неблагоприятного прогноза (G3, N2) отказаться от адъювантной ХТ в пользу адъювантной ГТ. Уровень Ki67 в послеоперационном материале>30% свидетельствует о менее благоприятном прогнозе и меньшей чувствительности к ГТ и является аргументом в пользу назначения адъювантной ХТ в рамках показаний, изложенных в табл. 3, особенно при наличии других факторов неблагоприятного прогноза (G3, N+). Уровень Ki67 в послеоперационном материале от 10% до 30% имеет неопределенное прогностическое значение, и решение вопроса о назначении адъювантной ХТ должно приниматься на основании стандартных клинико-морфологических признаков (табл. 3).
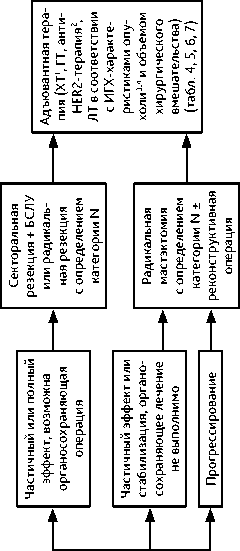
Перед началом неоадъювантной лекарственной терапии должно быть проведено полноценное клинико-лабораторное обследование (см. раздел 2.1. «Диагностика»), в том числе биопсия опухоли с гистологическим исследованием и определением РЭ, РП, HER2 и Ki67. Алгоритм лечебно-диагностических мероприятий при первично операбельном РМЖ в случае неоадъювантной лекарственной терапии представлен на рис. 3 и 4.
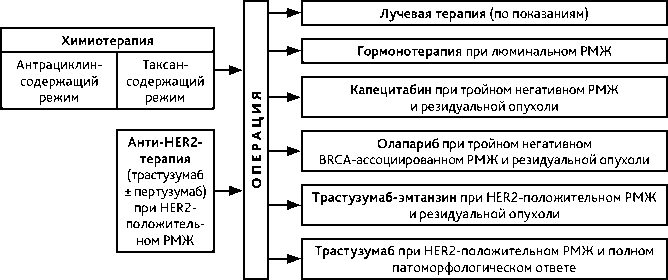
Рисунок 3. Рекомендуемая последовательность использования различных лечебных подходов в случае неоадъювантной терапии.
Режимы неоадъювантной лекарственной терапии представлены в табл. 8. Основные принципы неоадъювантной лекарственной терапии:
-
• все рекомендуемые курсы ХТ следует проводить до операции в полных дозах с соблюдением заданных интервалов, так как это повышает вероятность достижения полной морфологической регрессии;
-
• если все запланированные курсы ХТ проведены до операции, адъювантная ХТ, как правило, не назначается. Больным РМЖ с тройным негативным фенотипом, получившим неоадъювантную ХТ в стандартном объеме, при наличии инвазивной резидуальной опухоли рекомендуется адъювантная ХТ капецитабином, при наличии герминальных мутаций BRCA1/2 — олапарибом. Больным HER-2 позитивным РМЖ при наличии резидуальной опухоли, соответствующей RCB II–III или ypT≥1b или ypN+, в качестве постнеоадъювантной терапии рекомендуется трастузумаб эмтанзин (табл. 4, 5);
-
• если по каким-либо причинам на дооперационном этапе не удалось провести все запланированные курсы ХТ, то недостающие курсы проводятся после операции;
-
• на 6–8 неделе проведения неоадъювантной терапии целесообразно оценить промежуточный эффект лечения с целью исключения возможного прогрессирования; оценку эффекта следует производить с помощью осмотра и инструментальных методов, зафиксировавших патологические изменения в молочной железе и регионарных зонах до начала лечения;
-
• после завершения неоадъювантной терапии при отсутствии клинических признаков прогрессирования болезни оценку эффекта следует производить с помощью осмотра и инструментальных методов, зафиксировавших патологические изменения в молочной железе и регионарных зонах до начала лечения.
Неоадъювантная ХТ при первично операбельном люминальном А варианте РМЖ не рекомендуется.
sy ^ ' tu
1 cum
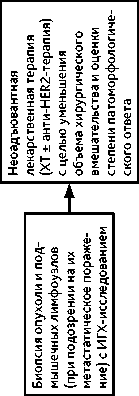

Рисунок 4. Рекомендуемая тактика лечения первично операбельного РМЖ (0, I, IIA, IIB, IIIA стадии) в случае неоадъювантной лекарственной терапии.
Таблица 8. Рекомендуемые режимы неоадъювантной лекарственной терапии рака молочной железы.
|
HER2-отрицательный |
|
|
ACx4 ^ Dx4 1 |
АС (доксорубицин 60 мг/м 2 в/в в 1-й день + циклофосфамид 600 мг/м 2 в/в в 1-й день) 1 раз в 3 нед., 4 цикла -> доцетаксел 75 мг/м 2 в/в в 1-й день 1 раз в 3 нед., 4 цикла |
|
ACx4 ^ Px12 1,2 |
АС (доксорубицин 60 мг/м 2 в/в в 1-й день + циклофосфамид 600 мг/м 2 в/в в 1-й день) 1 раз в 3 нед., 4 цикла -> паклитаксел 80 мг/м 2 в/в еженедельно, 12 введений |
|
ddACx4 ^ ddPx4 1,3,4 |
АС (доксорубицин 60 мг/м 2 в/в в 1-й день + циклофосфамид 600 мг/м 2 в/в в 1-й день) 1 раз в 2 нед., 4 цикла с первичной Г-КСФ профилактикой -> паклитаксел 175 мг/м 2 в/в в 1-й день 1 раз в 2 нед., 4 цикла с первичной Г-КСФ профилактикой |
|
ddACx4 ^ px12 1,2,3,4, 10 |
АС (доксорубицин 60 мг/м 2 в/в в 1-й день + циклофосфамид 600 мг/м 2 в/в в 1-й день) 1 раз в 2 нед., 4 цикла с первичной Г-КСФ профилактикой ^ паклитаксел 80 мг/м 2 в/в еженедельно, 12 введений |
|
ACx4 -> (Р + карбо)x12 1,2,3,4,5 |
АС (доксорубицин 60 мг/м 2 в/в в 1-й день + циклофосфамид 600 мг/м 2 в/в в 1-й день) 1 раз в 2 или 3 нед., 4 цикла -> паклитаксел 80 мг/м 2 в/в еженедельно 12 введений + карбоплатин AUC6 в/в 1 раз в 3 нед. 4 цикла |
|
ddACx4 ^ (Р + карбо) × 12 1, 2, 3, 4, 5 |
АС (доксорубицин 60 мг/м 2 в/в в 1-й день + циклофосфамид 600 мг/м 2 в/в в 1-й день) 1 раз в 2 нед., 4 цикла с первичной Г-КСФ профилактикой -> паклитаксел 80 мг/м 2 в/в + карбоплатин AUC1.5-2 в/в еженедельно, 12 введений |
|
HER2-положительный |
|
|
DCН×6 4,6,7 |
доцетаксел 75 мг/м 2 в/в в 1-й день 1 раз в 3 нед. + карбоплатин AUC6 в/в в 1-й день 1 раз в 3 нед. + трастузумаб 6 мг/кг (нагрузочная доза 8 мг/кг) в/в в 1-й день 1 раз в 3 нед., 6 циклов с первичной Г-КСФ профилактикой |
|
(DCН + пертузумаб)×6 4,6,7,8,10 |
доцетаксел 75 мг/м 2 в/в в 1-й день 1 раз в 3 нед. + карбоплатин AUC6 в/в в 1-й день 1 раз в 3 нед. + трастузумаб 6 мг/кг (нагрузочная доза 8 мг/кг) в/в в 1-й день 1 раз в 3 нед. + пертузумаб 420 мг (нагрузочная доза 840 мг) в/в в 1-й день 1 раз в 3 нед., 6 циклов с первичной Г-КСФ профилактикой |
|
ACx4 ^ (D + трастузумаб)×4 1,6,7,9 |
АС (доксорубицин 60 мг/м 2 в/в в 1-й день + циклофосфамид 600 мг/м 2 в/в в 1-й день) 1 раз в 3 нед., 4 курса -> доцетаксел 75 мг/м 2 в/в в 1-й день 1 раз в 3 нед. + трастузумаб 6 мг/кг (нагрузочная доза 8 мг/кг) в/в в 1-й день 1 раз в 3 нед., 4 цикла |
|
ACx4 ^ (Р + трастузумаб)×12 1,2,6,7,9 |
АС (доксорубицин 60 мг/м 2 в/в в 1-й день + циклофосфамид 600 мг/м 2 в/в в 1-й день) 1 раз в 3 нед., 4 курса ^ паклитаксел 80 мг/м 2 в/в еженедельно, 12 введений + трастузумаб 2 мг/кг (нагрузочная доза 4 мг/кг) в/в еженедельно 12 введений |
|
ddACx4 ^ (Р + трастузумаб)×12 1,2,3,4,6,7,9 |
АС (доксорубицин 60 мг/м 2 в/в в 1-й день + циклофосфамид 600 мг/м 2 в/в в 1-й день) 1 раз в 2 нед., 4 курса с первичной Г-КСФ профилактикой -> паклитаксел 80 мг/м 2 в/в еженедельно, 12 введений + трастузумаб 2 мг/кг (нагрузочная доза 4 мг/кг) в/в еженедельно 12 введений |
|
ddACxdd4 -> (Р + трастузумаб)×4 1,3,4,6,7,9 |
АС (доксорубицин 60 мг/м 2 в/в в 1-й день + циклофосфамид 600 мг/м 2 в/в в 1-й день) 1 раз в 2 нед., 4 цикла с первичной Г-КСФ профилактикой -> паклитаксел 175 мг/м 2 в/в в 1-й день 1 раз в 2 нед., 4 цикла + трастузумаб 2 мг/кг (нагрузочная доза 4 мг/кг) в/в еженедельно, 8 введений с первичной Г-КСФ профилактикой |
|
АСх4 -> (D + трастузумаб + пертузумаб)×4 1,3,4,6,7,8,9,10 |
АС (доксорубицин 60 мг/м 2 в/в в 1-й день + циклофосфамид 600 мг/м 2 в/в в 1-й день) 1 раз в 2-3 нед., 4 цикла -> доцетаксел 75 мг/м 2 в/в в 1-й день 1 раз в 3 нед. или паклитаксел 80 мг/м 2 в/в еженедельно, 12 введений + трастузумаб 6 мг/кг (нагрузочная доза 8 мг/кг) в/в в 1-й день 1 раз в 3 нед. + пертузумаб 420 мг (нагрузочная доза 840 мг) в/в в 1-й день 1 раз в 3 нед., 4 цикла |
-
1 Доксорубицин может быть заменен на эпирубицин в курсовой дозе 90–100 мг /м 2 (режим ЕС).
-
2 При использовании еженедельных введений паклитаксела объем стандартной премедикации может быть сокращен (на усмотрение лечащего врача) и проводиться по схеме: 1–2-й курсы — дексаметазон 10 мг в /м или внутрь за 12 и 6 часов до введения паклитаксела, блокаторы рецепторов H1 (дифенгидрамин 50 мг или эквивалентные дозы аналогов) в / в струйно за 30–60 мин. до введения паклитаксела, блокаторы рецепторов H2 (фамотидин 50 мг или эквивалентные дозы аналогов) в / в струйно за 30–60 мин. до введения паклитаксела. При отсутствии реакций гиперчувствительности на первых двух курсах в дальнейшем возможно введение дексаметазона 8 мг в / в за 30–60 мин. до введения паклитаксела, а введение блокаторов H1 / H2 гистаминовых рецепторов — только в случае предшествовавших реакций гиперчувствительности. Введение паклитаксела может проводиться при АЧН ≥ 1,0 × 10 9 /л и количестве тромбоцитов ≥ 100,0 × 10 9 /л.
-
3 Режим с уплотненным введением химиопрепаратов следует рассмотреть при быстро пролиферирующих (с высоким Ki67 и / или G3) вариантах РМЖ.
-
4 Рекомендуется профилактическое назначение Г-КСФ (филграстим 5 мкг /кг п /к через 24–72 часа после окончания введения химиопрепаратов и до восстановления нормального числа нейтрофилов после надира или пэгфилграстим 6 мг или эмпэгфилграстим 7,5 мг п /к, не ранее чем через 24 часа после окончания ХТ и не позднее чем за 14 дней до начала очередного курса ХТ).
-
5 Режимы с включением производных платины могут быть использованы при тройном негативном фенотипе.
-
6 Введение анти-HER2 препаратов (трастузумаба, пертузумаба) должно начинаться одновременно с безантрациклиновым таксан-содержащим режимом.
-
7 Возможно использование лекарственной формы трастузумаба для п /к введения в дозе 600 мг /5 мл (независимо от массы тела пациента) 1 раз в 3 нед.; нагрузочная доза не требуется.
-
8 Режим может быть использован в качестве неоадъювантной терапии при опухолях≥ Т2 или N +.
-
9 Не рекомендуется одновременное введение антрациклинов (доксорубицина, эпирубицина) и анти-HER2 препаратов (трастузумаба, пертузумаба) ввиду высокого риска кардиотоксичности; до и в процессе терапии антрациклинами и /или трастузумабом необходим контроль ФВлж с помощью ЭхоКГ с частотой 1 раз в 3 мес. (или чаще при наличии показаний).
-
10 Возможно использование лекарственной формы «трастузумаб + пертузумаб» для подкожного введения; нагрузочная доза составляет 1200 мг пертузумаба / 600 мг трастузумаба, далее — 600 мг пертузумаба / 600 мг трастузумаба, вводится через 3 нед. после нагрузочной дозы и повторяется каждые 3 нед.
-
2.2.2. Местнораспространенный первично не операбельный инвазивный рак молочной железы (стадии IIIA (кроме T3N1M0), IIIB и IIIC, в т. ч. инфильтративно-отечная форма)
Рак молочной железы стадий IIIA (кроме T3N1M0), IIIB и IIIC, в т. ч. инфильтративноотечная форма является первично не операбельным и требует лекарственной терапии в качестве первого этапа лечения. Основными целями неоадъювантной лекарственной терапии являются уменьшение размеров опухоли с целью достижения операбельного состояния и получение прогностической информации, основанной на степени выраженности лекарственного патоморфоза и необходимой для индивидуализации постнеоадъювантной терапии. Локальное лечение (хирургическое, лучевое) на первом этапе не показано. Тактика лечения местно-распространенного первично не операбельного РМЖ представлена на рис. 3, 5.
Первичное обследование проводится в стандартном объеме (см. раздел 2.1), включая дополнительные диагностические методы, позволяющие исключить наличие отдаленных метастазов, вероятность которых у данной категории больных значительно выше, чем у больных с первично операбельным процессом (см. раздел 2.1. «Диагностика»).
Неоадъювантная лекарственная терапия проводится по тем же правилам, что и при первично операбельном РМЖ (табл. 8). Больным в менопаузе с люминальным подтипом РМЖ может быть рекомендована неоадъювантная ГТ, которую следует проводить в течение 4–8 мес. или до достижения максимального эффекта. Препаратами выбора для неоадъювантной ГТ являются ингибиторы ароматазы.
Алгоритм назначения адъювантной лекарственной терапии аналогичен таковому при первично операбельном РМЖ:
-
• адъювантная ХТ, как правило, не назначается, если все запланированные курсы проведены до операции; больным РМЖ с тройным негативным и HER2-положительным фенотипом, получившим неоадъювантную ХТ антрациклинами и таксанами в полном объеме, при наличии резидуальной опухоли может быть назначена постнеоадъювантная лекарственная терапия капецитабином (при тройном негативном РМЖ), олапарибом (при тройном негативном BRCA-ассоциированном РМЖ) или трастузумабом эмтанзином (при HER2-положительном РМЖ) (табл. 4, 5);
-
• адъювантная ГТ назначается всем больным с гормонозависимыми опухолями (см. раздел 2.2.1.4., табл. 6, 7);
-
• адъювантная анти-HER2-терапия назначается всем больным при HER2-положитель-ных опухолях.
-
2.2.3. Наблюдение после первичного лечения раннего и местнораспространенного рака молочной железы
Основной целью наблюдения является максимально ранее выявление местных рецидивов и рака контралатеральной молочной железы, так как это обеспечивает возможность радикального лечения. Наблюдение после первичного лечения предполагает осмотр и выяснение жалоб от 1 до 4 раз в год (в зависимости от конкретной клинической ситуации) в течение первых 5 лет, далее — ежегодно.
Рекомендуется ежегодно выполнять двухстороннюю (в случае органосохраняющей операции) или контралатеральную маммографию в сочетании с УЗИ регионарных зон и области послеоперационного рубца. При отсутствии жалоб и симптомов, подозрительных в отношении прогрессирования болезни, лабораторное и инструментальное обследование (определение опухолевых маркеров, R-графическое, УЗИ, радиоизотопное, КТ, МРТ (в том числе головного мозга), ПЭТ/ КТ) не рекомендуется.
Женщины с неудаленной маткой, получающие адъювантно тамоксифен, должны осматриваться гинекологом ежегодно. Любые патологические состояния, подозрительные в отношении рака эндометрия, подлежат максимально быстрой уточняющей диагностике. Рутинное (в отсутствие жалоб) выполнение УЗИ и биопсии эндометрия (раздельное диагностическое выскабливание) не рекомендуется.
Следуетобращатьособое внимание на отдаленные нежелательныеэффекты, в частности остеопороз, особенно у женщин, длительно получающих ингибиторы ароматазы, а также достигших ранней менопаузы в результате противоопухолевой терапии. Этой категории пациентокпоказаноежегодное выполнение денситометрии и профилактическое назначение препаратов кальция, витамина D и бисфосфонатов (см. раздел 2.2.1.5). Следует информировать пациенток о пользе здорового образа жизни, включающего рациональную диету, достижение и поддержание идеальной массы тела, ведение активного образа жизни.
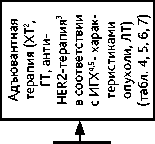
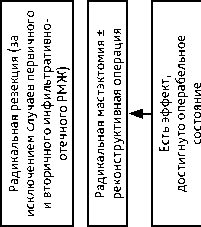


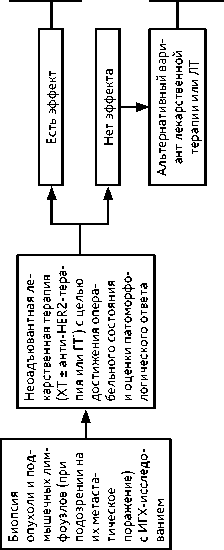

Рисунок 5. Рекомендуемая тактика лечения местнораспространенного первично не операбельного РМЖ (стадии IIIA (кроме T3N1M0), IIIB и IIIC, в т. ч. инфильтративно-отечная форма).
3. РЕЦИДИВНЫЙ И МЕТАСТАТИЧЕСКИЙ РАК МОЛОЧНОЙ ЖЕЛЕЗЫ 3.1. Диагностика
При наличии клинических подозрений необходимо подтверждение диагноза с помощью инструментальных методов обследования с выполнением общего и биохимического анализов крови (см. раздел 2.1. «Диагностика»). Морфологическое (гистологическое или цитологическое) исследование первичной опухоли с определением РЭ, РП, HER2 и Ki67 должно выполняться во всех случаях впервые выявленного метастатического РМЖ, а также во всех возможных случаях в метастатических и рецидивных очагах при прогрессировании после первичного лечения раннего и местно-распространенного РМЖ.
Всем больным показано генетическое тестирование с определением герминальных мутаций BRCA1/2 (если не проводилось ранее) для решения вопроса об объеме возможного хирургического лечения (при рецидивном РМЖ) и назначении ингибиторов PARP (при метастатическом HER2-отрицательном РМЖ).
-
У больных метастатическим гормонозависимым HER2-негативным РМЖ целесообразно определение мутаций в гене PIK3CA для решения вопроса о назначении алпелисиба в комбинации с фулвестрантом (табл. 9).
-
У больных метастатическим тройным негативным РМЖ, не получавших лечение по поводу метастатической болезни, целесообразно определение уровня экспрессии PD-L1 на иммунокомпетентных клетках (первичной опухоли или, предпочтительно, биопсийного материала из метастатического очага) с помощью теста Ventana SP142 или подсчет CPS при выполнении тестирования клоном 22С3 на платформе DACO для решения вопроса о назначении дополнительно к химиотерапии атезолизумаба или пембролизумаба (табл. 10).
-
3.2. Лечение изолированных местных рецидивов
Терапия изолированных местных рецидивов имеет целью излечение и должна проводиться аналогично лечению первичной опухоли с подключением необходимых методов диагностики (клиническое обследование с целью уточнения степени распространения болезни, определение РЭ, РП, HER2 и Ki67 в рецидивной опухоли; см. раздел 2.1 «Диагностика») и лечения (см. раздел 2.2 «Лечение»). После удаления изолированного местного рецидива рекомендуется назначение лекарственной терапии, выбор которой должен быть индивидуальным и учитывать иммунофенотип первичной и рецидивной опухоли, предшествующее нео-/адъювантное лечение и срок ремиссии, общее состояние больного, в т. ч. остаточные явления токсичности ранее проведенного лечения. Рекомендуется:
-
• при тройном негативном фенотипе: адъювантная ХТ (необходимо учесть суммарную дозу антрациклинов, если они назначались ранее) (табл. 4);
-
• при люминальном HER2-отрицательном фенотипе: только адъювантная ГТ; выбор препарата определяется предшествующей ГТ, если таковая проводилась, и функцией яичников (табл. 7);
-
• при HER2-положительном фенотипе: ХТ+ анти-HER2-терапия± ГТ (в зависимости от уровня экспрессии РЭ и РП) (табл. 5).
-
3.3. Лечение метастатического рака молочной железы
Следует рассмотреть назначение ЛТ во всех случаях, когда она не проводилась ранее, а также при наличии возможности дополнительного безопасного облучения пораженной зоны.
Наблюдение после лечения по поводу местных рецидивов аналогично таковому при первичном РМЖ.
Лечение метастатической болезни является паллиативным и направлено на улучшение качества жизни и увеличение ее продолжительности. Основным методом лечения метастатической болезни является лекарственная терапия. Единого стандарта лечения метастатического РМЖ не существует. Выбор варианта лекарственной терапии осуществляется с учетом биологических маркеров (экспрессия РЭ и РП, HER2, Ki67, мутации PIK3CA, экспрессия PD-L1, герминальные мутации BRCA1/2) и клинико-анамнестических особенностей больного. До начала терапии необходимо клинико-лабораторное обследование для определения степени распространенности заболевания и оценки функции внутренних органов (см. раздел 2.1. «Диагностика»).
Системная терапия при необходимости может дополняться локальными видами лечения (лучевым и/или хирургическим).
При метастазах в головном мозге в сочетании с отсутствием иных (экстракраниальных) проявлений болезни, а также при стабилизации или регрессии экстракраниальных метастазов в результате эффективной противоопухолевой лекарственной терапии целесообразно проведение локального лечения метастазов в головном мозге в соответствии с действующими Клиническими рекомендациями и сохранение режима проводимой противоопухолевой лекарственной терапии (при отсутствии неприемлемой токсичности).
При метастазах в костях показано назначение ОМА:
-
• золедронат 4 мг в/в 1 раз в 4–12 нед.
-
• памидронат 90 мг в/ в 1 раз в 3–4 нед.
-
• ибандронат 6 мг в / в 1 раз в 3–4 нед. или 50 мг / сут. внутрь ежедневно
-
• клодронат 1500 мг в/в 1 раз в 4 нед. или по 300 мг в/в в течение 5–7 дней каждые 4 нед. или 1600 мг внутрь ежедневно
-
• деносумаб 120 мг п/ к 1 раз в 4 нед.
-
3.3.1. Лекарственная терапия метастатического гормонозависимого рака молочной железы (гормонотерапия)
Подробнее — см. раздел «Использование остеомодифицирующих агентов для профилактики и лечения патологии костной ткани при злокачественных новообразованиях».
Методом выбора терапии гормонозависимого (люминального) РМЖ является ГТ даже при наличии висцеральных метастазов. Исключение составляют:
-
• быстропрогрессирующие варианты РМЖ, сопровождающиеся висцеральным кризом, в том числе развившимся в процессе предшествующих линий ГТ;
-
• иные клинические ситуации, требующие максимально быстрого достижения противоопухолевого эффекта;
-
• случаи исчерпанности возможностей ГТ.
Признаками висцерального криза являются:
-
• множественное метастатическое поражение внутренних органов;
-
• клинические и/или лабораторные признаки нарушения функции внутренних органов, создающие угрозу жизни пациента и требующие быстрого достижения противоопухолевого эффекта.
Асцит и плеврит не являются признаками висцерального криза и не должны служить основанием для отказа от ГТ (в пользу ХТ) в отсутствие клинических и/или лабораторных признаков нарушения функции внутренних органов после локального воздействия (плевроцентез, лапароцентез).
После завершения ХТ, назначенной в связи с висцеральным кризом, возможно назначение «поддерживающей» гормонотерапии с учетом предшествующих линий.
Алгоритм назначения лекарственной терапии при метастатическом гормонозависимом РМЖ представлен на рис. 6.
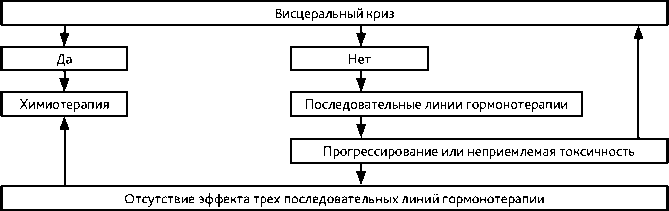
Рисунок 6. Рекомендуемый алгоритм назначения лекарственной терапии при метастатическом гормонозависимом раке молочной железы.
ГТ одной линии проводится до прогрессирования болезни (данные осмотра и инструментального обследования или появление/усиление симптомов, связанных с опухолевым ростом) или признаков неприемлемой токсичности. В отсутствие признаков висцерального криза рекомендуется последовательное назначение всех возможных линий ГТ. Неэффективность трех последовательных линий ГТ свидетельствует об устойчивости к данному виду лечения и необходимости назначения ХТ. При выборе варианта ГТ следует учитывать функцию яичников (пре- или постменопауза), предшествующую ГТ и ее эффективность, сопутствующую патологию. Больным с сохранной функцией яичников рекомендуется выполнить овариальную супрессию любым доступным способом (см. раздел 2.2.1.4.) и назначить ГТ, рекомендованную больным в постменопаузе (рис. 7, табл. 9). В отдельных случаях (например, при отказе больной от овариальной супрессии) могут быть назначены селективные модуляторы РЭ. Одновременное использование ХТ и ГТ не рекомендуется.
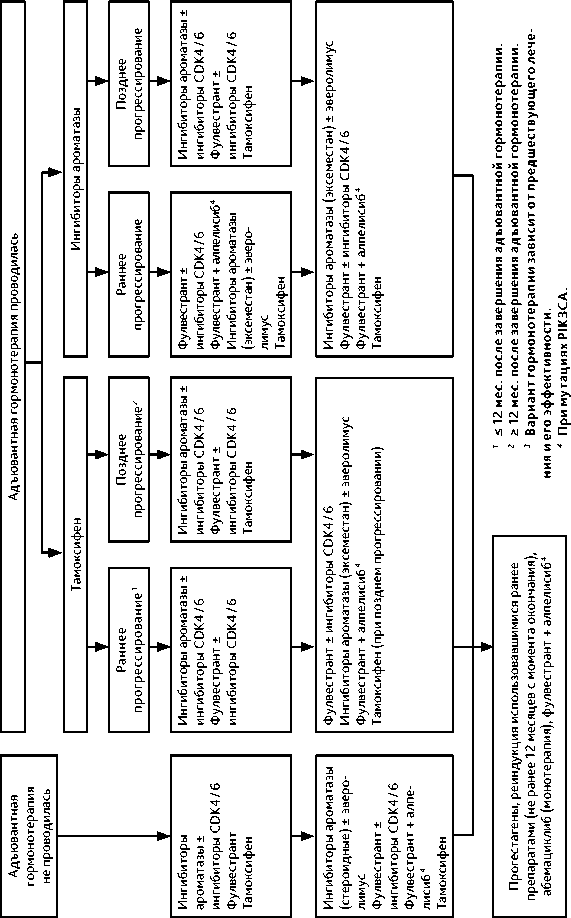
Рисунок 7. Рекомендуемый алгоритм выбора варианта гормонотерапии люминального HER2-отрицательного рака молочной железы у больных в постменопаузе в зависимости от предшествующего лечения и его эффективности.
1 линия 3
2 линия 3
3 линия 3
Таблица 9. Рекомендуемые режимы лекарственной терапии метастатического гормонозависимого HER2-отрицательного рака молочной железы (гормонотерапия).
|
аналоги ГРГ 1 |
гозерелин 3,6 мг п/к 1 раз в 28 дней бусерелин 3,75 мг в/м 1 раз в 28 дней лейпрорелин 3,75 мг в/м 1 раз в 28 дней любой из препаратов назначается на весь период ГТ |
|
ингибиторы ароматазы третьего поколения + ингибиторы CDK4/6 2,3,4 |
анастрозол 1 мг или летрозол 2,5 мг или эксеместан 25 мг внутрь ежедневно + палбоциклиб 125 мг или рибоциклиб 600 мг внутрь в 1–21-й дни, интервал 1 нед. (длительность цикла 28 дней) или абемациклиб по 300 мг/сут. внутрь (в 2 приема) ежедневно до прогрессирования или неприемлемой токсичности |
|
фулвестрант + ингибиторы CDK4/6 2,3,4 |
фулвестрант 500 мг в/м 1 раз в мес. (в первый месяц — по 500 мг в 1-й и 15-й дни) + палбоциклиб 125 мг или рибоциклиб 600 мг внутрь в 1–21-й дни, интервал 1 нед. (длительность цикла 28 дней) или абемациклиб по 300 мг внутрь (в два приема) ежедневно до прогрессирования или неприемлемой токсичности |
|
селективные модуляторы рецепторов эстрогенов 5 |
тамоксифен 20 мг внутрь ежедневно до прогрессирования или неприемлемой токсичности торемифен 60 мг внутрь ежедневно до прогрессирования или неприемлемой токсичности |
|
антагонисты рецепторов эстрогенов 2 |
фулвестрант 500 мг в/м 1 раз в мес. (в первый месяц — по 500 мг в 1-й и 15-й дни) (длительность цикла 28 дней) до прогрессирования или неприемлемой токсичности |
|
ингибиторы ароматазы третьего поколения (нестероидные) 2 |
анастрозол 1 мг внутрь ежедневно до прогрессирования или неприемлемой токсичности летрозол 2,5 мг внутрь ежедневно до прогрессирования или неприемлемой токсичности |
|
ингибиторы ароматазы третьего поколения (стероидные) 2 |
эксеместан 25 мг внутрь ежедневно до прогрессирования или неприемлемой токсичности |
|
эксеместан + эвероли-мус 2,6 |
эксеместан 25 мг внутрь ежедневно + эверолимус 10 мг внутрь ежедневно до прогрессирования или неприемлемой токсичности |
|
фулвестрант + алпели-сиб 7 |
фулвестрант 500 мг в/м 1 раз в мес. (в первый месяц — по 500 мг в 1-й и 15-й дни) + алпелисиб 300 мг внутрь ежедневно до прогрессирования или неприемлемой токсичности |
|
прогестагены 2 |
медроксипрогестерон 500–1000 мг внутрь ежедневно до прогрессирования или неприемлемой токсичности Мегестрол 160 мг внутрь ежедневно до прогрессирования или неприемлемой токсичности |
|
абемациклиб 8,9 |
абемациклиб 400 мг внутрь (в два приема) ежедневно до прогрессирования или неприемлемой токсичности |
-
3 При развитии токсичности рекомендуется редукция ежедневной дозы палбоциклиба до 100 мг и 75 мг, рибоциклиба — до 400 мг и 200 мг, абемациклиба — до 200 мг и 100 мг внутрь (в два приема) (см. инструкции по применению препаратов). Не рекомендуется назначение Г-КСФ для профилактики нейтропении, связанной с применением ингибиторов CDK4 / 6.
-
4 Комбинации ингибиторов CDK 4 / 6 с ингибиторами ароматазы или фулвестрантом рекомендуются только при HER2-негативных опухолях и являются предпочтительными опциями первой и второй линий лечения, поскольку обеспечивают значимый выигрыш в безрецидивной и общей выживаемости и обладают приемлемым профилем токсичности.
-
5 Для больных в пременопаузе и менопаузе; определение мутаций гена CYP2D6 для решения вопроса о назначении тамоксифена в рутинной практике не рекомендуется; следует избегать совместного назначения тамоксифена и ингибиторов CYP2D6.
-
6 Для больных в удовлетворительном общем состоянии, с нормальной функцией внутренних органов (в том числе при нормальном уровне глюкозы в крови) при наличии признаков резистентности к нестероидным ингибиторам ароматазы (прогрессирование в процессе адъювантной или лечебной терапии летрозолом /анастрозолом или в ближайшие 12 мес. после завершения приема этих препаратов ± одна линия ХТ).
-
7 Рекомендуется при наличии мутаций PIK3CA больным распространенным гормонозависимым HER2-отрицательным РМЖ с прогрессированием на фоне моно- или комбинированной ГТ. Алпелисиб не следует назначать больным с сахарным диабетом I типа, а также неконтролируемым диабетом II типа. До начала применения алпелисиба следует определить уровень глюкозы плазмы натощак и уровень HbA1c (гликированного гемоглобина). При уровне HbA1c > 7,0 % перед назначением терапии алпелисибом требуется консультация эндокринолога.
-
8 При прогрессировании на фоне ГТ и одной или нескольких линий ХТ.
-
9 При развитии токсичности возможна редукция дозы абемациклиба до 300 мг, 200 мг и 100 мг внутрь (в два приема) (см. инструкцию по применения препарата). Не рекомендуется назначение Г-КСФ для профилактики нейтропении, связанной с применением абемациклиба.
-
3.3.2. Лекарственная терапия метастатическогоHER2-негативного рака молочной железы (химиотерапия)
Больным гормонозависимым HER2-положительным РМЖ, не нуждающимся в немедленном начале ХТ, может быть назначена ГТ ингибиторами ароматазы, тамоксифеном или фулвестрантом в сочетании или без анти-HER2-терапии (табл. 9, 11).
ХТ показана следующим категориям больных:
-
• РМЖ с отрицательными РЭ и РП;
-
• люминальный РМЖ, резистентный к ГТ;
-
• люминальный РМЖ с признаками висцерального криза.
Стандарта ХТ первой линии рецидивного и метастатического РМЖ нет. Выбор режима должен быть индивидуальным и учитывать особенности опухоли и больного, а также состав и эффективность предшествующей, в т. ч. адъювантной/неоадъювантной ХТ, если таковая проводилась. Рекомендуется последовательное назначение химиопрепаратов в монотерапии. В качестве комбинированной терапии могут использоваться антрациклин-содержащие режимы, а также режимы, включающие платиновые производные. Комбинировать между собой антрациклины, таксаны, винорелбин, капецитабин не рекомендуется. В табл. 10 представлены режимы ХТ, рекомендуемые при рецидивном и метастатическом РМЖ.
ХТ с использованием одной и той же комбинации может продолжаться до прогрессирования болезни, доказанного клинически и/или с помощью методов инструментальной диагностики, или неприемлемой/дозолимитирующей токсичности. Длительная стабилизация болезни расценивается как положительный эффект лечения и не должна являться основанием для прекращения или смены терапии в отсутствие серьезной токсичности. Не существует стандартных подходов к проведению второй и последующих линий ХТ, равно как и каких-либо данных, свидетельствующих о преимуществах того или иного препарата или режима. Продолжение ХТ после третьей линии может обсуждаться для больных в удовлетворительном общем состоянии, ответивших на предшествующие линии ХТ.
Таблица 10. Рекомендуемые режимы химиотерапии метастатического HER2-отрицательного рака молочной железы.
Антрациклиновые1,2
-
• АС: доксорубицин 60 мг/м 2 в/в в 1-й день + циклофосфамид 600 мг/м 2 в/в в 1-й день каждые 3 нед.; до прогрессирования или неприемлемой токсичности или достижения суммарной дозы доксорубицина 450–500 мг/м 2 (с учетом нео-/адъювантной терапии);
-
• ЕС: эпирубицин 60–75 мг/м 2 в/в в 1-й день + циклофосфамид 600 мг/м 2 в/в в 1-й день каждые 3 нед.; до прогрессирования или неприемлемой токсичности или достижения суммарной дозы эпирубицина 900 мг/м 2 (с учетом нео-/адъювантной терапии);
-
• доксорубицин 60–75 мг/м 2 в/в в 1-й день каждые 3 нед. до прогрессирования или неприемлемой токсичности или достижения суммарной дозы доксорубицина 450–500 мг/м 2 (с учетом нео-/адъювант-ной терапии);
-
• эпирубицин 60–90 мг/м 2 в/в в 1-й день каждые 3 нед. до прогрессирования или неприемлемой токсичности или достижения суммарной дозы эпирубицина 900 мг/м 2 (с учетом нео-/адъювантной терапии)
-
• пегилированный липосомальный доксорубицин 50 мг/м 2 в/в в 1-й день 1 раз в 4 нед., до прогрессирования или неприемлемой токсичности 3
Таксановые
-
• паклитаксел 80 мг/м 2 в/в еженедельно; до прогрессирования или неприемлемой токсичности 4,5
-
• паклитаксел 90 мг/м 2 в/в 1-й, 8-й, 15-й дни каждые 4 нед; до прогрессирования или неприемлемой токсичности 5
-
• паклитаксел 175 мг/м 2 в/в 1 раз в 3 нед.; до прогрессирования или неприемлемой токсичности 4
-
• доцетаксел 75 мг/м 2 в/в в 1-й день каждые 3 нед.; до прогрессирования или неприемлемой токсичности
-
• паклитаксел 80 мг/м 2 в/в + карбоплатин AUC2 в/в еженедельно; до прогрессирования или неприемлемой токсичности 5
-
• (паклитаксел + альбумин) 260 мг/м 2 в/в в 1-й день каждые 3 нед.; до прогрессирования или неприемлемой токсичности
-
• паклитаксел 90 мг/м 2 в/в в 1-й, 8-й, 15-й дни + бевацизумаб 10 мг/кг в/в в 1-й и 15-й дни каждые 28 дней или 15 мг/кг каждые 21 день до прогрессирования или неприемлемой токсичности 5,6
-
• доцетаксел 75 мг/м 2 в/в в 1-й день каждые 3 нед. + бевацизумаб 15 мг/кг в/в в 1-й день каждые 3 нед.; до прогрессирования или неприемлемой токсичности 6
Другие
-
• капецитабин 2000–2500 мг/м 2 внутрь в 1-й–14-й дни каждые 3 нед.; до прогрессирования или неприемлемой токсичности
-
• эрибулин 1,4 мг/м 2 в/в в 1-й и 8-й дни каждые 3 нед.; до прогрессирования или неприемлемой токсичности
-
• винорелбин 25 мг/м 2 в/в в 1-й и 8-й дни в/в каждые 3 нед.; до прогрессирования или неприемлемой
токсичности
-
• винорелбин 60 мг/м 2 внутрь в 1-й, 8-й, 15-й дни; с 22-го дня — 80 мг/м 2 1 раз в нед.;
-
• гемцитабин 800–1200 мг/м 2 в/в в 1-й, 8-й, 15-й дни каждые 4 нед.; до прогрессирования или неприемлемой токсичности
-
• гемцитабин 800–1000 мг/м 2 в/в в 1-й и 8-й дни + цисплатин 75 мг/м 2 в/в в 1-й день (или карбоплатин AUC4–5 в/в в 1-й день) каждые 3 нед.; до прогрессирования или неприемлемой токсичности
-
• цисплатин 75 мг/м 2 в/в в 1-й день или карбоплатин AUC6 в/в в 1-й день каждые 3 нед.; до прогрессирования или неприемлемой токсичности
-
• циклофосфамид 50 мг внутрь ежедневно + метотрексат по 2,5 мг внутрь 2 раза в день в 1-й и 2-й дни каждой недели (метрономный режим); до прогрессирования или неприемлемой токсичности
-
• иксабепилон 40 мг/м 2 в/в в 1-й день каждые 3 нед. (при резистентности к антрациклинам, таксанам, капецитабину); до прогрессирования или неприемлемой токсичности
-
• иксабепилон 40 мг/м 2 в/в в 1-й день каждые 3 нед. + капецитабин 2000 мг/м 2 внутрь в 1-й–14-й дни каждые
-
3 нед.; до прогрессирования или неприемлемой токсичности 7
-
• CMF: циклофосфамид 100 мг/м 2 внутрь в 1-й–14-й дни + метотрексат 40 мг/м 2 в/в в 1-й и 8-й дни + фторура-цил 600 мг/м 2 в/в в 1-й и 8-й дни каждые 4 нед.; до прогрессирования или неприемлемой токсичности
-
• этопозид 100 мг внутрь в 1-й–10-й дни каждые 3 нед.; до прогрессирования или неприемлемой токсичности
Химиоиммунотерапия
-
• (паклитаксел + альбумин) 100 мг/м 2 в/в в 1-й, 8-й, 15-й дни + атезолизумаб 840 мг в/в в 1-й и 15-й дни каждые 4 нед. или 1200 мг в/в в 1-й день каждые 3 нед. или 1680 мг в/в в 1-й день каждые 4 нед. 8
-
• (паклитаксел + альбумин) 100 мг/м 2 в/в в 1-й, 8-й, 15-й дни каждые 4 нед. + пембролизумаб 200 мг
в/в каждые 3 нед. или 400 мг в/в каждые 6 нед. 9
-
• паклитаксел 90 мг/м 2 в/в в 1-й, 8-й, 15-й дни каждые 4 нед. + пембролизумаб 200 мг в/в каждые 3 нед. или 400 мг в/в каждые 6 нед. 9
-
• гемцитабин 1000 мг/м 2 в/в в 1-й и 8-й дни каждые 3 нед. + карбоплатин AUC2 в/в в 1-й и 8-й дни каждые 3 нед. + пембролизумаб 200 мг в/в каждые 3 нед. или 400 мг в/в каждые 6 нед. 9
-
8 Для больных тройным негативным РМЖ с прогрессированием по прошествии 1 года и более после завершения нео- /адъювантной ХТ в качестве первой линии лечения при экспрессии PD-L1 на ≥ 1 % иммунокомпетентных клеток (определение экспрессии PD-L1 на иммунокомпетентных клетках рекомендуется проводить с помощью теста Ventana SP142).
-
9 Для больных тройным негативным РМЖ с прогрессированием по прошествии 6 мес. и более после завершения нео-/адъювантной ХТ в качестве первой линии лечения при CPS ≥ 10 (определение PD-L1 на иммунокомпетентных клетках рекомендуется проводить с помощью клона 22С3 на платформе DACO).
-
3.3.3. Лекарственная терапия BRCA1/2-ассоциированного HER2-негативного метастатического рака молочной железы
-
3.3.4. Лекарственная терапия метастатического HER2-положительного рака молочной железы
Больным BRCA1/2-ассоциированным HER2-негативным метастатическим РМЖ, получавшим ранее химиотерапию антрациклинами и таксанами с нео-/адъювантной и/или лечебной целью, рекомендуется назначение PARP-ингибиторов (табл. 11). У больных BRCA-ассоциированным гормонозависимым РМЖ оптимальная последовательность назначения PARP-ингибиторов и ГТ (±ингибиторы CDK4/6) не определена; с учетом известного увеличения продолжительности жизни при назначении ГТ в сочетании с ингибиторами CDK4/6 рекомендуется эту опцию использовать в первую очередь.
Таблица 11. Рекомендуемая терапия BRCA1/2-ассоциированного HER2-негативного метастатического рака молочной железы.
олапариб (в таблетках) по 300 мг внутрь ×2 раза в день ежедневно, цикл 28 дней талазопариб 1 мг внутрь ежедневно, цикл 28 дней
Больные HER2-положительным РМЖ должны получать анти-HER2-терапию в сочетании с ХТ или ГТ (при люминальных опухолях) или в самостоятельном виде. Анти-HER2 терапия должна начинаться как можно раньше (с первой линии терапии) и продолжаться как можно дольше. При первом эпизоде прогрессирования на фоне терапии трастузумабом возможно продолжение лечения этим же препаратом со сменой химио-/гормонотерапевтического компонента. Рекомендуемые режимы анти-HER2-терапии представлены в табл. 12.
Таблица 12. Рекомендуемые режимы лекарственной терапии HER2-положительного метастатического рака молочной железы.
I линия
-
• трастузумаб + пертузумаб + таксаны (предпочтительный режим I линии лечения): трастузумаб 6 мг/кг (нагрузочная доза 8 мг/кг) в/в в 1-й день 1 раз в 3 нед. + пертузумаб 420 мг (нагрузочная доза 840 мг) в/в в 1-й день 1 раз в 3 нед. + таксаны (доцетаксел 75 мг/м 2 в/в в 1-й день 1 раз в 3 нед. 6 курсов или паклитаксел 80 мг/м 2 в/в еженедельно 18 введений или паклитаксел 175 мг/м 2 в/в в 1-й день 1 раз в 3 нед. 6 циклов); после завершения химиотерапии таксанами — продолжение анти-HER2-терапии трастузумабом 6 мг/кг в/в в 1-день 1 раз в 3 нед. и пертузумабом 420 мг в/в в 1-й день 1 раз в 3 нед. до прогрессирования или неприемлемой токсичности 1,2,3,10
II линия и последующие линии
-
• трастузумаб-эмтанзин 3,6 мг/кг в/в в 1-й день 1 раз в 3 нед. до прогрессирования или неприемлемой токсичности 4
-
• трастузумаб 2 мг/кг (нагрузочная доза 4 мг/кг) в/в еженедельно или 6 мг/кг (нагрузочная доза 8 мг/кг) в/в в 1-й день каждые 3 нед. (± пертузумаб 420 мг (нагрузочная доза 840 мг) в/в в 1-й день 1 раз в 3 нед., если не назначался ранее) в сочетании с одним из следующих режимов химиотерапии 5,6, 10 : – паклитаксел 80 мг/м 2 в/в в 1-й, 8-й, 15-й дни каждые 4 нед. + карбоплатин AUC2 в/в в 1-й, 8-й, 15-й дни каждые 4 нед. до прогрессирования или неприемлемой токсичности 6 ;
-
– паклитаксел 80 мг/м 2 в/в еженедельно до прогрессирования или неприемлемой токсичности 7 ;
-
– паклитаксел 90 мг/м 2 в/в в 1-й, 8-й, 15-й дни каждые 4 нед. до прогрессирования или неприемлемой токсичности 7 ;
-
– доцетаксел 75 мг/м 2 в/в в 1-й день каждые 3 нед. до прогрессирования или неприемлемой токсичности;
-
– винорелбин 25 мг/м 2 в/в в 1-й и 8-й дни в/в каждые 3 нед. до прогрессирования или неприемлемой токсичности;
-
– винорелбин 60 мг/м 2 внутрь в 1-й, 8-й, 15-й дни; с 22-го дня — 80 мг/м 2 1 раз в нед. до прогрессирования или неприемлемой токсичности;
-
– капецитабин 2000 мг/м 2 внутрь в 1-й–14-й дни каждые 3 нед. до прогрессирования или неприемлемой токсичности;
-
– эрибулин 1,4 мг/м 2 в/в в 1-й и 8-й дни каждые 3 нед. до прогрессирования или неприемлемой токсичности;
-
– гемцитабин 800–1200 мг/м 2 в/в в 1-й, 8-й, 15-й дни каждые 4 нед. до прогрессирования или неприемлемой токсичности;
-
– гемцитабин 800–1000 мг/м 2 в/в в 1-й и 8-й дни + цисплатин 75 мг/м 2 в/в в 1-й день (или карбоплатин AUC4–5 в/в в 1-й день) каждые 3 нед. до прогрессирования или неприемлемой токсичности;
-
– циклофосфамид 50 мг внутрь ежедневно + метотрексат по 2,5 мг внутрь 2 раза в день в 1-й и 2-й дни каждой недели (метрономный режим) до прогрессирования или неприемлемой токсичности;
-
– иксабепилон 40 мг/м 2 в/в в 1-й день каждые 3 нед. (при резистентности к антрациклинам, таксанам, капецитабину) до прогрессирования или неприемлемой токсичности;
-
– этопозид 100 мг внутрь в 1-й–10-й дни каждые 3 нед до прогрессирования или неприемлемой токсичности.
-
• возможно продолжение монотерапии трастузумабом без химиотерапевтического препарата в случае возникновении непереносимой токсичности последнего
или
-
• лапатиниб 1250 мг внутрь ежедневно + капецитабин 2000 мг/м 2 внутрь в 1-й–14-й дни каждые 3 нед. до прогрессирования или неприемлемой токсичности
или
-
• лапатиниб 1000 мг внутрь ежедневно + трастузумаб 2 мг/кг в/в еженедельно (нагрузочная доза 4 мг/кг в/в) или 6 мг/кг (нагрузочная доза 8 мг/кг) в/в 1 раз в 3 нед. до прогрессирования или неприемлемой токсичности.
-
2 Режим может быть рекомендован больным, не получавшим пертузумаб нео- /адъювантно, а также больным, получавшим пертузумаб нео- /адъювантно, если с момента завершения терапии пертузумабом до прогрессирования болезни прошло не менее 1 года.
-
3 Возможно использование лекарственной формы «трастузумаб + пертузумаб» для подкожного введения; нагрузочная доза составляет 1200 мг пертузумаба / 600 мг трастузумаба, далее — 600 мг пертузумаба / 600 мг трастузумаба, вводится через 3 нед. после нагрузочной дозы и повторяется каждые 3 нед.
-
4 Для больных, получавших трастузумаб (± пертузумаб); является предпочтительным в качестве первой линии лечения, если с момента окончания нео- или адъювантной терапии прошло менее 1 года.
-
5 Возможно использование лекарственной формы трастузумаба для п /к введения в дозе 600 мг /5 мл (независимо от массы тела пациента) 1 раз в 3 нед.; нагрузочная доза не требуется.
-
6 До и в процессе терапии трастузумабом необходим контроль ФВлж с помощью ЭхоКГ с частотой 1 раз в 3 мес. (или чаще при наличии показаний).
-
7 При использовании еженедельных введений паклитаксела объем стандартной премедикации может быть сокращен (на усмотрение лечащего врача) и проводиться по схеме: 1–2-й курсы — дексаметазон 10 мг в /м или внутрь за 12 и 6 часов до введения паклитаксела, блокаторы рецепторов H1 (дифенгидрамин 50 мг или эквивалентные дозы аналогов) в /в струйно за 30–60 мин. до введения паклитаксела, блокаторы рецепторов H2 (фамотидин 50 мг или эквивалентные дозы аналогов) в /в струйно за 30–60 мин. до введения паклитаксела. При отсутствии реакций гиперчувствительности на первых двух курсах в дальнейшем возможно введение дексаметазона 8 мг в /в за 30–60 мин. до введения паклитаксела, а введение блокаторов H1 /H2 гистаминовых рецепторов — только в случае предшествовавших реакций гиперчувствительности. Введение паклитаксела может проводиться при АЧН ≥ 1,0 × 10 9 /л и количестве тромбоцитов ≥ 100,0 × 10 9 /л.
-
8 В отсутствие признаков висцерального криза.
-
9 Все препараты используются в стандартных дозах и режимах; назначение ингибиторов ароматазы и фулвестранта возможно женщинам в состоянии менопаузы.
-
3.4. Наблюдение за больными при метастатическом раке молочной железы
-
3.4.1. Наблюдение в процессе лечения. Оценка эффекта
При прогрессировании на фоне одного из режимов лечения следует перейти на другой режим с включением анти-HER2 препаратов.
Наблюдение в процессе лечения имеет целью оценить пользу проводимой терапии (эффект) и ее возможные осложнения (токсичность) и внести необходимые коррективы (смена режима, редукция доз, отмена лечения, назначение симптоматической терапии и т. д.). Наблюдение включает периодический осмотр и оценку различных симптомов, лабораторных данных и результатов инструментального обследования.
Оценку эффекта рекомендуется проводить после каждых 2–3 мес. ГТ и каждых 2–3 курсов ХТ с помощью данных общего осмотра, выяснения жалоб, анализов крови и результатов инструментальных методов обследования, выявивших патологию на этапе первоначальной диагностики. Интервалы между обследованиями могут быть изменены в зависимости от конкретной клинической ситуации. Результаты осмотра и обследования классифицируются следующим образом:
• объективный эффект: существенное уменьшение размеров и / или количества опухолевых очагов; является показанием для продолжения проводимой терапии в отсутствие серьезной токсичности;
• стабилизация болезни: отсутствие значимых изменений размеров и количества опухолевых очагов; при удовлетворительном общем состоянии и хорошей переносимости лечение может быть продолжено;
• прогрессирование заболевания является показанием к смене лечения. При подозрении на прогрессирование болезни по данным осмотра необходимо выполнить уточняющие обследования, в т. ч. с оценкой зон, не исследовавшихся до начала терапии. Признаками прогрессирования являются:
– появление и /или усугубление симптомов, обусловленных опухолевым ростом (например, боли или одышки);
– существенное увеличение размеров или появление новых опухолевых очагов, выявляемых при осмотре;
– ухудшение общего состояния (дифференцировать с токсичностью лечения);
– немотивированная потеря веса (дифференцировать с токсичностью лечения);
– повышение ЩФ, АЛТ, АСТ, билирубина (дифференцировать с токсичностью лечения);
– гиперкальциемия;
– появление новых и /или существенное увеличение имевшихся ранее очагов по данным объективных методов обследования; при оценке результатов рентгенографии, сканирования костей и ПЭТ следует иметь в виду, что процессы репарации метастазов в костях, начавшиеся в результате эффективной противоопухолевой терапии (в сочетании с ОМА), сопровождаются повышенным метаболизмом, что может создавать формальную картину прогрессирования за счет появления на сканограммах новых остеобластических очагов и увеличения накопления РФП в имевшихся ранее очагах, особенно при первом оценочном исследовании.
3.4.2. Наблюдение после окончания лечения
4. ОСОБЕННОСТИ ОБСЛЕДОВАНИЯ И ЛЕЧЕНИЯ ПАЦИЕНТОК МОЛОДОГО ВОЗРАСТА4.1. Рак молочной железы у пациенток детородного возраста
Больные с метастатическим процессом должны наблюдаться с частотой, позволяющей проводить максимально возможное паллиативное лечение, обеспечивающее контроль симптомов, наилучшее качество и максимальные сроки жизни.
Молодой возраст сам по себе не является фактором, определяющим выбор более агрессивного лечения. Тактика лекарственной терапии должна определяться общепринятыми (для больных старшей возрастной группы) характеристиками: степенью рас- пространения опухоли, ее биологическими особенностями, сопутствующей патологией и предпочтениями больной.
Пациентки детородного возраста должны использовать надежные средства контрацепции в период лекарственной терапии и ближайшее время после нее. На этапе обследования следует информировать пациенток о возможном негативном влиянии лекарственного лечения на функцию яичников и фертильность. При желании пациентки в будущем иметь детей желательна консультация врача-репродуктолога для обсуждения возможных вариантов вспомогательных репродуктивных технологий (при потенциально излечимых стадиях РМЖ). Рекомендуемыми методами сохранения фертильности являются: • криоконсервация эмбрионов;
-
• криоконсервация ооцитов.
-
4.2. Рак молочной железы у беременных
-
4.3. Рак молочной железы у мужчин
Криоконсервация ткани яичников является экспериментальным методом сохранения фертильности и в рутинной практике не рекомендуется. Безопасность стимуляции суперовуляции у больных люминальным РМЖ не доказана; использование данного метода возможно только в рамках клинических исследований. Данные о возможности сохранения фертильности с помощью аналогов ГРГ противоречивы. Методы вспомогательных репродуктивных технологий могут применяться только при наличии заключения онколога.
При выявлении РМЖ у беременной женщины пациентка должна быть направлена в специализированное лечебное учреждение.
Рекомендации по лечению РМЖ у мужчин в целом экстраполированы из аналогичных рекомендаций для женщин, однако, имеются некоторые различия. В частности, генетическое тестирование рекомендуется всем мужчинам, страдающим РМЖ. Принципы локальной терапии не отличаются от таковых для женщин. В качестве нео- и адъювантной терапии используются те же режимы ХТ (+анти-HER2 терапия по показаниям), что и у женщин. В качестве адъювантной гормонотерапии используется тамоксифен в течение 5–10 лет или, при противопоказаниях к приему тамоксифена — аналоги ГРГ в сочетании с ингибиторами ароматазы. Адъювантная монотерапия ингибиторами ароматазы не рекомендуется, так как ассоциируется с более низкими отдаленными результатами по сравнению с монотерапией тамоксифеном, возможно вследствие недостаточной супрессии эстрадиола. Системная терапия распространенной болезни проводится в соответствии с аналогичными рекомендациями по лечению женщин. При назначении ингибиторов ароматазы рекомендуется одновременное введение аналогов ГРГ (или орхидэктомия). Согласно имеющимся данным, монотерапия фулвестрантом у мужчин так же эффективна, как и у женщин. Новые препараты, такие как ингибиторы CDK4/6, m-TOR, PIK3CA, систематически не изучались в соответствующих клинических исследованиях у мужчин, страдающих РМЖ. Однако, доступные данные реальной клинической практики свидетельствуют о сопоставимой эффективности этих препаратов у мужчин и позволяют рекомендовать их по показаниям, аналогичным таковым при лечении женщин. Рекомендации по назначению ХТ, анти-HER2 терапии, иммунотерапии и PARP-ингибиторов аналогичны таковым для женщин.
Наблюдение после первичного лечения: имеются лишь ограниченные данные, поддерживающие скрининг (прогрессирования) РМЖ у мужчин. Оценку плотности костной ткани рекомендуется проводить каждые 2 года у мужчин, получающих аналоги ГРГ с адъювантной целью. Принципы терапии при снижении минеральной плотности костей не отличаются от таковых для женщин.


