Практические рекомендации по лекарственному лечению рака поджелудочной железы
Автор: И. А. Покатаев, О. А. Гладков, В. Е. Загайнов, Н. Е. Кудашкин, В. К. Лядов, Ю. И. Патютко, Д. В. Подлужный, А. А. Трякин, М. В. Черных
Журнал: Злокачественные опухоли @malignanttumors
Статья в выпуске: 3S2-1 т.10, 2020 года.
Бесплатный доступ
Рак поджелудочной железы, карцинома, CA19-9, химиотерапия, классификация резектабельности
Короткий адрес: https://sciup.org/140254654
IDR: 140254654 | DOI: 10.18027/2224-5057-2020-10-3s2-27
Текст статьи Практические рекомендации по лекарственному лечению рака поджелудочной железы
Злокачественные опухоли поджелудочной железы делятся на две группы: экзокринной части (95% случаев) и эндокринной части (5% случаев). В казуистически редких случаях встречаются мезенхимальные опухоли и лимфомы. Данные рекомендации посвящены только карциномам экзокринной части поджелудочной железы.
Тактика лечения рака поджелудочной железы должна определяться на междисциплинарном онкологическом консилиуме с обязательным участием панкреатобилиарного хирурга, лучевого диагноста, специалистов по лекарственной и лучевой терапии.
1. КЛАССИФИКАЦИЯ И ОПРЕДЕЛЕНИЕ СТАДИИ
Стадирование осуществляется на основании TNM классификации рака поджелудочной железы (РПЖ) (8-е издание, 2017 г.) (табл. 1).
Первичная опухоль (T)
ТХ — недостаточно данных для оценки первичной опухоли;
Tis — карцинома in situ (данная категория включает панкреатическую интраэпителиальную неоплазию высокой степени (ПанИН-3), внутрипротоковую папиллярную муцинозную опухоль с тяжелой дисплазией, внутрипротоковую тубулопапиллярную опухоль с тяжелой дисплазией, муцинозную кистозную опухоль с тяжелой дисплазией);
T1 — опухоль ограничена поджелудочной железой до 2 см в наибольшем измерении (дополнительно введены группы T1a, T1b, T1c — для уточнения прогноза образований с размером инвазивного компонента до 0,5 см, 0,5–1 см и 1–2 см, соответственно);
Т2 — опухоль размером 2–4 см в наибольшем измерении;
-
1 Цитирование: Покатаев И. А., Гладков О. А., Загайнов В. Е., Кудашкин Н. Е., Лядов В. К., Патютко Ю. И. и со-авт. Практические рекомендации по лекарственному лечению рака поджелудочной железы. Злокачественные опухоли: Практические рекомендации RUSSCO #3s2, 2020 (том 10).27
Т3 — опухоль размером более 4 см в наибольшем измерении;
Т4 — опухоль вовлекает чревный ствол, верхнюю брыжеечную или общую печеночную артерию, вне зависимости от размера.
Региональные лимфатические узлы (N):
NХ — недостаточно данных для оценки регионарных лимфоузлов;
N0 — нет признаков метастатического поражения регионарных лимфоузлов;
N1 — наличие метастазов в 1–3 регионарных лимфоузлах;
N2 — наличие метастазов в 4 или более регионарных лимфоузлах.
Адекватное послеоперационное стадирование предполагает морфологическое изучение не менее 12 лимфатических узлов.
К регионарным лимфоузлам для опухоли головки поджелудочной железы относятся лимфоузлы вдоль общего желчного протока, общей печеночной артерии, воротной вены, задней и передней панкреатодуоденальных аркад, вдоль верхней брыжеечной вены и правой латеральной стенки верхней брыжеечной артерии. К регионарным лимфоузлам для опухоли тела и хвоста поджелудочной железы относятся лимфоузлы вдоль общей печеночной артерии, чревного ствола, селезеночной артерии, ворот селезенки, а также забрюшинные и латеральные аортальные лимфоузлы.
Отдаленные метастазы (M):
M0 — нет отдаленных метастазов;
M1 — наличие отдаленных метастазов.
Таблица 1. Стадирование рака поджелудочной железы
|
Стадия |
T |
N |
M |
|
0 |
Tis |
N0 |
M0 |
|
IA |
T1 |
N0 |
M0 |
|
IB |
T2 |
N0 |
M0 |
|
IIA |
T3 |
N0 |
M0 |
|
IIB |
T1–3 |
N1 |
M0 |
|
III |
T1–3 |
N2 |
M0 |
|
T4 |
любая N |
M0 |
|
|
IV |
любая T |
любая N |
M1 |
2. ДИАГНОСТИКА
Диагноз РПЖ устанавливается на основании анамнестических, лабораторных данных и результатов инструментального обследования. Морфологическое исследование необходимо только в тех случаях, когда планируется лекарственная терапия (предоперационная или паллиативная) или облучение. Оптимальным вариантом получения материала для верификации процесса является эндосо-нография и тонкоигольная аспирационная биопсия. Толстоигольная биопсия под контролем эндосонографии позволяет получить дополнительный материал для ИГХ или молекулярно-генетического исследования, однако является более сложным и дорогостоящим методом. Биопсия должна быть также выполнена в ходе эксплоративной лапаротомии или лапароскопии у тех пациентов, которым планировалась радикальная операция без предшествующей верификации, однако интраоперационно процесс был признан нерезектабельным.
У пациентов с резектабельными опухолями (15–20% от общего числа больных) отрицательный результат биопсии не должен приводить к задержке или отмене хирургического лечения в том случае, если тактика лечения обсуждается на междисциплинарном консилиуме и клинический диагноз рака поджелудочной железы не вызывает сомнения.
В план обследования должны быть включены:
-
• осмотр, сбор анамнеза болезни, семейного анамнеза;
-
• клинический анализ крови;
-
• биохимический анализ крови с оценкой функции печени, почек;
-
• определение СА19-9 в сыворотке крови (необходимо помнить, что уровень СА19-9 может быть повышен на фоне желтухи, холангита или иного воспалительного процесса в панкреатобилиарной области, в связи с чем определение базового уровня СА19-9 должно проводиться после билиарной декомпрессии, нормализации уровня билирубина и купирования воспалительных явлений);
-
• КТ грудной клетки, брюшной полости и малого таза; исследование брюшной полости должно проводиться строго с в/в болюсным контрастированием по разработанному для оценки поджелудочной железы протоколу: без перорального контрастирования йодсодержащими препаратами, толщина среза < 3 мм (предпочительно < 1 мм), с обязательной оценкой «панкреатической» (40–50 сек после начала введения контраста) и портальной (65–70 сек) фаз контрастирования, с использованием высокой концентрации (> 300 мг йода на литр) и скорости его введения 3–5 мл/сек;
-
• УЗИ органов брюшной полости, забрюшинного пространства, малого таза, шейно-надключичной области является допустимой при нецелесообразности КТ (например, у пациентов с диссеминацией опухоли) или невозможности КТ;
-
• Рентгенография органов грудной клетки является альтернативой при нецелесообразности КТ (например, у пациентов с диссеминацией опухоли) или невозможности КТ;
-
• ЭГДС;
-
• ЭКГ.
При наличии показаний дополнительно рекомендованы следующие методы обследования:
• эндоУЗИ преимущественно для верификации опухоли, в т. ч. биопсии подозрительных аортокавальных лимфоузлов, наличие метастазов в которых является противопоказанием для радикальной операции, а также для дополнительной оценки резектабельности;
• МРТ брюшной полости и малого таза с в / в контрастированием для определения степени распространенности, резектабельности или оценки эффективности консервативного лечения у пациентов с аллергией на йод-содержащие контрастные препараты, а также при сомнительных результатах КТ в отношении первичной опухоли либо очагов в печени;
• ПЭТ / КТ для выявления отдаленных метастазов у пациентов с высокой вероятностью их наличия (например, высокий уровень маркера СА19-9 или крупные размеры первичной опухоли). Однако ПЭТ/КТ НЕ является заменой КТ по вышеописанному протоколу в отношении оценки первичной распространенности при решении вопроса о возможности выполнения радикальной операции или при планировании ЛТ;
• диагностическая лапароскопия используется преимущественно при подозрении на перитонеальный карциноматоз, в т. ч. в смывах с брюшины, либо для биопсии в тех ситуациях, когда менее инвазивные способы получения материала оказались неинформативны или недоступны;
• определение хромогранина А в сыворотке крови (при клиническом подозрении на наличие у пациента нейроэндокринной опухоли).
3. ЛЕЧЕНИЕ
3.1. Лечение неметастатического рака поджелудочной железы (любая Т, любая N, M0)
В связи с частотой выявления мутаций в генах BRCA1, BRCA2 и PALB2 более 5%, а также существенным влиянием данных мутаций на выбор схемы ХТ, их определение целесообразно у всех пациентов. С учетом крайне низкой чувствительности существующих тест-систем на основе ПЦР следует отдать предпочтение секвенированию. При наличии гистологического материала целесообразно выполнение секвенирования в ткани опухоли с дополнительным определением статуса MSI.
Решение о тактике лечения неметастатического РПЖ основано на оценке резектабельности первичной опухоли и должно приниматься мультидиспли-нарной командой, включающей химиотерапевта, радиолога, рентгенолога и хирурга, обладающего достаточным опытом хирургического лечения больных с опухолями билио-панкреатодуоденальной области. В табл. 2 приведена классификация, которая позволяет судить о резектабельности по данным КТ, выполненной до начала лечения.
Таблица 2. Оценка резектабельности неметастатического рака поджелудочной железы (критерии клиники M. D. Anderson)
|
Сосуд |
Категория |
||
|
Резектабельный |
Погранично резектабельный |
Нерезектабельный |
|
|
Верхняя брыжеечная артерия |
Не вовлечена; нормальная жировая прослойка между опухолью и артерией |
Опухоль прилежит к ≤ 180° (половина или менее) окружности артерии; периартериальная исчерченность и опухолевые очаги, выпуклой поверхностью контактирующие со стенкой сосуда (на небольшой площади), что повышает шанс их удаления |
Опухоль прилежит к > 180° окружности |
|
Чревный ствол / печеночная артерия |
Не вовлечены |
Охват / прилежание к общей печеночной артерии на небольшом протяжении (чаще в зоне отхождения гастродуоденальной артерии); хирург должен быть готов к резекции сосуда с последующей реконструкцией |
Охват опухолью и отсутствие технических возможностей для реконструкции из-за распространения на чревный ствол на уровне отхождения селезеночной и левой желудочной артерии или на проксимальный отдел чревного ствола |
|
Верхняя брыжеечная вена / воротная вена |
Проходимы |
Окклюзия короткого сегмента с неизмененным сосудом выше и ниже; изолированная окклюзия сегмента вены без инвазии верхней брыжеечной артерии является редкостью и должна быть явно выражена на всех снимках КТ |
Окклюзия и отсутствие перспектив реконструкции |
При резектабельном РПЖ на первом этапе рекомендуется хирургическое лечение. Альтернативным вариантом является периоперационная ХТ длительностью 2–3 месяца до операции и 3–4 месяца — после нее. Все большее число исследований свидетельствует, что проведение периоперационной ХТ ассоциировано с повышением частоты R0 резекции и продолжительности жизни. Режимы предоперационной ХТ представлены в табл. 4. Начало лечения с ХТ сопряжено с необходимостью биопсии опухоли для морфологической верификации диагноза и выполнения желчеразгрузочных процедур.
При погранично резектабельном раке необходимо проведение предоперационной ХТ с последующей оценкой результатов. При отсутствии отрицательной динамики рекомендуется выполнение операции. В отдельных случаях при высоком риске нерадикальной операции возможно проведение предоперационной ЛТ (см. раздел 3.1.2.).
При нерезектабельном раке рекомендовано проведение индукционной терапии с последующей повторной оценкой резектабельности (рис. 1).
-
3.1.1. Предоперационная/индукционная химиотерапия
-
3.1.2. Предоперационная/индукционная лучевая терапия
Роль ЛТ в рамках индукционной терапии РПЖ железы окончательно не определена. Рандомизированные исследования не смогли однозначно доказать выигрыш в продолжительности жизни при ее добавлении. Однако небольшие исследования свидетельствуют о том, что добавление ЛТ к консервативному лечению после 3–6 мес. ХТ способно увеличить вероятность достижения резектабельности. Облучению подвергается первичная опухоль. Целесообразность облучения регионарной клетчатки сомнительна. При последовательной ХЛТ лечение проводится в РОД 2,4 Гр до СОД 36 Гр или в РОД 1,8–2,0 Гр до СОД 45–54 Гр в сочетании с капецитабином в дозе 1600 мг/м2/сут. внутрь ежедневно в течение всего периода облучения. Применение гемцитабина в дозе 300 мг/м2 еженедельно в качестве радиосенсибилизатора во время ЛТ является возможной альтернативой, однако существенно более токсичной, и, по-видимому, менее эффективной. При проведении стереотаксической ЛТ сочетанная ХТ не проводится, РОД составляет 7,5 Гр, 5 раз до СОД 37,5 Гр.
-
3.1.3. Хирургическое лечение
Единого протокола предоперационной/индукционной терапии не существует. Основным методом лечения остается ХТ. Режимы ХТ аналогичны таковым для лечения метастатического рака (табл. 4). Предпочтительными режимами (при отсутствии противопоказаний) являются FOLFIRINOX или комбинация гемцитабина и nab-паклитаксела (табл. 4). При наличии у пациентов мутаций в генах BRCA или PALB2 оптимальным является применение комбинации FOLFIRINOX или комбинация гемцитабина с производными платины. При выборе режима ХТ следует учитывать следующие данные: общее состояние пациента, возраст, наличие осложнений опухолевого процесса и серьезных сопутствующих заболеваний.
Длительность индукционной ХТ при погранично резектабельном и нере-зектабельном процессе определяется достижением максимального эффекта. Рекомендуется оценивать эффект по КТ каждые 6–8 нед. В случае отсутствия прогрессирования при первой оценке эффекта (уменьшение размера опухоли или стабилизация) следует продолжить ХТ. В случае отсутствия положительной динамики опухолевого процесса по данным двух последних изображений следует рассмотреть возможность выполнения радикальной операции.
В случае сохранения нерезектабельного процесса и отсутствия нарастания эффекта после окончания 16 нед. индукционной ХТ рекомендуется продолжение ранее начатого режима ХТ (при его хорошей переносимости) либо проведение поддерживающей ХТ (например, монотерапии фторпиримидиновым производным, если до этого пациент получал FOLFIRINOX). Доказательств преимущества какой-либо тактики на момент составления рекомендаций нет.
Рекомендуемая суммарная продолжительность ХТ с учетом индукционного и поддерживающего этапов должна составлять не менее 6 мес. Применение ХТ более 6 мес. (например, до прогрессирования опухоли) также является возможной опцией ввиду отсутствия клинических исследований, посвященных вопросу оптимальной длительности ХТ в этой группе пациентов. Решение о продолжении ХТ до прогрессирования должно приниматься с учетом динамики эффекта и переносимости данного лечения.
Основным дозолимитирующим фактором при стереотаксической ЛТ РПЖ является наличие полых органов, таких как желудок, двенадцатиперстная кишка, тонкая или толстая кишка. Это обусловлено высоким риском развития тяжелых постлучевых повреждений (расстояние между объемом облучения и органами риска должно быть не менее 5 мм). Вовлечение этих органов в опухолевый процесс является противопоказанием к стереотаксической ЛТ.
Стандартным доступом при всех операциях на поджелудочной железе является срединная лапаротомия. При опухолях головки поджелудочной железы следует выполнять гастропанкреатодуоденальную резекцию. При опухолях тела или хвоста поджелудочной железы следует выполнять дистальную субтотальную резекцию поджелудочной железы, включающую удаление тела, хвоста железы, а также селезенки. При поражении карциномой всех отделов поджелудочной железы рекомендуется выполнить тотальную панкреатэкто-мию. Стандартный объем лимфодиссекции при раке головки поджелудочной железы предполагает удаление следующих лимфатических узлов: надпилорических и подпилорических, лимфоузлов по ходу печеночной артерии и чревного ствола, лимфоузлов вдоль общего желчного протока, пузырного протока и воротной вены, ретропанкреатических лимфоузлов, лимфоузлов по нижнему краю головки поджелудочной железы, лимфоузлов по правой полуокружности верхней брыжеечной артерии, лимфоузлов по верхнему краю головки поджелудочной железы. При раке головки поджелудочной железы рекомендуется иссечение клетчатки и нервных сплетений вдоль правой полуокружности верхней брыжеечной артерии.
При карциномах тела и хвоста поджелудочной железы рекомендовано удаление следующих групп лимфозулов: лимфоузлов ворот селезенки, лимфоузлов вдоль селезеночной артерии, лимфоузлов по нижнему краю поджелудочной железы. Стандартная лимфаденэктомия должна включать удаление не менее 12 лимфатических узлов. Расширенная лимфаденэктомия не показала преимуществ в ходе сравнительных исследований, ее применение не рекомендовано на сегодняшний день.
Многочисленные исследования, посвященные возможностям выполнения операций по поводу РПЖ лапароскопическим способом, продемонстрировали сопоставимые с эффективностью традиционных вмешательств хирургические и онкологические результаты. В связи с этим они могут рассматриваться в качестве альтернативы стандартным операциям с лапаротомным доступом в центрах, имеющих существенный опыт подобных вмешательств.
Операция Appleby (дистальная резекция поджелудочной железы с резекцией чревного ствола) может применяться только в специализированных клиниках с участием специалистов, имеющих опыт подобных вмешательств, на фоне стабилизации или частичного ответа на предоперационную ХТ или ХЛТ.
-
3.1.4. Адъювантная терапия
В случае предоперационной ХТ длительностью 6 мес. с последующим хирургическим лечением после операции рекомендовано динамическое наблюдение без адъювантной терапии. Если длительность предоперационной ХТ была меньше 6 мес., рекомендовано применение адъювантной ХТ так, чтобы общая продолжительность ХТ составила 6 мес. В этом случае рекомендуется проводить адъювантный этап ХТ с использованием тех же цитотоксических препаратов, которые были использованы перед операцией. Однако, учитывая более высокий риск непереносимой токсичности после операции по сравнению с предоперационным этапом, следует адаптировать дозы препаратов из предоперационного режима в соответствии с состоянием пациента после операции.
В случае выполнения хирургического лечения без предоперационной ХТ проведение адъювантной ХТ рекомендовано всем пациентам вне зависимости от стадии и радикальности операции.
Лечение должно быть начато в течение 3 мес. после операции (оптимально начинать ХТ в промежутке между 4 и 8 неделями после операции). Если состояние пациента после операции не позволяет начать ХТ в течение 3 мес., более позднее начало адъювантной терапии все же целесообразно, хотя и менее эффективно. Перед началом ХТ целесообразно выполнить обследование (оценка грудной и брюшной полостей, а также СА19-9), чтобы убедиться в отсутствии прогрессирования заболевания. Рекомендуемые режимы адъювантной ХТ представлены в табл. 3.
Таблица 3. Режимы адъювантной химиотерапии при раке поджелудочной железы
|
Показания |
Режим химиотерапии |
|
Оптимальный объем химиотерапии |
mFOLFIRINOX 1: оксалиплатин 85 мг / м2 в / в 120 мин., иринотекан 150 мг / м2 в / в 90 мин., кальция фолинат 400 мг / м2 в / в 120 мин., 5-фторурацил 2400 мг / м2 в / в инфузия в течение 46 часов, каждые 2 нед., всего 12 циклов |
|
Минимальный объем химиотерапии2 |
GEMCAP: гемцитабин 1000 мг / м2 в / в капельно 30 мин. в 1-й, 8-й и 15-й дни + капецитабин 1660 мг / м2 внутрь ежедневно с 1-го по 21-й день каждые 4 нед., всего 6 циклов Гемцитабин 1000 мг / м2 в / в капельно 30 мин. еженедельно 7 нед., далее 1000 мг / м2 в 1-й, 8-й и 15-й дни каждые 4 нед., всего 6 циклов или Капецитабин 2000–2500 мг / м2 / сут. внутрь с 1-го по 14-й день каждые 3 нед., всего 8 циклов или 5-фторурацил 425 мг / м2 в / в струйно + кальция фолинат 20 мг / м2 в / в струйно с 1-го по 5-й дни каждые 4 нед., всего 6 циклов |
1 mFOLFIRINOX рекомендуется только пациентам с ECOG 0–1, без серьезных осложнений хирургического лечения, сопутствующих заболеваний и с уровнем общего билирубина < 1,5 ВГН.
2 При невозможности проведения адъювантной ХТ по схеме mFOLFIRINOX предпочтительным режимом является GEMCAP.
Применение предикторов эффективности гемцитабина при планировании адъювантной ХТ (например, hENT, RRM1 и др.) не рекомендуется вне рамок клинических исследований.
Роль адъювантной ЛТ в настоящее время изучается в проспективных рандомизированных исследованиях. Ее применение вне рамок исследований не рекомендуется.
-
3.1.5. Коррекция осложнений опухолевого процесса
-
3.1.6. Динамическое наблюдение после первичного лечения
Пациенты с механической желтухой нуждаются в выполнении билиодиге-стивных вмешательств, если лечение планируется начать с консервативного этапа. Решение о выполнении желчеотведения при планировании радикального хирургического лечения принимается индивидуально. Имеющиеся данные свидетельствуют о том, что гипербилирубинемия существенно не повышает риск серьезных послеоперационных осложнений, а желчеразгрузочные операции значительно и часто необоснованно отдаляют радикальное хирургическое лечение. Билиодигестивные вмешательства (антеградные (чрескожные чреспеченочные), ретроградные (эндоскопические) и открытые операции)) абсолютно показаны при наличии осложнений холестаза, например, при активном холангите, уровне общего билирубина более 250 мкмоль/л, а также при невозможности хирургического лечения в ближайшие 2 недели. Предпочтение должно быть отдано миниинвазивным вмешательствам (антеградные (чрескожные чреспеченочные), ретроградные (эндоскопические)), открытые операции следует осуществлять только в случае неэффективности миниинвазивных.
При наличии выраженного болевого синдрома возможно выполнение блокады чревного сплетения. Данная миниинвазивная процедура выполняется чрескожно или эндоскопически. Эндоскопическая блокада чревного сплетения считается более безопасной. В качестве альтернативы с обезболивающей целью может быть применена ЛТ, как стереотаксический курс в РОД 5–6 Гр, 5 раз в нед., СОД 25–30 Гр в зависимости от объема облучения окружающих критических органов и с учетом их толерантности, так и конформная ЛТ в РОД 3–4 Гр, 5 раз в нед., СОД 30–28 Гр соответственно. Пациент должен получать анальгетические препараты, обеспечивающие стойкое купирование болевого синдрома.
Кахексия должна корригироваться применением дополнительного энтерального питания. Пациенты, страдающие РПЖ, должны получать ферменты поджелудочной железы во время приема пищи.
Не существует доказательств того, что активное наблюдение за пациентами после первичного лечения и раннее выявление рецидива заболевания увеличивает продолжительность жизни. Поэтому допустимо проводить только выяснение жалоб пациента и физикальный осмотр на регулярной основе. Однако быстрое ухудшение состояния при прогрессировании заболевания лимитирует перспективы использования современных режимов ХТ. Поэтому оптимальными являются визиты пациента каждые 12–16 нед. в течение первых двух лет, каждые 6 мес.— в последующем для выполнения следующего обследования:
-
• УЗИ брюшной полости или КТ / МРТ брюшной полости с в / в контрастированием;
-
• УЗИ малого таза для женщин;
-
• рентгенография органов грудной клетки;
-
• определение СА19-9 в случае их повышенных уровней до лечения, а также общий и биохимический анализы крови для оценки функции печени и почек.
-
3.2. Лечение метастатического рака поджелудочной железы (любая Т, любая N, M1) и рецидивов после хирургического лечения
-
3.2.1. Химиотерапия I линии
Основным методом лечения данной группы пациентов является ХТ (рис. 1). Однако продолжительность жизни определяется не только эффективностью
ХТ, но и своевременным купированием возможных осложнений опухолевого процесса (см. раздел 3.1.5.).
Рекомендуемые режимы ХТ I линии при РПЖ суммированы в табл. 4. При применении любого режима ХТ рекомендуется продолжение лечения до прогрессирования или до неприемлемой токсичности, которая сохраняется, несмотря на редукции доз препаратов.
Таблица 4. Рекомендуемые режимы химиотерапии I линии рака поджелудочной железы
|
Режим химиотерапии (лечение до прогрессирования / неприемлемой токсичности) |
Критерии выбора режима химиотерапии |
|
FOLFIRINOX (оксалиплатин 85 мг / м2 в / в 120 мин., иринотекан 180 мг/м2 в/в 90 мин., кальция фолинат 400 мг / м2 в / в 120 мин., 5-фторурацил 400 мг / м2 в / в болюс, 5-фторурацил 2400 мг / м2 в / в инфузия в течение 46 часов, каждые 2 нед.) |
|
|
Nab-паклитаксел 125 мг / м2 в / в капельно 30 мин. + гемцитабин 1000 мг / м2 в / в капельно 30 мин. в 1-й, 8-й, 15-й дни каждые 4 нед. |
|
|
Гемцитабин 1000 мг / м2 в / в 1-й, 8-й дни каждые 3 нед. в сочетании с производным платины:
|
|
|
Гемцитабин 1000 мг/м2 в/в 1-й, 8-й, 15-й дни каждые 4 нед. |
|
Выбор режима ХТ при метастатическом РПЖ определяется, в первую очередь, состоянием пациента. При относительно удовлетворительном общем состоянии (по шкале ECOG 0–1 балл), нормальной функции печени и почек, отсутствии серьезных осложнений опухолевого процесса и сопутствующих заболеваний рекомендуется применение режимов FOLFIRINOX или гемцитабин + nab-паклитаксел. Отдельным пациентам, имеющим значительное распространение опухолевого процесса и связанные с этим симптомы (общее состояние по шкале ECOG 2 балла), может быть рекомендована комбинация гемцитабина и nab-паклитаксела, если ожидается, что в случае достижения противоопухолевого эффекта симптомы болезни могут регрессировать.
Пациентам с мутацией в генах BRCA1, BRCA2 или PALB2 рекомендуется применение комбинации FOLFIRINOX или комбинации гемцитабина с производным платины (цисплатином, карбоплатином или оксалиплатином).
Во всех случаях, не соответствующих критериям выбора многокомпонентных режимов ХТ (табл. 4), рекомендуется монохимиотерапия гемцитабином. Пациентам в тяжелом общем состоянии проведение ХТ не рекомендуется, показана только симптоматическая терапия.
Пациенты, получавшие ранее ХТ по поводу неметастатического РПЖ (индукционную или адъювантную), могут получать лечение теми же препаратами, если период от окончания предыдущего лечения до прогрессирования заболевания составил более 6 мес. Если этот период составил менее 6 мес., целесообразно назначить ХТ другими препаратами (табл. 5).
Комбинация гемцитабина и эрлотиниба не рекомендуется для применения при РПЖ, так как по данным рандомизированного исследования продемонстрировала минимальное преимущество в продолжительности жизни при существенном увеличении токсичности.
Значительная токсичность режима FOLFIRINOX обосновывает изначальную модификацию данного режима, которая может включать один или несколько нижеперечисленных вариантов:
-
• первичная профилактика нейтропении Г-КСФ;
-
• редукция дозы болюсного (до 320 мг / м2 или полная отмена) и инфузионного (до 2000 мг/м2) введения 5-фторурацила;
-
• редукция дозы иринотекана (до 150 мг / м2);
-
• редукция дозы оксалиплатина (до 65 мг / м2).
-
3.2.2. Лучевая терапия
-
3.2.3. Химиотерапия II линии
Применение ЛТ возможно в случае локорегионарного рецидива после хирургического лечения, а также продолженного роста первичной нерезек-табельной опухоли после ХТ при отсутствии отдаленных метастазов. Целесообразно проведение ХЛТ или 3–4 месяцев ХТ с последующим проведением стереотаксической ЛТ.
Облучение проводится в РОД 1,8–2,0 Гр до СОД 45–54 Гр в сочетании с капе-цитабином в дозе 1600 мг/м2/сут. внутрь ежедневно в течение всего периода облучения. В случае применения стереотаксической ЛТ рекомендуется использовать 3 фракции до СОД 30–45 Гр или 5 фракций до СОД 25–45 Гр. В объём облучения включается первичная опухоль с вовлеченными лимфатическими узлами или рецидив опухоли.
Рекомендуемые режимы ХТ II линии при РПЖ суммированы в табл. 5.
Таблица 5. Рекомендуемые режимы химиотерапии II линии рака поджелудочной железы
|
Режим химиотерапии (лечение до прогрессирования / неприемлемой токсичности) |
Критерии выбора режима химиотерапии |
|
Nab-паклитаксел 100–125 мг / м2 в / в капельно 30 мин. + гемцитабин 750–1000 мг / м2 в / в капельно 30 мин. в 1-й, 8-й, 15-й дни каждые 4 нед. |
|
|
Гемцитабин 750–1000 мг / м2 в / в в 1-й, 8-й дни каждые 3 нед. в сочетании с производным платины:
|
|
|
Гемцитабин 750–1000 мг / м2 в / в в 1-й, 8-й, 15-й дни каждые 4 нед. |
|
|
mFOLFIRINOX (оксалиплатин 60–85 мг / м2 в / в 120 мин., иринотекан 120–180 мг / м2 в / в 90 мин., кальция фолинат 400 мг / м2 в / в 120 мин., 5-фторурацил 2000–2400 мг / м2 в / в инфузия в течение 46 часов, интервал между циклами 2 нед.) |
|
|
mFOLFOX6 (оксалиплатин 85 мг / м2 в / в 120 мин., кальция фолинат 400 мг / м2 в / в 120 мин., 5-фторурацил 400 мг / м2 в / в болюс, 5-фторурацил 2400 мг / м2 в / в инфузия в течение 46 часов, интервал между циклами 2 нед.); XELOX (оксалиплатин 130 мг / м2 в / в 120 мин. в 1-й день, капецитабин 2000 мг / м2 / сут. внутрь в 1–14-й дни каждые 3 нед.); FOLFIRI. 3 (иринотекан 90 мг / м2 в / в 60 мин. в 1-й день, кальция фолинат 400 мг / м2 в / в 120 мин. в 1-й день, 5-фторурацил 2000 мг / м2 в / в инфузия в течение 46 часов, иринотекан 90 мг / м2 в / в 60 мин. в 3-й день после окончания инфузии 5-фторураци-ла, интервал между циклами 2 нед.); CAPIRI (иринотекан 200 мг / м2 в / в 90 мин. в 1-й день, капецитабин 1600 мг / м2 / сут. внутрь в 1–14-й дни каждые 3 нед.) OFF (оксалиплатин 85 мг / м2 в / в 120 мин. в 8-й и 22-й дни, кальция фолинат 200 мг / м2 в / в 120 мин. в 1-й, 8-й, 15-й, 22-й дни, 5-фторурацил 2000 мг / м2 в / в инфузия в течение 24 часов в 1-й, 8-й, 15-й, 22-й дни, интервал между циклами 6 нед. |
|

|
Режим химиотерапии (лечение до прогрессирования / неприемлемой токсичности) |
Критерии выбора режима химиотерапии |
|
Пембролизумаб 200 мг в / в 30 мин. 1 раз в 3 нед. |
|
|
Капецитабин 2000-мг / м2 / сут. внутрь в 1–14-й дни каждые 3 нед.; 5-фторурацил 425 мг / м2 в / в струйно + кальция фолинат 20 мг / м2 в / в струйно в 1–5-й дни каждые 4 нед. |
|
ХТ II линии может быть рекомендована пациентам в относительно удовлетворительном состоянии (ECOG 0–1) и отдельным пациентам в состоянии средней тяжести (ECOG 2), связанном с распространением опухолевого процесса, если эффект ХТ позволяет рассчитывать на улучшение общего состояния. Пациентам в тяжелом общем состоянии рекомендуется только симптоматическое лечение. В случае кахексии целесообразно назначение мегестрола ацетата в дозе 320–480 мг внутрь 1 раз в сутки. Данных, поддерживающих применение ХТ III линии, не существует. Решение о применении химиотерапии III линии принимается индивидуально.
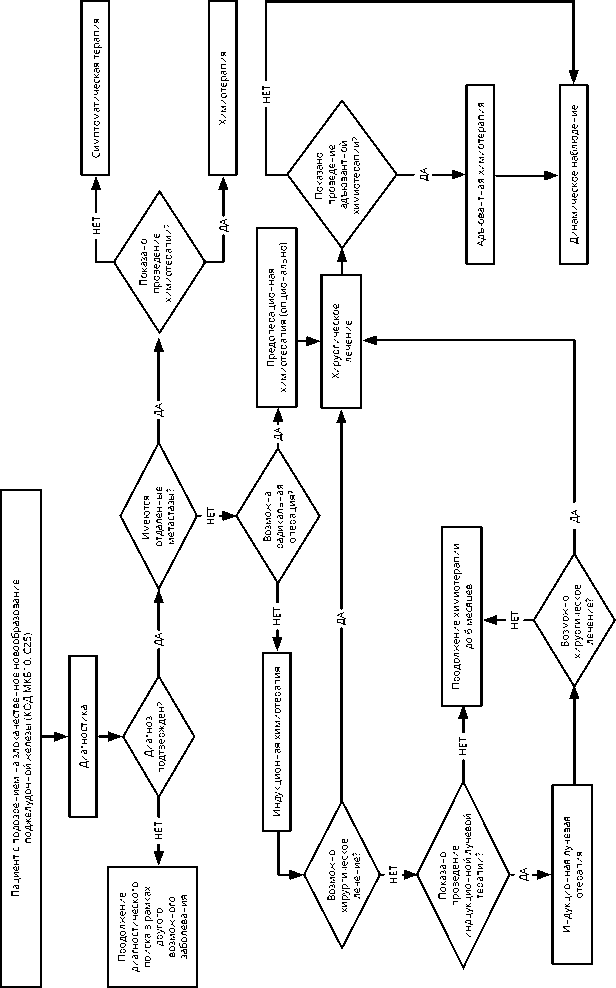
Рисунок 1. Рекомендуемый алгоритм лечебно-диагностических мероприятий при раке поджелудочной железы.


