Практические рекомендации по лекарственному лечению рака желудка
Автор: Бесова Н.С., Болотина Л.В., Гамаюнов С.В., Калинин А.Е., Козлов Н.А., Малихова О.А., Неред С.Н., Пирогов С.С., Проценко С.А., Стилиди И.С., Тер-ованесов М.Д., Трякин А.А., Хомяков В.М., Черных М.В.
Журнал: Злокачественные опухоли @malignanttumors
Статья в выпуске: 3S2-1 т.12, 2022 года.
Бесплатный доступ
Рак желудка, аденокарцинома желудка, аденокарцинома пищеводножелудочного перехода, лекарственная терапия, химиотерапия, трастузумаб, рамуцирумаб, эгдс
Короткий адрес: https://sciup.org/140296308
IDR: 140296308 | DOI: 10.18027/2224-5057-2022-12-3s2-382-400
Текст статьи Практические рекомендации по лекарственному лечению рака желудка
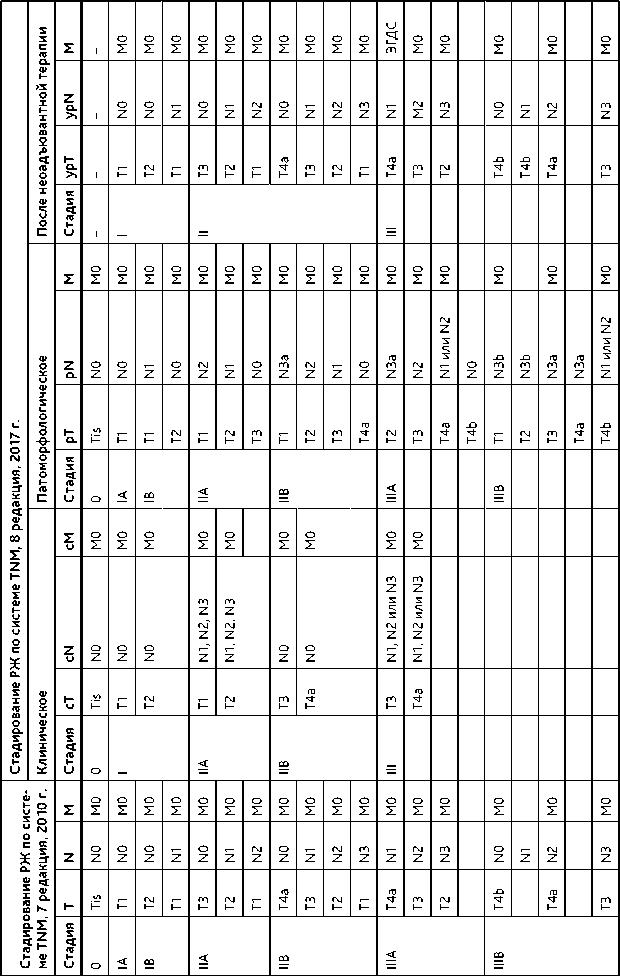
Если оперативное лечение было выполнено после ХТ, к указанию стадии по TNM добавляется префикс «у», т. е. ypTNM.
При вовлечении в опухолевый процесс зоны пищеводно-желудочного перехода применяют классификацию Зиверта. Аденокарциному, центр которой расположен на 2–5 см ниже анатомической границы пищеводно-желудочного перехода (III тип по Зиверту), классифицируют и лечат как РЖ. Если центр аденокарциномы расположен на уровне зубчатой линии, т. е. в пределах 2 см ниже и 1 см выше анатомической границы пищеводножелудочного перехода (II тип по Зиверту), или в нижней трети пищевода выше анатомической границы пищеводно-желудочного перехода в пределах 1–5 см (I тип по Зиверту), процесс классифицируют и лечат как рак пищевода. Тактика лечения локализованных форм аденокарциномы кардиоэзофагеального перехода I и II типов по Зиверту аналогична тактике лечения рака пищевода, лечение диссеминированных и метастатических форм аденокарцином аналогично лечению диссеминированного РЖ. Классификация РЖ по системе TNM и группировка по стадиям представлены в табл. 1 и 2 соответственно.
|
z z 1— и |
2 £ 5 О c |
Z |
z |
z |
z |
||
|
z |
z |
z |
z |
||||
|
^ |
|||||||
|
s и |
|||||||
|
1 -e- о e |
z |
z |
z |
z |
|||
|
z |
z |
z |
z z |
||||
|
m |
|||||||
|
и |
у |
||||||
|
sc |
z |
z |
z |
||||
|
z |
|||||||
|
1— |
|||||||
|
и |
< |
> |
|||||
|
за H | 5 ro °* H и z |
z |
z |
z |
z |
|||
|
z |
z |
z |
z |
||||
|
H |
|||||||
|
и |
у |
> |
|||||

2. ДИАГНОСТИКА
Диагноз РЖ основывается на данных осмотра, результатах инструментальных методов обследования и патоморфологическом заключении. Первичное обследование должно быть проведено до начала любого вида лечения и включает в себя:
сбор жалоб, анамнеза и физикальный осмотр с обязательной пальпацией левой надключичной области (исключение метастаза Вирхова в левых надключичных лимфоузлах), пупка (исключение метастаза сестры Жозеф в пупке), пальцевым исследованием прямой кишки у мужчин для исключения метастазирования в параректальную клетчатку (метастаз Шницлера) и бимануальным гинекологическим осмотром женщин (исключение метастаза Крукенберга в яичниках и метастаза Шницлера);
измерение роста и веса;
клинический анализ крови с подсчетом лейкоцитарной формулы и количества тромбоцитов;
биохимический анализ крови с исследованием показателей функции печени, почек; коагулограмма;
общий анализ мочи;
определение в опухоли гиперэкспрессии/амплификации HER2 (при подозрении или наличии диссеминации процесса);
тестирование опухоли на наличие MSI для планирования иммунотерапии при диссеминированных процессах и для определения показаний к адъювантной ХТ при операбельных формах;
исследование опухоли на статус PD-L1 CPS при местно-распространенном неоперабельном или диссеминированном процессе для планирования иммунотерапии; КТ органов грудной клетки, брюшной полости и таза с пероральным и в/в контра-строванием позволяет оценить состояние регионарных лимфатических коллекторов, распространение опухоли на соседние органы и ткани, исключить наличие отдаленных метастазов;
УЗИ шейных лимфатических узлов;
диагностическая лапароскопия показана:
– при подозрении на перитонеальный канцероматоз, при невозможности его верификации путем забора асцитической жидкости или чрескожной биопсии брюшины;
– перед хирургическим вмешательствам после неоадъювантной ХТ (для исключения прогрессирования), в том числе при планировании конверсионной хирургии
– при подозрении на канцероматоз после ранее проведенного хирургического или комбинированного лечения лапароскопия должна сопровождаться забором материала для морфологического исследования обнаруженных изменений и забором смывов с брюшины для цитологического исследования на предмет наличия свободных опухолевых клеток; при обнаружении диссеминации оптимальным является оценка PCI (перитонеальный раковый индекс). Лапароскопия не показана при раннем РЖ, а также при наличии ургентных осложнений, требующих неотложной операции;
ЭКГ;
колоноскопия выполняется для исключения опухоли кишки у больных старше 50 лет при планировании радикального лечения;
ПЭТ/КТ — при подозрении на наличие отдаленных метастазов в случаях, когда их подтверждение значимо изменяет тактику лечения;
биопсия метастазов или подозрительных в отношении метастазов очагов под контролем УЗИ/КТ, когда их подтверждение меняет лечебную тактику;
определение уровня СА-72–4, РЭА, СА19-9 для динамического контроля в процессе лечения диссеминированных форм;
остеосцинтиграфия — при подозрении на метастатическое поражение костей; консультация невролога — при подозрении на метастатическое поражение ЦНС; стернальная пункция или трепанобиопсия подвздошной кости (при подозрении на метастатическое поражение костного мозга).
При подготовке к хирургическому лечению с целью оценки функционального статуса по показаниям проводят дополнительные функциональные тесты: ЭхоКГ, холтеровское мониторирование, исследование ФВД, УЗДГ сосудов (вен) нижних конечностей, исследование свёртывающей системы крови, анализы мочи, консультации врачей-специалистов
(кардиолога, эндокринолога, невролога и т. п.), иные диагностические исследования, необходимые для оценки состояния пациента в конкретной клинической ситуации.
3. ЛЕЧЕНИЕ
Выбор лечебной тактики осуществляется на мультидисциплинарном консилиуме с участием хирурга, химиотерапевта, эндоскописта, терапевта, анестезиолога на основании результатов дооперационного обследования с определением клинической стадии заболевания и функционального состояния больного, при необходимости могут быть привлечены другие специалисты. Лечебная тактика определяется степенью распространённости (стадией) опухолевого процесса и функциональным состоянием пациента. Основным методом радикального лечения РЖ является хирургическое вмешательство, дополняемое в большинстве случаев системной противоопухолевой терапией.
Абсолютные показания:
-
• аденокарцинома дифференцированного типа без изъязвления (UL0), без признаков инвазии в подслизистый слой (Т1а), размером≤2 см (абсолютное показание к удалению методиками резекции опухоли с окружающей слизистой оболочкой и методикой диссекции подслизистого слоя);
-
• аденокарцинома дифференцированного типа без изъязвления (UL0), без признаков инвазии в подслизистый слой (Т1а), размером более 2 см (абсолютное показание к удалению методикой диссекции подслизистого слоя);
-
• аденокарцинома дифференцированного типа с наличием изъязвления (UL1), без признаков инвазии в подслизистый слой (Т1а), размером≤3 см (абсолютное показание к удалению методикой диссекции подслизистого слоя).
Расширенные показания
-
• аденокарцинома недифференцированного типа без изъязвления (UL0), без признаков инвазии в подслизистый слой (Т1а), размером≤2 см (расширенное показание к удалению методикой диссекции подслизистого слоя);
-
• аденокарцинома дифференцированного типа без изъязвления (UL0), при которой глубина инвазии диагностирована как T1b (sm1, ≤500 µm), отсутствует лимфоваскулярная инвазия, размером≤3 см.
-
3.1.1.2. Стадии IB–III (Tis–4N1–3M0)
В случае обнаружения при плановом гистологическом исследовании глубокой (более 500 мкм) инвазии опухоли в подслизистый слой, опухолевых клеток в вертикальном крае резекции или наличия лимфоваскулярной инвазии показано стандартное хирургическое лечение с лимфодиссекцией D1+ (удаление перигастральных лимфатических узлов, а также лимфатических узлов левой желудочной артерии, передне-верхних лимфоузлов общей печеночной артерии, лимфоузлов чревного ствола).
Для пожилых пациентов с высоким операционным риском и тяжелыми сопутствующими заболеваниями возможно расширение показаний для эндоскопического лечения или выполнение условно-радикальных эндоскопических вмешательств (аргон-плаз-менная коагуляция, фотодинамическая терапия). Такие клинические ситуации требуют мультидисциплинарного консилиума и рассматриваются как относительные показания, вмешательство может быть выполнено при наличии согласия, полученного от пациента после объяснения риска сохранения резидуальной опухоли и более высокого риска возможного метастазирования в лимфатические узлы.
Вариантом хирургического лечения являются лапароскопические операции: лапароскопическая дистальная субтотальная резекция, лапароскопическая гастрэктомия. Адъювантная лекарственная терапия не показана.
При невозможности хирургического вмешательства (противопоказания, местная распространенность, отказ пациента) рекомендуется проведение самостоятельной ХЛТ (см. раздел 3.1.2) или ХТ по принципам лечения IV стадии заболевания.
ХЛТ начинают на 29-й день после операции, на первом этапе проводят один 28-дневный цикл ХТ, далее с 29-го дня начинают ЛТ фракциями по 1,8 Гр 5 дней в неделю на протяжении 5 недель, СОД 45–50,4 Гр в комбинации с ХТ, по окончании комбинированного лечения проводят еще 2 цикла ХТ. ХЛТ неэффективна при диффузном подтипе по классификации Лаурена, в этом случае назначают ХТ. ХЛТ может быть применена для лечения изолированных местных рецидивов или олигометастатической болезни. Рекомендуемые режимы ХЛТ РЖ представлены в табл. 3.
|
Режим химиотерапии (без лучевой терапии) |
Цикличность |
Дни введения в комбинации с ЛТ |
Количество курсов до начала ХЛТ |
Количество курсов после ХЛТ с началом через 1 мес после окончания ЛТ |
|
капецитабин 1500– 2000 мг/м²/сут. внутрь за два приема в 1–14-й дни |
Каждые 21 день |
По 1250– 1650 мг/м²/сут. внутрь в два приема в дни ЛТ |
1 |
2 |
|
кальция фолинат 400 мг/м² в/в капельно 2 часа в 1-й день + 5-ФУ 400 мг/м 2 в/в струйно в день 1 + 5-фторурацил 2400 мг/м 2 в виде непрерывной в/в инфузии не менее 46 часов (т. е. по 1200 мг/м 2 в виде непрерывной 24-часовой инфузии в дни 1 и 2) |
Каждые 14 дней |
5-фторурацил 200–250 мг/м²/сут. в/в непрерывная 24-часовая инфузия в дни 1–5, еженедельно в течение 5 недель |
2 |
4 |
При решении вопроса о назначении адъювантной или периоперационной ХТ при операбельных стадиях РЖ возможен учет данных ретроспективного анализа исследований MAGIC и CLASSIC и последующих ретроспективных мета-анализов на основе объединения индивидуальных данных пациентов резектабельным РЖ исследований MAGIC и CLASSIC, а также MAGIC, CLASSIC, ARTIST и ITACA-S, показавших, что при MSI-H в опухоли добавление ХТ к оперативному лечению не улучшает выживаемость, однако из-за небольшого числа больных с MSI-H в этих исследованиях окончательный вывод об отмене адъювантной или периоперационной ХТ при MSI-H в опухоли и назначении ингибиторов контрольных точек делать преждевременно, необходимы проспективные клинические исследования.
Рекомендована при опухолях pT>2pN0 и pTлюбоеpN+ в режиме XELOX, который назначается через 3–6 нед. после операции и проводится на протяжении 6 мес., всего 6–8 курсов (табл. 4). Согласно исследованию CLASSIC, проведенному в Южной Корее, Китае и Тайвани, дополнение радикальной операции адъювантной ХТ улучшает безрецидивную 5-летнюю выживаемость на 15%, 5-летнюю общую выживаемость — на 8%. Возможно назначение ХТ при pT2N0 c признаками высокого риска рецидива болезни (низкодифференцированный рак, наличие лимфоваскулярной или периневральной инвазии, возраст менее 50 лет или отсутствие D2 диссекции, патоморфологическое исследование менее 16 лимфоузлов).
Рекомендована при опухоли cT >1Nлюбое и cTлюбоеN +. Предпочтительной программой является режим FLOT: 4 курса предоперационно, операция — через 4–6 нед. после окончания четвертого курса, через 4–8 (максимум через 12) нед. после операции — проведение еще 4 курсов в режиме FLOT вне зависимости от лечебного патоморфоза в опухоли. При невозможности проведения терапии в режиме FLOT возможными вариантами могут быть комбинации FOLFOX (суммарно 8 циклов), XELOX (3 цикла — до и 3 цикла — после операции, суммарно — 6 циклов) или цисплатин+фторурацил (3 цикла — до и 3 цикла — после операции, суммарно — 6 циклов) с началом послеоперационного этапа через 4–6 нед. после даты операции, максимально допустимый интервал до начала ХТ — 12 нед. (табл. 4).
В настоящее время активно изучается роль иммунотерапии и анти-HER2 препаратов в комбинированном лечении операбельного РЖ.
Под динамическим наблюдением подразумевают регулярный сбор жалоб и физикальный осмотр больных (после мукозэктомий в дополнение к этому рекомендуется выполнение ЭГДС) по определенному графику: каждые 3 мес. — в течение 1-го года после операции, каждые 3–6 мес. — на протяжении 2-го и 3-го года после операции, затем — ежегодно. Инструментальное обследование показано при подозрении на рецидив или метастазирование.
Больным данной группы показано паллиативное лекарственное лечение (табл. 4) либо симптоматическая терапия. Выбор лечебной тактики базируется на оценке общего состояния больного, функциональных резервов организма, ожидаемой эффективности и токсичности противоопухолевой терапии. Задачей противоопухолевой лекарственной терапии является увеличение продолжительности жизни больных и/или улучшение ее качества.
Рекомендуется проведение ХТ I линии на протяжении 18 нед. (6 трехнедельных циклов или 9 двухнедельных циклов) с последующим наблюдением до прогрессирования болезни. Роль поддерживающей ХТ фторпиримидинами изучается. Возможно проведение ХТ I линии до прогрессирования болезни. При HER2-позитивном РЖ и пищеводно-желудочного перехода после окончания ХТ рекомендуется продолжать терапию трастузумабом до прогрессирования болезни.
При определении показаний к проведению II линии лечения необходимо учитывать общее состояние больного, количество и тяжесть сопутствующих заболеваний, функ- циональное состояние внутренних органов, а также наличие или отсутствие осложнений опухолевого процесса (кровотечение, угроза перфорации полого органа, сдавление внутренних органов и т. д.). При общем состоянии по шкале ECOG 3 балла, наличии тяжелых сопутствующих заболеваний или осложнений опухолевого процесса показана симптоматическая терапия. После принятия решения о проведении II линии лекарственной терапии при выборе конкретного режима лечения необходимо учесть:
-
• наличие остаточных побочных эффектов предыдущего режима лечения;
-
• имеющуюся и потенциальную кумулятивную токсичность;
-
• возможность перекрестной резистентности и токсичности;
-
• эффективность режима I линии;
-
• длительность интервала без лечения, который исчисляется от даты введения последней дозы препаратов I линии или адъювантной ХТдо момента регистрации прогрессирования процесса на основании жалоб и/или данных объективных методов обследования.
При регистрации прогрессирования болезни через 3 мес. и более после окончания ХТ I линии (для адъювантной ХТ — через 6 и более мес.) возможна реинтродукция режима I линии лечения. При регистрации прогрессирования процесса на фоне ХТ I линии или адъювантной ХТ или в течение интервала без лечения менее 3 мес. от даты окончания I линии лечения (для адъювантной ХТ<6 мес.) показана смена режима. В качестве II линии терапии рекомендуется использовать препараты, не вошедшие в режим I линии. Таксаны и иринотекан равно эффективны во II линии ХТ. Вопрос о более высокой эффективности комбинированной терапии по сравнению с монотерапией остается открытым. Результаты сравнительных клинических исследований противоречивы.
При HER2-позитивном диссеминированном РЖ продолжение введения трастузумаба во II линии лечения оказалось неэффективным по сравнению с одной только ХТ. Однако по данным рандомизированного исследования DESTINY — Gastric01 назначение трастузумаба дерукстекана (T-DXd) во II и последующихлиниях привело к увеличению медианы выживаемости с 8,9 мес до 12,5 мес [ОР 0,60 (0,42–0,86)] по сравнению со стандартной ХТ. При сохранении HER2-позитивности в опухоли после прогрессирования на I линии может обсуждаться вопрос о продолжении введения трастузумаба со сменой режима ХТ в случае длительного интервала без ХТ.
Согласно результатам рандомизированных исследований применение рамуцирумаба в монорежиме или в комбинации с паклитакселом статистически значимо увеличивает общую выживаемость больных по сравнению с оптимальной симптоматической терапией или паклитакселом, в связи с чем предпочтительно назначение комбинации рамуцирумаба с паклитакселом. При наличии полинейропатии или при прогрессировании болезни на фоне таксанов возможно назначение комбинации рамуцирумаба с иринотеканом или режимом FOLFIRI. Длительность терапии II и последующих линий определяется эффективностью и переносимостью и может проводиться до прогрессирования заболевания. Рекомендуемые режимы II линии лекарственного лечения РЖ представлены в табл. 5.
Вопрос о проведении III и последующих линий лекарственной терапии решается индивидуально по усмотрению врача с учетом функционального статуса больного, эффективности и токсичности предшествующих линий лекарственной терапии, доступ- ности лекарственных препаратов, желания больного. Помимо лекарственных препаратов по выбору врача могут быть рекомендованы следующие опции:
-
• пембролизумаб рекомендуется к применению во II (при PD-L1 CPS>10 или MSI-H) и последующих (при PD-L1 CPS>1) линиях лечения;
-
• по данным рандомизированного двойного слепого плацебо контролируемого исследования III фазы ATTRACTION-2 иммунотерапия ниволумабом (по 3 мг/кг 1 раз в 2 недели) в III и последующихлинияхлечения статистически значимо (p<0,0001) увеличивает как медиану времени без прогрессирования (с 1,45 до 1,61 мес.), так и медиану общей выживаемости (с 4,1 до 5,3 мес.) по сравнению с оптимальной симптоматической терапией вне зависимости от экспрессии PD-L1 в азиатской популяции больных. Эффективность ниволумаба подтверждена и на европейской популяции пациентов.
-
• в РФ в 2022–2023 гг.. планируется регистрация трифлуридина/типирацила, показавшего эффективность в III и последующих линиях лечения больных химиорефрактерным диссеминированным РЖ по сравнению с плацебо в международном двойном слепом плацебо контролируемом рандомизированном клиническом исследовании III фазы в дозе 35 мг/м 2 2 раза в день в 1–5-й и 8–12-й дни каждых 28 дней с увеличением медианы общей выживаемости с 3,6 до 5,7 мес. (р=0,00029). После регистрации может быть рекомендован к применению.
После запланированной регистрации в Российской Федерации для лечения опухолей, позитивных по слиянию NTRK генов, вне зависимости от локализации первичного очага во второй линии лечения может быть рекомендовано назначение ларотрек-тиниба по 100 мг 2 раза в день непрерывно до прогрессирования процесса.
Решение о назначении препаратов должно приниматься на врачебном консилиуме или врачебной комиссии с соответствующей записью в медицинской документации.
|
Название режима |
Препараты |
Доза (мг/м²), способ введения |
Дни введения |
Цикличность |
|
Комбинированные режимы химиотерапии |
||||
|
CF |
цисплатин |
80 мг/м² в/в |
1 |
Каждые 4 нед. |
|
5-ФУ |
1000 мг/м² в/в 24 часа |
1, 2, 3, 4, 5 |
||
|
FOLFIRI |
иринотекан |
180 мг/м² в/в |
1 |
Каждые 2 нед. |
|
кальция фолинат |
400 мг/м² в/в |
1 |
||
|
5-ФУ |
400 мг/м² в/в струйно + 2400 мг/м² в/в 46–48 часов |
1 |
||
|
XP |
цисплатин |
80 мг/м² в/в |
1 |
Каждые 3 нед. |
|
капецитабин |
2000 мг/м² в сутки внутрь в 2 приема |
1–14 |
||
|
Название режима |
Препараты |
Доза (мг/м²), способ введения |
Дни введения |
Цикличность |
|
XELOX |
оксалиплатин 1 |
100–130 мг/м² в/в |
1 |
Каждые 3 нед. |
|
капецитабин |
2000 мг/м² в сутки внутрь в 2 приема |
1–14 |
||
|
mFOLFOX6 |
оксалиплатин |
85 мг/м² в/в |
1 |
Каждые 2 нед. |
|
кальция фолинат |
400 мг/м² в/в |
1 |
||
|
5-фторурацил |
400 мг/м² в/в струйно + 2400 мг/м² в/в 46–48 часов |
1 |
||
|
T-XP² |
трастузумаб |
6 мг/кг (нагрузочная доза 8 мг/кг) в/в |
1 |
Каждые 3 нед. |
|
цисплатин |
80 мг/м² в/в |
1 |
||
|
капецитабин |
2000 мг/м² в сутки внутрь в 2 приема |
1–14 |
||
|
T-XELOX² |
трастузумаб |
6 мг/кг (нагрузочная доза 8 мг/кг) в/в |
1 |
Каждые 3 нед. |
|
оксалиплатин 1 |
100–130 мг/м² в/в |
1 |
||
|
капецитабин |
2000 мг/м² в сутки внутрь в 2 приема |
1–14 |
||
|
T-mFOLFOX6² |
трастузумаб |
4 мг/кг (нагрузочная доза 6 мг/кг) в/в |
1 |
Каждые 2 нед. |
|
оксалиплатин |
85 мг/м² в/в |
1 |
||
|
кальция фолинат |
400 мг/м² в/в |
1 |
||
|
5-фторурацил |
400 мг/м² в/в струйно + 2400 мг/м² в/в 46–48 часов |
1 |
||
|
DCF |
доцетаксел |
75 мг/м² в/в |
1 |
Каждые 3 нед. |
|
цисплатин |
75 мг/м² в/в |
1 |
||
|
5-фторурацил |
750 мг/м²/сут. в/в 24 часа |
1, 2, 3, 4, 5 |
||
|
mDCF-1 |
доцетаксел |
40 мг/м² в/в |
1 |
Каждые 2 нед. |
|
цисплатин |
40 мг/м² в/в |
1 |
||
|
5-фторурацил |
2000 мг/м² в/в 48 часов |
1 |
||
|
mDCF-2 |
доцетаксел |
40 мг/м 2 в/в |
1 |
Каждые 2 нед. |
|
кальция фолинат |
400 мг/м² в/в |
1 |
||
|
5-фторурацил |
400 мг/м² в/в струйно + 2400 мг/м² в/в 46–48 часов |
1 |
||
|
цисплатин |
40 мг/м 2 в/в |
1 |
|
Название режима |
Препараты |
Доза (мг/м²), способ введения |
Дни введения |
Цикличность |
|
FLOT |
доцетаксел |
50 мг/м² в/в |
1 |
Каждые 2 нед. |
|
оксалиплатин |
85 мг/м² в/в |
1 |
||
|
кальция фолинат |
200 мг/м² в/в |
1 |
||
|
5-фторурацил 3 |
2600 мг/м² в/в 24 3 часа |
1 |
||
|
FOLFIRINOX |
иринотекан |
180 мг/м² в/в |
1 |
Каждые 2 нед. |
|
оксалиплатин |
85 мг/м² в/в |
1 |
||
|
кальция фолинат |
400 мг/м² в/в |
1 |
||
|
5-фторурацил |
250–400 мг/м² в/в струйно + 2200–2400 мг/м² в/в 46–48 часов |
1 |
||
|
N + XELOX (только при экспрессии PD–L1 CPS ≥ 5 или MSI-H) |
ниволумаб |
360 мг |
1 |
Каждые 3 нед. |
|
оксалиплатин 1 |
100–130 мг/м² в/в |
1 |
||
|
капецитабин |
2000 мг/м² в сутки внутрь за два приема |
1–14 |
||
|
N + mFOLFOX6 (только при экспрессии PD–L1 CPS ≥ 5 или MSI-H) |
ниволумаб |
240 мг |
1 |
Каждые 2 нед. |
|
оксалиплатин |
85 мг/м 2 в/в |
1 |
||
|
кальция фолинат |
400 мг/м 2 в/в |
1 |
||
|
5-фторурацил |
400 мг/м 2 в/в струйно + 2400 мг/м 2 в/в 46–48 часов |
1 |
||
|
Монотерапия (только для пожилых и ослабленных больных) |
||||
|
– |
5-фторурацил |
800 мг/м²/сут. в/в 24 часа |
1, 2, 3, 4, 5 |
Каждые 3–4 нед. |
|
– |
кальция фолинат |
200 мг/м² в/в |
1 |
Каждые 2 нед. |
|
5-фторурацил |
400 мг/м² в/в струйно + 2400 мг/м² в/в 46–48 часов |
1 |
||
|
– |
капецитабин |
2000–2500 мг/м² в сутки внутрь в два приема |
1–14 |
Каждые 3 нед. |
|
– |
иринотекан |
250 мг/м² в/в |
1 |
Каждые 3 нед. |
|
– |
иринотекан |
150–180 мг/м² в/в |
1 |
Каждые 2 нед. |
|
– |
доцетаксел |
60–75 мг/м² в/в |
1 |
Каждые 3 нед. |
|
Название режима |
Препараты |
Доза (мг/м²), способ введения |
Дни введения |
Цикличность |
|
– |
паклитаксел |
135–175 мг/м² в/в |
1 |
Каждые 3 нед. |
|
– |
паклитаксел |
80 мг/м² в/в |
1, 8, 15 |
Каждые 4 нед. |
1 При диссеминированном РЖ возможно применение разовой дозы 100 мг /м 2.
-
2 Только для HER2-положительных вариантов.
-
3 Возможно увеличение времени инфузии до 48 часов.
-
3.1.5.4. Особые клинические ситуации
-
3.1.5.4.1. ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ
-
|
Препарат |
Доза в мг/м², способ введения |
Дни введения |
Цикличность |
|
Монотерапия |
|||
|
иринотекан |
250–300 мг/м² в/в |
1 |
Каждые 21 день |
|
иринотекан |
150–180 мг/м² в/в |
1 |
Каждые 14 дней |
|
доцетаксел |
60–75 мг/м² в/в |
1 |
Каждые 21 день |
|
паклитаксел |
135–175 мг/м² в/в |
1 |
Каждые 21 день |
|
паклитаксел |
80 мг/м² в/в |
1, 8, 15 |
Каждые 28 дней |
|
рамуцирумаб |
8 мг/кг в/в |
1 |
Каждые 14 дней |
|
пембролизумаб |
2 мг/кг или 200 мг в/в |
1 |
Каждые 21 день |
|
пембролизумаб |
400 мг в/в |
1 |
Каждые 6 недель |
|
ниволумаб |
3 мг/кг или 240 мг в/в |
1 |
Каждые 14 дней |
|
ниволумаб |
480 мг в/в |
1 |
Каждые 28 дней |
|
ниволумаб |
360 мг в/в |
1 |
Каждые 21 день |
|
Комбинированные режимы |
|||
|
рамуцирумаб паклитаксел |
8 мг/кг в/в 80 мг/м² в/в |
1, 15 1, 8, 15 |
Каждые 28 дней |
|
рамуцирумаб иринотекан |
8 мг/кг в/в 150–180 мг/м² в/в |
1, 15 1, 15 |
Каждые 28 дней |
|
рамуцирумаб иринотекан кальция фолинат 5-фторурацил |
8 мг/кг в/в 150–180 мг/м² в/в 400 мг/м² в/в 400 мг/м² в/в струйно +2400 мг/м² в/в 46–48 часов |
1, 15 1, 15 1, 15 1, 15 |
Каждые 28 дней |
|
иринотекан цисплатин |
60 мг/м² в/в 30 мг/м² в/в |
1, 8 1, 8 |
Каждые 21 день |
|
иринотекан капецитабин |
200–250 мг/м² в/в 1500 мг/м² в сутки внутрь в 2 приема |
1 1–14 |
Каждые 21 день |
|
Препарат |
Доза в мг/м², способ введения |
Дни введения |
Цикличность |
|
доцетаксел капецитабин |
60–70 мг/м² в/в 1500 мг/м² в сутки в 2 приема |
1 1–14 |
Каждые 21 день |
|
этопозид кальция фолинат 5-фторурацил |
80–120 мг/м² в/в 30 мг/м² в/в 500 мг/м² в/в |
1, 2, 3 1, 2, 3 1, 2, 3 |
Каждые 21–28 дней |
XИМИОТЕРАПИЯ (HIPEC) И ВНУТРИБРЮШИННАЯ АЭРОЗОЛЬНАЯ ХИМИОТЕРАПИЯ ПОД ДАВЛЕНИЕМ (PIPEC)
Рутинно не рекомендуются. Допускаются только в рамках клинических исследований.
Отличается крайне неблагоприятным прогнозом, характеризуется меньшей чувствительностью к ХТ и ХЛТ. Лечение назначают в соответствии со стандартными рекомендациями, отдельных рекомендаций не разработано.
с обезболивающей целью в случае поражения костей. Режим ЛТ и объём облучения определяются в зависимости от локализации поражения и, соответственно, располагающихся в зоне облучения органов риска.


