Предикция рецидива лейомиомы матки в репродуктивном возрасте
Автор: Карамян Р.А., Ордиянц И.М., Рыженков К.В., Бокарев М.И., Мамыкин А.И.
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Статья в выпуске: 4, 2025 года.
Бесплатный доступ
Несмотря на ряд доступных вариантов лечения лейомиомы матки (ЛМ) и нивелирования ее симптомов, включая гистерэктомию, абляцию эндометрия, эмболизацию эндометриальных маточных артерий и фокусированную ультразвуковую хирургию под контролем магнитного резонанса, миомэктомия остается золотым стандартом для пациенток, желающих сохранить фертильность. Вместе с тем, хотя эта операция и является распространенным хирургическим методом удаления фибром, она несет известные риски, такие как рецидив фибромы, рецидив симптомов и последующая необходимость повторного вмешательства. Несмотря на продолжающиеся исследования и достижения в области оперативного лечения ЛМ в настоящее время не существует универсально рекомендуемых терапевтических вмешательств, способных гарантированно снизить частоту рецидивов. Цель. Определить клинико-анамнестические предикторы рецидивирования лейомиомы матки в репродуктивном возрасте. Материалы и методы. В ретроспективное исследование включено 225 женщин, поступивших на оперативное лечение ЛМ в репродуктивном возрасте. Пациентки были разделены на две группы: I группа – 156 женщин, которым миомэктомия была произведена впервые, II группа – 69 женщин, нуждавшихся в повторном вмешательстве. Рецидивом считалось возникновение ЛМ у пациенток, которые уже перенесли миомэктомию на момент включения в исследование, либо обнаружение миоматозных узлов на контрольном осмотре через 1 год после произведенной миомэктомии. Для создания базы данных и их математической обработки был применен пакет модулей IBM SPSS STATISTICS, v.26.0 for Windows (IBM Corporation, Somers, USA), Jamovi, version 1.2.27, StatTech v. 1.2.0 (номер регистрации 2020615715). Для построения математической модели использовалась логистическая регрессия. Результаты. Предикторами риска рецидивирования лейомиомы матки являются: возраст 42 года и менее (ОШ=3,2; 95 % ДИ 1,16–8,87), длительность течения заболевания 7 лет и более (ОШ=3,27; 95 % ДИ 1,17–9,18), отсутствие родов в анамнезе (ОШ=0,23; 95 % ДИ 0,08–0,68), избыточная масса тела и нарушения жирового обмена (ОШ=1,33; 95 % ДИ 0,49–3,62), сочетание ЛМ с эндометриозом (ОШ=1,23; 95 % ДИ 0,45–3,33). Выводы. В ходе исследования с помощью разработанной математической модели, включающей клинико-анамнестические факторы, на дооперационном этапе рассчитывался риск рецидивирования лейомиомы матки. Разработанная модель обеспечивает персонифицированный алгоритмированный подход к ведению женщин репродуктивного возраста с лейомиомой матки (чувствительность метода составила 90,9 %, специфичность – 73,8 %).
Лейомиома матки, клинико-анамнестические факторы риска, предикторы рецидивирования
Короткий адрес: https://sciup.org/14134214
IDR: 14134214 | УДК: 618.3:618.14-006.36-089 | DOI: 10.34014/2227-1848-2025-4-88-97
Текст научной статьи Предикция рецидива лейомиомы матки в репродуктивном возрасте
Введение. Лейомиома матки (ЛМ) является наиболее распространенной доброкачественной гинекологической опухолью, которая возникает в результате клональной экспансии отдельных клеток в миометрии [1]. Распространенность ЛМ в репродуктивном возрасте составляет 70 % [2]. Только 30 % пациенток имеют клинические симптомы, такие как аномальное маточное кровотечение, тяжелая анемия, запор, боль в пояснице и частое мочеиспускание [3]. У подавляющего же большинства женщин опухоль чаще обнаруживается при визуализационном обследовании [4].
Золотым стандартом лечения пациенток, желающих сохранить фертильность, остается миомэктомия. Однако выбор доступа (лапаро-томический или лапароскопический) остается за хирургом. Исследования A. Giannini, I. Cuc-cu, T.G. D’Auge et al. показали, что лапароскопический доступ может уменьшить интраоперационную кровопотерю, сократить сроки пребывания в стационаре и уменьшить частоту послеоперационных осложнений. Вместе с тем авторы утверждают, что операционный доступ не влияет на послеоперационное восстановление пациенток и исход беременности [5]. Следует отметить, что, несмотря на развитие хирургических методов лечения, частота рецидивов ЛМ не обнаруживает тенденции к снижению. Она зависит от хирургического доступа, после лапароскопии составляя от 11,0 до 76,2 % при наблюдении от одного до восьми лет, а после лапаротомии – от 5,3 до 63,4 % при аналогичной длительности наблюдения [6].
Значительная распространенность ЛМ оказывает негативное влияние на расходы в здравоохранении во всем мире. Так, ежегодные экономические потери при ЛМ в США составляют $34,4 млрд, в Германии – $348 млн, во Франции – $120 млн, в Англии – $86 млн, что превосходит затраты на два вида рака репродуктивной системы женщины – молочной железы и яичников [7].
Таким образом, факторы риска рецидивов ЛМ в настоящее время остаются до конца не изученными, а поиск более информативных маркеров – актуальным.
Цель исследования. Определить клинико-анамнестические предикторы рецидиви-рования лейомиомы матки в репродуктивном возрасте.
Материалы и методы. В сравнительный анализ особенностей преморбидного фона и клинико-анамнестических данных включены 225 женщин, поступивших на оперативное лечение лейомиомы матки в репродуктивном возрасте. Пациентки были разделены на две группы: I группа – 156 женщин, которым миомэктомия была произведена впервые, II группа – 69 женщин, нуждавшихся в повторном вмешательстве. Рецидивом считалось возникновение ЛМ у пациенток, которые уже перенесли миомэктомию на момент включения в исследование, либо обнаружение миоматозных узлов на контрольном осмотре через 1 год после произведенной миомэктомии.
Процедура статистического анализа проводилась с помощью статистического пакета IBM-SPSS Statistics 22. Критическое значение уровня статистической значимости при проверке нулевых гипотез принималось равным 0,05. Сравнение независимых выборок по качественным номинальным показателям выполнялось с помощью критерия χ2 Пирсона.
Для построения математической модели аденомиоза использовалась логистическая регрессия – метод принудительного включения. Общая оценка согласия модели и реальных данных оценивалась при помощи теста Хосмера – Лемешева. Применялся критерий Колмогорова – Смирнова для двух выборок. Качество модели оценивалось с помощью ROC-кривой. Определение порогового балла при построении скрининговой шкалы осуществлялось с помощью критерия Юдена.
Исследование проведено согласно принципам Хельсинкской конвенции. Протокол одобрен локальным этическим комитетом ФГАОУ ВО «Российский университет дружбы народов имени Патриса Лумумбы» (протокол № 3 от 26.05.2022).
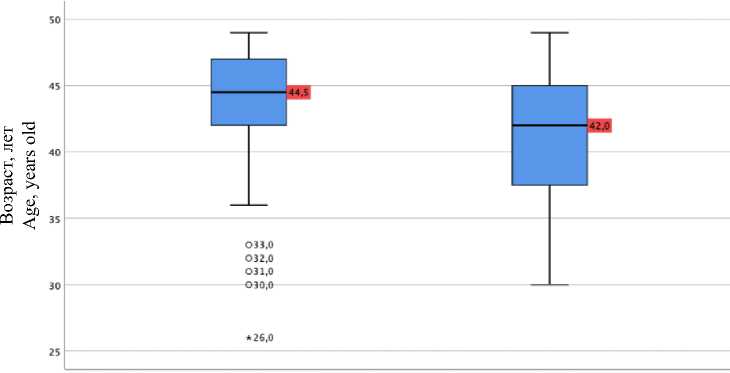
Результаты. Анализ показал, что группы были сопоставимы по возрасту менархе и начала половой жизни, наследственной предрасположенности и методам контрацепции (р>0,05). С целью поиска эффективных маркеров прогнозирования повторных оперативных вмешательств при ЛМ в репродуктивном возрасте была выполнена более детальная оценка факторов риска. Анализ возраста представлен на рис. 1.
Без рецидива Nonrelapsive
С рецидивом Relapsed
Рис. 1. Возраст женщин в момент обследования
Fig. 1. Age analysis at the time of examinations
Пациентки с рецидивом ЛМ были достоверно моложе: медиана их возраста составила 42 года, тогда как у женщин без рецидива – 44 года (р=0,027). Шансы развития рецидива ЛМ у пациенток в возрасте 42 лет и менее увеличиваются в 3 раза (ОШ=3,2; 95 % ДИ 1,16–8,87).
При сравнении двух групп пациенток по наличию родов в анамнезе также получены статистически значимые различия (p=0,01). Шансы рецидива ЛМ у пациенток с отсутствием родов в анамнезе увеличиваются в 23 раза (ОШ=0,23; 95 % ДИ 0,08–0,68). Между сопоставляемыми признаками отмечалась средняя связь по значению V Краммера (0,318).
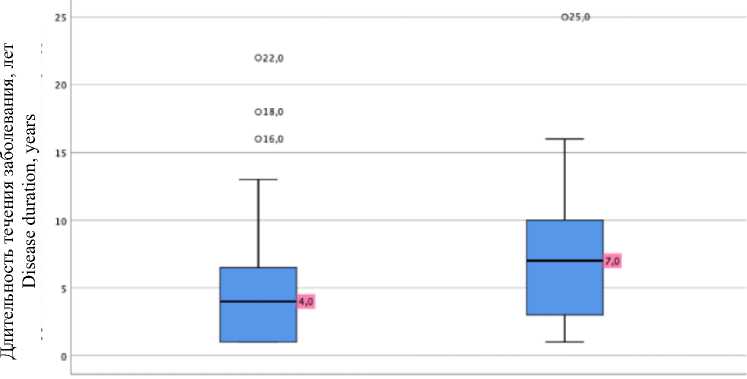
Анализ связи длительности течения заболевания и необходимости повторных оперативных вмешательств на матке представлен на рис. 2. У пациенток без рецидива длительность заболевания составила 4 года, а у женщин с рецидивом – 7 лет (р=0,023). Шансы развития рецидива ЛМ у пациенток с отсро-ченностью оперативного лечения увеличиваются в 3 раза (ОШ=3,27; 95 % ДИ 1,17–9,18).
Без рецидива Nonrelapsive
С рецидивом Relapsed
Рис. 2. Длительность течения заболевания
Fig. 2. Disease duration
При изучении сопутствующей экстраге-нитальной патологии обнаружено, что на одну пациентку приходилось 1,3 заболевания. Из них статистически значимым было нарушение жирового обмена (НЖО). При сравнении наличия НЖО у пациенток в изучаемых группах были получены достоверные различия (p<0,001). Шансы рецидива ЛМ у пациенток с НЖО в анамнезе увеличиваются в 25 раз (ОШ=25,9; 95 % ДИ 5,39–124,4).
Кроме того, на одну пациентку с ЛМ приходилось 1,9 гинекологического заболевания. Одним из наиболее значимых был наружный генитальный эндометриоз (НГЭ), который вы- явлен у 37,1 % женщин без рецидива миомы и 43,4 % женщин с рецидивом (p<0,001). Шансы развития рецидива у пациенток с НГЭ увеличивались в 23,1 раза (ОШ=23,1; 95 % ДИ 6,5– 82,5). Между сопоставляемыми признаками отмечалась относительно сильная связь (V Крамера = 0,634).
Из 69 пациенток с рецидивом ЛМ 54 женщинам (78,3 %) произведена миомэктомия. Лапароскопическим доступом прооперированы 18 чел. (33,3 %), лапаротомным – 36 чел. (66,7 %). Клинико-анамнестические факторы, влияющие на риск развития рецидивов ЛМ в репродуктивном возрасте, представлены в табл. 1.
Таблица 1
Table 1
Вклад факторов, влияющих на риск развития рецидивов лейомиомы матки в репродуктивном возрасте
Factors influencing the risk of uterine leiomyoma recurrence in women of reproductive age
|
Фактор Factor |
Наличие рецидива, абс. (%) Relapsed, abs. (%) |
Отсутствие рецидива, абс. (%) Nonrelapsive, abs. (%) |
ОШ (95 % ДИ) OR (95 % CI) |
р |
|
Возраст 42 года и менее Age ≤ 42 years |
14 (60,9) |
17 (32,7) |
3,2 (1,16–8,87) |
0,022* |
|
Длительность течения заболевания 7 лет и более Disease duration ≥ 7 years |
12 (52,2) |
13 (25) |
3,27 (1,17–9,18) |
0,021* |
|
Отсутствие родов в анамнезе Nulliparity |
12 (52,2) |
43 (82,7) |
0,23 (0,08–0,68) |
0,011* |
|
НГЭ EGE |
14(15,7) |
35 (25,7) |
23,1 (6,5–82,5) |
0,001* |
|
НЖО LMD |
14 (60,9) |
28 (53,8) |
25,9 (5,39–124,4) |
0,001* |
Примечания: 1. НГЭ – наружный генитальный эндометриоз, НЖО – нарушение жирового обмена. 2. * – различия показателей статистически значимы (p<0,05).
Notes: 1. EGE – external genital endometriosis, LMD – lipid metabolism disorder. 2. * – the differences in indicators are statistically significant (p<0.05).
Исходя из всех вышеперечисленных факто- возрасте по клинико-анамнестическим факто ров построена математическая модель прогно- рам (рис. 3).
зирования рецидивов ЛМ в репродуктивном
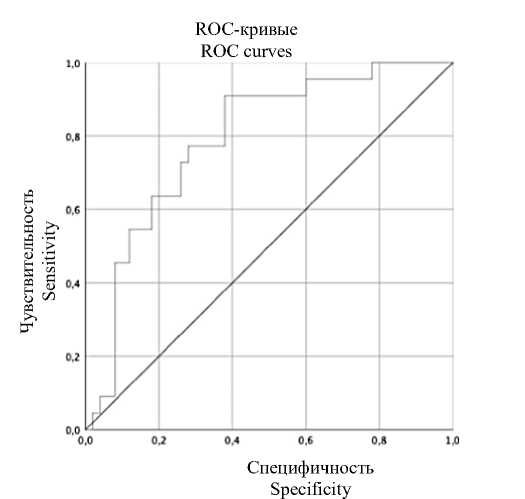
Рис. 3. ROC-кривая, характеризующая зависимость вероятности рецидива лейомиомы от значений прогностической функции
Fig. 3. ROC curve characterizing the dependence of uterine leiomyoma recurrence probability on prognostic function values
Площадь под ROC-кривой составила 0,79±0,06 (95 % ДИ 0,68–0,9). Значение логистической функции в точке cut-off равнялось 0,25. При значениях р>0,25 определялся высокий риск рецидива ЛМ, а при значениях р<0,25 – низкий. Чувствительность и специфичность модели при данном пороговом значении составили 90,9 % (соответствует проценту верных прогнозов о наличии исхода) и 73,8 % (соответствует проценту верных прогнозов об отсутствии исхода) соответственно.
Таким образом, факторами, влияющими на рецидивирование ЛМ в репродуктивном возрасте, являются возраст менее 42 лет (ОШ=3,2; 95 % ДИ 1,16–8,87), длительность течения заболевания 7 лет и более (ОШ=3,27; 95 % ДИ 1,17–9,18), отсутствие родов в анамнезе (ОШ=0,23; 95 %ДИ 0,08–0,68), НЖО (ОШ=25,9; 95 %ДИ 5,39–124,4), наружный генитальный эндометриоз (ОШ=23,1; 95 % ДИ 6,5–82,5).
Обсуждение. В последнее десятилетие во всем мире, в т.ч. и в России, отмечается повышение частоты возникновения гормонозависимых опухолей у женщин. Лидирующие по- зиции в структуре гинекологических заболеваний занимают ЛМ и эндометриоз. До 70 % оперативных вмешательств в гинекологических стационарах Российской Федерации приходится на ЛМ, в т.ч. на радикальные операции у молодых женщин, не успевших стать матерями [8]. Однако несмотря на развитие хирургических методов лечения, частота рецидивов ЛМ не снижается и зависит от множества клинико-анамнестических факторов.
Отметим, что лейомиома матки оказывает влияние на качество жизни женщин. Так, S.E. Chiuve, C. Huisingh, N. Petruski-Ivleva, C. Owens обнаружили, что у женщин с миомой зафиксирован более высокий уровень депрессия [9]. Прежде всего это связано с особенностями хирургического лечения. При миомэктомии (органосохраняющей операции) у молодых женщин часто остаются микроскопические зачатки будущих узлов, которые могут активироваться под влиянием гормонов. Рецидив миомы после миомэктомии в течение 5 лет наблюдается у 15–30 % пациенток. У женщин моложе 35 лет риск рецидива может достигать 40–50 %, особенно при множе- ственных узлах. После эмболизации маточных артерий рецидивы встречаются реже (около 10–15 %), но молодой возраст остается фактором риска [10].
Отсрочка хирургического вмешательства при миоме матки может повышать вероятность повторного развития опухоли из-за прогрессирования заболевания, увеличения размеров узлов и появления новых очагов. Однако в некоторых случаях при тщательном наблюдении она допустима. Оптимальный срок операции определяет врач, который учитывает размеры узлов, возраст пациентки и репродуктивные планы.
Отметим, что миома матки – это гормонозависимая опухоль, которая при отсрочке хирургического лечения может увеличиваться в размерах, неудаленные мелкие узлы успевают вырасти, а новые – сформироваться. Особенно это актуально для множественных миом и пациенток молодого возраста (до 35–40 лет).
Необходимо иметь в виду и некоторые технические сложности, которые могут возникнуть при операции. Так, крупные узлы затрудняют проведение органосохраняющей миомэктомии: труднее выделить капсулу узла, повышается риск массивной кровопотери, увеличивается объем рубцовой ткани, что может ухудшить заживление. Это приводит к неполному удалению зачатков миомы, повышая риск рецидива.
Кроме того, риск рецидива зависит от вида операции. При лапароскопической миомэктомии и своевременном оперативном лечении он составляет 15–30 % (за 5 лет), в то время как при отсроченном – 40–50 % (из-за роста оставшихся узлов); при лапаротомии риск достигает 10–25 % и 30–40 % (из-за технических сложностей при больших размерах); при гистерорезек-тоскопии подслизистых узлов – 5–15 % и 20– 30 %; при эмболизации маточных артерий – 10–15 % и 20–25 % (при гигантских миомах эффективность снижается) соответственно.
Еще одним фактором риска развития рецидива лейомиомы матки (миомы) считается молодой возраст (<35–40 лет). Это прежде всего связано с тем, что высокие уровни эстрогенов и прогестерона стимулируют рост миоматоз- ных узлов. После удаления миомы высока вероятность появления новых узлов из-за сохраняющейся гормональной активности [11].
Также значимым фактором риска развития и рецидива миомы матки является отсутствие родов. По данным исследований M.P. Radosa, Z. Owsianowski, A. Mothes et al., у нерожавших женщин риск возникновения миомы в 2–3 раза выше, чем у рожавших. Каждая последующая доношенная беременность снижает показатель на 10–20 %. Особенно заметна разница у женщин после 35 лет: риск у нерожавших в этом возрасте составляет до 40–50 %, в то время как у рожавших – 20– 30 %. У нерожавших женщин после миомэктомии чаще возникают рецидивы (до 40–50 % в течение 5 лет), что связано с сохранением высокой гормональной активности, отсутствием беременности после операции (если миомэктомия проводилась для восстановления фертильности, но зачатия не произошло) [11].
Показано также, что женщины с ожирением имеют в 2–3 раза более высокий риск развития миомы по сравнению с женщинами с нормальным ИМТ. При ИМТ более 30 кг/м2 чаще встречаются множественные и крупные узлы. После миомэктомии у пациенток с ожирением чаще возникают рецидивы (до 50– 60 % в течение 5 лет). Это связано с гормональными, метаболическими и воспалительными механизмами. У женщин с ожирением чаще наблюдается относительная гиперэстро-гения на фоне сниженного прогестерона. Жировая ткань экспрессирует ароматазу, которая преобразует андрогены в эстрогены (в основном эстрон E1). Повышенный уровень эстрогенов стимулирует рост миоматозных узлов. В исследовании S. Afrin, M. Ramaiyer, U.A.M. Begum, M.A. Borahay независимыми факторами риска рецидива после лапароскопической миомэктомии у пациенток с миомой матки названы ИМТ>24 кг/м2, количество беременностей более 2 и эндометриоз [12]. Также предполагается, что у женщин с ожирением гормоны, секретируемые адипоцитами или адипоцитами, могут способствовать развитию и росту лейомиомы путем активации сигнального пути рецептора лептина. Кроме того, лейомиома представляет собой моноклональную опухоль, в которой миогенные стволовые клетки становятся опухолеобразующими после мутации, аномального метилирования или аномальной передачи сигнала, а ожирение может опосредовать миогенные стволовые клетки, чтобы инициировать опу-холегенез и привести к лейомиоме [13]. Все вышеуказанное может привести к росту риска рецидива лейомиомы.
Поскольку ЛМ и эндометриоз имеют общие гормональные, воспалительные и иммунные механизмы развития, после миомэктомии у женщин с эндометриозом чаще встречаются рецидивы (до 40–50 % в течение 5 лет). Хотя прямая причинно-следственная связь не доказана, эндометриоз рассматривается как фактор риска возникновения и роста миоматоз-ных узлов. Оба заболевания эстрогензави-симы: рост эндометриоидных очагов и миомы стимулируется эстрогенами. При эндометриозе часто наблюдается дисбаланс эстрогена и прогестерона (относительная гиперэстроге-ния), что способствует пролиферации клеток миометрия [14].
Заключение. Полученные результаты существенно дополняют современные представления о рецидивировании лейомиомы матки после миомэктомии в репродуктивном возрасте.
В ходе исследования с помощью разработанной математической модели, включающей клинико-анамнестические факторы, на доопе-рационном этапе рассчитывался риск рециди-вирования лейомиомы матки. Разработанная модель обеспечивает персонифицированный алгоритмированный подход к ведению женщин репродуктивного возраста с лейомиомой матки (чувствительность метода составила 90,9 %, специфичность – 73,8 %).


