Предикторы эффективности интраоперационной лучевой терапии в органосохраняющем лечении раннего рака молочной железы
Автор: Алайчиев Н.А., Усынин Е.А., Дорошенко А.В., Кондакова И.В., Гарбуков Е.Ю., Середа Е.Е., Старцева Ж.А., Вострикова М.А., Иванова А.Г.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 3 т.22, 2023 года.
Бесплатный доступ
Введение. Несмотря на совершенствование методов комбинированного лечения раннего рака молочной железы (РМЖ), частота локорегионарных рецидивов остается на уровне 7-15 %. В связи с этим поиск прогностических факторов течения заболевания остается актуальной задачей. Цель исследования -оценка взаимосвязи клинико-морфологических параметров с показателями 10-летней безрецидивной выживаемости больных РМЖ, перенесших комбинированное лечение с интраоперационной лучевой терапией (ИОЛТ). материал и методы. В исследование включено 383 больных с морфологически верифицированным РМЖ стадий T1-3N0-1M0. Средний возраст пациенток 53 года (28-80 лет). В плане комбинированного лечения всем пациенткам выполнялись органосохраняющие операции с ИОЛТ на ложе удаленной опухоли в однократной дозе 10 Гр (24,8 Гр по изоэффекту). В послеоперационном периоде осуществлялась дистанционная гамма-терапия (ДГТ) на оставшуюся часть молочной железы. Результаты. За 10-летний период наблюдения отмечено 20 (5,2 %) локорегионарных рецидивов, из них 7 (35 %) развилось при первичной опухоли размером ≤2 cм (Т1), а большинство рецидивов - 13 (65 %) - диагностировано при исходной распространенности опухоли, соответствующей Т2-3. Частота рецидивов у больных с люминальным А подтипом опухоли - 5 %, у пациенток с трижды негативным подтипом опухоли - 45 %. Безрецидивная 10-летняя выживаемость больных после комбинированного лечения с ИОЛТ составила 94,8 %. Заключение. Полученные результаты свидетельствуют о наличии взаимосвязи между частотой рецидивов и такими клинико-морфологическими параметрами опухоли, как размер и молекулярный подтип опухоли, которые должны учитываться при планировании лечения у больных ранними формами РМЖ.
Рак молочной железы, локальные рецидивы, интраоперационнная лучевая терапия
Короткий адрес: https://sciup.org/140300188
IDR: 140300188 | УДК: 618.19-006.6-08-089:615.28 | DOI: 10.21294/1814-4861-2023-22-3-49-56
Текст научной статьи Предикторы эффективности интраоперационной лучевой терапии в органосохраняющем лечении раннего рака молочной железы
Рак молочной железы продолжает лидировать в структуре онкологической заболеваемости женской репродуктивной системы как в мире, так и в России [1, 2]. В настоящее время в Российской Федерации в более чем 70 % случаев выявляется РМЖ I–II стадий [2]. Органосохраняющие операции (ОСО), безопасность и целесообразность которых подтверждены большим количеством клинических исследований, дополненные адъювантной лучевой терапией (АЛТ), являются основой в лечении ранних форм РМЖ [3–5]. Однако, несмотря на совершенствование методов комбинированного лечения раннего РМЖ, частота локорегионарных рецидивов остается на уровне 7–15 % [6]. Основная часть местных рецидивов возникает в области послеоперационного рубца, при этом менее 5 % случаев встречаются в других квадрантах [7, 8]. Это объясняется тем, что высокая плотность микроскопических фокусов располагается в пределах 3–4 см от опухоли [9, 10], что определяет необходимость усиленного локального воздействия на данную область. Тем временем возникший интерес к индексному квадранту инициировал серию клинических исследований, направленных на изучение возможностей ИОЛТ [11].
Интраоперационная лучевая терапия применяется как в монорежиме («single dose»), так и в качестве дополнительного прицельного облучения («boost»). К потенциальным преимуществам ИОЛТ можно отнести адресную доставку высокой однократной дозы, минимальное воздействие на окружающие ткани и возможность повторного облучения при прогрессировании заболевания. Также ИОЛТ предотвращает возможную репопуляцию остаточных опухолевых клеток между хирургическим вмешательством и АЛТ и тем самым способствует уменьшению количества местных рецидивов [12–14].
R. Orecchia et al. в 2021 г. опубликовали результаты исследования ELIOT фазы III (Electron Intra Operative Therapy), в котором для облучения ложа удаленной опухоли во время операции использовались высокоэнергетические электроны. В исследование были включены 1305 больных в возрасте старше 48 лет с размером опухоли ≤2,5 см, получивших высокую однократную дозу 21 Гр, в контрольной группе проводилось традиционное фракционирование в дозе 50 Гр и «буст» 10 Гр суженным полем. В течение 15 лет местные рецидивы выявлены у 12,6 % больных в группе ИОЛТ и у 2,2 % при облучении всей молочной железы. Авторами определены факторы, благоприятно влияющие на безрецидивную выживаемость: опухоль pT1 (<1,0 см), люминальный A подтип опухоли, низкая степень злокачественности (G1) и пролиферативная активность (Ki67) опухоли <14 % [15].
Обновленные данные TARGeted Intraoperative Radotherapy – Alone (TARGIT-A), в которых достигнуто 95 % полных 5-летних наблюдений, стали объектом острых дискуссий. В исследовании приняли участие 2298 пациенток с инвазивной карциномой молочной железы (Т1–2 ≤3,5 см, N0–1) в возрасте более 45 лет. В основную группу включено 1140 пациенток, которым после ОСО проводилась ИОЛТ с использованием аппарата Intrabeam. Контрольная группа, включающая 1158 больных, получила стандартную дистанционную лучевую терапию (ДЛТ). За 5 лет было зарегистрировано 24 (2,11 %) местных рецидива в группе ИОЛТ и 11 (0,95 %) в группе ДЛТ (р=0,0116). Отмечено, что ИОЛТ можно использовать как альтернативу ДЛТ при низком риске прогрессирования [11, 16]. Принимая во внимание противоречивые мнения в отношении эффективности TARGIT-A, следует отметить, что ускоренное частичное облучение молочной железы с ИОЛТ электронами или низкоэнергетическими фотонами все еще не вошло в рутинную практику [17–19]. В исследовании Hypofractionated Whole Breast Irradiation (HIOB) ИОЛТ электронным пучком применили у 1119 больных с ранним РМЖ (T1–2N0). Лечение включало в себя органосохраняющие операции, ИОЛТ в дозе 11,1 Гр и АЛТ в режиме гипофракционирования (40,5 Гр за 15 фракций). Комбинация фракционированного облучения и ИОЛТ привела к высоким показателям местного контроля – отсутствие рецидивов при медиане наблюдения 50 мес [20].
Таким образом, несмотря на накопленный клинический опыт по использованию ИОЛТ в комбинированном лечении раннего РМЖ, поиск критериев неблагоприятного прогноза течения заболевания остается актуальной задачей. В настоящее время продолжаются работы с целью расширения контингента больных для самостоятельного использования ИОЛТ.
Целью исследования явилась оценка взаимосвязи клинико-морфологических параметров с показателями 10-летней безрецидивной выживаемости больных РМЖ, перенесших комбинированное лечение с применением ИОЛТ.
Материал и методы
В исследование включено 383 больных с морфологически верифицированным диагнозом РМЖ стадий T1–3N0–1M0, проходивших лечение на базе НИИ онкологии Томского НИМЦ за период 2005–2015 гг. Средний возраст пациенток 53 года (28–80 лет). Сроки наблюдения за больными составили от 3 до 120 мес. Работа проведена с разрешения этического комитета НИИ онкологии
Томского НИМЦ в соответствии с «Правилами клинической практики в Российской Федерации», утвержденными Приказом Минздрава РФ № 266 от 19.06.2003. Всеми пациентками дано информированное согласие на проведение исследования.
При оценке распространенности первичной опухоли РМЖ были получены следующие данные: T1a регистрировался у 1 (0,3 %) пациентки, T1b – у 16 (4,2 %), Т1c – у 173 (45,1 %), Т2 – у 192 (50,1 %), T3 – у 1 (0,3 %) больной. По данным гистологического исследования поражение регионарных лимфатических узлов N1 выявлено у 93 (24,3 %) пациенток. Cтепень злокачественности определена как G1 в 40 (10,4 %), G2 – в 220 (57,4 %), G3 – в 28 (7,3 %), Gx – в 95 (24,9 %) случаях. В соответствии с ИГХ-статусом больные распределились следующим образом: люминальный А подтип выявлен в 146 (38,1 %) случаях, люминальный В – в 115 (30,0 %), люминальный Her2-позитивный – в 29 (7,6 %), трижды негативный подтип (ТНР) – в 93 (24,3 %) случаях (табл. 1).
В рамках комбинированного лечения всем пациенткам были выполнены ОСО с ИОЛТ, которая проводилась при помощи малогабаритного бетатрона МИБ-6Э, производящего пучок электронов с энергией 6 МэВ, установленного в операционном блоке. Для облучения использовались коллиматоры разной конфигурации (круглый – 3,5 см, овальный прямой и овальный скошенный – размерами 4×7; 7×9 см), которые подбирались с учетом размеров операционной раны. Во всех случаях однократная доза ИОЛТ на ложе удаленной опухоли составила 10 Гр (24,8 Гр по изоэффекту).
В послеоперационном периоде осуществлялась дистанционная гамма-терапия на оставшуюся часть молочной железы. Режим фракционирования был стандартным: разовая очаговая доза 1,8–2 Гр 5 раз в неделю, до СОД 50–55 Гр в течение 5–6 нед. Курсовая доза смешанного облучения составляла 60 изоГр. Гормональная и химиотерапия осуществлялась в рамках существующих рекомендаций в зависимости от биологического подтипа и распространенности опухолевого процесса.
Cтатистический анализ проводился в программе Statistica 10.0 (StatSoft). При оценке взаимосвязи показателей 10-летней безрецидивной выживаемости с клинико-морфологическими параметрами был использован обобщенный критерий Гехана–Вилкоксона и анализ выживаемости с использованием критерия χ2 для сравнения множественных групп. Кривые кумулятивной выживаемости строились по методу Каплана–Майера. При анализе выживаемости расчет проводился на десятый год после проведения операции с учетом выбывших из-под наблюдения больных и умерших от сопутствующих неонкологических заболеваний. Продолжительность жизни исчисляли в месяцах с момента проведенной ОСО до выявления рецидивов.
|
Общая характеристика больных general characteristics of patients |
Таблица 1/table 1 |
|
Параметр/Parameters |
Число больных/ Number of patients |
|
Возраст/Age |
<50 лет |
144 (37,6 %) |
|
>50 лет |
239 (62,4 %) |
|
|
pT1a |
1 (0,3 %) |
|
|
pT1b |
16 (4,2 %) |
|
|
Распространенность |
pT1c |
173 (45,1 %) |
|
опухолевого процесса/ |
pT2 |
192 (50,1 %) |
|
Tumor extension |
pT3 |
1 (0,3 %) |
|
pN0 |
290 (75,7 %) |
|
|
pN1 |
93 (24,3 %) |
|
|
Инвазивная протоковая карцинома/Invasive ductal carcinoma |
301 (78,6 %) |
|
|
Гистологический тип/ |
Инвазивная дольковая карцинома/Invasive lobular carcinoma |
33 (8,6 %) |
|
Histological type |
Инвазивная дольково-протоковая карцинома/ Invasive ductal lobular carcinoma |
5 (1,3 %) |
|
Другие формы/Other forms |
44 (11,5 %) |
|
|
G1 |
40 (10,4 %) |
|
|
Степень дифференцировки/ |
G2 |
220 (57,4 %) |
|
Grade of differentiation |
G3 |
28 (7,3 %) |
|
Gx |
95 (24,9 %) |
|
|
Люминальный А (Ki67<20 %)/Luminal A (Ki67<20 %) |
146 (38,1 %) |
|
|
ИГХ-подтипопухоли/ |
Люминальный В/Luminal B |
115 (30,0 %) |
|
IHC-subtypetumor |
Люминальный В Her2/neu (+)/Luminal B Her2/neu (+) |
29 (7,6 %) |
|
Трижды негативный/Triple-negative cancer |
93 (24,3 %) |
|
|
Неоадъювантная терапия/ |
Гормонотерапия/Hormone therapy |
61 (15,9 %) |
|
Neoadjuvant therapy |
Химиотерапия/Chemotherapy |
116 (30,3 %) |
|
Адъювантная терапия/ |
Гормонотерапия/Hormone therapy |
253 (66,0 %) |
|
Adjuvant therapy |
Химиотерапия/Chemotherapy |
156 (40,2 %) |
Примечание: ИГХ – иммуногистохимическое исследование.
Note: IHC – immunohistochemical examination.
Результаты
В течение периода наблюдения локорегио-нарные рецидивы были зарегистрированы у 20 больных, что составило 5,2 % от всего числа пациенток, участвующих в исследовании. Таким образом, 10-летняя безрецидивная выживаемость составила 94,8 %. Далее проводилось изучение сопряженности отдаленных результатов лечения с клинико-морфологическими параметрами РМЖ. Оценивались следующие критерии: размер опухоли, вовлеченность регионарных лимфоузлов, молекулярный подтип опухоли, гистологический тип, степень злокачественности, наличие лимфоваскулярной инвазии, опухолевых эмболов и лимфоидной инфильтрации (табл. 2).
Показатели 10-летней безрецидивной выживаемости значимо отличались в зависимости от размера и молекулярного подтипа опухоли (χ2=12,66, p=0,01; и χ2=8,81, p=0,03 соответственно) (рис. 1, 2). Основная масса рецидивов зарегистрирована в первые 5 лет наблюдения, что составило 75 %. В зоне проведения ИОЛТ рецидивы возникли у 12 (60 %) пациенток. Кроме того, рецидивные опухоли вне зоны ИОЛТ были диагностированы у 5 (25 %) больных в ткани молочной железы и у 3 (15 %) пациенток в аксиллярной зоне. Следует отметить, что 7 (35 %) рецидивов развились при I стадии и локализовались в зоне проведения ИОЛТ. Наиболее часто рецидивы регистрировались при первичный опухоли стадии Т2–3 (13/65 %) (p=0,01), что свидетельствует об увеличении вероятности возникновения рецидива при выполнении ОСО с ИОЛТ у пациенток с большой распространенностью опухолевого процесса.
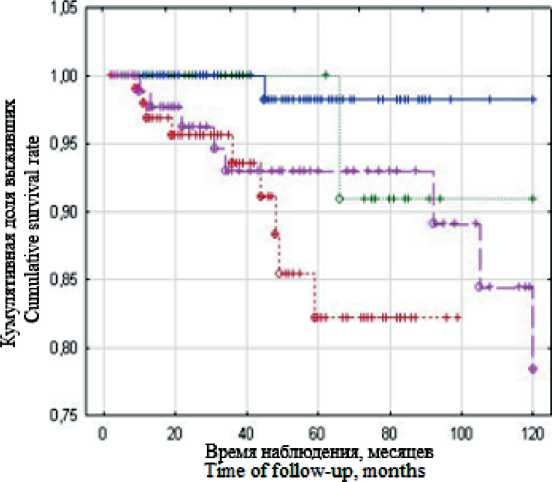
При анализе частоты возникновения рецидивов в зависимости от ИГХ подтипа опухоли было выявлено, что при люминальном подтипе А за 10летний период наблюдения зарегистрирован 1 (5 %) рецидив, при люминальном В – 9 (45 %), при люминальном В с гиперэкспрессией белка Her2Neu – 1 (5 %), при ТНР – 9 (45 %) (χ2=8,81, p=0,03). Таким образом, показано, что принадлежность к люминальному В Her2(+) или трижды негативному подтипу РМЖ увеличивает вероятность реализации рецидива после ОСО в комбинации с ИОЛТ.
Таблица 2/table 2
Показатели 10-летней безрецидивной выживаемости больных РМЖ, которым было проведено органосохраняющее лечение с использованием ИОЛТ во взаимосвязи с клиникоморфологическими характеристиками the 10-year recurrence-free survival rates in breast cancer patients who underwent organ-preserving treatment with ioRt in relation to clinical and morphological characteristics
|
Фактор/Factor |
Общее количество пациентов/количество прогрессирований/ Total number of patients/number of progressions |
10-летняя безрецидивная выживаемость/ 10-year recurrence-free survival rate |
||
|
Кумулятивная доля выживших/ Cumulative survival rate |
Gehan’s-Wilcoxon Test/χ2; p |
|||
|
pТ1a |
1/1 |
0 % |
||
|
Размер опухоли (T)/ Tumor size (T) |
pT1b |
16/2 |
87,5 % |
χ2=12,66 p=0,01 |
|
pT1c |
173/4 |
91,4 % |
||
|
pT2 |
192/12 |
75,4 % |
||
|
pT3 |
1/1 |
0 % |
||
|
Лимфатические узлы (N)/ |
pN0 |
290/15 |
74,5 % |
χ2=3,71 |
|
Lymph nodes (N) |
pN1 |
93/4 |
92 % |
p=0,25 |
|
Гистологический тип/ Histological type |
ИПР, ИДР, ИДПР/ IDC, ILC, ILDC |
339/7 |
85,1 % |
p=0,69 |
|
Другие/Others |
44/13 |
91,1 % |
||
|
G1 |
40/0 |
100 % |
||
|
Степень дифференцировки/ |
G2 |
220/13 |
81 % |
χ2=3,78 |
|
Grade of differentiation |
G3 |
28/2 |
91,5 % |
p=0,24 |
|
Gx |
95/4 |
69,6 % |
||
|
Мультицентричность/ |
Нет/No |
343/15 |
89,4 % |
p=0,12 |
|
Multicentricity |
Да/Yes |
40/4 |
45,2 % |
|
|
Мультифокальность/ |
Нет/No |
365/18 |
86 % |
p=0,32 |
|
Multifocality |
Да/Yes |
18/1 |
93 % |
|
|
Лимфоваскулярная инвазия/ |
Нет/No |
382/19 |
86,1 % |
p=0,74 |
|
Lymphovascular invasion |
Да/Yes |
1/0 |
100 % |
|
|
Опухолевые эмболы/ |
Нет/No |
377/18 |
86,3 % |
p=0,41 |
|
Tumor emboli |
Да/Yes |
6/1 |
80 % |
|
|
Лимфоидная инфильтрация/ |
Нет/No |
357/17 |
85,7 % |
p=0,54 |
|
Lymphoid infiltration |
Да/Yes |
364/2 |
88 % |
|
|
Люминальный А/ |
146/1 |
98 % |
||
|
Luminal A |
||||
|
ИГХ-подтип опухоли/ IHC-subtype tumor |
Люминальный В (HER-2(-))/ Luminal B (HER-2(-)) |
115/9 |
81,9 % |
χ2=8,81 |
|
Люминальный В |
p=0,03 |
|||
|
(HER-2+))/ Luminal B (HER-2(+)) |
29/1 |
91,3 % |
||
|
Трижды негативный/ Triple-negative cancer |
93/9 |
75,8 % |
||
Примечание: ИПР – инвазивная протоковая карцинома; ИДР – инвазивная дольковая карцинома; ИДПР – инвазивная дольково-протоковая карцинома.
Note: IDC – invasive ductal carcinoma; ILC – invasive lobular carcinoma; ILDC – invasive ductal lobular carcinoma.
Обсуждение
Полученные результаты органосохраняющего лечения РМЖ с использованием ИОЛТ свидетельствуют о заметной разнице в показателях безрецидивной выживаемости в зависимости от размера первичной опухоли и молекулярного подтипа. Показано, что 7 из 20 диагностированных локорегионарных рецидивов возникли при РМЖ I стадии. Частота рецидивов при опухолях, соот- ветствующих T2 (n=12) и Т3 (n=1), согласуется с данными других исследований. В частности, по данным M. Leonardi et al. [21], одним из благоприятных факторов прогноза при ускоренном частичном облучении молочной железы является размер опухоли <2,0 см.
У больных с тройным негативным РМЖ кумулятивная безрецидивная выживаемость составила 75,8 %, что, несомненно, свидетельствует о не-
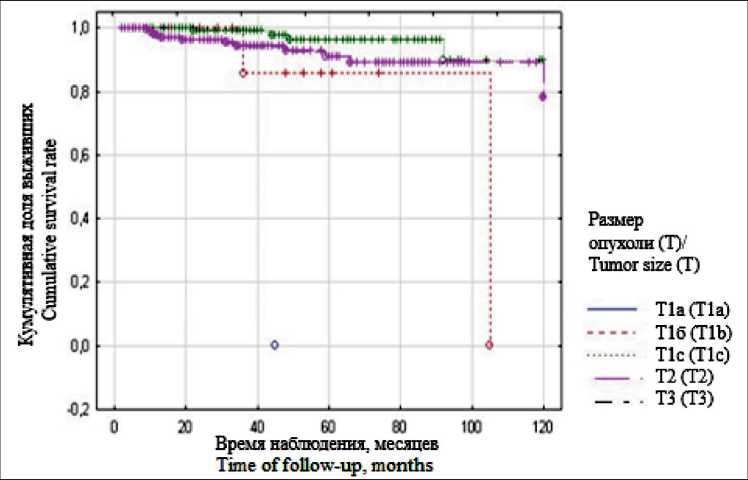
Рис. 1. Показатели 10-летней безрецидивной выживаемости в зависимости от размера опухоли Fig. 1. 10-year recurrence-free survival rates according to tumor size
Молекулярный подтип
РМЖ Molecular subtype of breast cancer
Люминальный A
Luminal A
Люминальный В (HER-2(-))
Luminal В (HER-2Q) ........Люминальный В (HER-2+)
l umin al В (HER-2(+)) ' Триады негативный рак Triple-negative cancer
Рис. 2. Показатели 10-летней безрецидивной выживаемости в зависимости от молекулярного подтипа опухоли
Fig. 2. 10-year recurrence-free survival rates according to tumor molecular subtype
благоприятном прогнозе при данным гистологическом варианте опухоли по сравнению с другими подтипами. Это связано с тем, что высокая пролиферативная активность и отсутствие рецепторов в ТНР обусловливают резистентность к парциальному облучению и рассматриваются в качестве противопоказания к данному методу лечения [22, 23]. Напротив, кумулятивная доля больных без рецидива с люминальным А подтипом РМЖ составила 98 %, что соответствует результатам крупных рандомизированных исследований [11, 15].
Одним из основных преимуществ нашей работы является то, что она содержит данные о более долгосрочном наблюдении среди исследований, оценивающих эффективность комбинированных методов лечения РМЖ с использованием ИОЛТ. Безусловно, проведенный анализ содержит ряд нерешенных вопросов и ограничений. Одним из
Список литературы Предикторы эффективности интраоперационной лучевой терапии в органосохраняющем лечении раннего рака молочной железы
- Ferlay J., Colombet M., Soerjomataram I., Parkin D.M., Pineros M., Znaor A., Bray F. Cancer statistics for the year 2020: An overview. Int J Cancer. 2021. https://doi.org/10.1002/ijc.33588.
- Kaprin A.D., Starinskii V.V., Shakhzadova A.O. Sostoyanie onkologicheskoi pomoshchi naseleniyu Rossii v 2020 godu. M., 2021. 239 s.
- Clarke M., Collins R., Darby S., Davies C., Elphinstone P., Evans V., Godwin J., Gray R., Hicks C., James S., MacKinnon E., McGale P., McHugh T., Peto R., Taylor C., Wang Y.; Early Breast Cancer Trialists' Collaborative Group (EBCTCG). Effects of radiotherapy and of differences in the extent of surgery for early breast cancer on local recurrence and 15-year survival: an overview of the randomised trials. Lancet. 2005; 366(9503): 2087-106. https://doi.org/10.1016/S0140-6736(05)67887-7.
- Early Breast Cancer Trialists' Collaborative Group (EBCTCG); Darby S., McGale P., Correa C., Taylor C., Arriagada R., Clarke M., Cutter D., Davies C., Ewertz M., Godwin J., Gray R., Pierce L., Whelan T., Wang Y., Peto R. Effect of radiotherapy after breast-conserving surgery on 10-year recurrence and 15-year breast cancer death: meta-analysis of individual patient data for 10,801 women in 17 randomised trials. Lancet. 2011; 378(9804): 1707-16. https://doi.org/10.1016/S0140-6736(11)61629-2.
- de Boniface J., Szulkin R., Johansson A.L.V. Survival After Breast Conservation vs Mastectomy Adjusted for Comorbidity and Socioeconomic Status: A Swedish National 6-Year Follow-up of 48 986 Women. JAMA Surg. 2021; 156(7): 628-37. https://doi.org/10.1001/jamasurg.2021.1438.
- Siegel R.L., Miller K.D., Jemal A. Cancer statistics, 2020. CA Cancer J Clin. 2020; 70(1): 7-30. https://doi.org/10.3322/caac.21590.
- Faverly D.R., Hendriks J.H., Holland R. Breast carcinomas of limited extent: frequency, radiologic-pathologic characteristics, and surgical margin requirements. Cancer. 2001; 91(4): 647-59. https://doi.org/10.1002/1097-0142(20010215)91:4<647::aid-cncr1053-3.0.co;2-z.
- Formenti S.C., Arslan A.A., Pike M.C. Re: Long-term outcomes of invasive ipsilateral breast tumor recurrences after lumpectomy in NSABP B-17 and B-24 randomized clinical trials for DCIS. J Natl Cancer Inst. 2011; 103(22): 1723. https://doi.org/10.1093/jnci/djr406.
- Bartelink H., Horiot J.C., Poortmans P.M., Struikmans H., Van den Bogaert W., FourquetA., Jager JJ., Hoogenraad W.J., Oei S.B., Warlam-Rodenhuis C.C., Pierart M., Collette L. Impact of a higher radiation dose on local control and survival in breast-conserving therapy of early breast cancer: 10-year results of the randomized boost versus no boost EORTC 22881-10882 trial. J Clin Oncol. 2007; 25(22): 3259-65. https://doi.org/10.1200/JCO.2007.11.4991.
- Holland R., Veling S.H., Mravunac M., Hendriks J.H. Histologic multifocality of Tis, T1-2 breast carcinomas. Implications for clinical trials of breast-conserving surgery. Cancer. 1985; 56(5): 979-90. https://doi.org/10.1002/1097-0142(19850901)56:5<979::aid-cncr2820560502-3.0.co;2-n.
- Vaidya J.S., Bulsara M., Saunders C., Flyger H., Tobias J.S., Corica T., Massarut S., Wenz F., Pigorsch S., Alvarado M., Douek M., Eiermann W., Brew-Graves C., Williams N., Potyka I., Roberts N., Bernstein M., Brown D., Sperk E., Laws S., Sutterlin M., Lundgren S., Holmes D., VinanteL., BozzaH, PazosM, LeBlanc-Onfroy M., Gruber G., Polkowski W., Dedes K.J., Niewald M., Blohmer J., McCready D., Hoefer R., Kelemen P., Petralia G., Falzon M., Baum M., Joseph D. Effect of Delayed Targeted Intraoperative Radiotherapy vs Whole-Breast Radiotherapy on Local Recurrence and Survival: Long-term Results From the TARGIT-A Randomized Clinical Trial in Early Breast Cancer. JAMA Oncol. 2020; 6(7). https://doi.org/10.1001/jamaoncol.2020.0249. Erratum in: JAMA Oncol. 2020; 6(7): 1123.
- Sedlmayer F., Reitsamer R., Wenz F., Sperk E., Fussl C., Kaiser J., Ziegler I., Zehentmayr F., Deutschmann H., Kopp P., Fastner G. Intraoperative radiotherapy (IORT) as boost in breast cancer. Radiat Oncol. 2017; 12(1): 23. https://doi.org/10.1186/s13014-016-0749-9.
- Pilar A., Gupta M., Ghosh Laskar S., Laskar S. Intraoperative radiotherapy: review of techniques and results. Ecancermedicalscience. 2017; 11: 750. https://doi.org/10.3332/ecancer.2017.750.
- Fisher B., Anderson S.J. Local therapy and survival in breast cancer. N Engl J Med. 2007; 357(10): 1051; author reply 1052. https://doi.org/10.1056/NEJMc076272.
- Orecchia R., Veronesi U., Maisonneuve P., Galimberti V.E., Laz-zari R., Veronesi P., Jereczek-Fossa B.A., Cattani F., Sangalli C., Luini A., Caldarella P., Venturino M., Sances D., Zurrida S., Viale G., Leonardi M.C., Intra M. Intraoperative irradiation for early breast cancer (ELIOT): longterm recurrence and survival outcomes from a single-centre, randomised, phase 3 equivalence trial. Lancet Oncol. 2021; 22(5): 597-608. https://doi.org/10.1016/S1470-2045(21)00080-2.
- Vaidya J.S., Bulsara M., Baum M., Alvarado M., Bernstein M., Massarut S., Saunders C., Sperk E., Wenz F., Tobias J.S.; TARGIT-A investigators. Intraoperative radiotherapy for breast cancer: powerful evidence to change practice. Nat Rev Clin Oncol. 2021; 18(3): 187-8. https://doi.org/10.1038/s41571-021-00471-7.
- Sasieni P.D., Sawyer E.J. Intraoperative radiotherapy for early breast cancer - insufficient evidence to change practice. Nat Rev Clin Oncol. 2020; 17(12): 723-4. https://doi.org/10.1038/s41571-020-00444-2.
- Sasieni P.D., Sawyer E.J. Reply to ‘Intraoperative radiotherapy for breast cancer: powerful evidence to change practice'. Nat Rev Clin Oncol. 2021; 18(3): 188-9. https://doi.org/10.1038/s41571-021-00472-6.
- Piroth M.D., Strnad V., Krug D., Fastner G., Baumann R., Combs S.E., Duma M.N., Dunst J., Feyer P., Fietkau R., Haase W., Harms W., Hehr T., Sedlmayer F., Souchon R., Budach W. Long-Term Results of the TARGIT-A Trial: More Questions than Answers. Breast Care (Basel). 2022; 17(1): 81-4. https://doi.org/10.1159/000515386.
- Fastner G., Reitsamer R., Gaisberger C., Hitzl W., Urbanski B., Murawa D., Matuschek C., Budach W., Ciabattoni A., Reiland J., Molnar M., Vidali C., Schumacher C., Sedlmayer F., On Behalf Of The Hiob Trialist Group. Hypofractionated Whole Breast Irradiation and Boost-IOERT in Early Stage Breast Cancer (HIOB): First Clinical Results of a Prospective Multicenter Trial (NCT01343459). Cancers (Basel). 2022; 14(6): 1396. https://doi.org/10.3390/cancers14061396.
- Leonardi M.C., Maisonneuve P., Mastropasqua M.G., Morra A., Lazzari R., Dell'Acqua V., Ferrari A., Rotmensz N., Sangalli C., Luini A., Veronesi U., Orecchia R. Accelerated partial breast irradiation with intraoperative electrons: using GEC-ESTRO recommendations as guidance for patient selection. Radiother Oncol. 2013; 106(1): 21-7. https://doi.org/10.1016/j.radonc.2012.10.018.
- Garrido-Castro A.C., Lin N.U., Polyak K. Insights into Molecular Classifications of Triple-Negative Breast Cancer: Improving Patient Selection for Treatment. Cancer Discov. 2019; 9(2): 176-98. https://doi.org/10.1158/2159-8290.CD-18-1177.
- Kulcenty K., Piotrowski I., Wroblewska J.P., Wasiewicz J., Suchorska A.W.M. The Composition of Surgical Wound Fluids from Breast Cancer Patients is Affected by Intraoperative Radiotherapy Treatment and Depends on the Molecular Subtype of Breast Cancer. Cancers (Basel). 2019; 12(1): 11. https://doi.org/10.3390/cancers12010011.


