Предоперационная лучевая и лекарственная терапия местнораспространённого и прогностически неблагоприятного рака прямой кишки
Автор: Бердов Б.А., Ерыгин Д.В., Березовская Т.П., Титова Л.Н., Карпов А.А.
Рубрика: Научные статьи
Статья в выпуске: 1 т.26, 2017 года.
Бесплатный доступ
Целью работы было изучение непосредственных и отдалённых результатов комбинированного лечения больных местнораспространённым раком прямой кишки. Клинический материал представлен 73 пациентами раком прямой кишки с клинической стадией cT3-4, cN0-2, cM0-1. Всем больным в предоперационном периоде проводили конвенциональную лучевую терапию (СОД 50 Гр), методикой классического фракционирования дозы на фоне химиотерапии оксалиплатин+капецитабин (CaрOх). Токсические проявления в ходе химиолучевой терапии развились у 28 больных (38,3%). Осложнения 3 степени развились у 4 больных (5,4%). Хирургическое лечение в объёме тотальной мезоректумэктомии выполнено у 70 больных (95,9%). Оперативное лечение выполнялось лапароскопическим 44 (62,9%) или открытым 26 (37,1%) доступом, различия статистически значимые (OR 2,865 [95% CI: 1,442-5,686], p=0,0039). Частота сфинктеросохраняющих операций составила 67,1% (47 больных). Послеоперационные осложнения развились у 16 пациентов (22,9%). Радикальное удаление опухоли в объёме R0 резекции выполнено у 61 (87,1%) больных, R1 резекция - у 9 (12,9%) больных. Частота полных регрессий составила 13%. Общая 2-летняя выживаемость в группе составила 82,8±6,0%. Безрецидивная выживаемость у больных с ypSt 0 и ypSt I составила 100%, в то время как выживаемость больных с ypSt III составила 65,6±14,0%, различия достигли статистической значимости (c2 - 5,853; р=0,016). Безрецидивная выживаемость после R0 резекции достоверно выше, чем после R1 резекции (R0 резекция - 84,7±6,4%, R1 резекция - 50,0±25,0%, р=0,041). Предоперационная химиолучевая терапия в дозе 50 Гр в сочетании с оксалиплатином и капецитабином у больных с местнораспространённым раком прямой кишки демонстрирует приемлемый профиль токсичности и хорошую регрессию первичной опухоли. От слаженной работы мультидисциплинарной команды во многом зависит качество жизни и клинические результаты лечения больных.
Рак прямой кишки, лучевая терапия, химиотерапия, лучевые реакции, лечебный патоморфоз, хирургическое лечение, передняя резекция прямой кишки, брюшно-анальная резекция прямой кишки, брюшно-промежностная экстирпация прямой кишки, комбинированное лечение
Короткий адрес: https://sciup.org/170170285
IDR: 170170285 | DOI: 10.21870/0131-3878-2017-26-1-60-77
Текст научной статьи Предоперационная лучевая и лекарственная терапия местнораспространённого и прогностически неблагоприятного рака прямой кишки
Колоректальный рак за последние 10-20 лет неуклонно наращивает своё присутствие в структуре опухолевых заболеваний [1, 2] . Сегодня это одна из наиболее распространённых опухолей в мире, занимающая 3-е место в структуре смертности от злокачественных новообразований. В РФ рак ободочной кишки находится на 4-м месте, рак прямой кишки – на 5-м: 7,6% и 5,9% соответственно. «Классическими» стали данные о том, что на момент выявления опухолевого поражения толстой кишки у половины пациентов имеется метастатическое поражение печени, драматически ухудшающее прогноз заболевания [1] . Современное лечение колоректального рака базируется на двух важнейших составляющих – прогрессе хирургических технологий и внедрении новейших методик лучевой и лекарственной терапии [3, 4].
В настоящее время принято выделять в отдельные группы больных местнораспространённым раком прямой кишки и больных, течение заболевания у которых осложнилось целым рядом
Бердов Б.А. – зав. отд., д.м.н., проф.; Ерыгин Д.В.* – вед. научн. сотр., к.м.н .;. Березовская Т.П. – гл. научн. сотр., д.м.н., проф.; Титова Л.Н. – врач, к.м.н.; Карпов А.А. – научн. сотр. МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИРЦ» Минздрава России.
«прогностически неблагоприятных факторов», которые оказывают негативное влияние на заболевание и результаты лечения. К ним следует отнести опухоли, локализующиеся в нижнеампулярном отделе прямой кишки, лишённом жирового и фасциального футляра, с сосудистой и/или периневральной инвазией; множественным поражением регионарных лимфатических узлов; выраженной (T3c,d-T4) инвазией опухоли в окружающие ткани и предполагаемый положительный латеральный край резекции (по данным магнитно-резонансной томографии) [5, 6] .
При лечении больных раком прямой кишки вопросы целесообразности соблюдения принципа комбинированного лечения ушли из области дискуссии и переместились в плоскость практического применения. Выбор оптимального метода лечения и вероятностный прогноз прямо зависят от точности и полноты диагностической информации об опухоли, полученной на этапе дооперационного обследования [4, 7]. Использование мультидисциплинарной команды, со стоящей из онкохирурга, радиолога, лучевого терапевта, патоморфолога и химиотерапевта, в лечении больных раком прямой кишки может свести к минимуму частоту ошибочных решений в процессе выбора лечения больного [8-11].
В связи с этим среди приоритетных направлений улучшения результатов лечения больных раком прямой кишки является разработка и совершенствование различных вариантов комбинированного и комплексного лечения. Задача его – максимально возможное снижение риска развития локального рецидива и отдалённого метастазирования при минимальной острой и отсроченной токсичности. Одним из путей решения этой проблемы является разработка и клиническая апробация новых, более эффективных методик лучевой терапии в сочетании с лекарственной модификацией ответа опухоли на лучевое воздействие [3 -5, 12] .
Наибольшее количество вопросов, находящихся в настоящее время в состоянии дискуссии, касается местнораспространённого и «прогностически неблагоприятного» вариантов течения заболевания. До конца не установлено, насколько в целом целесообразна периоперационная терапия, какие схемы являются оптимальными, когда нужно начинать и заканчивать лечение, как меняется биология опухоли на фоне лекарственного лечения, как оно влияет на течение послеоперационного периода, а также на отдалённые результаты. Поиску ответов на вышеназванные вопросы и посвящена эта работа.
Материалы и методы
В первую фазу лечебного протокола в период с июня 2013 г. по июль 2016 г. было включено 73 больных раком прямой кишки с клинической стадией сT3-4 сN0-2, сM0-1. Всем больным наряду с общеклиническими, эндоскопическими и лучевыми методами диагностики (спиральная компьютерная томография грудной и брюшной полости) для определения распространённости опухолевого процесса в малом тазу выполнялась магнитно-резонансная томография (МРТ) малого таза.
Критерии включения:
-
• морфологически подтверждённая аденокарцинома прямой кишки;
-
• локализация опухоли в нижнеампулярном отделе прямой кишки (cT3-4, сN0-1);
-
• локализация опухоли в среднеампулярном отделе прямой кишки с положительной циркулярной границей резекции по данным МРТ (cT3c,d-T4, сN0-2);
-
• признаки сосудистой и/или периневральной инвазии опухоли по данным МРТ;
-
• с множественным поражением тазовых лимфатических узлов.
Критерии невключения:
-
• первично-множественные синхронные опухоли других локализаций, кроме рака кожи;
-
• метастатическое поражение головного мозга;
-
• тяжёлые интеркуррентные заболевания в стадии декомпенсации.
Клиническая характеристика больных, включённых в исследование, представлена в табл. 1.
Таблица 1
Клиническая характеристика больных
|
Характеристика |
ХЛТ-CapOx n=73 (%) |
|
Медиана возраста (года), (диапазон) |
60 (42-79) |
|
Пол,n (%) |
|
|
Мужской |
34 (46,6) |
|
Женский |
39 (53,4) |
|
Локализация опухоли, n (%) |
|
|
Нижнеампулярный, 0-5 см |
42 (57,5) |
|
Среднеампулярный, 5,1-10 см |
29 (39,7) |
|
Верхнеампулярный, 10,1-15 см |
2 (2,8) |
|
Расстояние от анального края, медиана (интервал), см |
5,0 (0-12) |
|
Протяжённость опухоли, медиана (интервал), см |
5,0 (2-14) |
|
Морфологический тип, n(%) |
|
|
Аденокарцинома |
65 (89,0) |
|
Муцинозная аденокарцинома |
8 (11,0) |
|
Степень дифференцировки, n (%) |
|
|
G1 |
26 (35,6) |
|
G2 |
43 (58,9) |
|
G3 |
4 (5,5) |
|
Клиническая стадия заболевания (TNM) |
|
|
cT3 |
49 (67,1) |
|
cT4 |
24 (32,9) |
|
cN0 |
10 (13,7) |
|
cN1 |
44 (60,3) |
|
cN2 |
19 (26,0) |
|
cM0 |
60 (82,2) |
|
cM1 |
13 (17,8) |
Примечание: ХЛТ – химиолучевая терапия.
Пациенты, включённые в исследование, чаще всего – женщины (53,4%), с преимущественной локализацией опухоли в нижнеампулярном отделе – 42 больных (57,5%). У 63 (86,3%) больных имелись МРТ-признаки поражения регионарных лимфатических узлов.
На первом этапе лечения всем больным проводили конвенциональную лучевую терапию на область малого таза. Топометрическая подготовка осуществлялась с помощью компьютерной томографии с использованием симулятора фирмы «Philips». При этом ампула прямой кишки обязательно контрастировалась бариевой взвесью. Далее «срез» тела на уровне центра пересечения полей при помощи дигитайзера переносили на дисплей компьютерной планирующей системы «Theraplan». Расчёт производили в точке дозирования ICRU пересечения центральных лучей. Применяли четырёхпольную методику облучения.
Поля облучения
Вентро-дорзальные поля. Каудальная граница поля при опухолях, локализующихся в нижней трети прямой кишки (0-5 см от анального края), анальный канал и перианальная область включались в объём лучевого воздействия. При локализации опухоли в средней трети прямой кишки (6-10 см от анального края) анальный канал и перианальную область включали в зону облучения только в тех случаях, когда расстояние между нижним полюсом опухоли и анальным каналом было < 5 см. Краниальная граница поля проходила на уровне L5/S1, а латеральная – на 1 см кнаружи от внутреннего края тазового кольца.
Латеральные поля. Границы дорзального поля включали задний край крестцовой кости. При планировании вентрального поля было важно, чтобы его граница проходила на 2 см кнаружи от переднего края опухоли. Для включения в зону облучения зон регионарного метастазирования краниальная граница проходила на 2,5 см вентральнее от промонториума, каудально – на дорзальной границе нижнего края симфиза. Использовалось оборудование с низкой энергией пучка (< 8 МеV), и вентральное расположение опухоли требовало соответствующей регулировки границ вентрального поля.
Таким образом, в зону 95%-ной изодозы включали первичную опухоль и основные лимфатические коллекторы: лимфатические узлы параректальной клетчатки, пресакральные, лимфоузлы вдоль дистальной части общей подвздошной артерии и вдоль внутренней подвздошной артерии и лимфоузлы в средней части обтураторной ямки.
Лучевая терапия проводилась методикой классического фракционирования дозы в РОД 2 Гр ежедневно, пять дней в неделю, до СОД 50 Гр.
Предоперационная лучевая терапия проводилась на фоне химиотерапии в режиме CapOx: оксалиплатин 50 мг/м2 внутривенно в 1 8 22 29 дни и капецитабин в дозе 825 мг/м2 2 раза в д
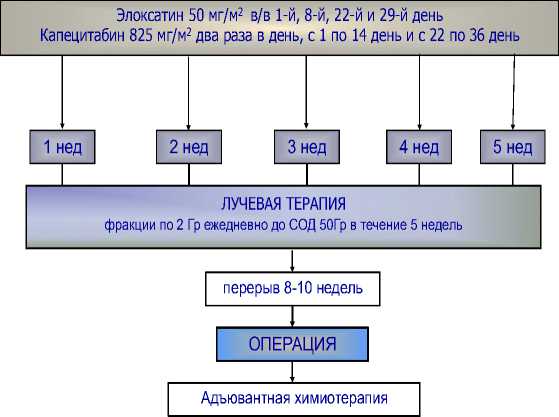
Рис. 1. Схема лечения больных раком прямой кишки.
По окончании курса неоадъювантного лечения следовал перерыв длительностью 8 недель. Оценка ответа опухоли прямой кишки на химиолучевую терапию проводили на основании данных МРТ органов малого таза в соответствии с критериями TRG [11] . Хирургическое лечение выполняли в объёме тотальной мезоректумэктомии (ТМЭ). Адъювантную химиотерапию назначали у больных с III стадией заболевания по схеме XELOX или капецитабин.
Запланированный объём химиолучевого лечения был реализован у 67 пациентов (91,8%), у 6 больных (8,2%) в связи с развитием токсических реакций мы были вынуждены прервать введение оксалиплатина. Токсические реакции оценивали по критериям CTCAE v.4. Токсические проявления в ходе химиолучевой терапии развились у 28 больных (38,3%). В целом общее количество токсических реакции составило 38 (50,5%). Среди местных реакций наиболее частым проявлением был лучевой ректит, который развился у 11 пациентов (15%). Гематологические реакции отмечены у 14 больных, что составило 19,1%. Структура токсических реакций представлена в табл. 2.
Таблица 2 Токсические реакции
|
Тип реакции |
ХЛТ-CapOx, n=73 (%) |
||
|
1 ст. |
2 ст. |
3 ст. |
|
|
Тромбоцитопения |
3 (4,1) |
- |
3 (4,1) |
|
Анемия |
2 (2,7) |
1 (1,3) |
- |
|
Лейкопения |
1 (1,3) |
1 (1,3) |
- |
|
Нейтропения |
1 (1,3) |
2 (2,7) |
- |
|
Слабость |
- |
3 (4,1) |
- |
|
Тошнота/рвота |
2 (2,7) |
1 (1,3) |
- |
|
Дизурия |
- |
1 (1,3) |
- |
|
Ректит |
2 (2,7) |
9 (12,3) |
- |
|
Лучевой эпидермит |
- |
1 (1,3) |
|
|
Диарея |
1 (2,7) |
1 (1,3) |
1 (1,3) |
|
Ишемия миокарда |
- |
1 (1,3) |
- |
|
ВСЕГО |
12 (16,4) |
21 (28,7) |
4 (5,4) |
|
37 (50,5) |
|||
|
Количество больных с лучевыми реакциями |
28 (38,3) |
||
Из таблицы видно, что токсические реакции в основном были представлены 1 и 2 степенью тяжести. Токсические проявления 3 ст. в нашем исследовании развились у 4-х больных (5,4%). Ни в одном случае они не стали причиной перерыва в курсе лучевой терапии.
Оценка ответа первичной опухоли после неоадъювантного лечения проводилась через 8 недель с помощью клинических и радиологических методов обследования (МРТ малого таза). В результате контрольного обследования нами установлено, что у 46,4% больных отмечено полное или почти полное замещение опухоли фиброзом (рис. 2, 3). Прогрессирования заболевания выявлено не было (табл. 3).
Таблица 3
Степень регрессии опухоли
|
mrTRG |
Число больных n=69 |
Проценты |
|
mrTRG 1 |
10 |
14,6 |
|
mrTRG 2 |
22 |
31,8 |
|
mrTRG 3 |
33 |
47,8 |
|
mrTRG 4 |
4 |
5,8 |
Примечание: у 4-х больных МРТ не выполнялась.
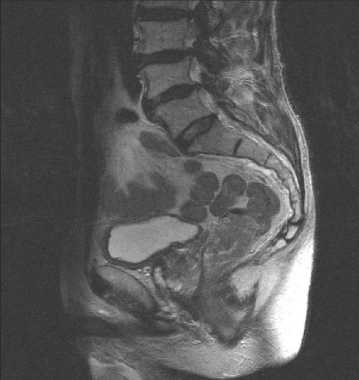
Рис. 2. МРТ малого таза до лечения.
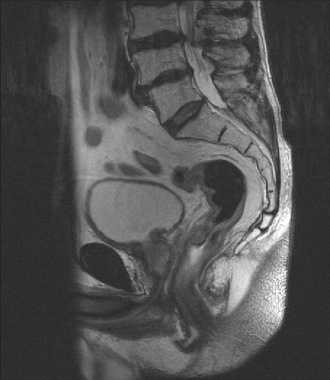
Рис. 3. МРТ малого таза после ХЛТ. Отмечается выраженная регрессия внутрипросветного компонента опухоли, участки экстрамуральной инвазии замещены фиброзом. МР-картина соответствует частичной регрессии опухоли (TRG 1-2).
В результате проведённого неоадъювантного лечения у 2-х больных с локализацией опухоли в нижнеампулярном отделе выявлена клинически полная регрессия опухоли. С учётом выявленной полной регрессии опухоли больные находились под динамическим наблюдением. Сроки наблюдения составили 10 и 11 месяцев. Признаков возврата заболевания не выявлено.
На развитие полной регрессии опухоли оказывает влияние ряд факторов: доза лучевой терапии, химиотерапевтические препараты, интервал «лучевая терапия-операция». На сегодняшний день в результате проведённых крупных рандомизированных исследований определён оптимальный интервал между химиолучевой терапией и операцией. Так, в Лионском исследовании R-90-01 и по данным Национальной базы данных США (NCDB) было показано, что при выполнении операции в сроки до 60 дней после окончания лучевой терапии частота R1 резекций составила 6,7%, а при увеличении интервала она снизилась до 4,8% (p=0,009). Частота сфинктеросохраняющих операций также была достоверно выше при выполнении операции в более поздние сроки – 68,9% против 64,9% (p=0,007). В то же время исследователи в своей работе указывают на вероятность возрастания рисков прогрессирования заболевания при увеличении интервала между лучевой терапией и операцией более чем на 75 дней [13, 14]. В нашем исследовании медиана интервала между ХЛТ и операцией составила 64,5 дня.
По окончании перерыва после неоадъювантной ХЛТ хирургическое лечение выполнено у 70 больных (95,9%). Как говорилось ранее, 2 больных не оперированы в связи с полной регрессией опухоли и 1 больная отказалась от продолжения лечения. Оперативное лечение выполнялось в объёме тотальной мезоректумэктомии, с высоким лигированием нижних брыжеечных сосудов, лапароскопическим 44 (62,9%) или открытым 26 (37,1%) доступом (OR 2,865 [95% CI: 1,442-5,686], p=0,0039). Частота сфинктеросохраняющих операций составила 67,1% (47 больных). Типы оперативных вмешательств в зависимости от доступа представлены в табл. 4.
Структура оперативных вмешательств
Таблица 4
|
Виды операций |
Доступ |
р |
|
|
лапароскопический n=44 (%) |
открытый n=26 (%) |
||
|
БПЭ прямой кишки |
9 (20,5) |
14 (53,8) |
0,007 |
|
БАР прямой кишки |
6 (13,6) |
1 (3,8) |
н.р. |
|
Передняя резекция |
29 (65,9) |
11 (42,3) |
0,046 |
|
Сфинктеросохраняющие операции |
35 (79,5) |
12 (46,1) |
0,0047 |
Примечание: БПЭ – брюшно-промежностная экстирпация; БАР – брюшно-анальная резекция; н.р. – нет различий.
В нашем исследовании частота выполнения сфинктеросохраняющих операций лапароскопическим доступом была статистически значимо больше чем при открытом доступе, 35 (79,5%) против 12 (46,1%) соответственно (OR 4,537 [95% CI: 1,566-13,145], p=0,0047). В случаях вовлечения мезоректальной фасции в опухолевый процесс выполнялось экстрафасциаль-ное выделение прямой кишки. При формировании колоректального анастомоза использовался торцевой или боко-концевой анастомоз.
Лапароскопические операции выполняли из 5 или 6 портов, принципиальных различий в объёме операции между лапароскопическими и открытыми операциями не было. Из особенностей выполнения лапароскопических операций у больных после пролонгированного курса хи-миолучевой терапии следует отметить повышенный отёк тканей в малом тазу из-за сопутствующего перифокального воспаления. Данное обстоятельство затрудняло визуализацию при работе в малом тазу вследствие развития так называемого эффекта вскипания тканей при работе высокоэнергетическими инструментами.
Радикальное удаление опухоли в объёме R0 резекции выполнено у 61 (87,1%) больных, R1 резекция – у 9 (12,9%) больных. В группе R1 резекций при морфологическом исследовании латеральный край резекции составлял ≤ 1 мм.
Изменение стандартного объёма оперативных вмешательств потребовалось у 19 больных (27%). Комбинированные и симультанные операции выполнены у 14 (20%) и 5 (7,0%) больных соответственно. В структуре комбинированных операций в 4-х случаях выполнена резекция предстательной железы, по 3 случая – влагалище и матка, яичники – 2 случая, по одному – семенные пузырьки и мочевой пузырь. Структура симультанных операций: атипичная резекция печени – 3 случая, паховые лимфоузлы – 1 пациент, в одном случае выполнена симультанная лапароскопическая передняя резекция с торакоскопической резекцией лёгкого.
Анализ особенностей течения послеоперационного периода является важным фактором, который демонстрирует безопасность и совместимость применяемой методики неоадъювантного лечения с оперативными вмешательствами. Послеоперационные осложнения оценивали по классификации хирургических осложнений Clavien-Dindo. В группе оперированных больных у 16 пациентов (22,9%) развилось 18 осложнений. Распределение осложнений по степени тяжести представлено на рис. 4.
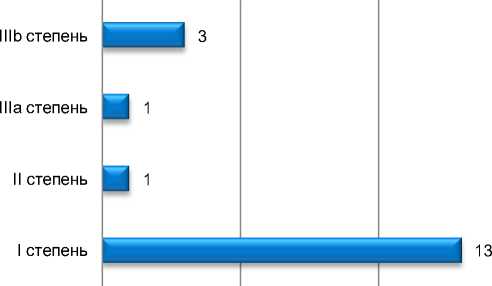
Рис. 4. Послеоперационные осложнения Clavien-Dindo.
Частота несостоятельности анастомоза у больных после сфинктеросохраняющих операций составила 14% (6 больных). В 4 случаях несостоятельность анастомоза развилась у больных после лапароскопических операций и в 2 случаях после открытых операций. Увеличение частоты несостоятельности анастомозов после лапароскопических операций мы связываем с этапом накопления опыта работы лапароскопическим доступом. Все хирургические вмешательства завершались формированием превентивной колостомы и дренированием малого таза через промежность. Лишь в одном случае потребовалось повторное оперативное вмешательство из-за неадекватного дренирования полости малого таза. В целом количество повторных операций составило 4% (3 больных). Летальных случаев в данной группе оперированных больных не было.
Средний послеоперационный койко-день в группе составил 12,8±5,6 дней (медиана 11,0, интервал 4-28 дней). Послеоперационный койко-день после лапароскопических операций составил 11,3±5,1 (медиана 10, интервал 4-28 дней), после открытых операций – 15,1±5,6 (медиана 13,5 интервал 8-27 дней), различия достигли статистической значимости (р=0,0065, критерий Манна-Уитни).
В ходе патоморфологического исследования удалённого препарата после проведённого неоадъювантного лечения определялась патологическая стадия заболевания (pT, pN), проводилась оценка латерального и дистального краев резекции, исследовалась степень выраженности лечебного патоморфоза в опухоли прямой кишки.
При исследовании глубины инвазии опухоли у 9 (13%) больных выявлена полная регрессия первичной опухоли. У 32 (45,7%) больных выявлено поражение регионарных лимфатических узлов и у 12 (17,1%) больных установлена IV стадия заболевания (табл. 5).
Таблица 5
Патологическая стадия
|
ypStage |
ХЛТ-CapOx, n=70 |
Проценты |
|
ypSt 0 |
9 |
13,0 |
|
ypSt I |
7 |
10,0 |
|
ypSt II |
20 |
28,5 |
|
ypSt III |
22 |
31,4 |
|
ypSt IV |
12 |
17,1 |
Существенная регрессия опухоли после неоадъювантного лечения у больных местнораспространённым раком прямой кишки привела к изменению стадии опухоли, значительно увеличилось число начальных форм ypT0-2 у 22 больных (31,4%). В таблице 6 представлены данные по динамике глубины инвазии опухоли и поражения лимфатических узлов до и после неоадъювантного лечения.
Таблица 6 Динамика глубины инвазии опухоли и поражения лимфатических узлов до и после неоадъювантного лечения
|
Факторы |
ХЛТ-CapOx, n (%) |
р |
|
|
до ХЛТ |
после ХЛТ |
||
|
T0 |
- |
9 (12,9) |
0,002 |
|
T1 |
- |
1 (1,4) |
н.р. |
|
T2 |
- |
12 (17,1) |
0,0001 |
|
T3 |
49 (67,1) |
41 (58,6) |
н.р. |
|
T4 |
24 (32,9) |
7 (10,0) |
0,0008 |
|
N0 |
10 (14,3) |
38 (54,3) |
0,0001 |
|
N1 |
41 (58,6) |
22 (31,4) |
0,001 |
|
N2 |
19 (27,1) |
10 (14,3) |
0,04 |
Примечание: н.р. – нет различий.
В результате проведённого предоперационного лечения отмечается статистически значимое уменьшение количества больных с глубокой инвазией опухоли в мезоректальную клетчатку и уменьшение числа больных с поражением регионарных лимфоузлов.
При исследовании дистального края резекции ни в одном случае после морфологического исследования не был получен позитивный дистальный край резекции, медиана расстояния дистального края резекции до опухоли составила 2,2 см (0,2-9 см).
Латеральный край резекции (pCRM) является важнейшим показателем качества выполненной операции и ведущим фактором, оказывающим прямое влияние на развитие рецидивов и метастазов у больных раком прямой кишки. В группе оперированных больных латеральный край исследован у 59 больных (84,2%).
Нами был проведён анализ влияния основных клинико-морфологических факторов (локализация, распространённость и размер опухоли, тип операции) на статус латерального края резекции.
Зависимость латерального края резекции от уровня опухолевой инвазии представлены в табл. 7. Как видно из представленных данных, при опухолевом процессе, ограниченном стенкой прямой кишки (рT0/Т1/Т2), в нашем исследовании ни у одного больного не было признаков вовлечения латерального края резекции, в то время как при инвазии в мезоректальную клетчатку и/или мезоректальную фасцию или серозную оболочку прямой кишки (рТ3-Т4) частота данного показателя резко возрастает до 22,5%, различия статистически значимые (OR 0,08502 [95% CI: 0,0046-1,545], p=0,0465). В то же время ни поражение лимфатических узлов, ни локализация опухоли не оказывали влияния на статус латерального края резекции.
При анализе влияния типа операции на латеральный край резекции мы отметили значительное увеличение позитивного латерального края резекции у больных после БПЭ прямой кишки по сравнению с органосохранными операциями, 5 (27,8%) против 4(10,8%) соответственно, однако данные различия не имели статистической значимости (р=0,087).
Таким образом, единственным фактором, оказывающим негативное влияние на позитивный латеральный край резекции в нашем исследовании, была глубина инвазии опухоли в стенку кишки (pT3/T4).
Таблица 7
Факторы, влияющие на позитивный латеральный край резекции
|
Факторы |
pCRM, n (%) |
р |
|
|
pCRM- |
pCRM+ |
||
|
pT pT0/T1/T2, n=19 (%) pT3/T4, n=40 |
19 (100) 31 (77,5) |
9 (2-2,5) |
0,0465 |
|
pN pN0, n=32 (%) pN1/2, n=27 (%) |
28 (87,5) 22 (81,5) |
4 (12,5) 5 (18,5) |
0,718 |
|
Локализация опухоли 0-5 см, n=31 (%) 5,1-10 см, n=26 (%) 10,1-15 см, n=2 (%) |
25 (80,6) 24 (92,3) 1 (50,0) |
6 (19,4) 2 (17,7) 1 (50,0) |
0,269 |
|
Тип операции БПЭ прямой кишки, n=18 (%) Сфинктеросохраняющие операции, n=41 (%) |
13 (72,2) 37 (89,2) |
5 (27,8) 4 (10,8) |
0,087 |
В ходе патоморфологического исследования оценивался лечебный патоморфоз в опухоли после проведённого предоперационного лечения. В своей работе мы пользовались классификацией патоморфоза, предложенной Г.А. Лавниковой. Данные по степени лечебного пато-морфоза представлены на рис. 5.
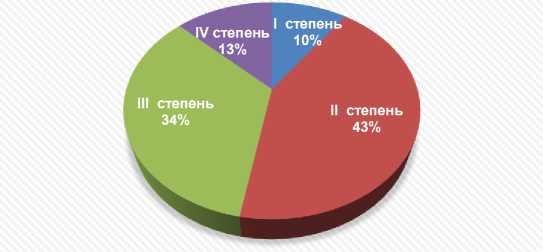
■ I степень ■ II степень ■ III степень ■ IV степень
Рис. 5. Патоморфоз опухоли по Г.А. Лавниковой.
В результате проведённого неоадъювантного лечения IV степень патоморфоза зафиксирована у 13% больных. Лечебный патоморфоз III и IV степени установлен у 47% больных.
Важнейшими показателями эффективности лечения является частота местных рецидивов и метастазов, а также выживаемость больных. Средний период наблюдения за больными составил 23,0±1,6 месяца. Из анализа исключены больные с IV стадией заболевания. За период наблюдения у 2 больных развились местные рецидивы, в сроки 7 и 32 месяца. Частота рецидивов составила 2,8%. Локализация рецидивов: в одном случае в ткани промежности и в другом случае в лимфоузлах у стенки таза. Отдалённые метастазы выявлены у 10 больных в сроки от 3-х до 25 месяцев. Таким образом, частота метастазирования составила 14,3%. Локализация метастазов: печень и лёгкие по 4 случая, у 2-х больных в отдалённых лимфоузлах.
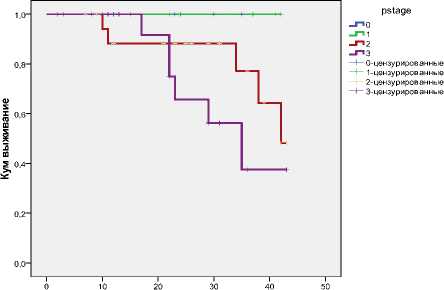
Общая 2-летняя выживаемость составила 82,8±6,0% (рис. 6). При сравнении безреци-дивной выживаемости в зависимости от стадии патологического процесса (рис. 7), нами получены следующие результаты: выживаемость больных с ypSt 0, ypSt I составила 100%, так как негативных проявлений заболевания у данной группы больных за период наблюдения не выявлено. Общая выживаемость больных с ypSt II составила 88,2±7,7%, тот же показатель для больных с ypSt III составил 65,6±14,0%, различия достигли статистической значимости (χ² – 5,853; р=0,016).
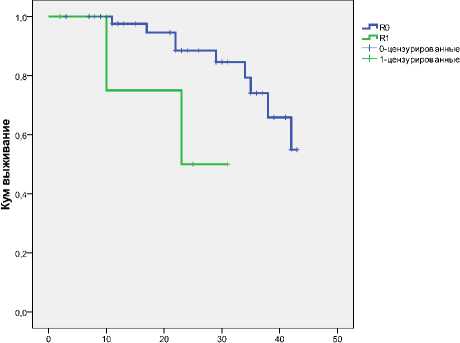
Мы провели оценку влияния на безрецидивную выживаемость больных в зависимости от статуса R резекции. Безрецидивная 2-летняя выживаемость после R0 резекции составила 84,7±6,4%, после R1 резекции – 50,0±25,0%, р=0,041 (рис. 8).
Таким образом, на безрецидивную выживаемость больных оказывает негативное влияние стадия заболевания и радикальность выполненной операции.
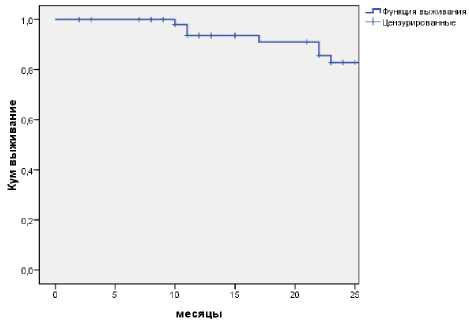
Рис. 6. Общая 2-летняя выживаемость.
месяцы
Рис. 7. Безрецидивная 2-летняя выживаемость в зависимости от стадии заболевания.
месяцы
Рис. 8. Безрецидивная выживаемость при R0 и R1 резекции.
Обсуждение
Предоперационная химиолучевая терапия на основе 5-фторурацила (5-ФУ) является стандартом лечения местнораспространённого рака прямой кишки, несмотря на демонстрацию схожих с послеоперационной химиолучевой терапией результатов выживаемости больных, но с более высокими показателями местного контроля заболевания и меньшей токсичностью [15, 16]. Использование пероральных пиримидинов является особенно привлекательной опцией для пациентов, позволяя избегать инфузионных осложнений. Капецитабин является наиболее изученным пероральным фторпиримидином, и в сочетании с оксалиплатином продемонстрировал одинаковую эффективность по сравнению со стандартным режимом химиотерапии FOLFOX у больных колоректальным раком [17]. Таким образом, сочетание обоих препаратов в сочетании с лучевой терапией может быть перспективным подходом в лечении больных раком прямой кишки.
В нашем исследовании использование пероральных фторпиримидинов в сочетании с оксалиплатином у больных раком прямой кишки довольно хорошо переносилось. Как и следовало ожидать, чаще всего регистрировалась гастроэнтерологическая и гематологическая токсичность, осложнения 3 степени развились у 5,4% больных. В полном объёме неоадъювантное лечение удалось реализовать у 67 больных, у 6 больных (8,2%) вследствие токсических реакций мы вынуждены были отменить инфузию оксалиплатина. Лучевой компонент был реализован у всех больных. Послеоперационной летальности в исследуемой группе не было. Частота послеоперационных осложнений составила 22,9% (16 больных). Данный показатель не отличается от литературных данных и собственных результатов. Частота повторных операций составила 4,3% (3 больных). Проведение химиолучевой терапии и активная хирургическая позиция в нашем исследовании позволили у 67,2% (47 больных) выполнить сфинктеросохраняющие операции.
Частота полных ответов в нашем исследовании составила 13% (9 больных). Как было указано ранее, понижение стадии после проведённого неоадъювантного лечения в целом составляет около 80% пациентов. Никаких различий по результатам рандомизированных исследований III фазы не наблюдалось по частоте полных регрессий при использовании оксалиплатина по сравнению со стандартной ХЛТ на основе фторпиримидинов (табл. 8).
Таблица 10
Обзор рандомизированных исследований по лечению рака прямой кишки с использованием оксалиплатина
|
Исследование |
Число больных |
Режим ХТ |
Токсичность 3-4 ст. |
ypCR |
||
|
% |
р |
% |
р |
|||
|
ACCORD 12, 2012 |
588 |
Cap 45 CapOx 50 |
11 25 |
<0,001 |
14 19 |
0,09 |
|
STAR 01, 2011 |
747 |
FU FU+OX |
8 24 |
<0,001 |
16 16 |
н.р. |
|
NSABP R-04, 2011 |
1608 |
FU+OX CAP+OX |
6 15 |
<0,05 |
19 21 |
н.р. |
|
CAO/ARO 04, 2015 |
1265 |
FU FU+OX |
21 23 |
н.р. |
13 18 |
0,033 |
Улучшение безрецидивной выживаемости было получено лишь в одном исследовании CAO/ARO 04 при использовании оксалиплатина как в неоадъювантном, так и в адъювантом режиме, безрецидивная выживаемость составила 75,9% против 71,2% (р=0,03) [4].
Следует отметить, что на сегодняшний день полная регрессия опухоли после неоадъювантного лечения является мощным прогностическим фактором, позитивно влияющим на без-рецидивную выживаемость больных. В нашем исследовании ни в одном случае не зафиксировано прогрессирования заболевания у больных с полной регрессией опухоли, это также подтверждается данными исследования NSABP R-03 и других исследований [16, 18, 19]. Все эти исследования указывают на улучшение результатов лечения с увеличением патологического ответа на предоперационную химиолучевую терапию [20]. С практической точки зрения необходим поиск новых схем предоперационной химиолучевой терапии, которые позволили бы увеличить количество полных регрессий опухоли.
Каковы перспективы дальнейшего развития неоадъювантной терапии при раке прямой кишки? Низкий уровень местных рецидивов после стандартной ТМЭ и отсутствие преимуществ в выживаемости при применении предоперационной химиолучевой терапии по сравнению с лучевой терапией требует тщательного отбора пациентов на неоадъювантную ХЛТ с наличием прогностически неблагоприятных факторов (положительная циркуляторная граница резекции, множественное поражение мезоректальных лимфатических узлов, низкая локализация опухоли по данным МРТ, которая могла бы улучшить результаты лечения у данной группы больных). Получение детальной информации по распространённости опухолевого процесса в малом тазу возможно только с помощью МРТ высокого разрешения. Все остальные пациенты без наличия прогностически неблагоприятных факторов могут получать лечение в объёме тотальной мезо-ректумэктомии в самостоятельном варианте или в сочетании с коротким курсом лучевой терапии или неоадъювантной химиотерапией. Этот подход требует дальнейшей проверки в открытых клинических исследованиях. Клинические исследования должны дать ответ на вопрос: какой курс лучевой терапии необходимо проводить: «короткий» курс или длительный курс, возможно с динамическим фракционированием, в сочетании с химиотерапией. Новые схемы хи-миолучевой терапии, в том числе с использованием таргетных препаратов, должны сравниваться со стандартной химиолучевой терапией на основе 5-фторурацила, как это было сделано с оксалиплатином. Наконец, роль системной неоадъювантной или адъювантной химиотерапии еще до конца недооценена, возможно, это путь к улучшению общей выживаемости больных.
Выводы
Предварительные результаты нашего исследования показывают эффективность данной схемы лечения по частоте рецидивов – 2,8% – и метастазов – 14,3%. Так же получены достаточно высокие показатели 2-летней выживаемости – 82,8±6,0%. Результаты проведённой работы свидетельствуют о необходимости увеличения частоты полных регрессий опухоли, так как данный фактор оказывает положительное влияние на выживаемость больных. Безрецидивная выживаемость у больных с ypSt 0 и ypSt I составила 100%, в то время как выживаемость больных с ypSt III составила 65,6±14,0%, различия достигли статистической значимости (χ² – 5,853; р=0,016). Это же относится к фактору R0 резекций, так как не радикально выполненная операция (R1 резекция) оказывает негативное влияние на выживаемость (R0 резекция 84,7±6,4%, R1 резекции 50,0±25,0%, р=0,041).
Оптимизация схемы лечения больных местнораспространённым и прогностически неблагоприятным раком прямой кишки должна решаться мультидисциплинарной командой. От слаженной работы всех её звеньев во многом зависит качество жизни и онкологические результаты лечения больных.
Список литературы Предоперационная лучевая и лекарственная терапия местнораспространённого и прогностически неблагоприятного рака прямой кишки
- Состояние онкологической помощи населению России в 2014 году/под ред. А.Д. Каприна, В.В. Старинского, Г.В. Петровой. М.: МНИОИ им. П.А. Герцена -филиал ФГБУ «НМИРЦ» Минздрава России, 2015. 236 с.
- Siegel R., Miller K., Jemal A. Cancer statistics, 2016//CA Cancer J. Clin. 2016. V. 66. P. 7-30.
- Ерыгин Д.В., Бердов Б.А. Неоадъювантная химиолучевая терапия прогностически неблагоприятного и местно-распространённого рака прямой кишки//Онкология. Журнал им. П.А. Герцена. 2013. № 6. С. 72-76.
- Rödel C., Graeven U., Fietkau R., Hohenberger W., Hothorn T., Arnold D., Hofheinz R.D., Ghadimi M., Wolff H.A., Lang-Welzenbach M., Raab H.R., Wittekind C., Ströbel P., Staib L., Wilhelm M., Grabenbauer G.G., Hoffmanns H., Lindemann F., Schlenska-Lange A., Folprecht G., Sauer R., Liersch T.; German Rectal Cancer Study Group. Oxaliplatin added to fluorouracil-based preoperative chemoradiotherapy and postoperative chemotherapy of locally advanced rectal cancer (the German CAO/ARO/AIO-04 study): final results of the multicentre, open-label, randomised, phase 3 trial//Lancet Oncol. 2015. V. 16, N 8. P. 979-989.
- Бердов Б.А., Невольских А.А., Неборак Ю.Т. Латеральный край резекции как фактор прогноза при раке прямой кишки//Сибирский онкологический журнал. 2010. № 5. С. 5-10.
- Eriksen M., Wibe A., Haffner J., Wiig J.N.; Norwegian Rectal Cancer Group. Prognostic groups in 1,676 patients with T3 rectal cancer treated without preoperative radiotherapy//Dis. Colon Rectum. 2007. V. 50, N 2. P. 156-167.
- Ерыгин Д.В., Бердов Б.А., Невольских А.А., Титова Л.Н., Смирнова С.Г. Неоадъювантная химиолучевая терапия местно-распространённого рака прямой кишки//Онкология. Журнал им. П.А. Герцена. 2015. Т. 4, № 1. С. 13-20.
- Burton S., Brown G., Radcliffe A.G., Newcombe R.G. Preoperative assessment of prognostic factors in rectal cancer using high-resolution magnetic resonance imaging//Br. J. Surg. 2003. V. 90. P. 355-364.
- Beyond TME Collaborative. Consensus statement on the multidisciplinary management of patients with recurrent and primary rectal cancer beyond total mesorectal excision planes//Br. J. Surg. 2013. V. 100, N 8. P. E1-33.
- Бердов Б.А., Ерыгин Д.В., Невольских А.А., Курпешев О.К., Закурдяева И.Г., Титова Л.Н. Междисциплинарный подход в лечении рака прямой кишки//Поволжский онкологический вестник. 2015. № 4. С. 21-28.
- MERCURY Study Group. Diagnostic accuracy of preoperative magnetic resonance imaging in predicting curative resection of rectal cancer: prospective observational study//BMJ. 2006. V. 333. P. 779.
- Manceau G., Panis Y. Laparoscopic colorectal surgery: why, when, how?//Updates Surg. 2016. V. 68, N 1. P. 3-5.
- Francois Y., Nemoz C.J., Baulieux J. Influence of the interval between preoperative radiation therapy and surgery on downstaging and on the rate of sphincter-sparing surgery for rectal cancer: the Lyon R90-01 randomized trial//J. Clin. Oncol. 1999. V. 17. P. 2396.
- Huntington C.R., Boselli D., Symanowski J., Hill J.S., Crimaldi A., Salo J.C. Optimal timing of surgical resection after radiation in locally advanced rectal adenocarcinoma: an analysis of the National Cancer Database//Ann. Surg. Oncol. 2016. V. 23, N 3. P. 877-887.
- Sauer R., Becker H., Hohenberger W.; German Rectal Cancer Study Group. Preoperative versus postoperative chemoradiotherapy for rectal cancer//N. Engl. J. Med. 2004. V. 351. P. 1731-1740.
- Roh M.S., Colangelo L.H., O’Connell M.J. Preoperative multimodality therapy improves disease-free survival in patients with carcinoma of the rectum: NSABP R-03//J. Clin. Oncol. 2009. V. 27. P. 5124-5130.
- Arkenau H.T., Arnold D., Cassidy J. Efficacy of oxaliplatin plus capecitabine or infusional fluorouracil/leucovorin in patients with metastatic colorectal cancer: a pooled analysis of randomized trials//J. Clin. Oncol. 2008. V. 26. P. 5910-5917.
- Capirci C., Valentini V., Cionini L. Prognostic value of pathologic complete response after neoadjuvant therapy in locally advanced rectal cancer: long-term analysis of 566 ypCR patients//Int. J. Radiat. Oncol. Biol. Phys. 2008. V. 72, N 1. P. 99-107.
- Stipa F., Chessin D.B., Shia J. A pathologic complete response of rectal cancer to preoperative combined-modality therapy results in improved oncological outcome compared with those who achieve no downstaging on the basis of preoperative endorectal ultrasonography//Ann. Surg. Oncol. 2006. V. 13. P. 1047-1053.
- Stein D.E., Mahmoud N.N., Anné P.R. Longer time interval between completion of neoadjuvant chemoradiation and surgical resection does not improve downstaging of rectal carcinoma//Dis. Colon Rectum. 2003. V. 46. P. 448-453.


