Предоперационное обезболивание в аноректальной хирургии: результаты проспективного, рандомизированного, двойного слепого, плацебо-контролируемого исследования
Автор: Гарманова Т.Н., Маркарьян Д.Р., Казаченко Е.А., Лукьянов А.М., Кривоносова Д.А., Агапов М.А.
Журнал: Хирургическая практика @spractice
Рубрика: Статьи
Статья в выпуске: 4 (52), 2022 года.
Бесплатный доступ
Цель: Оценить эффективность предоперационной анальгезии кетопрофеном в дозе 100 мг, применяемого перорально за 2 часа до оперативного вмешательства в аноректальной хирургии, в отношении выраженности послеоперационного болевого синдрома.Методы: Проспективное, рандомизированное, двойное слепое, одноцентровое исследование, проведенное на базе хирургического отделения МНОЦ МГУ им. Ломоносова. В исследование включались пациенты c аноректальными заболеваниями ≥18 лет с анестезиологическим риском по ASA I-II, которым планировалось хирургическое лечение в период 09.2020 - 09.2021г. После получения письменного согласия пациенты были рандомизированы в основную (прием 100мг кетопрофена за 2 часа до операции) и в группу плацебо. Главной конечной точкой являлась оценка количества назначенных опиоидных анальгетиков в течение недели после операции. Вторичные конечные точки: выраженность боли в покое и при дефекации, длительность и частота приема анальгетиков, частота повторных госпитализаций, качество жизни, время от операции до возвращения на работу и частота осложнений. Результаты: В исследование включено 134 участника: в основной группе - 68, в контрольной - 66. Послеоперационный болевой синдром был статистически значимо меньше в основной группе на 4, 5, 6 и 7 дни послеоперационного периода (р=0,035; р=0,023; р=0,046 соответственно). Прием опиоидов после операции также был несколько ниже у пациентов основной группы (р=0,174). Показатели частоты побочных эффектов, качество жизни, времени от операции до возвращения к прежнему образу жизни не различались между группами.Заключение: Предоперационная анальгезия является безопасной и эффективной в отношении снижения выраженности послеоперационного болевого синдрома в аноректальной хирургии, позволяет снизить количество пациентов, требующих обезболивание опиоидами, не увеличивает частоту побочных эффектов, связанных с приемом лекарственных препаратов. Предоперационное обезболивание должно быть частью рутинного ведения пациентов в аноректальной хирургии в рамках мультимодальной анальгезии
Мультимодальная анальгезия, аноректальная хирургия, нпвс, лечение боли, предоперационное обезболивание
Короткий адрес: https://sciup.org/142236612
IDR: 142236612 | УДК: 616-089.5-037:616.352 | DOI: 10.38181/2223-2427-2022-4-5-14
Текст научной статьи Предоперационное обезболивание в аноректальной хирургии: результаты проспективного, рандомизированного, двойного слепого, плацебо-контролируемого исследования
В большинстве случаев аноректальные заболевания являются доброкачественными и не влияют на продолжительность жизни, поэтому в настоящее время, как пациенты, так и врачи крайне заинтересованы в проведении хирургии одного дня.Аноректальная хирургия сама по себе вызывает значительный дискомфорт для пациента, обусловленный выраженной послеоперационной болью,длительным периодом восстановления и снижением качества жизни на несколько месяцев.
Боль в послеоперационном периоде возникает в результате воздействия эндогенных и экзогенных факторов на периферические нервные окончания,а также из-за патологического возбуждения центральной нервной системы.Любое хирургическое вмешательство активирует ноцицепторы с помощью различных стимулов, включая механические факторы, такие как разрез ткани, химические факторы в результате с воздействия медиаторов воспаления и термические факторы в результате нагрева или охлаждения ткани. Таким образом любая операция всегда сопровождается болевым синдромом с различной степенью выраженности боли.
Проблема обезболивания по-прежнему актуальна для пациентов после аноректальной хирургии, поскольку этими заболеваниями страдают более 50% населения старше 50 лет. [2] В аноректальной хирургии почти каждый пациент испытывает умеренную/силь-ную боль в послеоперационном периоде, 12% пациентов испытывают сильную боль в течение всего периода восстановления. Контроль послеоперационной боли все еще остается проблематичным в 5% случаев, когда выраженный болевой синдром продолжается на фоне стандартной схемы обезболивания. Это приводит к увеличению срока госпитализации и назначения опиоидных обезболивающих препаратов. [1] Практически любое оперативное вмешательство в зоне промежности связано с интенсивной послеоперационной болью,ко-торая значительно снижает качество жизни в послеоперационном периоде и общую удовлетворенность пациентов лечением [3], [4] Боль после геморроидэкто-мии (ГЭ) и других аноректальных операций зависит от спазма анального сфинктера и пуборектальных мышц выбранного вида анестезии, скорости заживления раны, хирургической техники, типа стула и субъективного восприятия пациента. [5], [6] Согласно международным рекомендациям целевой уровень послеоперационной боли должен составлять 3-4 или менее баллов по визуально-аналоговой шкале (ВАШ), чего редко удается добиться в аноректальной хирургии [7]
Превентивная анальгезия направлена на предотвращение боли после операции и воздействует на несколько точек "болевого" каскада. [3] Наиболее часто применяемыми ненаркотическими анальгетиками, блокирующими периферическое восприятие боли, являются НПВП, кортикостероиды и ацетилсалициловая кислота. Ненаркотические препараты, включают кета-мин,ацетаминофен и некоторые противосудорожные средства (в частности,габапентин) подавляют центральную сенсибилизацию.НПВС и кортикостероиды блокируют периферическое восприятие боли, таким образом, мультимодальная анальгезия теоретически может почти полностью ликвидировать боль за счет блокирования всех видов болевых рецепторов.Пред-операционное применение даже одного вида анальгетика способствует снижению боли и потребления опиоидов после оперативного вмешательства. [1], [8]– [10] Одной из наиболее часто назначаемых групп обезболивающих являются нестероидные противовоспалительные препараты (НПВП), которые оказывают адекватное обезболивающее действие и могут снизить частоту назначения опиоидных анальгетиков на 18%. [11]Применение кетопрофена в качестве предопера- ционной анальгезии в аноректальной хирургии на данный момент в литературе не описано.Однако,данный препарат успешно применяется в травматологии, стоматологической, детской и общей хирургии. Использование кетопрофена способствует значительному снижению потребления опиоидов (на 33%) и улучшает контроль послеоперационной боли после вмешательств на позвоночнике и брюшной полости. [12]–[15] В стоматологической практике на фоне лечения кетопрофеном пациентам с острым приступом боли удается достигнуть значимого снижения болевого синдрома более быстрого наступления эффекта и более длительной продолжительности действия анальгезии,нежели чем на фоне других НПВП. [16], [17] Кетопрофен также продемонстрировал свою эффективность в качестве предоперационной анальгезии по сравнению с другими группами препаратов. [18] Он одобрен к применению в качестве анальгетика для лечения легкой и умеренной боли в послеоперационном периоде и хронической онкологической боли в максимальной суточной дозе до 300 мг; рекомендуемая начальная доза составляет 25-50 мг каждые 6-8 часов. [19] По сравнению с ацетаминофеном кетопрофен показал значительно лучший противовоспалительный эффект на 3-й и 6-й день после хирургического вмешательства и более низкую интенсивность боли. [20] Во всех выше упомянутых исследованиях побочные эффекты кетопрофена были незначительными и встречались достаточно редко.
Адекватная анальгезия требует мультимодального подхода, включающего опиоидные анальгетики, нестероидные противовоспалительные препараты (НПВП), ацетаминофен и местные анестетики. Возможно, предоперационное обезболивание в аноректальной хирургии может дополнить схему мультимодального обезболивания, изучению чего посвящена данная работа.
Цель
Оценить эффективность предоперационной анальгезии кетопрофеном в дозе 100 мг, применяемого перорально за 2 часа до хирургического вмешательства, со спинномозговой анестезией в отношении выраженности послеоперационного болевого синдрома.
Материалы и методы
Дизайн исследования
Это проспективное, рандомизированное, двойное слепое, одноцентровое исследование с 2 параллельными группами с соотношением распределения 1:1. Исследование проведено в хирургическом отделении МНОЦ МГУ им. М. В. Ломоносова за период с сентября 2020
года по сентябрь 2021 года. Главной конечной точкой являлась оценка количества принимаемых опиоидов в день в течение первой недели после операции, необходимые для поддержания уровня боли не более 3-4 баллов по ВАШ у каждого пациента. В исследовании также оценивались следующие вторичные конечные точки: (1) выраженность боли до и после дефекации по ВАШ через 6, 12 и 24 часа после процедуры, затем каждый день до 7-го послеоперационного дня, (2) продолжительность и (3) частота приема других анальгетиков (системно и местно) в течение первой недели после операции, (4) частота повторных госпитализаций и (5) качество жизни на 7-й и 30-й дни, (6) время от операции до возвращения на работу и (7) частота осложнений (кровотечения, задержка мочи, инфекционные осложнения) в раннем послеоперационном периоде (через 30 дней после процедуры). Общее качество жизни будет оцениваться с помощью краткой формы опросника пациента 36 (SF-36).
Все пациенты, обратившиеся за медицинской помощью в МНОЦ МГУ им. М.В. Ломоносова в период между сентябрем 2020г. и сентябрем 2021г. с такими заболеваниями как анальная трещина, свищ прямой кишки, геморрой, анальные кондиломы, были дообследованы перед включением в исследование.Пациентам старше 18 лет, которым предполагалось хирургическое вмешательство, с I, II классом анестезиологического риска по классификации ASA было предложено участие в исследовании. Пациенты с аллергией на используемые препараты или постоянно принимающие стероидные или наркотические препараты, а также пациенты с хроническим болевым синдромом или имеющие противопоказания или техническую невозможность выполнения субарахноидальной анестезии или декомпенсированные соматические заболевания,либо отказавшиеся от участия, а также беременные женщины в исследование не включались.Письменное добровольное информированное согласие на участие в исследовании получают все пациенты до начала рандомизации.
После получения письменного информированного согласия пациенты были случайным образом рандомизированы либо в группу исследования (основная группа), либо в группу контроля (группа плацебо). При этом использовалась «en bloc» рандомизация с распределением в зависимости от типа операции для сведения к минимуму межгрупповых различий.Статистик случайным образом распределял пациентов с помощью программы «PLAN» (SAS Institute Inc, Cary, NC) с раз- мером блока 4. Для ослепления пациента, хирургов и сестринского персонала статистик предоставлял координатору исследования название группы для следующего пациента, который включался в исследование, далее координатор раскрывал название группы только анестезиологическому персоналу. Кроме того, размер блоков был известен только статистику.
В рамках дооперационной подготовки все пациенты оценивали наличие боли по шкале ВАШ от 0до 10и отвечали на вопросы скрининга. Это было необходимо для выявления факторов исключения пациентов.За 2 часа до операции каждый пациент из группы исследования (основной группы) получал кетопрофен в дозе 100 мг перорально, в группе контроля – плацебо.
Оперативный и послеоперационный этапы
Во время анестезии пациент находится в положении сидя. Игла вводится между промежутками L3 и L4 или между промежутками L4 и L5. Для спинномозговой анестезии использовался раствор бупивакаина 5 мг/мл. Никаких вспомогательных лекарственных средств для премедикации не использовалось. Под спинномозговой анестезией пациента помещают в модифицированное литотомическое положение на спине с раздвинутыми ногами на опорах. Операционное поле трижды обрабатывают раствором антисептика.Далее выполняется соответствующее хирургическое вмешательство.
В послеоперационном периоде пациенту выдавался опросник и шкала для оценки болевого синдрома в покое и при дефекации в течение первых 6, 12, 24 часов после операции, далее – на 2-7 день после операции. В течение госпитализации медицинской сестрой заполнялся раздел по принимаемым препаратам,после выписки пациент заполнял этот раздел самостоятельно в течение 7 дней после хирургического вмешательства. По истечении 30 дней заполнялся раздел побочных эффектов, и оценивалось качество жизни.
В послеоперационном периоде пациентам проводилась анальгезия по схеме: 1000 мг ацетаминофена каждые 24 часа, 30мг в/м кеторола каждые 8 часов. В случае неэффективности стандартной схемы обезболивания и появления на ее фоне выраженного болевого синдрома (6-10 баллов по ВАШ) пациентам вводилась 1 ампула трамадола (50мг/мл, 2 мл – 100мг, 1 ампула – 2 мл) внутримышечно.
Статистические методы
Учитывая то, что это исследование по доказательству более высокой эффективности,размер выборки был рассчитан с использованием одностороннего теста
Блэквелдера. По имеющимся данным частота приема опиоидов после геморроидэктомии колеблется от 20 до 30%. [7] Ожидаемая частота приема опиоидов после ге-морроидэктомии при предоперационной анальгезии составляет не более 10%. Цель данного исследования – продемонстрировать то,что потребление опиоидов у пациентов с предоперационной анальгезией ниже,чем без нее. Учитывая, что а = 0,05; статистическая мощность исследования составляет 80%; пациенты рандомизированы на 2 группы с соотношением распределения 1:1; предел неполноценности D = 5%, необходимый объем выборки-144 пациента (по 72 пациента в каждой из 2-х групп).
Все соответствующие данные из карты пациента, за исключением имен,будут перенесены в электронную форму отчета о пациенте,которая должна содержать результаты всех обследований и анализов, включая анамнез и демографические данные пациента,запол-ненные анкеты,описание хода операции и послеоперационные обходы во время пребывания пациента в хирургическом отделении.
Количественные переменные описываются как средние значения со стандартными отклонениями,ме-дианы,диапазон или межквартильный диапазон в зависимости от обстоятельств.Категориальные переменные описываются в абсолютных числах и процентах. Статистический анализ количественных переменных с независимыми группами проводился с помощью параметрического t-критерия Стьюдента, обеспечивающего выполнение условий его применения. В противном случае использовали непараметрический U-критерий Манна-Уитни. Статистический анализ для категориальных переменных проводится с использованием критерия Пирсона χ2 или точного критерия Фишера. В частности, вышеприведенные методы используются для сравнения двух групп с точки зрения исходных харак-теристик,чтобы оценить,была ли рандомизация эффективной.
Результаты
Всего в исследование включено 146 пациентов: 76 человека в экспериментальной группе и 68 человек в группе контроля. Каждый из включенных пациентов соответствовал всем критериям включения. В ходе послеоперационного мониторинга в анализ было вошли только те пациенты,которые пришли на повторный прием через 30 дней или с которыми удалось связаться. Таким образом, в анализ включено 68 человек из экспериментальной группы и 66 из группы контроля. Де- мографические данные и клинические характеристики двух группы представлены в Таблице 1. Значимых различий между исследуемыми группами по этим параметрам не было выявлено.
Частота применения наркотических обезболивающих препаратов в основной и контрольной группах составила 3% и 13 %, однако различия не были статически значимыми ( р =0,174).
Впервые болевой синдром был оценен через 6часов после вмешательства. В сроки через 6, 12, 24 часа и 1, 2 дня после вмешательства уровень болевого синдрома в покое и при дефекации не различался между группами. Однако через 4, 5, 6 и 7 дней после хирургического наблюдения в основной группе уровень болевого синдрома при дефекации был ниже, чем в контрольной (статистически значимая разница через 4, 5 и 7 дней: р =0,035; р =0,023 и р =0,046
Таблица 1.
Клинические данные пациентов
Tab le 1.
Demographic data and clinical characteristics of patients
|
Группа 1 (Кетопрофен) |
Группа 2 (плацебо) |
Значение p |
|
|
Кол-во пациентов |
68 |
66 |
|
|
Возраст |
45.7±10.1 |
44.2±10.2 |
0.4686 |
|
Пол (м/ж) |
35/33 |
34/32 |
0.7948 |
|
Заболевания: |
|||
|
Геморроидальная болезнь |
41 |
39 |
0.8463 |
|
Анальная трещина |
15 |
15 |
1 |
|
Свищ прямой кишки |
10 |
8 |
0.7429 |
|
Анальное недержание |
2 |
4 |
0.650 |
Таблица 2.
Среднее значение уровня боли в послеоперационном периоде
Tab le 2.
The average pain level in the postoperative period
|
Интенсивность боли (1-10) |
Исследуемая группа |
Контрольная группа |
Значение p |
|
1 день |
3 (2-4) |
5 (3-6) |
0,404 |
|
1-ая дефекация |
7 (6-8) |
7 (6-9) |
0,477 |
|
2 день |
2(1-3) |
3 (2-5) |
0,109 |
|
4 день |
1 (0-3) |
3 (1-3) |
0,035 |
|
5 день |
1 (0-2) |
2 (1-3) |
0,023 |
|
6 день |
0 (0-2) |
1 (0-3) |
0,064 |
|
7 день |
0 (0-2) |
1 (0-3) |
0,046 |
*представлены медианы и 1-ый и 3-ий квартили
соответственно, и близок к статистически значимой на 6-й день после операции, р =0,064) (Таблица 2, рис. 1, 2, 3 и 4).
Также за время наблюдения в группе исследования не было отмечено побочных действий Кетопрофена,таких как диспепсия, головная боль, повышение артериального давления, тахикардия, бронхоспазм, аллергические реакции.
Медиана среднего времени возврата к труду или к прежнему образу жизни составила 14 дней (7-21), различия между группами оказались статистически незначимыми.
Через 30 дней после оперативного вмешательства был проведен опрос для оценки качества жизни участников с помощью краткой формы опросника пациента 36 (SF-36). Медиана суммарного показателя SF-36 составила 0 баллов
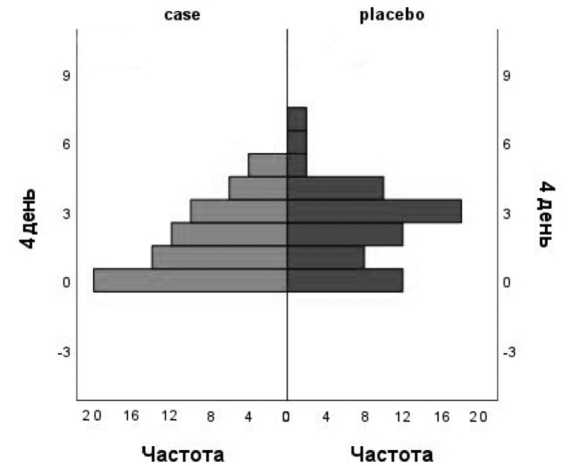
Рис. 1. Уровень боли по ВАШ у пациентов при дефекации через 4 дня после оперативного вмешательства (ранговый критерий Манна-Уитни) Fig. 1. Pain level according to VAS during defecation 4 days after surgery (Mann-Whitney rank criterion)
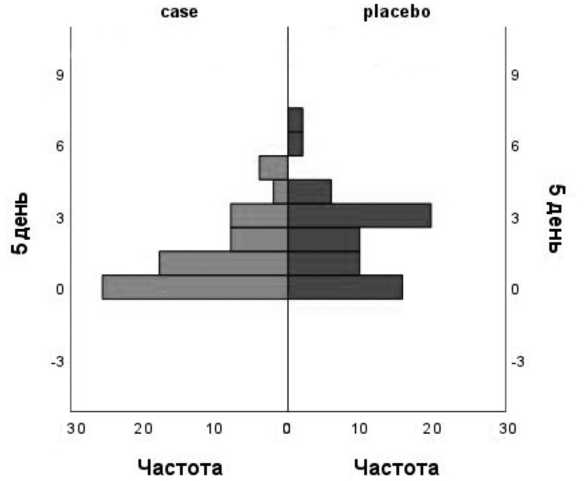
Рис. 2. Уровень боли по ВАШ у пациентов при дефекации через 5 дней после оперативного вмешательства (ранговый критерий Манна-Уитни) Fig. 2. Pain level according to VAS during defecation 5 days after surgery (Mann-Whitney rank criterion)
для обеих групп, статистически значимых различий между группами не было выявлено.
В течение 30 дней послеоперационного наблюдения повторные госпитализации и рецидивы заболевания не были отмечены ни в одной группе. В контрольной и исследуемой группах у 2 и 2 пациентов соответственно было отмечено послеоперационное кровотечение, которое не потребовало повторноговмешательства, было купировано консервативно.
Обсуждение
Исследования показывают, что мультимодальное обезболивание в аноректальной хирургии облегчает контроль боли и снижает потребность в опиоидах в послеоперационном периоде.Предоперационная анальгезия помогает уменьшить боль, предотвращая гипералгезию связанную с сенсибилизацией болевых волокон в центральной и периферической нервной системах.
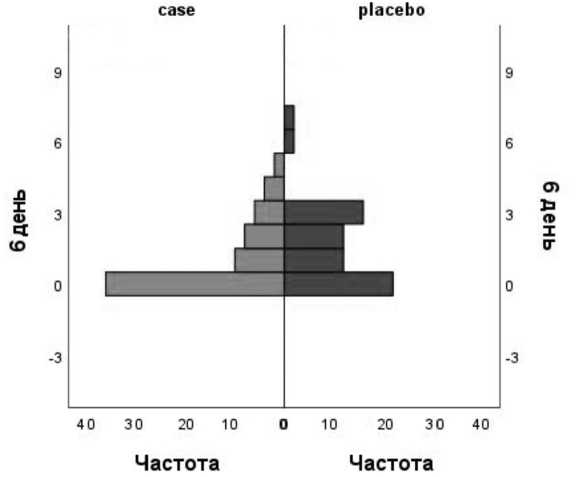
Рис. 3. Уровень боли по ВАШ у пациентов при дефекации через 6 дней после оперативного вмешательства (ранговый критерий Манна-Уитни) Fig. 3. Pain level according to VAS during defecation 6 days after surgery (Mann-Whitney rank criterion)
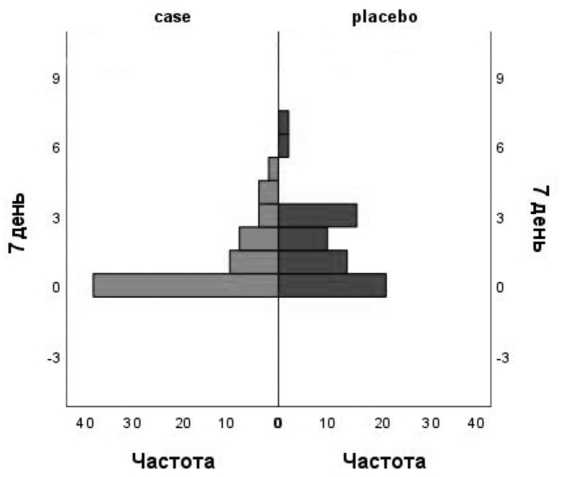
Рис. 4. Уровень боли по ВАШ у пациентов при дефекации через 7 дней после оперативного вмешательства (ранговый критерий Манна-Уитни) Fig. 4. Pain level according to VAS during defecation 7 days after surgery (Mann-Whitney rank criterion)
Предоперационный пероральный прием ацетаминофена и габапентина с последующим внутривенным введением кетамина в раннем послеоперационном периоде приводил к значительному снижению уровня боли в послеоперационном периоде и снижению потребления наркотических препаратов. [1, 3] Эффективность применения габапентина в качестве обезболивающего препарата до хирургического вмешательства была продемонстрирована в ряде исследований. [4]
Анальгезирующие свойства НПВП обусловлены периферической блокадой синтеза простагландинов. Это позволяет уменьшить воспалительную реакцию в дополнение к снижению восприятия боли. Кроме того, реакция центральной нервной системы на болевые раздражители может также изменяться благодаря снижению синтеза простагландинов с помощью НПВП. [3]
Системный прием кеторолака с местными анестетиками продемонстрировал значительное снижение потребности в послеоперационных анальгетиках, а также способствовал уменьшению частоты расстройств мочеиспускания у пациентов после аноректальной хирургии. [21]
Это первое рандомизированное двойное слепое пла-цебо-контролируемое исследование для оценки эффективности предоперационного применения кетопрофена в аноректальной хирургии. В нашем исследовании было продемонстрировано, что использование предоперационной анальгезии позволяет снижать выраженность болевого синдрома после вмешательства через 4, 5, 6, 7 дней после операции. Также наблюдалась тенденция к уменьшению числа пациентов, нуждающихся в обезболивании наркотическими анальгетиками в течение 24 часов. Эти результаты особенно важны, поскольку они демонстрируют способность кетопрофена снижать потребление наркотических анальгетиков у пациентов в послеоперационном периоде.
Один из побочных эффектов кетопрофена – послеоперационное кровотечение. В литературе имеются данные о том, что в 2% случаях после аноректальной хирургии такое кровотечение приводило в последующем к гипотензии, переливанию крови или повторной операции. Недавнее исследование с постмаркетинговым наблюдением показало, что более чем у 10000 пациентов риск кровотечения в месте операции или желудочно-кишечного тракта был статистически одинаковым,независимо от того, получали ли пациенты кетопрофен или нет. [3]
Периферическая сенсибилизация возникает из-за избыточного воздействия раздражителей.Этот тип сенсибилизации обычно предотвращается с помощью регио- нарной анестезии и путем повышения ноцицептивного порога нейронов с помощью различных средств. Превентивная фармакологическая блокада возбуждения эффективно применяется как в общей хирургии, так и в нейрохирургии. У пациентов, перенесших эндопротезирование тазобедренного сустава, блокада как центральной, так и периферической сенсибилизации приводит к значительному уменьшению субъективной боли и тенденции к меньшему послеоперационному использованию анальгетиков. Аналогичным образом пациенты, перенесшие многоуровневую операцию на позвоночнике,и пациенты, перенесшие операцию на предстательной железе, потребляют меньше послеоперационных анальгетиков при проведении мультимодальной предоперационной анальгезии, блокируя оба пути сенсибилизации. [22, 23]
Местная периферическая сенсибилизация также сводится к минимуму при использовании НПВП из-за снижения выработки простагландинов и кининов, поскольку ацетаминофен и НПВП блокируют фермент, необходимый для образования этих молекул. [24] Кеторолак также демонстрировал способность контролировать уровень контроля боли у пациентов при его превентивном применении. [25]
Мы считаем, что превентивная анальгезия должна быть частью рутинного ведения пациентов в аноректальной хирургии, и что наши результаты применимы к большинству пациентов, оперируемых по поводу аноректальных заболеваний.
Заключение
Предоперационная анальгезия в аноректальной хирургии позволяет уменьшить болевой синдром в раннем послеоперационном периоде, уменьшает количество пациентов, требующих обезболивание наркотическими анальгетиками,и не увеличивает частоту побочных эффектов, связанных с приемом лекарств. Назначение кетопрофена является безопасным и эффективным,и рекомендуется применять соответствующим пациентам как в рамках предоперационного обезболивания в аноректальной хирургии, так и в рамках мультимодальной анестезии после аноректальных вмешательств.
Список литературы Предоперационное обезболивание в аноректальной хирургии: результаты проспективного, рандомизированного, двойного слепого, плацебо-контролируемого исследования
- V. Poylin, J. Quinn, K. Messer, and D. Nagle, Gabapentin significantly decreases posthemorrhoidectomy pain: a prospective study, Int. J. Colorectal Dis., vol. 29, no. 12, pp. 1565–1569, 2014, https://doi.org/10.1007/s00384-014-2018-4
- G. Gallo, Martellucci J., Sturiale A., Clerico G., Milito G., Marino F., Cocorullo G., Giordano P., Mistrangelo M., Trompetto M., Consensus statement of the Italian society of colorectal surgery (SICCR): management and treatment of hemorrhoidal disease, Techniques in Coloproctology, vol. 24, no. 2. 2020, https://doi.org/10.1007/s10151-020-02149-1
- J. T. Van Backer, Jordan Matthew R., Leahy Danielle T., Moore Jesse S., Callas Peter, Dominick Timothy, Cataldo Peter A., Preemptive analgesia decreases pain following anorectal surgery: A prospective, randomized, double-blinded, placebo-controlled trial, Dis. Colon Rectum, vol. 61, no. 7, pp. 824–829, 2018, https://doi.org/10.1097/DCR.0000000000001069
- B. Penprase, E. Brunetto, E. Dahmani, J. J. Forthoffer, and S. Kapoor, The efficacy of preemptive analgesia for postoperative pain control: A systematic review of the literature, AORN J., vol. 101, no. 1, pp. 94-105.e8, 2015, https://doi.org/10.1016/j.aorn.2014.01.030
- Y. J. Huang, C. Y. Chen, R. J. Chen, Y. N. Kang, and P. L. Wei, Topical diltiazem ointment in post-hemorrhoidectomy pain relief: A meta-analysis of randomized controlled trials, Asian J. Surg., vol. 41, no. 5, 2018, https://doi.org/10.1016/j.asjsur.2017.06.002.
- J. W. Liu, C. C. Lin, K. T. Kiu, C. Y. Wang, and K. W. Tam, Effect of Glyceryl Trinitrate Ointment on Pain Control after Hemorrhoidectomy: A meta-analysis of randomized controlled trials, World J. Surg., vol. 40, no. 1, 2016, https://doi.org/10.1007/s00268-015-3344-6
- P.E. Frasco, J. Sprung, and T. L. Trentman, “The impact of the joint commission for accreditation of healthcare organizations pain initiative on perioperative opiate consumption and recovery room length of stay,” Anesth. Analg., vol. 100, no. 1, pp. 162–168, 2005, https://doi.org/10.1213/01.ANE.0000139354.26208.1C
- I. M. Richman, Use of Toradol® in anorectal surgery, Dis. Colon Rectum, vol. 36, no. 3, 1993, https://doi.org/10.1007/BF02053515
- G. Khalili, M. Janghorbani, H. Saryazdi, and A. Emaminejad, Effect of preemptive and preventive acetaminophen on postoperative pain score: A randomized, double-blind trial of patients undergoing lower extremity surgery, J. Clin. Anesth., vol. 25, no. 3, 2013, https://doi.org/10.1016/j.jclinane.2012.09.004
- J. I. Wu, S. F. Lu, Y. Y. Chia, L. C. Yang, W. P. Fong, and P. H. Tan, Sevoflurane with or without antiemetic prophylaxis of dexamethasone in spontaneously breathing patients undergoing outpatient anorectal surgery, J. Clin. Anesth., vol. 21, no. 7, 2009, https://doi.org/10.1016/j.jclinane.2008.11.007
- J. Y. Chen, Ko Tsung Lin, Wen Yeong Ray,Wu Shu Ching,Chou Yenn Hwei, Yien Hwey Wen, Kuo Cheng Deng, “Opioid-sparing effects of ketorolac and its correlation with the recovery of postoperative bowel function in colorectal surgery patients: A prospective randomized double-blinded study,” Clin. J. Pain, vol. 25, no. 6, 2009, https://doi.org/10.1097/AJP.0b013e31819a506b
- F. Aubrun, O. Langeron, D. Heitz, P. Coriat, and B. Riou, Randomised, placebo-controlled study of the postoperative analgesic effects of ketoprofen after spinal fusion surgery, Acta Anaesthesiol. Scand., vol. 44, no. 8, pp. 934–939, 2000, https://doi.org/10.1034/j.1399-6576.2000.440807.x
- D. Fletcher, Nègre I., Barbin C., François A., Carreres C., Falgueirettes C., Barboteu A., Samii K., Postoperative analgesia with iv propacetamol and ketoprofen combination after disc surgery, Can. J. Anaesth., vol. 44, no. 5, pp. 479–485, 1997, https://doi.org/10.1007/BF03011934
- A. Hiller, O. A. Meretoja, R. Korpela, S. Piiparinen, and T. Taivainen, The analgesic efficacy of acetaminophen, ketoprofen, or their combination for pediatric surgical patients having soft tissue or orthopedic procedures, Anesth. Analg., vol. 102, no. 5, pp. 1365–1371, 2006, https://doi.org/10.1213/01.ane.0000204278.71548.bf
- D. Oberhofer, J. Skok, and V. Nesek-Adam, Intravenous ketoprofen in postoperative pain treatment after major abdominal surgery, World J. Surg., vol. 29, no. 4, 2005, https://doi.org/10.1007/s00268-004-7612-0
- H. Gaskell, S. Derry, P. J. Wiffen, and R. A. Moore, Single dose oral ketoprofen or dexketoprofen for acute postoperative pain in adults, Cochrane Database of Systematic Reviews, vol. 2017, no. 5. 2017, https://doi.org/10.1002/14651858.CD007355.pub3
- S. A. Cooper, Ketoprofen in oral surgery pain: a review, Journal of clinical pharmacology, vol. 28, no. 12 Suppl. 1988, https://doi.org/10.1002/j.1552-4604.1988.tb05976.x
- G. Velásquez, L. A. Cruz, and M. Espinoza, Ketoprofen Is More Effective Than Diclofenac After Oral Surgery When Used as a Preemptive Analgesic: A Pilot Study, J. Oral Facial Pain Headache, vol. 28, no. 2, 2014, https://doi.org/10.11607/ofph.1200
- A. Sunshine and N. Z. Olson, Analgesic efficacy of ketoprofen in postpartum, general surgery, and chronic cancer pain, Journal of clinical pharmacology, vol. 28, no. 12 Suppl. 1988, https://doi.org/10.1002/j.1552-4604.1988.tb05977.x
- G. A. Bjornsson, H. R. Haanæs, and L. A. Skoglund, Ketoprofen 75 mg qid versus acetaminophen 1000 mg qid for 3 days on swelling, pain, and other postoperative events after third-molar surgery, J. Clin. Pharmacol., vol. 43, no. 3, 2003, https://doi.org/10.1177/0091270002250603
- R. J. Place, M. Coloma, P. F. White, P. J. Huber, J. Van Vlymen, and C. L. Simmang, Ketorolac improves recovery after outpatient anorectal surgery, Dis. Colon Rectum, vol. 43, no. 6, pp. 804–808, 2000, https://doi.org/10.1007/BF02238018
- Mathiesen O, Dahl B, Thomsen BA, Kitter B, Sonne N, Dahl JB, Kehlet H. A comprehensive multimodal pain treatment reduces opioid consumption after multilevel spine surgery. Eur Spine J. 2013 Sep;22(9):2089-96. https://doi.org/10.1007/s00586-013-2826-1
- Trabulsi EJ, Patel J, Viscusi ER, Gomella LG, Lallas CD. Preemptive multimodal pain regimen reduces opioid analgesia for patients undergoing robotic-assisted laparoscopic radical prostatectomy. Urology. 2010 Nov;76(5):1122-4. https://doi.org/10.1016/j.urology.2010.03.052
- Tang R, Evans H, Chaput A, Kim C. Multimodal analgesia for hip arthroplasty. Orthop Clin North Am. 2009 Jul;40(3):377-87. https://doi.org/10.1016/j.ocl.2009.04.001
- Richman IM. Use of Toradol in anorectal surgery. Dis Colon Rectum. 1993 Mar;36(3):295-6. https://doi.org/10.1007/BF02053515


