Предоперационное планирование выбора метода реимплантации рено-висцеральных ветвей при реконструкциях торакоабдоминального отдела аорты
Автор: Чарчян Э.Р., Маметов А.У., Степаненко А.Б., Брешенков Д.Г., Мальгин Г.А., Белов Ю.В.
Журнал: Московский хирургический журнал @mossj
Рубрика: Сердечно-сосудистая хирургия
Статья в выпуске: 4 (90), 2024 года.
Бесплатный доступ
Введение. Протезирование торакоабдоминального отдела аорты (ТАА) является сложным хирургическим вмешательством, требующим реконструкции и реимплантации рено-висцеральных ветвей (РВВ). Выбор оптимального метода реимплантации РВВ играет важную роль в достижении долгосрочного успеха операции.Цель. Проанализировать и оценить предоперационные параметры МСКТ-аортографии и анатомо-морфологические характеристики РВВ и определить их влияние на выбор метода реимплантации РВВ при реконструкции ТАА.Материалы и методы. В РНЦХ им. Б.В. Петровского в рамках исследования проведен ретроспективный анализ данных у 120 пациентов с 01.2018 по 09.2023 гг., которым было выполнено протезирование ТАА с имплантацией всех РВВ. Оценены предоперационные данные и параметры аорты и РВВ по данным МСКТ-аортографии. Пациенты разделены на три группы; группа I - «Crawford» (n=43, 35,8 %), гр. II - «Coselli» (n=32, 26,7 %) и III гр. - «кнопки» (n=45, 37,5 %).Результаты. 1) «Crawford» следует выбирать у пожилых пациентов, с близким расположением устьев РВВ по отношению друг к другу, при отсутствии ДСТ и дегенеративного поражения РВВ. 2) «Coselli» целесообразно у пациентов с большим диаметром аневризмы на уровне РВВ (p function show_abstract() { $('#abstract1').hide(); $('#abstract2').show(); $('#abstract_expand').hide(); }
Аневризма торакоабдоминального отдела аорты, рено-висцеральные ветви, имплантация, метод «кнопки», метод crawford, метод coselli
Короткий адрес: https://sciup.org/142243828
IDR: 142243828 | УДК: 006.617-089 | DOI: 10.17238/2072-3180-2024-4-73-83
Текст научной статьи Предоперационное планирование выбора метода реимплантации рено-висцеральных ветвей при реконструкциях торакоабдоминального отдела аорты
Впервые реконструкцию торакоабдоминального отдела аорты (ТАА) с реимплантацией чревного ствола (ЧС) и верхней брыжеечной артерии (ВБА) выполнил S.N. Etheredge с коллегами в 1954 году [1]. Начиная с 80-х годов XX века под руководством E.S. Crawford были разработаны современные методы лечения аневризмы ТАА, а также предложены различные техники имплантации рено-висцеральных ветвей (РВВ) в зависимости от расстояния между устьями РВВ и их поражения (стеноз, окклюзия и расслоение) [2]. При наличии сочетанного поражения РВВ зачастую требуются дополнительные вмешательства (эндартерэктомия, иссечение интимы, резекция проксимального отдела артерии) на ветвях для предотвращения осложнений со стороны последних [3].
С накоплением опыта и появления отдаленных результатов были обнаружены случаи прогрессирования дилатации резидуальной аортальной ткани в области площадки с РВВ и формированием псевдоаневризмы. Аневризма площадки РВВ, встречается в 7,5 % случаев и может являться причиной повторных операций, ассоциированных с высокими рисками [4].
Изучение анатомо-морфологических особенностей РВВ и их поражения перед операцией считается одним из основных этапов при реконструкции ТАА, при этом не только в открытой аортальной хирургии, но и в трансплантологии, абдоминальной и эндоваскулярной хирургии. В связи с этим, многие авторы начали изучать данные мультиспиральной компьютерной томографии (МСКТ) и анатомо-морфологические особенности аорты и ее ветвей в предоперационном этапе [3, 5–9]. Исходя из полученных данных, были предложены разные методики имплантации РВВ. Первый метод, классический метод, предложенный E.S. Crawford, при котором все РВВ имплантируются на единой площадке или левая почечная артерия отдельно (рис. 1А). Второй метод – это использование готового много-браншевого протеза – метод «Coselli» (рис. 1Б). Третий метод, активно используемый в нашей практике – имплантация устьев РВВ по отдельности с максимальной резекцией измененной стенки аорты. Эта техника названа нами как метод «кнопки» (рис. 1В). Впервые метод «кнопки» был описан и опубликован академиком Ю.В. Беловым и его коллегами в 2007 году [10]. Мы представляем ретроспективный анализ данных предоперационной МСКТ – анатомии торакоабдоминальной аорты и определение ее влияния на выбор техники имплантации РВВ.
Цель исследования. Оценить предоперационные параметры МСКТ и анатомо-морфологические особенности РВВ, влияющие на выбор метода имплантации РВВ при реконструкции ТАА.
Материалы и методы
В РНЦХ им. Б.В. Петровского в рамках исследования проведен ретроспективный анализ данных у 120 пациентов с 01.2018 по 09.2023 гг., которым было выполнено протезирование ТАА с имплантацией всех РВВ. Оценены антропометрические данные, наличие дисплазии соединительной ткани (ДСТ) и сопутствующие заболевания. У 116 (96,7 %) пациентов по данным МСКТ-аортографии оценены следующие параметры: максимальный диаметр аорты на уровне РВВ, наличие расслоения, «shaggy aorta», вариантная анатомия РВВ, расстояние между РВВ и их поражение (стеноз, окклюзия/тромбоз и расслоение). Пациенты разделены на три группы; группа I – по методу «Crawford» (n=43, 35,8 %), группа II – по методу «Coselli» (n=32, 26,7 %), III группа – раздельная имплантация устьев РВВ по методу «кнопки» (n=45, 37,5 %).
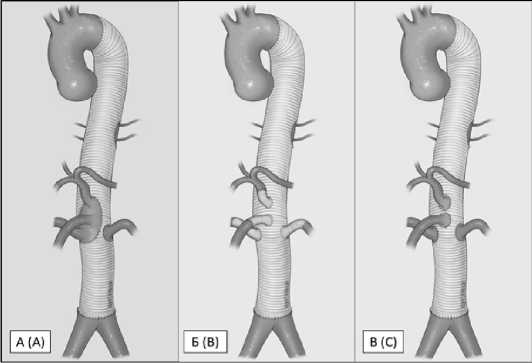
Рис. 1. Техника имплантации рено-висцеральных ветвей
А – метод Crawford, Б – метод Coselli, В – метод «кнопки»
Fig. 1. Technique of reimplantation of reno-visceral branches
A – Crawford technique, B – Coselli technique, C – «button» technique
(изгиб) аорты в сагиттальной плоскости, а также вариантное или аномальное отхождения РВВ от аорты. Кроме того, оценивали расстояние между устьями РВВ в сагиттальной плоскости, наличие расслоения, стенозов и окклюзии последних (рис. 2). Расстояние между устьями измерялись следующим образом: 1 — расстояние между устьем чревного ствола (ЧС) и верхней брыжеечной артерии (ВБА) в режиме MPR (рис. 2Б), 2 — расстояние между ВБА и правой почечной артерии в VR режиме (рис. 2В).
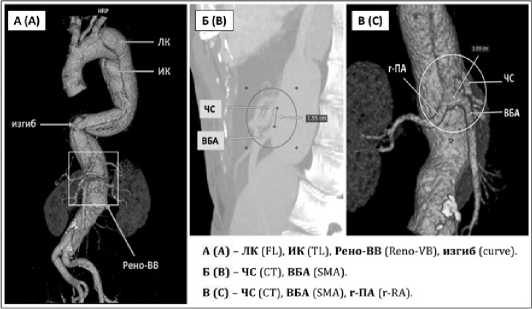
Рис. 2. 3D — МСКТ всей аорты и измерение расстояние РВВ ТАА.
А — построение трехмерного изображения по результатам МСКТ. ЛК — ложный канал, ИК — истинный канал, Рено-ВВ — рено-висцеральные ветви. Б — измерение расстояния между ЧС и ВБА. В — измерение расстояния ВБА и правой почечной артерии. ЧС — чревный ствол, ВБА — верхняя брыжеечная артерия, r-ПА — правая почечная артерия
Fig. 2. 3D — MSCT of the entire aorta and measurement of the distance of the RVB of the TAA.
A — construction of a three-dimensional image based on the results of MSCT. FL — false lumen, TL — true lumen, Reno-VB — reno-visceral branches. B — measurement of the distance between the CT and SMA. C — measurement of the distance between the SMA and the right renal artery. CT — celiac trunk, SMA — superior mesenteric artery, r-RA — right renal artery
Статистический анализ
Оценка МСКТ параметров
МСКТ с контрастированием аорты и ее ветвей выполнялась с использованием 64-срезового МСКТ Somatom Definition AS 64 фирмы «Siemens» (Германия). Исследование проводилось (от нижнего угла челюсти до верхней трети бедра) с внутривенным введением контрастного вещества через венозный катетер со скоростью 4–5 мл/сек. с обязательной кардиосинхронизацией. Полученные результаты были оценены с помощью программы Radiant DICOM Viewer 2022.1 (Medixant, Польша) в 3D режимах мультипланарной реконструкции (MPR) и объемной визуализации (VR).
При выполнении измерения оценивались размеры аорты на всех уровнях, протяженность аневризмы или расслоения, вовлеченность РВВ в аневризму или расслоение, девиация
Статистический анализ проводился с использованием количественных показателей в соответствие с нормальным распределением (критерий Шапиро-Уилка). Для сравнения нескольких групп использовались параметрические и непараметрические методы анализа (критерии Краскела-Уоллеса, ANOVA). Сравнение данных с нормальным распределением проводилось с помощью критерия χ 2 Пирсона или критерия Фишера (если ожидаемые результаты меньше 5). При статистически значимых показателях номинальных данных был проведен «Post-hoc» анализ с помощью критерия χ2 Пирсона. Для оценки диагностической значимости количественных признаков при прогнозировании определенного исхода, в том числе вероятности наступления исхода, рассчитанной с помощью регрессионной модели, применялся метод анализа
ROC-кривых. Качество прогностической модели, полученной данным методом, оценивалось исходя из значений площади под ROC-кривой со стандартной ошибкой и 95 % доверительным интервалом (ДИ) и уровня статистической значимости. Статистически значимой считалась разница между группами p-value равном <0,05.
Результаты
Анализ предоперационных данных, представленных в таблице 1 показал, что группы сопоставимы по возрасту и полу, статистически значимые различия между группами отсутствуют (p<0,005) (табл. 1).
Таблица 1
Характеристика больных
Table 1
Characteristics of patients
|
Параметры Parameters |
«Crawford» «Crawford» n=43 (100 %) |
«Coselli» «Coselli» n=32 (100 %) |
«кнопки» «button» n=45 (100 %) |
p-value |
|
Возраст, лет / Age, years, (median (Q1-Q3) |
57 (45 – 66) |
64 (58 – 68) |
53 (40 – 66) |
0,091 |
|
Мужчины / Males, n (%) |
32 (74,4 %) |
24 (75 %) |
32 (71,1 %) |
0,932 |
|
Женщины / Females, n (%) |
11 (25,6 %) |
8 (25 %) |
13 (28,9 %) |
0,900 |
|
Курение / Smoking, n (%) |
26 (60,5 %) |
22 (68,8 %) |
23 (51,1 %) |
0,290 |
|
Заболевания СТ (ЗСТ), n (%) Connective tissue diseases (CTD), n (%) |
10 (23,3 %) |
4 (12,5 %) |
19 (42,2 %) |
0,012* р2-3=0,015 |
|
Синдром Марфана / Marfan syndrome, n (%) |
6 (14 %) |
4 (12,5 %) |
14 (31,1 %) |
0,071 |
|
ИБС в анамнезе / History of coronary artery disease, n (%) |
18 (41,9 %) |
15 (46,9 %) |
11 (24,4 %) |
0,094 |
|
ХСН ≥ 2 ФК по NYHA / CHF ≥ 2 NYHA class, n (%) |
7 (16,7 %) |
6 (18,8 %) |
3 (6,7 %) |
0,211 |
|
ГБ ≥ 2 ст. / Hypertension ≥ 2 stage, n (%) |
37 (86 %) |
29 (90,6 %) |
37 (82,2 %) |
0,607 |
|
НРС / Arrhythmias, n (%) |
10 (23,3 %) |
5 (15,6 %) |
13 (28,9 %) |
0,413 |
|
Сахарный диабет / Diabetes mellitus, n (%) |
2 (4,7 %) |
3 (9,4 %) |
2 (4,4 %) |
0,697 |
|
ЦВБ в анамнезе / History of cerebrovascular disease, n (%) |
11 (25,6 %) |
10 (31,3 %) |
12 (26,7 %) |
0,871 |
|
ОНМК в анамнезе / History of stroke, n (%) |
5 (11,6 %) |
5 (15,6 %) |
7 (15,6 %) |
0,845 |
|
ХБП ≥ 2 стадии (ст.) / CKD ≥ stage 2, n (%) |
14 (32,6 %) |
22 (68,8 %) |
20 (44,4 %) |
0,006* р2-1=0,006 |
|
Заболевания легких (ХОБЛ, бронхит) / Lung diseases (COPD, bronchitis), n (%) |
14 (32,6 %) |
12 (37,5 %) |
11 (24,4 %) |
0,490 |
|
Заболевания ЖКТ / Gastrointestinal diseases, n (%) |
6 (14 %) |
8 (25 %) |
9 (20 %) |
0,494 |
При сравнении предоперационных показателей по группам, выявлены статистически значимые различия по наличию ДСТ между группами (p=0,012). Внутригрупповой анализ показал различия между второй и третьей группами — 4 (12,5 %) и 19 (42,2 %) соответственно (р2-3=0,015). Большинство пациентов с наличием ХБП≥2 стадии выявлено в группе «Coselli» — 22 (68,8 %). При внутригрупповом анализе определены различия между первой и второй группами соответственно (р2-1=0,006). В дополнение, выявлена тенденция к наличию статистически значимых различий между группами по наличию синдрома Марфана по группам 6 (14 %), 4 (12,5 %) и 14 (31,1 %) соответственно (p=0,071). По другим показателям, группы статистически сопоставимы и значимые различия между группами отсутствуют (табл. 1).
Таблица 2
Характеристика поражения аорты и хирургические вмешательства в анамнезе
Table 2
Aortic injury characteristics and history of surgical interventions
|
Параметры Parameters |
«Crawford» «Crawford» n=43 (100 %) |
«Coselli» «Coselli» n=32 (100 %) |
«кнопки» «button» n=45 (100 %) |
p-value |
|
Характеристика аорты / Aortic characteristics |
||||
|
ТААА (Crawford — Safi) |
42 (97,7 %) |
30 (93,8 %) |
44 (97,8 %) |
0,676 |
|
I тип / type I |
5 (11,6 %) |
2 (6,3 %) |
7 (15,6 %) |
0,518 |
|
II тип / type II |
20 (46,5 %) |
14 (43,8 %) |
23 (51,1 %) |
0,719 |
|
III тип / type III |
4 (9,3 %) |
10 (31,3 %) |
10 (22,2 %) |
0,054 |
|
IV тип / type IV |
9 (20,9 %) |
2 (6,3 %) |
3 (6,7 %) |
0,083 |
|
V тип / type V |
1 (2,3 %) |
2 (6,3 %) |
1 (2,2 %) |
0,676 |
|
Shaggy aorta |
1 (2,3 %) |
9 (28,1 %) |
3 (6,7 %) |
0,001* р1-2=0,003 р2-3=0,016 |
|
Расслоение аорты (РА) Aortic dissection (AD) |
28 (65,1 %) |
13 (40,6 %) |
33 (73,3 %) |
0,012* р2-3=0,012 |
|
острое / acute |
0 |
1 (3,1 %) |
1 (2,2 %) |
|
|
подострое / subacute |
1 (2,3 %) |
1 (3,1 %) |
0 |
0,729 |
|
хроническое / chronic |
27 (62,8 %) |
11 (34,4 %) |
32 (71,1 %) |
0,527 0,004* р1-2=0,022 р2-3=0,004 |
|
Надрыв аорты / Aortic tear |
1 (2,3 %) |
1 (3,1 %) |
1 (2,2 %) |
1,000 |
|
Разрыв аорты / Aortic rupture |
1 (2,3 %) |
5 (15,6 %) |
1 (2,2 %) |
0,034* р1-2 =0,078 р2-3 = 0,076 |
|
Открытые операции на аорте в анамнезе / Previous open aortic surgeries |
||||
|
на грудной аорте / on thoracic aorta |
14 (32,6 %) |
10 (31,3 %) |
17 (37,8 %) |
0,808 |
|
на брюшной аорте / on abdominal aorta |
5 (11,6 %) |
2 (6,3 %) |
2 (4,4 %) |
0,470 |
|
Эндоваскулярные операции на аорте в анамнезе / Previous endovascular aortic procedures |
||||
|
TEVAR (Thoracic Endovascular Aortic Repair) |
7 (16,3 %) |
0 |
5 (11,1 %) |
0,037* р1-2 = 0,018 р2-3 = 0,072 |
|
EVAR (Endovascular Aneurysm Repair) |
1 (2,3 %) |
1 (3,1 %) |
3 (6,7 %) |
0,633 |
Исходя из классификации распространенности аневризмы ТАА по Crawford, имелась тенденция к статистически значимым различиям между группами по III типу аневризмы, в 10 (31,3 %) случаях во второй группе (p=0,054) (табл. 2).
Большинство пациентов с наличием «shaggy aorta» выявлено в группе Coselli — 9 (28,1 %), (p=0,001), статистически значимые различия между группами (р1-2=0,003 и р2-3=0,016). Также выявлены различия между группами по наличию расслоения аорты (p=0,012 и р2-3=0,012). Чаще расслоение встречалось в первой и третьей группах 28 (65,1 %) и 33 (73,3 %) соответственно. Стоит отметить, что в большинстве случаев оперированы пациенты с наличием хронического расслоения в первой и третьей группах 27 (62,8 %) и 32 (71,1 %) соответственно. Разрыв стенки аорты выявлен в 5 (15,6 %) случаях в группе Coselli, в первой и третьей группах по 1 случаю 2,3 % и 2,2 % соответственно, p=0,034. У 7 (16,3 %) пациентов в группе Crawford и у 5 (11,1 %) пациентов в группе метод «кнопки» в анамнезе эндопротезирование грудного отдела аорты (p=0,037) (табл. 2).
В таблице 3 представлены параметры, отражающие анатомоморфологические особенности аорты и РВВ у 116 пациентов по данным МСКТ-аортографии (табл. 3).
Таблица 3
МСКТ параметры аорты и РВВ у пациентов
MSCT parameters of the aorta and RVV in patients
Table 3
|
Параметры Parameters |
«Crawford» «Crawford» n=42 (100 %) med. (Q1-Q3) |
«Coselli» «Coselli» n=30 (100 %) med. (Q1-Q3) |
«кнопки» «button» n=44 (100 %) med. (Q1-Q3) |
p-value |
|
Особенности ТАА и отхождение её ветвей / Features of the TAA and the divergence of its branches |
||||
|
Девиация аорты / Aortic deviation: вправо / to the right влево / to the left |
13 (31 %) 11 (26,2 %) 2 (4,8 %) |
10 (33,3 %) 5 (16,7 %) 5 (16,7 %) |
8 (18,2 %) 5 (11,4 %) 3 (6,8 %) |
0,277 0,219 0,227 |
|
Диаметр аорты / Aortic diameter (max.), мм |
75 (60 – 90) |
75 (65 – 85) |
70 (60 – 80) |
0,327 |
|
Диаметр аорты на уровне ВВ, мм Aortic diameter at the level of the BB, mm |
43 (40 – 55) |
50 (45 – 65) |
46 (43 – 55) |
0,026* р 1-2 =0,007 |
|
Расстояние между ЧС и ВБА, мм Distance between the CT and the SMA, mm |
13 (10 – 15) |
20 (14,5 – 23) |
14,5 (10,5–18) |
0,001* р1-2=0,001 р2-3=0,001 |
|
Расстояние между ВБА и правой почечной артерии (пПА), мм Distance between the SMA and the right renal artery (rRA), mm |
15 (13 – 17) |
24,5 (20 – 29) |
22 (18 – 25) |
<0,001* р1-2<0,001 р1-3<0,001 |
|
Особенности висцеральных ветвей и почечных артерий / Features of the visceral branches and renal arteries |
||||
|
Вариантная анатомия ЧС и ВБА / Variant anatomy of the CT and SMA |
1 (2,3 %) |
1 (3,1 %) |
4 (8,9 %) |
0,443 |
|
Добавочная почечная артерия / Accessory renal artery: справа / right слева / left |
5 (11,6 %) 6 (14 %) |
4 (12,5 %) 1 (3,1 %) |
10 (22,2 %) 12 (26,7 %) |
0,356 0,016* р2-3=0,020 |
|
Поражения ЧС (стеноз, окклюзия, расслоение) / Lesions of the CT (stenosis, occlusion, dissection) |
10 (23,3 %) |
14 (43,8 %) |
12 (26,7 %) |
0,137 |
|
Поражения ВБА (стеноз, окклюзия, расслоение) / Lesions of the SMA (stenosis, occlusion, dissection) |
7 (16,3 %) |
7 (21,9 %) |
8 (17,8 %) |
0,834 |
|
Поражения правой ПА (стеноз, окклюзия, расслоение) / Lesions of the right RA (stenosis, occlusion, dissection) |
3 (7 %) |
10 (31,3 %) |
5 (11,1 %) |
0,014* р1-2=0,018 р2-3=0,042 |
|
Поражения левой ПА (стеноз, окклюзия, расслоение) / Lesions of the left RA (stenosis, occlusion, dissection) |
6 (14 %) |
8 (25 %) |
2 (4,5 %) |
0,031* р2-3=0,028 |
Сравнительная оценка параметров: девиация аорты, максимальный диаметр аорты, вариантная анатомия ЧС и ВБА между группами не показала статистически значимых различий. Выявлены статистически значимые различия между группами по величине максимального диаметра на уровне висцеральных ветвей (p=0,026). Внутригрупповой анализ показал различия между первой и третьей группой 43 (40–55) мм и 50 (45–65) мм, соответственно, (p=0,007) (табл. 3). Группы значимо различались по величине расстояния между ЧС и ВБА, p=0,001. В группе «Coselli» выявлено большее расстояние между устьями ЧС и ВБА, чем в других группах (р1-2=0,001 и р3-2=0,001) (рис. 3А). Кроме того, группы значимо различались по величине расстояния между ВБА и правой ПА (p <0,001). В группе «Coselli» выявлено большее расстояние между устьями ВБА и правой ПА, чем в других группах – 24,5 мм (р1-3 <0,001 и р1-2<0,001) (рис. 4А). Нами проведено изучение вариантной анатомии РВВ. В результате чего, наличие левой добавочной почечной артерии выявлено преимущественно в третьей группе
12 (26,7 %) случаев (p=0,016). При сравнительной характеристике частоты поражения почечных артерий установлено, что в группе «Coselli» – окклюзия, стеноз, расслоение правой или левой почечных артерий встречались статистически значимо чаще, чем в других группах (p=0,014 и p=0,031) (табл. 3).
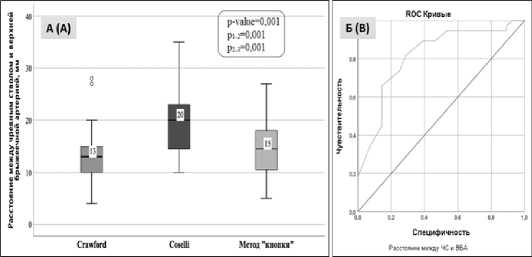
Рис. 3. Статистический анализ по группам
А — Расстояние между чревным стволом (ЧС) и верхней брыжеечной артерией (ВБА). Б — ROC – анализ, ROC — Кривые, чувствительность, специфичность Fig. 3. Statistical analysis by groups
A — Distance between the celiac trunk (CT) and the superior mesenteric artery (SMA). B — ROC analysis, ROC — curves, sensitivity, specificity
Площадь под ROC-кривой, соответствующая взаимосвязи длины расстояния между ЧС и ВБА, составила 0,816±0,054 с 95 % ДИ: 0,709–0,922. Полученная модель была статистически значимой (p<0,001). Проведенный анализ показал, что при расстоянии ≥ 15,5 мм выполнялась имплантация РВВ по методу «Coselli», чувствительность и специфичность метода составили 81,6 % и 71,4 % соответственно (рис. 4Б).
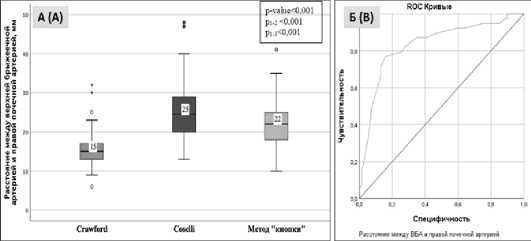
Рис. 4. Статистический анализ по группам
А — Расстояние между верхней брыжеечной артерией (ВБА) и правой почечной артерией. Б — ROC – анализ, ROC — Кривые, чувствительность, специфичность Fig. 4. Statistical analysis by groups
A — Distance between the superior mesenteric artery (SMA) and the right renal artery. B — ROC analysis, ROC — curves, sensitivity, specificity
А также проведенный ROC-кривой анализ показателя расстояние между ВБА и правой ПА продемонстрировал статистическую значимость р<0,001 и составил 0,834±0,043 с 95 % ДИ: 0,749–0,918. При расстоянии ≥ 17,5 мм предпочте- ние отдавалось методу имплантации РВВ по методу «Coselli» или методу «кнопки». Результаты анализа показали 79,5 % чувствительности и 74,9 % специфичности метода, что является приемлемым (рис. 4Б).
Обсуждение
Предоперационная оценка и подготовка пациента имеют решающее значение для оптимизации послеоперационных результатов при реконструкции ТАА.
По данным авторов, вариантная анатомия отхождения висцеральных ветвей (ВВ) встречается до 29 % [11–13]. Встречаемость добавочной почечной артерии по данным различных источников литературы колеблется от 12 % до 40 % [14–16]. Наши данные показали, что встречаемость вариантной анатомии ВВ (ЧС и ВБА) составила – 5 % (n=6), а добавочная почечная артерия была выявлена в 28,3 % (n=34) случаях.
Авторы описывают, что по их результатам расстояние между РВВ колеблется от 10 до 31 мм при нормальном диаметре аорты [5, 6]. При аневризме аорты на уровне ВВ и почечных артерий расстояние устьев может значимо отличаться, поскольку при аневризме данного участка происходит отдаление устьев РВВ относительно друг от друга. Наши результаты показали следующее (мм, медиана (Q1–Q3): диаметр аорты на уровне ВВ и почечных артерий – 47 мм (40–55), расстояние между устьями ЧС и ВБА – 14 мм (11–18,75), а расстояние между ВБА и правой почечной артерии – 20 мм (15–25). Эти же показатели являлись значимыми при внутригрупповом анализе (р<0,05).
Как сказано выше, на выбор метода имплантации РВВ влияет расстояние и отхождение ветвей, вариантная анатомия РВВ, а также степень поражения последних (протяженная окклюзия, значимые стенозы, расслоение). Помимо этого, генетические заболевания, такие как: синдром Марфана, Элерса-Данлоса и Лойса-Дитца или другие заболевание соединительной ткани (ЗСТ) усложняют выбор метода имплантации РВВ [7, 17, 18, 19].
У пациентов с ЗСТ остаточная стенка аорты (площадка с висцеральными и межреберными артериями) имеет высокий риск дегенерации, что может привести к дальнейшей дилатации и возможным повторным вмешательствам. В исследованиях сообщалось о частоте аневризм площадки с РВВ от 3 % и до 18 % [17, 18]. С целью уменьшения площади остаточной стенки аорты, авторы предлагают ограничить размер анастомоза прибегнув к агрессивной резекции измененной аорты, либо применять методику раздельного протезирования висцеральных ветвей [4, 7, 17, 18, 19].
В 2023 году Tanaka A., Smith H.N., Safi H.J., Estrera A.L., опубликовали результаты открытых методов лечения ТАА. По их мнению, если устья находятся на расстоянии менее 2 см друг от друга, можно имплантировать РВВ на единой площадке или левую почечную отдельно. При синдроме Марфана или других ЗСТ у пациентов моложе 60 лет или при расстоянии устьев более 3 см применять готовый многобраншевый протез с протезированием каждого сосуда по-отдельности [7].
Известно, что при патологии «shaggy aorta» («лохматая аорта») риски операционной смертности, травма спинного мозга, почечная недостаточность и риски эмболии высокие как в открытой, так и в эндоваскулярной хирургии. Распространение атероматоза на РВВ и периоперационная эмболия при данной патологии встречается до 30 %, в связи с чем осложнения в послеоперационном периоде увеличиваются >5 раз [8, 9]. С целью предотвращения эмболических осложнений и максимальной резекции измененной стенки аорты и её ветвей при патологии «shaggy aorta», на наш взгляд, предпочтительнее выполнить протезирование по методике «Coselli» или раздельную имплантацию РВВ по методике «кнопки». По нашим данным «shaggy aorta» встречалась у 13 (11,2 %) пациентов, преимущественно в группе II – 9 (28,1 %) (p=0,001).
Пациенты с аневризмой или расслоением ТАА часто имеют поражения РВВ (расслоение ветвей, протяженные или устьевые окклюзии и стенозы), что существенно увеличивает риски возникновение осложнений со стороны внутренних органов и почек. При наличии такого сочетания зачастую требуются дополнительные вмешательства (эндартерэктомия, иссечение интимы, стентирования и резекция проксимального отдела ветвей) для улучшения проходимости РВВ. По данным литературы дополнительные вмешательства на РВВ при ТАА выполняются до 60 % [3].
Мы считаем, что при протяженных стенозах или окклюзии РВВ целесообразно использовать методику «Coselli». Этот метод дает нам возможность проводить протяженную резекцию артерий и исключает натяжение РВВ, за счет интраоперационной коррекции длины каждой бранши по отдельности. Кроме того, при устьевом стенозе или окклюзии мы рекомендуем дополнительно выполнять эндартерэктомию из РВВ с целью восстановления адекватного кровотока по последним. Данную технику желательно использовать при раздельной имплантации РВВ по методу «кнопки» или «Coselli», так как при имплантации РВВ на единой площадке (метод «Crawford») выполнение эндартерэктомии из одной артерии технически сложнее и может привести к нарушению целостности стенки других ветвей.
Исходя из опыта и полученных данных ретроспективного анализа мы считаем, что предоперационные данные и параметры МСКТ-аортографии играют важную роль при выборе техники имплантации РВВ во время реконструкции ТАА. Однако можно сделать следующие выводы: 1) Методику «Crawford» следует выбирать у пожилых пациентов, с близким расположением устьев РВВ по отношению друг к другу (p<0,001), при отсутствии ДСТ и дегенеративном поражении РВВ. 2) Использование методики «Coselli» целесообразно у пациентов с большим диаметром аневризмы на уровне РВВ, поскольку этот параметр коррелирует с рено-висцеральной удаленностью ветвей относительно друг от друга (p<0,001). Метод имеет преимущество у больных с «shaggy aorta» и морфологически измененными РВВ (стеноз, окклюзия, расслоение) — р=0,001 и р<0,050, соответственно. 3) Имплантацию РВВ по методу «кнопки» целесообразно применять при удаленном рено-вис-церальном расположении (р=0,001), у больных с ДСТ (р=0,012) и при вариантной анатомии РВВ (р<0,050).
Также, мы считаем, что использование методик «Coselli» и «кнопки» предпочтительнее у молодых пациентов, с ДСТ, при нарушениях проходимости РВВ, которые требуют дополнительных вмешательств на последних.
Заключение
Оценка предоперационных данных и МСКТ параметров является основой для выбора метода имплантации РВВ, при реконструкции ТАА при ее различных патологиях.
Несмотря на то, что окончательный выбор метода реимплантации РВВ при реконструкции ТАА принимается во время операции и зависит от опыта хирурга, предоперационное планирование хирургической тактики и стратегии в каждом конкретном случае позволяет улучшить результаты и значимо снизить развитие осложнений, ассоциированных с РВВ, у столь тяжелой категории больных.
Список литературы Предоперационное планирование выбора метода реимплантации рено-висцеральных ветвей при реконструкциях торакоабдоминального отдела аорты
- Etheredge S.N., Yee J., Smith J.V., Schonberger S., Goldman M.J. Successful resection of a large aneurysm of the upper abdominal aorta and replacement with homograft. Surgery, 1955, № 38, рр. 1071-1081. https://doi.org/10.5555/uri:pii:0039606055901446
- Crawford E.S., Snyder D.M., Cho G.C., Roehm J.O. Jr. Progress in treatment of thoracoabdominal and abdominal aortic aneurysms involving celiac, superior mesenteric, and renal arteries. Ann Surgery, 1978, № 3, рр. 404-422. https://doi.org/10.1097/00000658-197809000-00016
- Coselli J.S., LeMaire S.A., Preventza O., de la Cruz K.I., Cooley D.A., Price M.D., Stolz A.P., Green S.Y., Arredondo C.N., Rosengart T.K. Outcomes of 3309 thoracoabdominal aortic aneurysm repairs. Journal Thorac Cardiovasc Surgery, 2016, May; № 151(5), рр. 1323-1337. https://doi.org/10.1016/j.jtcvs.2015.12.050
- Dardik A., Perler B.A., Roseborough G.S., Williams G.M. Aneurysmal expansion of the visceral patch after thoracoabdominal aortic replacement: an argument for limiting patch size?. Journal Vascular Surgery, 2001, Sep; № 34(3), рр. 405-409. https://doi.org/10.1067/mva.2001.117149
- Гайворонский И.В., Быков П.М., Гайворонская М.Г., Синенченко Г.И. Сравнительная характеристика морфометрических параметров брюшной аорты и ее непарных ветвей у женщин с различным типом телосложения. Курский научно-практический вестник «Человек и его здоровье», 2019. № 1. С. 93-102. https://doi.org/10.21626/vestnik/2019-1/11
- Ekingen A., Hatipoğlu E.S., Hamidi C. Distance measurements and origin levels of the coeliac trunk, superior mesenteric artery, and inferior mesenteric artery by multiple-detector computed tomography angiography. Anatomical Science International, 2021, Mar; № 96(2), рр. 332. https://doi.org/10.1007/s12565-020-00591-7
- Tanaka A., Smith H.N., Safi H.J., Estrera A.L. Open Treatments for Thoracoabdominal Aortic Aneurysm Repair. Methodist Debakey Cardiovasc Journal, 2023, Mar 7; № 19(2), рр. 49-58. https://doi.org/10.14797/mdcvj.1178
- Rinaldi E., Loschi D., Santoro A., Bilman V., De Freitas D.M., Campesi C., Tinaglia S., Chiesa R., Melissano G. A comparison of thoracoabdominal aortic aneurysms open repair in patients with or without «shaggy aorta». Journal Vascular Surgery, 2023, Feb; № 77(2), рр. 347-356. https://doi.org/10.1016/j.jvs.2022.10.006
- Yokawa K., Ikeno Y., Henmi S., Yamanaka K., Okada K., Okita Y. Impact of shaggy aorta on outcomes of open thoracoabdominal aortic aneurysm repair. Journal Thorac Cardiovasc Surgery, 2020, Oct; № 160(4), рр. 889-897. https://doi.org/10.1016/j.jtcvs.2019.07.112
- Белов Ю.В., Генс А.П., Степаненко А.Б., Зверхановская Т.Н., Алексеев И.А. Протезирование торакоабдоминального отдела аорты с реимплантацией висцеральных ветвей в сторону протеза на отдельных платформах. Ангиология и сосудистая хирургия, 2007. Т.13. № 1. С. 139-142.
- Balcerzak A., Tubbs R.S., Waśniewska-Włodarczyk A., Rapacka E., Olewnik Ł. Classification of the superior mesenteric artery. Clinical Anatomy, 2022, vol. 35, № 4, рр. 501-511. https://doi.org/10.1002/ca.23841
- Michels N. A. Blood supply and anatomy of the upper abdominal organs, with a descriptive atlas. British Journal of Surgery, 1956, Marc; vol. 43, № 181, pр. 560. https://doi.org/10.1002/bjs.18004318131
- Wang Y., Cheng C., Wang L., Li R., Chen J.H., Gong S.G. Anatomical variations in the origins of the celiac axis and the superior mesenteric artery: MDCT angiographic findings and their probable embryological mechanisms. European radiology, 2014, vol. 24, № 8, рр. 1777-1784. https://doi.org/10.1007/s00330-014-3215-9
- Колсанов А.В., Назарян А.К., Воронин А.С., Гелашвили О.А. Изучение вариантной анатомии почечных артерий с помощью КТангиографии. Журнал анатомии и гистопатологии, 2020. № 9(1). С. 43-48. https://doi.org/10.18499/2225-7357-2020-9-1-43-48
- Farghadani M., Momeni M., Hekmatnia A., Momeni F., Baradaran Mahdavi M.M. Anatomical variation of celiac axis, superior mesenteric artery, and hepatic artery: Evaluation with multidetector computed tomography angiography. International Journal of Research in Medical Sciences, 2016, Dec 26; № 21, рр. 129. https://doi.org/10.4103/1735-1995.196611
- Majos M., Stefańczyk L., Szemraj-Rogucka Z., Elgalal M., De Caro R., Macchi V., Polguj M. Does the type of renal artery anatomic variant determine the diameter of the main vessel supplying a kidney? A study based on CT data with a particular focus on the presence of multiple renal arteries. Surgery Radiol Anatomy, 2018, Apr; № 40(4), рр. 381-388. https://doi.org/10.1007/s00276-017-1930-z
- Dandekar U. K., Dandekar K. N. Variant anatomy of the celiac trunk - review of literature with a case report. International Journal of Biomedical and Advance Research, 2014, vol. 5, № 10, рр. 480. https://doi.org/10.7439/ijbar.v5i10.907
- Glebova N.O., Cameron D.E., Black J.H. 3rd. Treatment of thoracoabdominal aortic disease in patients with connective tissue disorders. Journal Vascular Surgery, 2018, Oct; № 68(4), рр. 1257-1267. https://doi.org/10.1016/j.jvs.2018.06.199
- Белов Ю.В., Чарчян Э.Р., Степаненко А.Б., Скворцов А.А., Хачатрян З.Р., Комаров Р.Н., Винокуров И.А. Хирургическое лечение больных с торакоабдоминальными аневризмами аорты. Хирургия. Журнал им. Н.И. Пирогова, 2015. № 12. С. 33-38. https://doi.org/10.17116/hirurgia20151233-38


