Предоперационный уровень половых гормонов как предиктор морфологической характеристики злокачественных новообразований яичка
Автор: Холбобозода Р.Ф., Костин А.А., Воробьев Н.В., Толкачев А.О., Крашенинников А.А., Тараки И.А., Каприн А.Д.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 1 т.23, 2024 года.
Бесплатный доступ
Введение. Злокачественные новообразования яичка (ЗНО) встречаются преимущественно у мужчин репродуктивного возраста. В ряде исследований отмечена зависимость уровня половых гормонов от ЗНО яичка и сывороточных онкомаркеров. Однако в настоящее время достоверная взаимосвязь уровня гормонов до орхифуникулэктомии (ОФЭ) с клинико-патоморфологической характеристикой опухоли недостаточно изучена. Цель исследования - анализ взаимосвязи уровня половых гормонов с гистологической характеристикой опухоли у пациентов с ЗНО яичка и разработка прогностических моделей. Материал и методы. В проспективное одноцентровое исследование включено 66 пациентов с ЗНО яичка. Локализованный, местнораспространенный и метастатический опухолевый процесс был у 55 (83,3 %), 9 (13,6 %) и 2 (3,0 %) больных соответственно. Выполнена предоперационная оценка следующих гормонов: общий и свободный тестостерон (T), эстрадиол (E2), гонадотропные гормоны (ЛГ, ФСГ, Пролактин) и бета-ХГЧ. В зависимости от гистологического типа опухоли пациенты были разделены на 2 группы: типичная семинома (n=31) и несеминомые опухоли (n=35). Оценили ряд показателей: размер опухоли, лимфоваскулярную инвазию и врастание опухоли в сеть яичка.
Злокачественные новообразования яичек, типичная семинома, несеминомные опухоли, половые гормоны, гипоталамо-гипофизарно-гонадная ось, бета-хгч
Короткий адрес: https://sciup.org/140303748
IDR: 140303748 | УДК: 616.681-006.04:612.616.31 | DOI: 10.21294/1814-4861-2024-23-1-63-74
Текст научной статьи Предоперационный уровень половых гормонов как предиктор морфологической характеристики злокачественных новообразований яичка
Злокачественные новообразования яичка (ЗНО) наиболее часто встречаются у мужчин репродуктивного возраста в периоде с 15 до 44 лет [1, 2]. Начало этого периода совпадает с началом полового созревания, что указывает на возможную связь между гормональными факторами и опухолевой трансформацией половых клеток.
M. Bandak et al. пришли к выводу, что комбинированные методы лечения ЗНО яичка и высокий уровень сывороточных онкомаркеров (АФП, Бета-ХГЧ, ЛДГ) влияют на уровень половых гормонов
[3–5]. Другие исследователи считают, что патологические изменения в яичке (тестикулярный микролитиаз и атрофия), которые определяются до лечения, также влияют на уровень гормонов [1, 6]. В настоящее время имеется лишь ограниченная информация об изменениях уровня половых гормонов перед орхифункулэктомией (ОФЭ) [7]. В частности, о взаимосвязях между уровнем мужских половых гормонов и клинико-патоморфологической характеристикой опухоли. Таким образом, требуются дополнительные исследования клинической значимости уровня половых гормонов перед ОФЭ как предиктора морфологической характеристики злокачественных новообразований яичка
Цель исследования – анализ взаимосвязи уровня гормонов с клинической стадией и гистологической характеристикой опухоли у пациентов с ЗНО яичка и разработка прогностических моделей.
Материал и методы
В исследование включено 66 больных ЗНО яичка, получивших хирургическое лечение в период с декабря 2021 по май 2023 г. на базе МНИОИ им. П.А. Герцена – филиала НМИЦ радиологии в отделении урологии. Диагноз устанавливался на основании результатов УЗИ и/или МРТ органов малого таза и уровня онкомаркеров (альфа-фетопротеина (АФП), бета-хорионического гонадотропина (бета-ХГЧ), лактатдегидрогеназы (ЛДГ). Для оценки распространенности опухолевого процесса пациентам выполнялась КТ органов грудной клетки, брюшной полости и забрюшинного пространства с внутривенным контрастированием.
Забор крови для определения уровня гонадотропных (ЛГ, ФСГ, пролактин) и стероидных гормонов (общий и свободный тестостерон, эстрадиол) производился до хирургического вмешательства, натощак, в промежутке с 8.00 до 10.00. Анализ уровня гормонов в сыворотке выполнен на оборудовании Beckman Coulter UniCel DxI 800, Immulite 2000XPi.
В качестве возможных факторов, влияющих на гормональный статус мужчин с ЗНО яичка, оценивали следующие параметры: распространенность опухолевого процесса (локализованный, метастатический), размер опухолевого образования, гистологическую характеристику опухоли (типичная семинома; несеминомные опухоли; наличие/ отсутствие лимфоваскулярной инвазии; врастание в сеть яичка) и уровень бета-ХГЧ. При этом объем яичек определяли по результатам МРТ/УЗИ, а размер опухолевого образования – по данным планового патоморфологического исследования послеоперационного материала.
Учитывая гистотип опухоли, пациенты были разделены на две группы: 1 группа – типичная семинома (n=31); 2 группа – несеминомые опухоли (n=35) (табл. 1). У пациентов с несеминомными опухолями идентифицированы следующие гисто- логические подтипы: тератомы (n=11), эмбриональные карциномы (n=17) и опухоли желточного мешка (n=7). Медиана возраста больных в общей группе составила 33 года (Q1–Q3: 27–40; семинома – 35 лет; несеминома – 30 лет), преобладали мужчины молодого возраста. Группы были сопоставимы по возрасту, индексу массы тела, размеру опухоли, объему здорового и пораженного яичка (p>0,05). Средний размер первичной опухоли при семиноме был несколько меньше, чем при несеми-номе, но значимых различий не отмечено.
Статистический анализ проводился с использованием программы IBM SPSS v.27 и StatTech v. 3.1.10 (разработчик ООО «Статтех», Россия). Количественные показатели, имеющие нормальное распределение, описывались с помощью средних арифметических величин (M) и стандартных отклонений (SD), границ 95 % доверительного интервала (95 % ДИ). В случае отсутствия нормального распределения количественные данные описывались с помощью медианы (Me) и нижнего и верхнего квартилей (Q1–Q3). Категориальные данные описывались с указанием абсолютных значений и процентных долей. Сравнение двух групп по количественному показателю, распределение которого отличалось от нормального, выполнялось с помощью U-критерия Манна–Уитни. Сравнение процентных долей при анализе четырехпольных таблиц сопряженности выполнялось с помощью точного критерия Фишера. Сравнение процентных долей при анализе многопольных таблиц сопряженности выполнялось с помощью критерия χ2 Пирсона. Направление и теснота корреляционной связи между двумя количественными показателями оценивались с помощью коэффициента ранговой корреляции Спирмена (при распределении показателей, отличном от нормального). Статистически значимыми различия считали при уровне p ≤0,05.
Прогностическая модель, характеризующая зависимость количественной переменной от факторов, разрабатывалась с помощью метода линейной регрессии. Построение прогностической модели вероятности определенного исхода выполнялось при помощи метода логистической регрессии. Для оценки доли вариации зависимой переменной использовали коэффициент детерминации Найджелкерка.
Результаты
Локализованный, местнораспространенный и метастатический опухолевый процесс был выявлен у 55 (83,3 %), 9 (13,6 %) и 2 (3,0 %) больных соответственно. Между группами значимых различий в зависимости от распространенности опухолевого процесса не получено (p>0,05) (табл. 2).
Всем больным (n=66) выполнена ОФЭ: правосторонняя – в 36 (54,5 %), левосторонняя – в 25 (37,9 %), двусторонняя – в 5 (7,6 %) случаях. При
Таблица 1/Table 1
Сравнительная характеристика пациентов с учетом гистологического варианта опухоли Comparative characteristics of patients taking into account the histological type of the tumor
|
Показатели/Parameters |
Гистологическое строение/Histological structure |
р |
|||
|
Семинома/ Seminoma (n=31) |
Несеминома/ Nonseminoma (n=35) |
||||
|
Me |
Q₁–Q₃ |
Me |
Q₁–Q₃ |
||
|
Возраст, Me (лет)/Age, Me (years) |
35 |
28–42 |
30 |
25–39 |
0,094 |
|
Индекс масса тела, M ± SD (кг/м2)/ Body mass index, M ± SD (kg/m2) |
25,38 |
24,12–28,09 |
24,90 |
22,22–26,59 |
0,272 |
|
Размер опухоли, M ± SD (см)/ Tumor size, M ± SD (cm) |
3,8 |
2,6–5,8 |
5,3 |
3,0–6,2 |
0,134 |
|
Объем пораженного яичка, Me (см3)/ Volume of the affected testicle, Me (сm3) |
31,8 |
20,2–58,8 |
56,0 |
25,0–131,0 |
0,160 |
|
Объем здорового яичка, Me (см3)/ Healthy testicular volume, Me (сm3) |
17,8 |
12,3–24,2 |
13,0 |
11,4–18,0 |
0,215 |
Примечание: таблица составлена авторами.
Note: created by the authors.
Таблица 2/Table 2
Распространенность опухолевого процесса по классификации TNM в зависимости от гистологического строения
Extent of the tumor according to the TNM classification depending on the histological structure
|
Показатели/ Indicators |
Категории/ Categories |
Гистологическое строение/Histological structure |
p |
|
|
Семинома/ Seminoma |
Несеминома/ Nonseminoma |
|||
|
T1 |
15 (48,4 %) |
14 (40,0 %) |
||
|
T |
T2 |
12 (38,7 %) |
18 (51,4 %) |
0,566 |
|
T3 |
4 (12,9 %) |
3 (8,6 %) |
||
|
N0 |
25 (80,6 %) |
30 (85,7 %) |
||
|
N |
N1 |
0 (0,0 %) |
1 (2,9 %) |
0,055 |
|
N2 |
1 (3,2 %) |
4 (11,4 %) |
||
|
N3 |
5 (16,1 %) |
0 (0,0 %) |
||
|
M |
M0 |
30 (96,8 %) |
34 (97,1 %) |
1,000 |
|
M1 |
1 (3,2 %) |
1 (2,9 %) |
||
|
0 |
18 (58,1 %) |
17 (48,6 %) |
||
|
S |
1 |
10 (32,3 %) |
12 (34,3 %) |
0,615 |
|
2 |
3 (9,7 %) |
6 (17,1 %) |
||
Примечание: таблица составлена авторами.
Note: created by the authors.
плановом гистологическом исследовании операционного материала наличие лимфоваскулярной инвазии и врастания в сеть яичка выявлено у 37 (56,1 %) и у 45 (68,2 %) больных. Средний размер опухолевого образования в группе типичной семиномы составил 3,8 см (Q1–Q2: 2,6–5,8 см), несеминомы – 5,3 см (Q1–Q2: 3–6,2 см), без существенных различий (p>0,05).
При сравнении уровня половых и гонадотропных гормонов в зависимости от распространенности опухолевого процесса (по классификации TNM) между группами нам не удалось установить значимых различий (p>0,05). Однако при анализе уровня бета-ХГЧ в зависимости от pT стадии после ОФЭ выявлены значимые различия (p=0,018) (рис. 1). Апостериорные сравнения показали, что уровень бета-ХГЧ при распространении опухоли на семенной канатик (pT3) был значимо выше, чем при опухолях, ограниченных яичком (pT1-pT2) (p<0,03).
Анализ уровня гормонов в зависимости от гистологического подтипа (типичная семинома, несеминомые опухоли)
При анализе половых и гонадотропных гормонов, а также бета-ХГЧ в зависимости от гистоло-
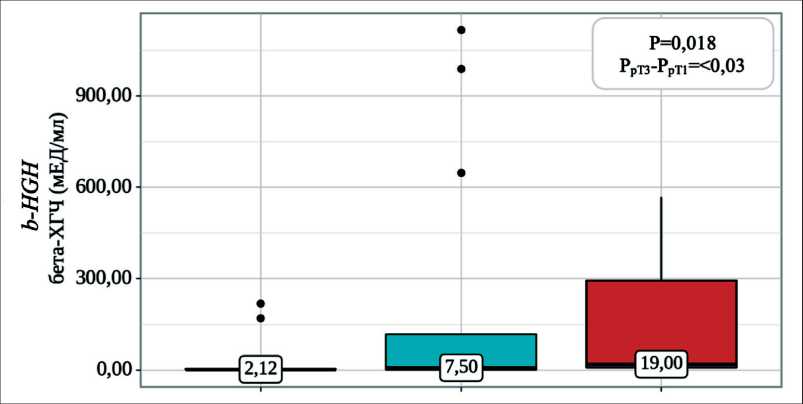
Рис. 1. Анализ уровня бета-ХГЧ в зависимости от pT стадии в общей когорте пациентов. Примечание: рисунок выполнен авторами Fig. 1. Analysis of beta-hCG levels depending on the pT stage in the overall cohort of patients. Note: created by the authors
Таблица 3/Table 3
Анализ уровня гормонов до операции в зависимости от гистологического строения Analysis of hormone levels before surgery depending on the histological structure
|
Гистологическое строение/Histological structure |
|
Семинома/ Несеминома/ |
|
Показатели/Indicators р |
|
Seminoma (n=31) Nonseminoma (n=35) |
|
Me Q₁–Q₃ Me Q₁–Q₃ |
|
Т общий (нмоль/л)/Total testosterone |
12,70 |
9,74–14,93 |
17,70 |
13,36–27,18 |
<0,001* |
|
Т свободный (пг/мл)/Free testosterone |
7,88 |
6,48–11,09 |
14,40 |
11,32–20,46 |
<0,001* |
|
Эстрадиол (пмоль/л)/Estradiol |
82,39 |
73,00–151,37 |
115,00 |
93,60–336,18 |
0,010* |
|
ЛГ (мМЕ/мл)/LH |
2,74 |
1,27–5,54 |
0,42 |
0,23–2,67 |
0,007* |
|
ФСГ (мМЕ/мл)/FSH |
5,25 |
3,00–8,44 |
1,29 |
0,30–3,98 |
<0,001* |
|
Пролактин (мЕд/л)/Prolactin |
165,54 |
124,26–234,33 |
254,00 |
169,00–435,66 |
0,002* |
|
бета-ХГЧ (мЕД/мл)/b-HCG |
3,40 |
1,20–6,50 |
5,46 |
2,00–193,87 |
0,035* |
Список литературы Предоперационный уровень половых гормонов как предиктор морфологической характеристики злокачественных новообразований яичка
- Sung H., Ferlay J., Siegel R.L., Laversanne M., Soerjomataram I., Jemal A., Bray F. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin. 2021; 71(3): 209-49. https://doi.org/10.3322/caac.21660.
- Zlokachestvennye novoobrazovaniya v Rossii v 2021 godu (zabolevaemost' i smertnost'). Pod red. A.D. Kaprina, V.V. Starinskogo, A.O. Shakhzadovoi. M., 2022. 252 s.
- Bandak M., Aksglaede L., Juul A., Rørth M., Daugaard G. The pituitary-Leydig cell axis before and after orchiectomy in patients with stage I testicular cancer. Eur J Cancer. 2011; 47(17): 2585-91. https://doi.org/10.1016/j.ejca.2011.05.026.
- Bandak M., Jørgensen N., Juul A., Lauritsen J., Kier M.G.G., Mortensen M.S., Daugaard G. Longitudinal Changes in Serum Levels of Testosterone and Luteinizing Hormone in Testicular Cancer Patients after Orchiectomy Alone or Bleomycin, Etoposide, and Cisplatin. Eur Urol Focus. 2018; 4(4): 591-8. https://doi.org/10.1016/j.euf.2016.11.018.
- Bandak M., Lauritsen J., Johansen C., Kreiberg M., Skøtt J.W., Agerbaek M., Holm N.V., Daugaard G. Sexual Function in a Nationwide Cohort of 2,260 Survivors of Testicular Cancer after 17 Years of Followup. J Urol. 2018; 200(4): 794-800. https://doi.org/10.1016/j.juro.2018.04.077.
- Heinzelbecker J., Katzmarzik M., Weiss C., Trojan L., Michel M.S., Haecker A. Changes of stage, predictive factors and adjuvant treatment modalities in seminomatous testicular cancer from 1987 to 2007 and their impact on the status of metastasis, recurrence-free and overall survival: a single-center analysis. Urol Int. 2011; 87(3): 282-7. https://doi.org/10.1159/000329768.
- Wiechno P.J., Kowalska M., Kucharz J., Sadowska M., Michalski W., Poniatowska G., Jońska-Gmyrek J., Rzymkowska J., Nietupski K., Demkow T. Dynamics of hormonal disorders following unilateral orchiectomy for a testicular tumor. Med Oncol. 2017; 34(5): 84. https://doi.org/10.1007/s12032-017-0943-0.
- Bandak M., Jørgensen N., Juul A., Vogelius I.R., Lauritsen J., Kier M.G., Mortensen M.S., Glovinski P., Daugaard G. Testosterone deficiency in testicular cancer survivors - a systematic review and metaanalysis. Andrology. 2016; 4(3): 382-8. https://doi.org/10.1111/andr.12177.
- Dieckmann K.P., Simonsen-Richter H., Kulejewski M., Anheuser P., Zecha H., Isbarn H., Pichlmeier U. Serum Tumour Markers in Testicular Germ Cell Tumours: Frequencies of Elevated Levels and Extents of Marker Elevation Are Significantly Associated with Clinical Parameters and with Response to Treatment. Biomed Res Int. 2019. https://doi.org/10.1155/2019/5030349.
- Pineault K.G., Cheaib J.G., Herati A.S., Pierorazio P.M. Associations of preorchiectomy hormone levels to testicular germ cell tumor pathology, clinical stage, and size. Asian J Androl. 2021; 23(2): 224-6. https://doi.org/10.4103/aja.aja_27_20.
- Boime I., Ben-Menahem D. Glycoprotein hormone structure-function and analog design. Recent Prog Horm Res. 1999; 54: 271-88; discussion 288-9.
- Duparc C., Boissiere-Veverka G., Lefebvre H., Laquerriere A., Vuillermet P., Landreat A., Ivell R., DeRoux N., Kuhn J.M. An oestrogen-producing seminoma responsible for gynaecomastia. Horm Metab Res. 2003; 35(5): 324-9. https://doi.org/10.1055/s-2003-41310.
- de Bruin D., de Jong I.J., Arts E.G., Nuver J., Dullaart R.P., Sluiter W.J., Hoekstra H.J., Sleijfer D.T., Gietema J.A. Semen quality in men with disseminated testicular cancer: relation with human chorionic gonadotropin beta-subunit and pituitary gonadal hormones. Fertil Steril. 2009; 91(6): 2481-6. https://doi.org/10.1016/j.fertnstert.2008.03.016.
- Madersbacher S., Gerth R., Mann K., Dirnhofer S., Berger P. Gonadotrophin secretion patterns in testicular cancer patients with greatly increased human chorionic gonadotrophin serum concentrations. J Endocrinol. 1998; 159(3): 451-8. https://doi.org/10.1677/joe.0.1590451.
- Watanabe M., Fuji K., Suzuki K., Kitamura T., Okumura D., Kasahara T., Igarashi T., Masuyama T., Hiramori T., Higaki M., Yoshida H. [Endocrine profiles and gonadotropin response to Gn-RH of men with testicular cancer]. Nihon Hinyokika Gakkai Zasshi. 2003; 94(5): 543-50. Japanese. https://doi.org/10.5980/jpnjurol1989.94.543.


