Предварительная оценка эффективности комбинированного лечения с включением HIFU-терапии у больных раком поджелудочной железы
Автор: Болотина Лариса Владимировна, Москвичева Людмила Ивановна, Корниецкая Анна Леонидовна, Сидоров Дмитрий Владимирович, Гришин Николай Александрович, Ложкин Михаил Владимирович, Каприн Андрей Дмитриевич
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 3 т.20, 2021 года.
Бесплатный доступ
Целью исследования является предварительный анализ безопасности и эффективности применения HiFU-терапии на низкоэнергетическом аппарате HiFU-2001 (Shenzhen Huikang Medical Apparatus Co., Ltd) на фоне специфической лекарственной терапии у больных раком поджелудочной железы, не подлежащих хирургическому или химиолучевому лечению. Материал и методы. В исследование включено 24 больных раком поджелудочной железы, получавших лечение на базе МНИОИ им. П.А. Герцена в период с 2016 по 2019 г., из них 17 (71 %) женщин и 7 (29 %) мужчин. Доля пациентов, входящих в возрастные группы пожилого и старческого возраста, составила 79 %. Рак поджелудочной железы iiA стадии диагностирован у 3 (12,5 %) пациентов, iiВ стадии - у 5 (21 %), iii стадии - у 9 (37,5 %), iV стадии - у 7 (29 %) больных. Всем пациентам проводилась комбинированная терапия, включающая системную химиотерапию и HiFU-терапию. Результаты. Наиболее частыми нежелательными явлениями лечения являлись ожоги кожи (n=6), в том числе iii степени - у 2 (8,3 %) пациентов. Локальный склероз подкожной жировой клетчатки был отмечен у 4 (17 %); развитие бессимптомной псевдокисты поджелудочной железы в области HiFU воздействия - у 1 (4 %) пациента. Контроль болевого синдрома был достигнут у 17 (85 %), локальный контроль опухоли - у 19 (79,2 %) больных. Сроки наблюдения за пациентами составили 5-30 мес с медианой - 14,5 мес. Медиана общей продолжительности жизни пациентов составила 16 мес, медиана времени до прогрессирования - 9 мес. Общая 6-месячная выживаемость составила 100,0 %, 1-летняя - 75,0 %, 1,5-летняя - 41,7 %, 2-летняя - 17,2 %. Полугодовая выживаемость без прогрессирования равнялась 62,5 %, 1-летняя - 12,5 %. Заключение. Полученные ближайшие и отдаленные результаты являются сопоставимыми с ранее описанными в международной клинической практике, кроме того, они демонстрируют перспективность использования комбинации системной лекарственной терапии и локального термического воздействия у больных раком поджелудочной железы и дальнейшего изучения ее эффективности.
Рак поджелудочной железы, аденокарцинома, паллиативное лечение, химиотерапия, высокоинтенсивная фокусированная ультразвуковая терапия, HiFu-терапия, безопасность, эффективность
Короткий адрес: https://sciup.org/140254506
IDR: 140254506 | УДК: 616.37-006.6-08-059 | DOI: 10.21294/1814-4861-2021-20-3-18-27
Текст научной статьи Предварительная оценка эффективности комбинированного лечения с включением HIFU-терапии у больных раком поджелудочной железы
Несмотря на достижения фундаментальной науки и совершенствование технологий современной медицины, борьба с онкологическими заболеваниями остается одним из наиболее приоритетных направлений деятельности большинства развитых стран. Однако успехи в этом направлении во многом зависят от конкретной нозологической формы опухоли. Одной из наиболее неблагоприятных нозологий остается рак поджелудочной железы (РПЖ), при котором соотношение уровня годичной смертности и уровня заболеваемости достигает 98 % [1]. В США рак поджелудочной железы является 4-й ведущей причиной смерти от онкологических заболеваний [2]. По данным ряда исследований, общая 1-летняя выживаемость пациентов с РПЖ составляет 26 % и практически не зависит от принадлежности страны исследования к группе развитых или развивающихся [3]. Локализованный РПЖ выявляется у 9,4 % пациентов, но даже в этом случае общая 5-летняя выживаемость (ОВ) не превышает 29,3 %. При местнораспространенном РПЖ уровень 5-летней ОВ достигает 10 %. Генерализованная форма опухоли на момент выявления диагностируется у 52 % пациентов с показателем 5-летней ОВ, равным 2,6 % [4, 5].
В Российской Федерации РПЖ характеризуется наименьшим удельным весом морфологической верификации (65,8 %), максимальными показателями несвоевременной диагностики (58,9 % выявления на IV стадии), крайне низким показателем завершенности радикального лечения, высоким уровнем летальности пациентов в течение года с момента установления диагноза (66,9 %) [6].
Лишь 15–25 % больных РПЖ может быть выполнено радикальное хирургическое вмешательство, в связи с чем имеется острая необходимость в развитии и широком внедрении в клиническую практику новых методов паллиативного противоопухолевого лечения, способствующих увеличению продолжительности жизни пациентов, а также контролю за клиническими проявлениями болезни, сохранению или повышению качества жизни [7]. Одним из наиболее активно изучаемых в последние годы методов паллиативного лечения больных РПЖ является комбинация системной химиотерапии и высокоинтенсивной фокусированной ультразвуковой терапии (high intensity focused ultrasound therapy, HIFU-терапии) для максимального воздействия на зону поражения.
HIFU-терапия представляет собой неинвазивный метод термического воздействия, основные биологические эффекты которого представлены термическим и кавитационным повреждением клеток опухоли, деструкцией мелких кровеносных сосудов опухоли, локальной и системной иммунной реакцией на продукты клеточного распада [8]. В настоящее время данная технология применяется для лечения доброкачественных и злокачественных новообразований различных органов в качестве самостоятельного метода либо в комбинации с другими вариантами противоопухолевой терапии [9].
Проведение HIFU-терапии на фоне системной химиотерапии у пациентов с местнораспространенным РПЖ позволяет достигать медианы общей продолжительности жизни в 12,5 мес, а также общей 6-месячной и 1-летней выживаемости – до 94,25 % и 59,34 % соответственно [10–12].
По данным J. Vidal-Jove et al., комбинированное лечение 43 больных РПЖ III–IV стадии позволило добиться полного ответа опухоли в 11 (25 %) случаях, медианы общей продолжительности жизни, равной 16 мес, общей 4,2-летней выживаемости – 33,5 %. Однако ожоги кожи III степени, требующие выполнения пластической операции, наблюдались у 2 (4,7 %) пациентов, у 1 (2,3 %) отмечено развитие острого панкреатита с желудочно-кишечным кровотечением [13].
Сегодня на мировом рынке существует значительное число аппаратов для проведения процедур HIFU, характеризующихся различными энергетическими параметрами, методиками проведения процедур, с чем, вероятнее всего, связаны различный характер и частота нежелательных явлений, а также ранние и отдаленные результаты применения.
Целью исследования является предварительный анализ безопасности и эффективности применения HIFU-терапии на низкоэнергетическом аппарате HIFU-2001 (Shenzhen Huikang Medical Apparatus Co., Ltd) на фоне специфической лекарственной терапии рака поджелудочной железы.
Материал и методы
В исследование включено 24 пациента с РПЖ, получавших лечение на базе МНИОИ им. П.А. Герцена в период с 2016 по 2019 г., из них 17 (71 %) женщин и 7 (29 %) мужчин, в возрасте 42–81 год (средний возраст – 67,5 года). Доля пациентов, входящих в возрастные группы пожилого и старческого возраста, составила 79 % (рис. 1).
Критериями включения являлись: наличие гистологического или цитологического подтверждения диагноза; наличие метастатического процесса, либо инструментальных признаков не-резектабельности опухоли, либо принадлежность больных к категории неоперабельных в связи с тяжелой сопутствующей патологией; наличие четкой визуализации опухоли при ультразвуковом исследовании; статус ECOG ≤2; уровень активности по шкале Карновского ≥60 %; уровни общего, прямого и непрямого билирубина крови в пределах референсных значений; уровень гемоглобина ≥100 г/л, тромбоцитов ≥80×109/л; наличие компенсированной сопутствующей патологии; способность пациента соблюдать технологию проведения HIFU процедуры (неподвижное положение в прон-позиции); предполагаемое время дожития не менее 3 мес.
Согласно классификации TNM 7-го пересмотра, рак поджелудочной железы IIА стадии был диагностирован у 3 (12,5 %), IIВ стадии – у 5 (21 %), III стадии – у 9 (37,5 %), IV стадии – у 7 (29 %) больных (табл. 1). У 17 (71 %) пациентов злокачественная опухоль располагалась в головке поджелудочной железы, у 5 (21 %) – в теле, у 2 (8 %) – в хвосте органа. Во всех случаях морфологически опухоль была представлена аденокарциномой.
Размер опухоли, определяемый посредством компьютерной томографии, варьировал от 18 мм до 68 мм (средний – 45 мм). Объем новообразований
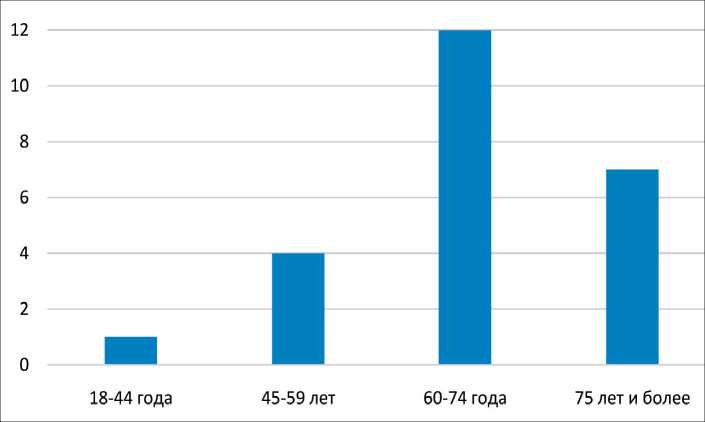
Рис. 1. Распределение пациентов по возрастным группам (ось абсцисс – возрастные группы, лет; ось ординат – число пациентов)
Fig. 1. The distribution of patients according to age groups (x-axis – age group, years; y-axis – the number of patients)
Таблица 1/table 1
Распределение пациентов с различной локализацией опухоли по стадии заболевания и значениям t, n, M (классификация tnM 7-е издание)
distribution of patients by disease stage and t, n, M classification (7 ed.)
У всех больных имела место клинико-инстру-ментально или лабораторно подтвержденная комбинированная сопутствующая патология. Компенсированные заболевания сердечно-сосудистой системы (ишемическая болезнь сердца, гипертоническая болезнь, хроническая сердечная недостаточность, варикозная трансформация вен нижних конечностей) были выявлены у 18 (75 %), эндокринной системы (сахарный диабет, зоб щитовидной железы) – у 9 (37,5 %), желудочнокишечного тракта (хронический гастрит, дуоденит, язвенная болезнь двенадцатиперстной кишки в стадии рубцевания, желчекаменная болезнь, гастроэзофагеальный рефлюкс) – у 8 (33 %) человек.
У 20 (83 %) пациентов на начало комбинированного лечения имелся хронический болевой синдром. При оценке выраженности данного синдрома по визуально-аналоговой шкале боли уровень болевых ощущений пациентов находился в диапазоне от 2 до 9 единиц (среднее значение – 4,82). При этом стоит отметить, что уровень боли от 6 баллов (ограничение повседневной активности больного) и более имел место у половины пациентов (рис. 2).
При оценке общего состояния больных по шкале ECOG половина пациентов (n=12) соответствовали 1 баллу, остальные – 2 баллам. По индексу Карновского активность пациентов составляла 60–90 % (средняя – 78,5 %).
Всем пациентам проводилась комбинированная терапия, включающая системную химиотерапию и HIFU-терапию. Двадцать человек получали монохимиотерапию: 3 больных – капецитабин, 17 – гемцитабин (при прогрессировании опухоли и сохранении удовлетворительного общего статуса схема химиотерапии менялась на капе-цитабин, иринотекан). Четыре человека с IV стадией заболевания и в хорошем функциональном статусе (ECOG1) получали полихимиотерапию по схеме FOLFIRINOX, с переходом при прогрессировании болезни на режим гемцитабин + nab-паклитаксел.
Сеансы HIFU-терапии проводились между днями внутривенного введения химиопрепаратов либо параллельно с приемом капецитабина ежедневно. Локальное лечение проводилось на аппарате HIFU-2001 (Shenzhen Huikang Medical Apparatus Co., Ltd) курсами по 6–8 сеансов в стационарном или амбулаторном режиме (рис. 3).
Общее число курсов HIFU-терапии составило 2–18. Сеансы локального воздействия осуществлялись со следующими параметрами: частота излучения 1,0 ± 0,1 МГц, фокусное расстояние излучающих линз 150 мм; длительность инсонации – 200 мсек, длительность паузы между импульсами 50 мсек; число повторения импульсов – 100–200 ударов в одну точку; средняя мощность инсонации за курс – 300–650 Вт; длительность одного сеанса HIFU-терапии – 35–50 мин.
Интенсивность болевых ощущений пациента во время процедуры HIFU регулировалась уровнем акустической мощности. После окончания инсонации акустическое окно (кожа и подкожная клетчатка) обследовалось на предмет выявления нежелательных явлений проведения процедуры.
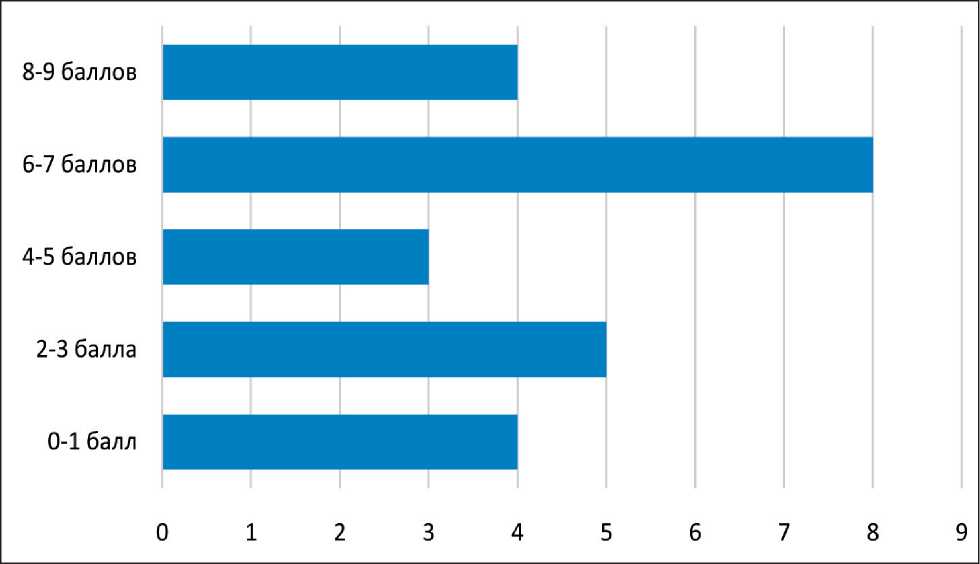
Рис. 2. Распределение пациентов по степени выраженности болевого синдрома по визуально-аналоговой шкале боли (ось абсцисс – число пациентов; ось ординат – уровень боли, единиц)
Fig. 2. Distribution of patients according to the severity of pain according to the visual-analog pain scale (х-axis – the number of patients; y-axis – the level of pain, units)

Рис. 3. Аппарат для проведения HIFU-терапии – HIFU-2001 (Shenzhen Huikang Medical Apparatus Co., Ltd)
Fig. 3. HIFU therapy Device – HIFU-2001 (Shenzhen Huikang Medical Apparatus Co., Ltd)
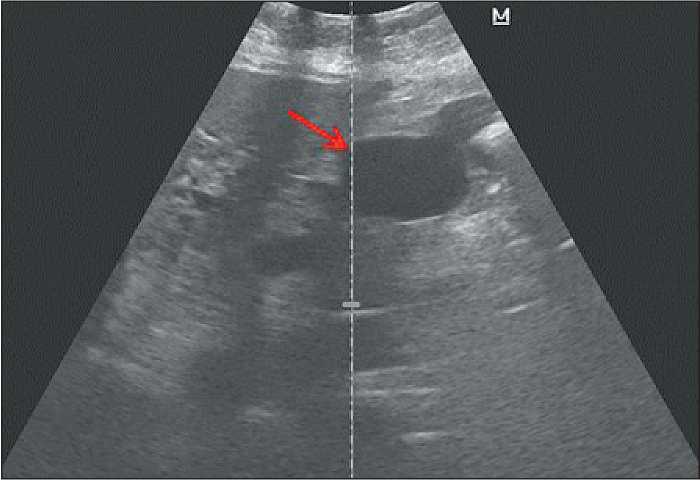
Рис. 4. Ультрасонограмма псевдокисты поджелудочной железы: сформированная полость с анэхогенным содержимым, ровные четкие контуры, тонкая рыхлая капсула Fig. 4. Ultrasound image of pancreatic pseudocysts: cavity with anechogenic content, smooth clear contours, thin loose capsule
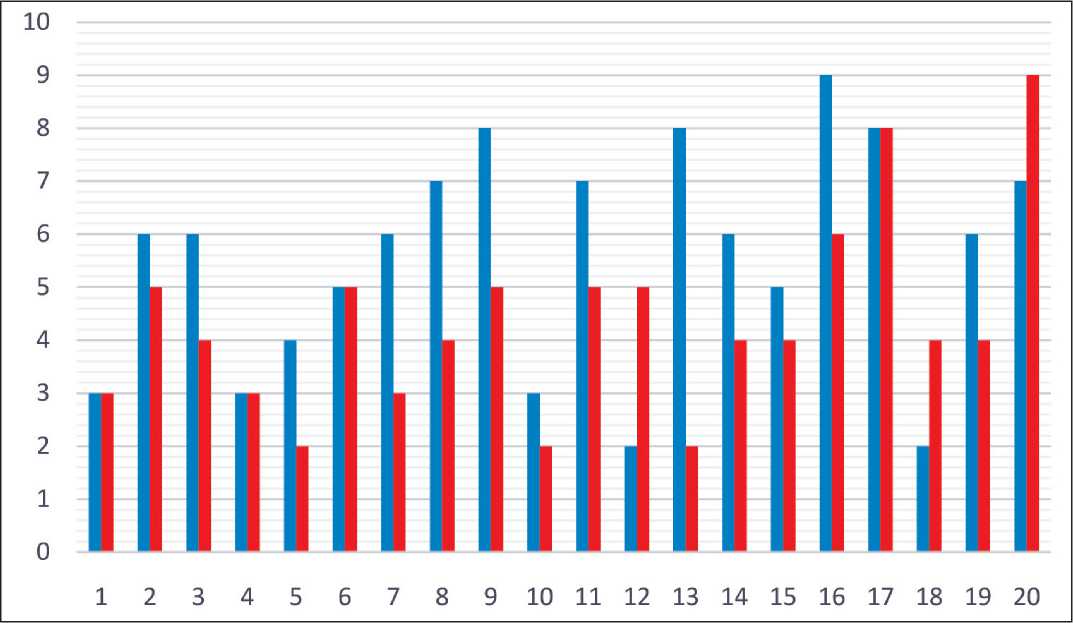
Рис. 5. Уровень болевого синдрома пациентов по визуально-аналоговой шкале боли до начала лечения (синие столбцы) и в процессе него (красные столбцы) (ось абсцисс – число пациентов; ось ординат – уровень боли, единиц)
Fig. 5. The level of pain on the visual-analog pain scale before treatment (blue columns) and during treatment (red columns) (x-axis – the number of patients;
y-axis – the level of pain, units)
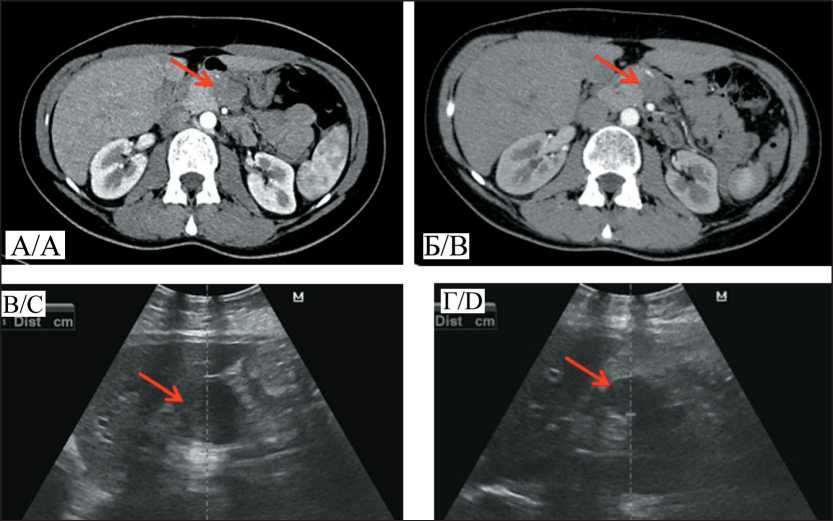
Рис. 6. Изменения размеров первичного опухолевого очага в поджелудочной железе в процессе лечения: А – КТ опухоли тела поджелудочной железы, размером 28×26×25 мм до начала лечения; Б – КТ опухоли тела поджелудочной железы, размером 23×18×19 мм, после 6-го курса лечения;
В – ультрасонограмма опухолевого образования головки поджелудочной железы, размером 47×39×32 мм, до начала терапии;
Г – ультрасонограмма опухолевого образования головки поджелудочной железы, размером 33×36×30 мм, после 8-го курса комбинированного лечения
Fig. 6. Changes in size of the primary tumor after treatment: A – CT image of the tumor measuring 28×26×25 mm before starting combined treatment; B – CT image of the pancreatic body tumor measuring 23×18×19mm after 6 courses of treatment; C – Ultrasound image of the pancreatic head tumor measuring 47×39×32 mm before the start of therapy; D – Ultrasound image of the pancreatic head tumor measuring 33×36×30 mm after 8 courses of combined treatment
Результаты
Осложнения после HIFU-терапии наблюдались у 8 пациентов, из них ожоги кожи имели место у 6 (25 %) больных; ожоги III степени – у 2 (8,3 %), склероз подкожной жировой клетчатки – у 4 (17 %); развитие псевдокисты поджелудочной железы в области HIFU-воздействия – у 1 (4 %) пациента (рис. 4).
Эффективность лечения с точки зрения уменьшения выраженности болевого синдрома оценена у всех больных, отмечавших болевые ощущения на момент включения в исследование. Среди 20 больных снижение уровня болевого синдрома в процессе комбинированной терапии наблюдалось у 13 (65 %) человек, 4 (20 %) пациента отметили отсутствие изменения уровня боли, 3 (15 %) больных – его увеличение. Диапазон снижения уровня боли составил 1–6 единиц по визуальноаналоговой шкале боли (среднее значение – 2,5). Уровень болевого синдрома от 6 баллов и более сохранялся у 3 пациентов (рис. 5).
Непосредственная эффективность лечения оценивалась по критериям RECIST 1.1. Частота объективного ответа составила 12,5 % (уменьшение максимального размера опухоли в процессе лечения на 30 % и более отмечено у 3 пациентов). Дополнительно у 16 (66,7 %) больных зафиксирована длительная (более 6 мес) стабилизация процесса. Таким образом, локальный контроль был достигнут у 79,2 % пациентов. Регрессия объема новообразо-
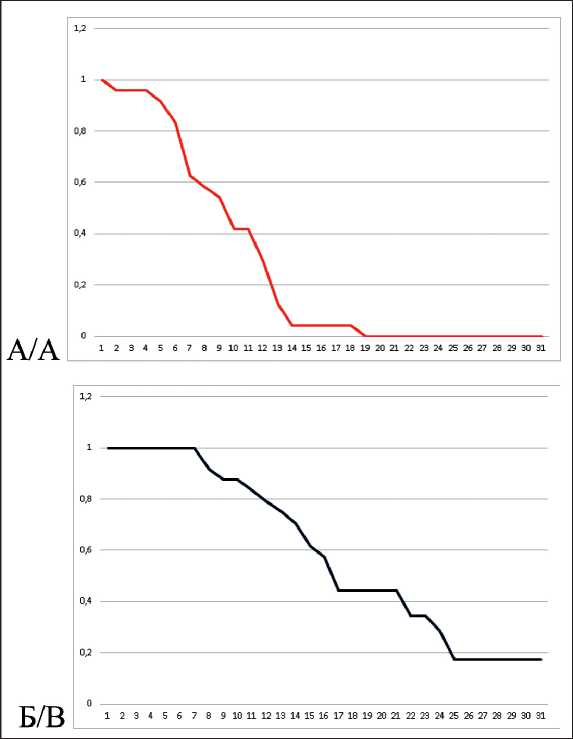
Рис. 7. Показатели выживаемости пациентов: А – без прогрессирования; Б – общая выживаемость (ось абсцисс – период времени, мес; ось ординат – выживаемость, %) Fig. 7. The survival rate of patients without progression (A), overall survival of patients (B) (the x-axis – a time period, a month; the y-axis – the survival of patients, %)
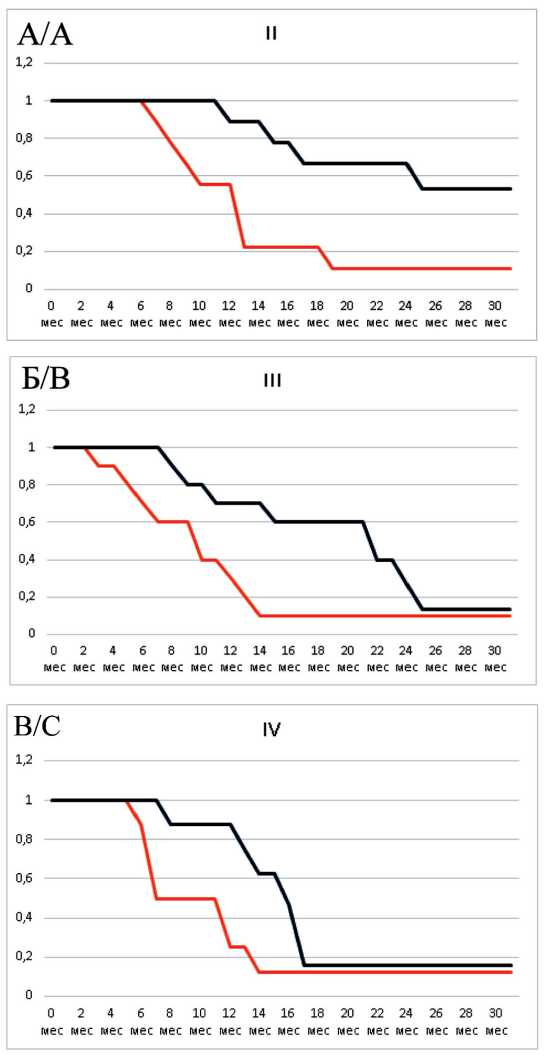
Рис. 8. Показатели общей выживаемость (график синего цвета) и выживаемости без прогрессирования (график красного цвета) в зависимости от стадии заболевания: А – II стадия; Б – III стадия; В – IV стадия (ось абсцисс – период времени, мес; ось ординат – выживаемость, %)
Fig. 8. Overall survival (blue graph) and progression-free survival (red graph) in patients depending on the stage of the disease:
A – stage II, B – stage III, C – stage IV (x-axis – time period, month; y-axis – patient survival, %)
ваний отмечена у 9 (37,5 %) больных и составила 21–82 % (среднее значение – 51,9 %) (рис. 6).
Сроки наблюдения за пациентами составили 5–30 мес с медианой – 14,5 мес. На момент проведения промежуточного анализа 15 больных умерли от прогрессирования заболевания. Медиана общей продолжительности жизни пациентов составила 16 мес, медиана времени до прогрессирования – 9 мес. Для определения показателей выживаемости был использован метод Kaplan–Meier. Общая 6-месячная выживаемость составила 100,0 %, 1-летняя – 75,0 %, 1,5-летняя – 41,7 %, 2-летняя – 17,2 %. Полугодовая выживаемость пациентов без прогрессирования оказалась равна 62,5 %, 1-летняя – 12,5 % (рис. 7). При анализе эффективности данного вида комбинированного лечения в зависимости от стадии процесса было отмечено, что она ожидаемо оказалась выше у пациентов с РПЖ II и III стадий (рис. 8). Полученная закономерность объясняется более частым прогрессированием заболевания у пациентов с РПЖ IV стадии в зонах отдаленного метастазирования, не подвергавшихся воздействию HIFU.
Обсуждение
Сегодня на мировом рынке существует значительное число аппаратов для проведения процедур HIFU, особенности использования которых представлены в табл. 2.
В 2017 г. J. Zhao et al. продемонстрировали преимущество использования низкомощностных аппаратов для HIFU-терапии при комбинированном лечении. Авторами проведен ретроспективный анализ эффективности терапии у 38 пациентов с РПЖ III стадии. Медиана общей выживаемости больных, лечение которых осуществлялось на низкоэнергетическом аппарате, составила 10,3 мес, на высокомощностных аппаратах – 6,0 мес (р=0,018). Статистически значимой разницы в частоте нежелательных явлений при проведении процедур HIFU не выявлено [25].
В настоящем исследовании продемонстрирована относительная безопасность проведения HIFU-терапии на низкоэнергетическом аппарате HIFU-2001 (Shenzhen Huikang Medical Apparatus Co., Ltd) на фоне специфической лекарственной терапии у больных раком поджелудочной железы. Развития осложнений, требующих проведения оперативного вмешательства, не отмечено. Наиболее частыми нежелательными явлениями являлись ожоги кожи (6 пациентов из 24), III степень которых имела место у 2 (8,3 %) пациентов, возникновение которых не препятствовало продолжению системного лечения. Всем больным с ожогами кожи проводилось консервативное местное лечение. Локальный склероз подкожной жировой клетчатки был отмечен у 4 (17 %) больных; развитие бессимптомной псевдокисты поджелудочной железы в области HIFU-воздействия – у 1 (4 %) пациента.
В настоящем исследовании контроль болевого синдрома был достигнут у 17 (85 %) пациентов, локальный контроль опухоли – у 19 (79,2 %) больных. Полученные результаты сопоставимы с ранее описанными в международной клинической практике. Медиана общей продолжительности жизни пациентов составила 16 мес, общая 1-летняя выживаемость – 75,0 %. Данные показатели также являются сопоставимыми с результатами проведенных ранее зарубежных исследований, однако небольшое число больных в настоящем исследовании пока не позволяет сделать однозначные выводы.
|
Таблица 2/table 2 Сравнительная характеристика параметров, показателей безопасности и эффективности использования аппаратов для проведения процедур HiFu [10–24] Comparative characteristics of parameters, safety indicators and efficiency of using devices for HiFu procedures [10–24] |
||
|
Характеристика/ Characteristics |
Аппараты, генерирующие УЗ волны высокой интенсивности/ Devices generating high-intensity ultrasound waves JC HIFU system (Chongqing Haifu Tech Co. Ltd, Chongqing, China) |
Аппараты, генерирующие УЗ волны низкой интенсивности/ Devices generating low-intensity ultrasound waves FEPBY02 HIFU system (Yuande Biomedical Engineering Co. Ltd, Beijing, China)/ HIFUNIT-9000 system (Shanghai A&S Sci-Tec Co., Ltd, Shanghai, China) |
|
Интенсивность УЗ волн/ Intensity of ultrasound waves |
5–20 кВт/см2/ 5–20 kW/cm2 |
менее 3 кВт/см2/ less than 3 kW/cm2 |
|
Кратность выполнения процедур/ Multiplicity of procedures |
Однократно/ Once |
2–10 процедур в течение 10–14 дней/ 2–10 procedures for 10–14 days |
|
Необходимость в наркозе/ седации/ Need for anesthesia/sedation |
Имеется/ Yes |
Отсутствует/ No |
|
Режим пребывания пациента/ Patient stay mode |
Стационарный/ Inpatient |
Стационарный, амбулаторный/ Inpatient, outpatient |
|
Основные осложнения терапии/ Major complications of therapy |
Боль в животе, лихорадка, тошнота – 57,1 %/ Abdominal pain, fever, nausea 57.1 % Ожоги кожи II–III степени – 4,7 %/ Skin burns of 2–3 degrees 4.7 % Острый панкреатит – 2,3 %/ Acute pancreatitis – 2.3 % Образование панкреатического свища – 4,1 %/ Formation of pancreatic fistula – 4.1 %. Желудочно-кишечное кровотечение – 2,0 %/ Gastrointestinal bleeding – 2.0 % |
Боль в животе, лихорадка, тошнота, кожная сыпь – 28,7 %/ Abdominal pain, fever, nausea, skin rash – 28.7% Локальный склероз подкожной жировой клетчатки – 6,7 %/ Local sclerosis of subcutaneous fatty tissue – 6.7 %. Обструктивная желтуха – 5,2 %/ Obstructive jaundice – 5.2% Поверхностные ожоги кожи – 3,4 %/ Superficial skin burns – 3.4% Развитие бессимптомных псевдокист поджелудочной железы – 1,1 %/ Development of asymptomatic pseudocysts of the pancreas – 1.1 % |
|
Контроль болевого синдрома/ Pain control |
78,6–87,5 % |
80,6–100 % |
|
Локальный контроль опухоли/ Local tumor control |
78,2–82,0 % |
76,3–78,2 % |
|
Отдаленные результаты применения в комбинации с химиотерапией/ Long-term outcomes |
Медиана продолжительности жизни больных РПЖ III ст. – до 12,4 мес, IV ст. – до 6 мес/ Median survival of patients with stage III pancreatic cancer – 12.4 months, stage IV – 6 months. Общая 1-летняя выживаемость – 49,9 %/ Overall 1-year survival rate – 49.9 % |
Медиана продолжительности жизни больных РПЖ III ст. – до 12,2 мес, IV ст. – до 5,4 мес/ Median survival of patients with stage III pancreatic cancer – 12.2 months, stage IV – 6 months Общая 1-летняя выживаемость – 59,34 %/ Overall 1-year survival rate – 59.34 % |
Заключение
Предварительный анализ эффективности комбинированного лечения с включением системной химиотерапии и HIFU-терапии у больных раком поджелудочной железы продемонстрировал удовлетворительную переносимость и относительную безопасность данной методики. Возможность применения монокомпонентных схем химиотерапии, а также описанный эффект снижения уровня вы- раженности болевого синдрома на фоне лечения способствуют сохранению, а в ряде случаев и росту качества жизни пациентов. Полученные ближайшие и отдаленные результаты показали перспективность дальнейшего изучения эффективности комбинации системной лекарственной терапии и локального термического воздействия у больных, которым не показана радикальная операция.
Список литературы Предварительная оценка эффективности комбинированного лечения с включением HIFU-терапии у больных раком поджелудочной железы
- Ilic M., Ilic I. Epidemiology of pancreatic cancer. World J Gastroenterol. 2016 Nov 28; 22(44): 9694-9705. https://doi.org/10.3748/wjg.v22.i44.9694.
- Siegel R.L., Miller K.D., Jemal A. Cancer statistics, 2019. CA Cancer J Clin. 2019 Jan; 69(1): 7-34. https://doi.org/10.3322/caac.21551.
- Lepage C., Capocaccia R., Hackl M., Lemmens V., Molina E., Pierannunzio D., Sant M., Trama A., Faivre J.; EUROCARE-5 Working Group. Survival in patients with primary liver cancer, gallbladder and extrahepatic biliary tract cancer and pancreatic cancer in Europe 1999-2007: Results of EUROCARE-5. Eur J Cancer. 2015 Oct; 51(15): 2169-2178. https://doi.org/10.1016/j.ejca.2015.07.034.
- Wang H., Liu J., Xia G., Lei S., Huang X., Huang X. Survival of pancreatic cancer patients is negatively correlated with age at diagnosis: a population-based retrospective study. Sci Rep. 2020; 10(1): 7048. https://doi.org/10.1038/s41598-020-64068-3.
- Ansari D., Tingstedt B., Andersson B., Holmquist F., Sturesson C., Williamsson C., Sasor A., Borg D., Bauden M., Andersson R. Pancreatic cancer: yesterday, today and tomorrow. Future Oncol. 2016; 12(16): 1929-46. https://doi.org/10.2217/fon-2016-0010.
- Kaprin A.D., Starinskii V.V., Petrova G.V. Sostoyanie onkologicheskoi pomoshchi naseleniyu Rossii v 2018 godu. M., 2019. 236 s.
- Goodman M.D., Saif M.W. Adjuvant therapy for pancreatic cancer. JOP. 2014 Mar 10; 15(2): 87-90. https://doi.org/10.6092/1590-8577/2324.
- Zhou Y.F. High intensity focused ultrasound in clinical tumor ablation. World J Clin Oncol. Jan 10, 2011; 2(1): 8-27. https://doi.org/10.5306/wjco.v2.i1.8.
- Izadifar Z., Izadifar Z., Chapman D., Babyn P. An Introduction to High Intensity Focused Ultrasound: Systematic Review on Principles, Devices, and Clinical Applications. J Clin Med. 2020; 9(2): 460. https://doi.org/10.3390/jcm9020460.
- Ji Y., Zhang Y., Zhu J., Zhu L., Zhu Y., Hu K., Zhao H. Response of patients with locally advanced pancreatic adenocarcinoma to high-intensity focused ultrasound treatment: a single-center, prospective, case series in China. Cancer Manag Res. 2018 Oct 9; 10: 4439-46. https://doi.org/10.2147/CMAR.S173740.
- Tao S.F., Gu W.H., Gu J.C., Zhu M.L., Wang Q., Zheng L.Z. A Retrospective Case Series Of High-Intensity Focused Ultrasound (HIFU) In Combination With Gemcitabine And Oxaliplatin (Gemox) On Treating Elderly Middle And Advanced Pancreatic Cancer. Onco Targets Ther. 2019 Nov; 12: 9735-45. https://doi.org/10.2147/OTT.S220299.
- Lv W., Yan T., Wang G., Zhao W., Zhang T., Zhou D. High-intensity focused ultrasound therapy in combination with gemcitabine for unresectable pancreatic carcinoma. Ther Clin Risk Manag. 2016 May 2; 12: 687-91. https://doi.org/10.2147/TCRM.S90567.
- Vidal-Jove J., Perich E., Del Castillo M.A. Ultrasound Guided High Intensity Focused Ultrasound for malignant tumors: The Spanish experience of survival advantage in stage III and IV pancreatic cancer. Ultrason Sonochem. 2015 Nov; 27: 703-706. https://doi.org/10.1016/j.ultsonch.2015.05.026.
- Wu F. High intensity focused ultrasound: a noninvasive therapy for locally advanced pancreatic cancer. World J Gastroenterol. 2014 Nov 28; 20(44): 16480-8. https://doi.org/10.3748/wjg.v20.i44.16480.
- Diana M., Schiraldi L., Liu Y.Y., Memeo R., Mutter D., Pessaux P., Marescaux J. High intensity focused ultrasound (HIFU) applied to hepatobilio-pancreatic and the digestive system-current state of the art and future perspectives. Hepatobiliary Surg Nutr. 2016; 5(4): 329-44. https://doi.org/10.21037/hbsn.2015.11.03.
- Wang K., Zhu H., Meng Z., Chen Z., Lin J., Shen Y., Gao H. Safety evaluation of high-intensity focused ultrasound in patients with pancreatic cancer. Onkologie. 2013; 36(3): 88-92. https://doi.org/10.1159/000348530.
- Sung H.Y., Jung S.E., Cho S.H., Zhou K., Han J.Y., Han S.T., Kim J.I., Kim J.K., Choi J.Y., Yoon S.K., Yang J.M., Han C.W., Lee Y.S. Long-term outcome of high-intensity focused ultrasound in advanced pancreatic cancer. Pancreas. 2011 Oct; 40(7): 1080-6. https://doi.org/10.1097/MPA.0b013e31821fde24.
- Orsi F., Zhang L., Arnone P., Orgera G., Bonomo G., Vigna P.D., Monfardini L., Zhou K., Chen W., Wang Z., Veronesi U. High-intensity focused ultrasound ablation: effective and safe therapy for solid tumors in difficult locations. Am J Roentgenol. 2010 Sep; 195(3): W245-52. https://doi.org/10.2214/AJR.09.3321.
- Gao H.F., Wang K., Meng Z.Q., Chen Z., Lin J.H., Zhou Z.H., Wang P., Shi W.D., Sheng Y.H. High intensity focused ultrasound treatment for patients with local advanced pancreatic cancer. Hepatogastroenterology. 2013 Nov-Dec; 60(128): 1906-10. https://doi.org/10.5754/hge13498.
- Wang K., Chen Z., Meng Z., Lin J., Zhou Z., Wang P., Chen L., Liu L. Analgesic effect of high intensity focused ultrasound therapy for unresectable pancreatic cancer. Int J Hyperthermia. 2011; 27(2): 101-7. https://doi.org/10.3109/02656736.2010.525588.
- Li P.Z., Zhu S.H., He W., Zhu L.Y., Liu S.P., Liu Y., Wang G.H., Ye F. High-intensity focused ultrasound treatment for patients with unresectable pancreatic cancer. Hepatobiliary Pancreat Dis Int. 2012 Dec 15; 11(6): 655-60. https://doi.org/10.1016/s1499-3872(12)60241-0.
- Xiong L.L., Hwang J.H., Huang X.B., Yao S.S., He C.J., Ge X.H., Ge H.Y., Wang X.F. Early clinical experience using high intensity focused ultrasound for palliation of inoperable pancreatic cancer. JOP. 2009 Mar 9; 10(2): 123-9.
- Lau P.C., Zheng S.F., Ng W.T., Yu S.C. Inoperable pancreatic adenocarcinoma rendered complete remission by high-intensity focused ultrasound concurrent with gemcitabine-capecitabine chemotherapy: case report and topic review. J Dig Dis. 2012 Jan; 13(1): 60-4. https://doi.org/10.1111/j.1751-2980.2011.00546.x.
- Moskvicheva L.I., Petrov L.O., Sidorov D.V. Vozmozhnosti sovremennykh metodov ablyatsii pri nerezektabel'nom mestnorasprostranennom rake podzheludochnoi zhelezy. Issledovaniya i praktika v meditsine. 2018; 5(2): 86-99. https://doi.org/10.17709/2409-2231-2018-5-2-10.
- Zhao J., Zhao F., Shi Y., Deng Y., Hu X., Shen H. The efficacy of a new high intensity focused ultrasound therapy for locally advanced pancreatic cancer. J Cancer Res Clin Oncol. 2017; 143(10): 2105-11. https://doi.org/10.1007/s00432-017-2459-6.


