Предварительное описание нового вида галофильной метилобактерии рода Methylophaga из фильтрата полигона захоронения твёрдых бытовых отходов
Автор: Шаравин Д.Ю., Саралов А.И.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Микробиология
Статья в выпуске: 4, 2015 года.
Бесплатный доступ
Из слабощелочного фильтрата (pH 8.0-8.3) полигона твёрдых бытовых отходов (г. Пермь) с высоким уровнем загрязнения по аммонию, нитратам, нитритам и метану выделен и описан умеренно галофильный метилотрофный денитрификатор (изолят RS-MM3). Является аэробом, наиболее активную денитрификацию осуществляет на среде с пируватом. Способен расти в среде с 0.02-5% СН 3ОН, 0.2-10% NaCl при 10-40°C и pH 6.0-9.5. Факультативный метилотроф: метанол, метиламин, фруктозу и сахарозу использует в качестве источников углерода и энергии. При оптимальных условиях роста (30°C, pH 7.8, 30 г/л NaCl, 20 мкг/л витамин B 12) на среде с метанолом (5 мл/л) основными жирными кислотами являются C 16:1to7c, C 16:0, C 18:1to7c. Содержание Г+Ц в ДНК составляет 43.9 мол.%. По совокупности гено- и фенотипических признаков изолят отнесён к метилотрофным представителям Gammaproteobacteria рода Methylophaga в качестве нового вида Methylophaga RS-MM3 sp. nov. Филогенетическое сходство с различными ограниченно галоалкалофильными видами рода достигало межвидового уровня (95.3-96.7%).
Полигон твёрдых бытовых отходов, фильтрат, метилотрофия
Короткий адрес: https://sciup.org/147204742
IDR: 147204742 | УДК: 579.26+579.84
Текст научной статьи Предварительное описание нового вида галофильной метилобактерии рода Methylophaga из фильтрата полигона захоронения твёрдых бытовых отходов
Основную часть твердых бытовых отходов (ТБО) городов подвергают захоронению на специально оборудованных полигонах (ПТБО). В России на ПТБО ежегодно производится захоронение око ло 40 млн т ТБО [Вайсман. Вайсман, Максимов, 2003]. Деградация органических субстратов анаэробными микроорганизмами сопровождается высвобождением простых органических соединений, таких как ацетат, бутират. лактат, пируват, пропионат. пропанол, этанол, метанол и формальдегид. Органические компоненты залежи ТБО разла-
(С Шаравин Д. Ю Саралов А. PL 2015
гаются микроорганизмами с образованием биогаза. состоящего на 50-70% из СН4 и на 30-50% - из СО3- ПТБО являются важным источником атмосферного метана, их вклад в глобальную эмиссию этого парникового газа оценивается в 6-12% [Кожевникова, Каллистова, Кевбрина. 2006]. Кроме эмиссии метана,. ПТБО оказывают негативное влияние на окружающую среду даже после их закрытия. в частности, из-за продолжающегося стока загрязненных фильтрационных вод [Вайсман, Вайсман, Максимов, 2003].
Разнообразные представители филума Proieo-bucteria широко распространены в природе и могут быть изолированы из различных ИСТОЧНИКОВ разных климатических зон Землш они часто доминируют в пресноводных и морских экосистемах [Amann, Ludwig. Schleifer 1995: Snaidr el aL 1997]. а также в сточных водах и активных илах городских и промышленных биологических ОЧИСТНЫХ сооружений [Manz el al.. 1992; Jurelscliko el al.. 2002]."
Аэробные метилотрофные бактерии, использующие метан (метанотрофы) и его окисленные и замещенные производные (метилобактерии) в качестве источников углерода и энергии, повсеместно распространены в природе. Метилотрофы часто ассоциированы с метанотрофами. особенно в почве. хотя часто и с высокой плотностью колонизируют листовую поверхность, присутствуют б семенах и ризосфере многих растений и играют значительную роль в превращениях одноу глеродных соединений на ПТБО [Иванова и др.. 2000; Knief el al., 2008].
Цель настоящего исследования - изучение и предварительное описание новых таксонов мети-лотрофных денитрификаторов, изолированных из фильтрационных вод ПТБО.
Материалы и методы исследования
В период С мая 2010 по октябрь 2013 г. изучали микробиоценоз водных масс обводного канала (средняя глубина 1.5 м) ПТБО «Софроны» г. Перми, используемого для утилизации основной массы городского мусора с 1978 г. Полигон расположен в 12 км от города и занимает 52 га, представляя из себя холм от 20 до 30 м в высоту. Температура внутри полигона варьирует от 30 до 60°С (вследствие разогрева его процессами анаэробного разложения органических веществ).
В 2010-2013 гг. исследовали старую «холодноводную секцию» ирригационного канала в южной части полигона. На протяжении зимы вода '?десь промерзала от поверхности до дна. В середине марта 2013 г. в северной части полигона исследовали молодую «тепловодную секцию». На этом специфичном участке из «тела» полигона истекал горячий тёмно-коричневый раствор (водный гу- мус), поэтому на момент отбора проб температура в придонном слое канала составляла +23°С, в то время как температура на открытом воздухе не превышала минус 13°C.
Пробы отбирали в стерильные бутыли объёмом 1.5 л, использовали их для гидрохимических и микробиологических анализов. Гидрохимические анализы выполняли согласно практическому руководству по изучению состава промышленных сточных вод. Содержание растворенного метана в пробах оценивали по результатам анализа газовых смесей на хроматографе Chrom-5 (Чехословакия), металлы - в гексановых и хлороформных экстрактах на атомно-абсорционном спектрометре Shimadzu АА-6300 (Япония). Состав органических веществ фильтрационных вод и жирнокислотный состав (ЖК) определяли на хромато-масс-спектрометрической системе Agilent 6890/5973N (США). Идентификацию метиловых эфиров ЖК осуществляли с использованием автоматизированной системы обработки массспектральных данных AMD IS с поиском целевых компонентов по библиотеке NISTEPA. MSL (США) с фактором сходства не менее 80%.
Способность к денитрификации микрофлоры сточных бод и культур протеобакгерий оценивали по накоплению N3O в газовой фазе с N3 и ацетиленом. Анализ газовых смесей производили на хроматографе Chrom-5 (Чехословакия) с применением катарометра, колонки длиной 2.4 м и диаметром 6 мм с абсорбентом Porapak N (США).
Фрагменты тотальной ДНК из нативных образцов, кодирующие бактериальные гены 16S рРНК, были амплифицированы с использованием ПЦР с эу бактериальным и праймерами: 27Ги 1492г [Lane, 1991]. Ген метанолдегидрогеназы (mxaF) ампли-фицировали в полимеразной цепной реакции. используя пару праймеров; F1003 и R1561 [McDonald. Murrell, 1997; Lau el al. 2013].
Секвенирование полученных ПЦР-фрагментов генов, кодирующих 16S рРНК. проводили по методу Сэнгера с помощью набора реактивов Big Dye Terminator v.3.1 (Applied Biosyslems. Inc..USA) на автоматическом секвенаторе ABI PRIZM 3730 (Applied Biosystems, Inc.USA) согласно инструкциям производителя. Первичный анализ полученных последовательностей проводили с помощью программного пакета BLAST. Филогенетический анализ проводили по методу Maximum-Likelihood и алгоритмов, реализованных в пакете программ TREECONnMEGA 4.
Результаты и их обсуждение
Слабощелочные (pH 80-8.3) фильтрационные воды бикарбонатного типа «тепловодной секции» характеризовались высоким уровнем загрязнения по аммонию, нитратам, нитритам, фосфору. желе- зу, хрому; никелю и метану7 (табл. 1). В «холодноводной секции» по сравнению с «тепловодной секцией» наблюдалось резкое снижение цветности раствора (в 40-60 раз), концентрации метана (32-260 раз), общего фосфора (35-56 раз), хрома (19-56). железа (7-20 раз) и натрия (6-14 раз).
Таблица 1
Гидрохимическая характеристика фильтрационных вод обводного канала ПТБО «Софроны» в течение 2010-2013 гп в «старой холодноводной секции» и в марте 2013 г, в «молодой тепл овод нои секции» (значения приведены в скобках)
|
Параметр |
Поверхностная вода |
Придонная вода |
|
Температура. °C |
15±14 (3) |
15±14 (23) |
|
pH |
8.310.3(8.2) |
8.010.3 (8.3) |
|
Содержание метана, мл/л |
0.23Ю.18(13.0) |
1.5110.66(15.1) |
|
Минеральные вещества, мг/л: Общий фосфор |
0.3510.08(15.2) |
2.510.6(16.4) |
|
Аммоний |
39,2±18.3 (272.1) |
48.7117.7 (265,3) |
|
Нитраты |
47.6114.6(537.2) |
45.1115 3 (829.9) |
|
Нитриты |
1.94=0,5 (53.6) |
2,2И,1 (76,6) |
|
Гидрокарбонаты |
8031120(8540) |
8421105 (9760) |
|
Натрий |
5821224 (5054) |
6451266(5954) |
|
Железо |
0 4110.20 (4.28) |
3.2311.45(3.71) |
|
Никель |
0.1210.02 (0.50) |
0.1410.03(0.47) |
|
Хром |
0.02Ю.01 (0.56) |
0.0210,01 (0,67) |
Из фильтрационных вод ПТБО был выделен умеренно галофильный метилотрофный денитри-фикатор RS-MM3. По совокупности гено- и хемо- таксономических признаков изолят был отнесен к представителям рода Xlelhylophaga (табл. 2; рисунок).
Таблица 2
Сравнительная таблица фенотипического сходства культуры RS-MM3 и некоторых членов рода Methylophaga. Штаммы: RS-MM3;M nitratireducenticrescens JAM1T [Villeneuve et aL, 2013]; M.
frappieri JAM7T [Villeneuve et aL, 2013]; M. alcalica M39T [Doronina, Darmaeva, Trotsenko, 2003]; M. aminisuyidivorans MPT [Kim et aL, 2007]; M* lonarensis MPLT [Antony et aL, 2012]
|
11араметр |
Methylophaga sp* RS-MM3 |
,1АМ1Т |
JAM7T |
М39т |
МРТ |
MPLT |
|
1>Фрукгоза |
+ |
— |
— |
— |
+ |
— |
|
D-Глюкоза |
+ |
ND |
ND |
ND |
ND |
ND |
|
Метанол 1% |
+ |
+ |
1 |
1 |
+ |
+ |
|
Метиламин |
+ |
- |
- |
+ |
+ |
— |
|
Диан, темп., °C |
10—40 |
15-37 |
15-37 |
4-35 |
20-37 |
20-37 |
|
Опгим, темп,,°C |
30 |
30 |
34 |
25-29 |
30 |
28-30 |
|
pH диапазон |
6.0-9.5 |
6.0-11.0 |
6.0-11.0 |
7.0-11.0 |
6.0-8.0 |
7.0-10.0 |
|
Оптимум. pH |
7,5-8,2 |
8,0 |
8,0 |
9.O-9.5 |
6,8-7,0 |
9.0-10,0 |
|
NaCl диап., % |
0.2-10 |
0.5-8.0 |
0 5-8.0 |
0.05-10.0 |
1.5-9.0 |
0.05-10.0 |
|
Опгим. NaCl, % |
3.0 |
3.0 |
3.0 |
ND |
3.0 |
0.5-2.0 |
|
Нитрат редукция |
+ |
+ |
+ |
+ |
+ |
|
|
Морфология клеток |
Палочки |
Палочки |
Палочки |
Палочки |
Палочки |
Палочки |
|
Размер клеток, мкм |
0.3-0.5 *1.0-2,0 |
0.6^1.5 |
07*1,5 |
0.6-0.8 И,4-2.8 |
0.2-0.4 *0.8-1,2 |
1.2-2.0 *0,2 |
|
11одвижность |
+ |
+ |
+ |
+ |
1 |
|
|
G+C (mol %) |
43.9 |
44.7 |
47.8 |
48.3 |
44.9 |
50.0 |
|
Доминирующие ЖК |
Ci» i,C|6q, Cis । |
С|6о, С1б:Ь С|£] |
Смог См л C1KI |
Смог См л C1KI |
Смог См ] |
Ci6o. Ci» 1, С]Ц:1 |
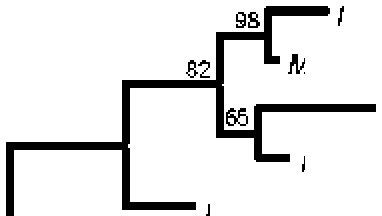
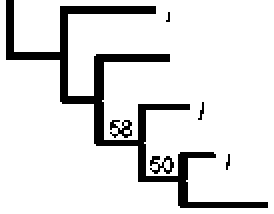
Филогенетическое дерево, показывающее положение штамма RS-MM3 относительно видов рода Methyiophaga, представлено на рисунке. Филогенетическое сходство с различными вицами рода достигало лишь межвидового уровня (95.3-96.7%). Изолят RS-MM3 сильнее связан с Methylophaga lonarensis MPLT, но значительно слабее - с груп пой метилобактерий, включающей XL frappieri JAM7T, XL nitrafireducenticrescens JAM1T, XL ni-iratireducenticrescens MIK и XL thiooxydans DMS 010.
Колонии на среде с агаром и метанолом бледно-розовые. круглые, выпуклые до 1-2 мм в диаметре. Клетки грамотрицательные аспорогенные подвижные палочки (0.3-0.5 х 1.0-2.0 мкм), умеренно галофильные, нейтрофильные и мезофильные. Растет в среде с 0.02-5% СН^ОН (оптимум 0.6-0.8%) и 0.2-10% NaCl (оптимум 3-5%), при 10-40°€ (оптимум 28-33°С) и pH 6.0-9.5 (оптимум pH 7.5-8.2). Аэроб, или факультативный анаэроб, оксидазо- и каталазо-положителен. Активную денитрификацию осуществляет в среде с пируватом, но значительно слабее с метанолом, лактатом, малатом и ацетатом. Факультативный метилотроф; метанол, метиламин, фруктозу и сахарозу использует в качестве источников углерода и энергии.
Содержит mxaF ген, кодирующий метанолдегидрогеназу. Метан, глюкозу, дрожжевой экстракт не утилизирует. Продуцирует кислоты из метанола, но не из фруктозы и сахарозы. Гидролизует крахмал, но не казеин или желатин. В качестве источников азота использует аммоний, нитрат, триптон и метиламин. Добавка витамина Bi2, дрожжевого экстракта (0.005%) и микроэлементов ускоряет рост. Чувствителен к эритромицину (15 мкг /диск) и стрептомицину (10 мкг /диск), но устойчив к ампициллин}7 (10 мкг /диск) и новобиоцину (30 мкг /диск).
0 02
Afetfiy/даада /cnarensts MPLT (JF3307 73)
— Methytophaga sp. RS-MM3(KF371S56)
M aminssuifidtvorans MP1 (NRO43871)
ff^/ass/ca ATOC 33145r (X87339)
M manna DSM 5989' (X95459)
M suifidavorans RB-11 (X95461)
M. tfnooxydans DMS0101 (DQ660915)
M framer/J AM 7' (NR121698) — M aicaiica M391 (AF364373) M ^atirec^erteesc JAM1 (NR074321)
M. nrtratireducenticrascans M1K (KM 192265)
M murahs КгЗг (AY694421)
^^^^^^^^^^^^^^" ГЛют/сго^о/га arct/ca SVAL-ET (AJ4Q4/31) Cycfoc&stio/s pugetii PS-1 (L34955)
Филогенетические отношения между7 изолятом денитрифицирующего метилотрофа RS-MM3 из фильтрационных вод ПТБО и представителями у-протеобактерий рода Methylophaga. Дерево построено на основе выравнивания последовательностей гена 16S рРНК длиной 1420 нк при использовании алгоритма Maximum-Likelihood. Число над ветвью обозначает Bootstrap значения выше 50%. Последовательности гена 16S рРНК Thiomicrospira ага lea SVAL-ET и Cydodasiicus pugeHi PS-1т взяты как внегрупповые виды. Масштаб соответствует 2% дивергенции
При оптимальных условиях роста (30°С, pH 7.8) в среде с метанолом (5 мл/л. 30 г/л NaCl, 20 мкг/л витамин Bi2) преобладают следующие жирные кислоты (% от общего количества ЖК): С|б:1о>7с (40.5). С]б:0 (35.2) И С13:Кй?с (1^.7). СОДСр-жание Г+Ц в ДНК составляет 43.9 мол. %. Основываясь на секвенировании гена 16S рРНК (Gen-Bank No KF371656) организм филогенетически близок к ограниченно-галоалкалофильным мети-лотрофам рода Methylophaga (95.3-96.7% сходства).
Заключение
В фильтрационных водах ПТБО С высоким уровнем загрязнения по нитратам и метану выявлено широкое распространение метилотрофных денитрифицирующих Proteohacteria. Выделена и описана умеренно галофильная метилотрофная денитрифицирующая GatHmaproteohactena рода Methylophaga (изолят RS-MM3) с низким содержанием Г+Ц в ДНК 43,9 мол.%. Основываясь на секвенировании гена 16S рРНК. у изолята установили филогенетическую близость к ограниченно галоал- калофильным метилотрофам рода Methylophaga (межвидовой уровень сходства составил 95.3-96.7%). По совокупности гено- и фенотипических признаков новый штамм идентифицирован как Methylophaga RS-ММ3 sp. nov.
Работа выполнена в рамках Комплексной программы УрО РАН (проект № 15-4-4-2).
Список литературы Предварительное описание нового вида галофильной метилобактерии рода Methylophaga из фильтрата полигона захоронения твёрдых бытовых отходов
- Вайсман Я.И., Вайсман О.Я., Максимов С.В. Управление метаногенезом на полигонах твердых бытовых отходов. Пермь: Изд-во ПГТУ, 2003. 232 с
- Иванова Е.Г. и др. Факультативные и облигатные метилобактерии синтезируют цитокинины//Микробиология. 2000. Т. 69, № 6. С. 764-769
- Ножевникова А.Н., Каллистова А.Ю., Кевбрина М.В. Эмиссия и окисление метана на полигоне захоронения твердых бытовых отходов: сезонные измерения//Труды Института микробиологии им. С.Н. Виноградского. 2006. Т. 13. С. 172-191
- Amann R.I., Ludwig W., Schleifer K.H. Phylogenetic identification and in situ detection of individual microbial cells without cultivation//Microbiol. Rev. 1995. Vol. 59. P. 143-169
- Doronina N.V., Darmaeva T.D., Trotsenko Y.A. Me-thylophaga alcalica sp. nov., a novel alkaliphilic and moderately halophilic, obligately methylotro-phic bacterium from an East Mongolian saline soda lake//Int. J. Syst. Evol. Microbiol. 2003. Vol. 53. P. 223-229
- Juretschko S. et al. The microbial community composition of a nitrifying-denitrifying activated sludge from an industrial sewage treatment plant analyzed by the full-cycle rRNA approach//Syst. Appl. Microbiol. 2002. Vol. 25. P. 84-99
- Kim H.G. et al. Methylophaga aminisulfidivorans sp. nov., a restricted facultatively methylotrophic marine bacterium//Int. J. Syst. Evol. Microbiol. 2007. Vol. 57. P. 2096-2101
- Knief C. et al. Cultivation-independent characterization of methylobacterium populations in the plant phyllosphere by automated ribosomal intergenic spacer analysis//Appl. and Environ. Microb. 2008. Vol. 74, № 7. P. 2218-2228
- Lane D.J. 16S/23S rRNA sequencing//Stackebrandt E., Goodfellow M. (eds) Nuc. Acids Tech. in Bact. Syst. Chichester: Academic Press, 1991. Р. 115167
- Lau E. et al. The methanol dehydrogenase gene mxaF, as a functional phylogenetic marker for proteobacterial methanotrophs in natural environments//PLOS ONE. 2013. Vol. 8. e56993
- Manz W. et al. Phylogenetic oligodeoxynucleotide probes for the major subclasses of proteobacteria: problems and solutions//Syst. Appl. Microbiol. 1992. Vol. 15. P. 593-600
- McDonald I.R., Murrell J.C. The methanol dehydro-genase structural gene mxaF and its use as a functional gene probe for methanotrophs and methy-lotrophs//Appl. Environ. Microbiol. 1997. Vol. 63. P. 3218-3224
- Snaidr J. et al. Phylogenetic analysis and in situ identification of bacteria in activated sludge//Appl. Environ. Microbiol. 1997. Vol. 63. P. 2884-2896
- Villeneuve C. et al. Methylophaga nitratireducen-ticrescens sp. nov. and Methylophaga frappieri sp. nov., isolated from biofilm of the methanol-fed denitrification system treating the seawater at the Montreal Biodome//Int. J. Syst. Evol. Microbiol. 2013. Vol. 63. P. 2216-2222


