Предварительные результаты исследования по оценке эффективности периоперационной химиотерапии в режиме FOLFIRINOX в сравнении с режимом FLOT у больных операбельной аденокарциномой желудка или кардиоэзофагеального перехода (II–III тип по классификации SIEWERT) cT4aN0M0, T1–4cN+cM0
Автор: Калинин А.Е., Авдюхин И.Г., Неред С.Н., Бесова Н.С., Трякин А.А., Артамонова Е.В., Титова Т.А., Обаревич Е.С., Игнатова Е.О., Козлов Н.А., Россомахина О.В., Шишкина Н.А., Колобанова Е.С., Малихова О.А., Абгарян М.Г., Никулин М.П., Архири П.П., Вашакмадзе Л.А., Перегородиев И.Н., Сулейманов Э.А., Стилиди И.С.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Собственные исследования. Вопросы онкохирургии
Статья в выпуске: 4 т.13, 2023 года.
Бесплатный доступ
Введение: В настоящий момент основным подходом к лечению больных операбельным раком желудка (РЖ) и кардио-эзофагеального перехода (КЭП) является проведение периоперационной химиотерапии в режиме FLOT. Режим mFOLFIRINOX показал свою эффективность и безопасность при диссеминированной аденокарциноме желудка и КЭП. В данной статье представлены предварительные результаты оценки эффективности и безопасности периоперационной химиотерапии в режиме FOLFIRINOX у больных операбельным РЖ и пищеводно-желудочного перехода. Материалы и методы: Исследование FOLFIRINOX/FLOT — открытое рандомизированное исследование 2/3 фазы. Набор пациентов в работу открыт в январе 2019 года и продолжается в настоящий момент. Критериями включения больных являются: гистологически подтвержденная резектабельная аденокарцинома желудка или пищеводно-желудочного перехода II–III типа по классификации Siewert с клинической стадией cT4aN0M0, cT1–4N1–3M0 или сT2–4N0–3M0 с тотальным или субтотальным поражением желудка. В качестве схем периоперационной химиотерапии использовали режимы FLOT: доцетаксел 50 мг/м2 в день 1, оксалиплатин 85 мг/м2 в день 1, лейковорин 200 мг/м2 в день 1, 5-фторурацил (5ФУ) 2600 мг/м2 за 24 часа, начиная с 1 дня, или режим mFOLFIRINOX: иринотекан 180 мг/м2 в день 1, оксалиплатин 85 мг/м2 в день 1, лейковорин 200 мг/м2 в день 1, 5ФУ 250 мг/м2 струйно в 1 день и далее 2200 мг/м2 за 48 часов, начиная с 1 дня. Первичной конечной точкой исследования является 5-летняя общая выживаемость. Результаты: Все запланированные предоперационные курсы химиотерапии в группе FLOT (n = 29) проведены 25 (86%) больным, в группе FOLFIRINOX (n = 24) — 22 пациентам (92%). Досрочно прекратили лечение 4 (12%) и 2 (8%) пациента в группах FLOT и FOLFIRINOX соответственно. Хирургический этап выполнен 48 пациентам (91%) (25 [86%] в группе FLOT и 23 [96%] в группе FOLFIRINOX). Полный регресс опухолевого процесса (Mandard 1) достигнут у 4 пациентов (2 [7%] в группе FLOT и 2 [8%] в группе FOLFIRINOX). Послеоперационные осложнения выявлены у 2 больных (8%) в группе FLOT и у 4 (17%) в группе FOLFRIRNOX. Тридцать три пациента (62%) получили все запланированные курсы лечения после операции: FLOT — у 19 (66%) и FOLFIRINOX — у 14 (58%) соответственно. Выводы: Предварительные результаты исследования FOLFIRINOX/FLOT показывают сопоставимую переносимость режимов и частоту полных патоморфологических регрессов опухоли. Однако отмечается более высокая частота послеоперационных осложнений среди больных, получивших режим FOLFIRINOX, в сравнении с группой больных, получивших режим FLOT.
Периоперационная химиотерапия, аденокарцинома желудка, аденокарцинома кардиоэзофагеального перехода, FLOT, FOLFIRINOX
Короткий адрес: https://sciup.org/140304588
IDR: 140304588 | DOI: 10.18027/2224-5057-2023-13-4-7-17
Текст научной статьи Предварительные результаты исследования по оценке эффективности периоперационной химиотерапии в режиме FOLFIRINOX в сравнении с режимом FLOT у больных операбельной аденокарциномой желудка или кардиоэзофагеального перехода (II–III тип по классификации SIEWERT) cT4aN0M0, T1–4cN+cM0
В НМИЦ онкологии имени Н.Н. Блохина для больных диссеминированным РЖ и кардиоэзофагеального перехода (КЭП) разработан и внедрен в рутинную клиническую практику режим mFOLFIRINOX. На основании наших данных объективный ответ на фоне терапии зарегистрирован у 56,6% пациентов при контроле роста опухоли в 84,6%. При медиане наблюдения в 7 мес. медиана безрецидив-ной выживаемости (БРВ) составила 8,7 мес., а медиана ОВ не достигнута.
МЕТОДЫ
Обследование больных было стандартным и включало: компьютерную томографию грудной клетки (КТ), брюшной полости и малого таза с двойным контрастированием или ПЭТ-КТ (в случае умеренно- или высокодифференцированной гистологической структуры опухоли), гастроскопию с эндосонографией, диагностическую лапароскопию с цитологическим исследованием смывов с брюшины.
Информированное согласие было утверждено этическим комитетом ФГБУ «НМИЦ онкологии имени Н.Н. Блохина» Минздрава России и комитетами онкологических центров, участвующих в работе. Исследование проводится в соответствии с Хельсинской декларацией и рекомендациями по проведению клинических исследований, утвержденными на международной конференции по гармонизации (International Conference on Harmonization). Координация, сбор и анализ данных исследования проводился в ФГБУ «НМИЦ онкологии им. Н. Н. Блохина» Минздрава России.
ХИМИОТЕРАПИЯ И ОПЕРАЦИЯ
В качестве режима периоперационной химиотерапии использовали режимы FLOT: доцетаксел 50 мг/м 2 в день 1, оксалиплатин 85 мг/м 2 в день 1, лейковорин 200 мг/м 2 в день 1, 5ФУ 2600 мг / м 2 × 24 часа, начиная с 1 дня, или режим mFOLFIRINOX: иринотекан 180 мг/м 2 в день 1, оксалиплатин 85 мг/м 2 в день 1, лейковорин 200 мг/м 2 в день 1, 5ФУ 250 мг/м 2 струйно в 1 день и далее 2200 мг/м 2 × 48 часов, начиная с 1 дня. Колоние-стимулируюшие факторы вводились согласно рутинной клинической практике, принятой в центре. Химиотерапия проводилась каждые 2 недели, всего 4 курса до операции и 4 курса после. Врач опрашивал и осматривал пациента перед началом каждого курса химиотерапии, оценивал статус пациента в соответствии с классификацией ECOG, оценивал побочные эффекты химиотерапии, дополнительно измеряли вес больного и выполняли общий и биохимический анализ крови.
ИЛИ КАРДИОЭЗОФАГЕАЛЬНОГО ПЕРЕХОДА (II–III ТИП ПО КЛАССИФИКАЦИИ SIEWERT) cT4aN0M0, T1–4cN+cM0
Собственные исследования. Вопросы онкохирургии
Рестадирование производилось на основании данных эндоскопии и компьютерной томографии (допустимо было выполнение магнитно-резонансной томографии (МРТ) или ПЭТ-КТ в зависимости от исследования, проведенного до начала лечения). В случае увеличения опухоли и/или регионарных лимфоузлов в размерах, повторно выполняли диагностическую лапароскопию с забором смывов с брюшины.
Операцию планировали через 4–6 недель после окончания последнего курса химиотерапии. В случае опухолевой
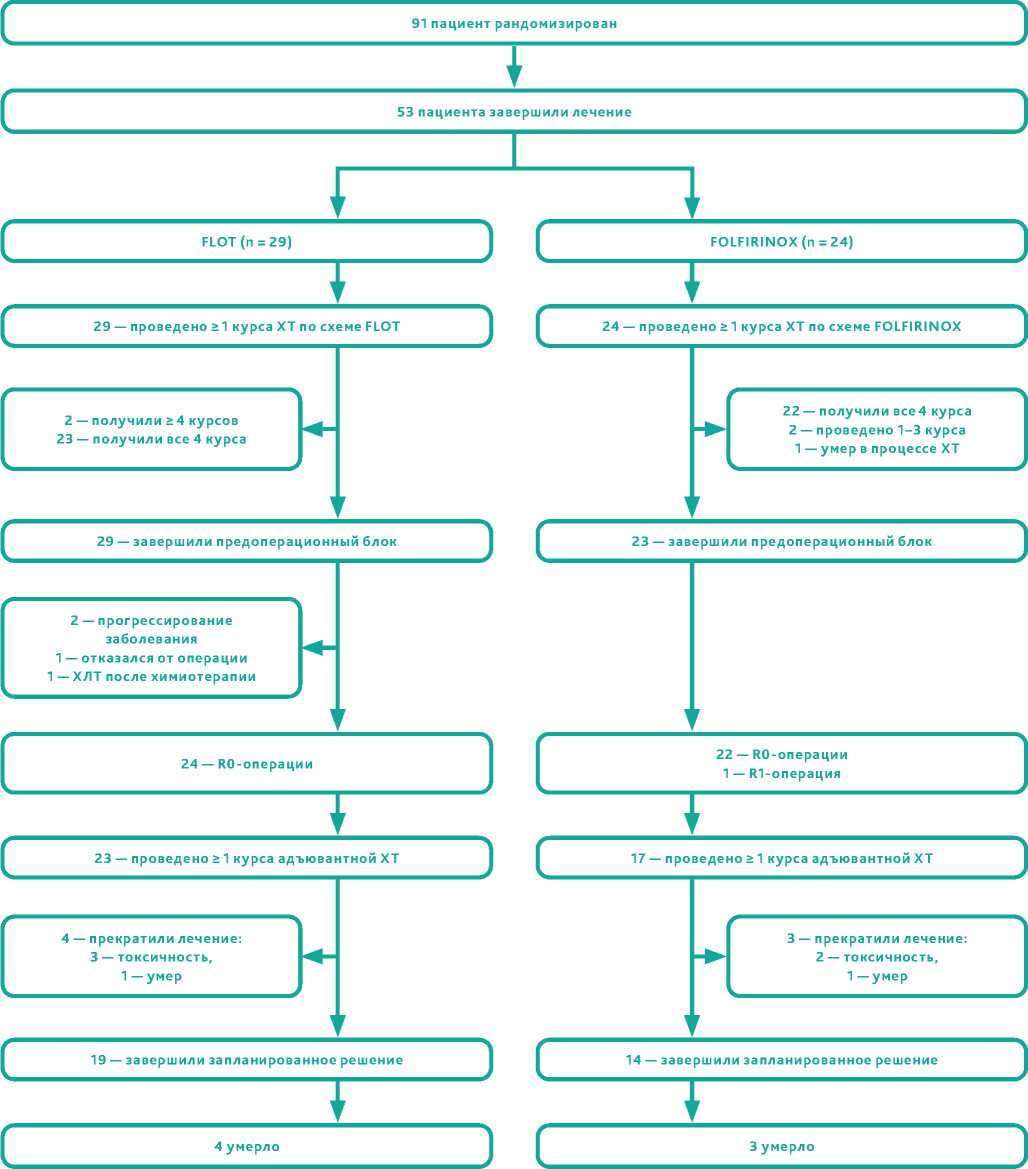
Рисунок 1.
Собственные исследования. Вопросы онкохирургии инфильтрации абдоминального сегмента пищевода, выполнение операции было возможным как из трансхиатального, так и из комбинированного торакотомного и лапаротом-ного доступов с экспресс-исследованием проксимального края резекции, при более высоком поражении пищевода — только из комбинированного доступа. Лимфодиссекцию выполняли в объеме D2.
Рестадирование после операции было основано на результатах исследования глубины инвазии опухоли, количества пораженных лимфоузлов, состояния краев резекции (R0, R1, R2) в соответствии с 7 классификацией TNM [11].
Побочные эффекты химиотерапии оценивали согласно 4.1 версии классификации осложнений, возникающих в результате использования противоопухолевых средств (CTCAE) [3].
Тяжесть послеоперационных осложнений оценивали в соответствии с классификацией Clavien–Dindo [6].
Динамическое наблюдение пациентов после завершения лечения включало компьютерную томографию или ПЭТ-КТ или МРТ каждые 4 месяца в течение 2 лет после операции, каждые 6 месяцев в течение последующих 3 лет.
КОНЕЧНЫЕ ТОЧКИ ИССЛЕДОВАНИЯ
Первичной конечной точкой исследования является 5-летняя ОВ, вторичными конечными точками — 5-летняя БРВ, частота достижения полного патоморфоза, R0 резекций. Общую выживаемость рассчитывали от даты рандомизации до последнего контакта с больным или смерти пациента, безрецидивную выживаемость — от даты рандомизации до выявления локального или системного рецидива заболевания, или смерти больного от любой причины.
СТАТИСТИЧЕСКАЯ ГИПОТЕЗА
В исследовании FLOT4 было показано, что проведение больным локализованным РЖ периоперационной химиотерапии в режиме FLOT позволяет достигнуть 5-летнюю
Таблица 1. Характеристика пациентов, включенных в исследование.
|
FLOT |
FOLFIRINOX |
||||
|
Пациенты |
n = 29 |
% |
n = 24 |
% |
P |
|
Возраст |
0,59 |
||||
|
< 60 лет |
16 |
55 |
11 |
46 |
|
|
60–70 |
13 |
45 |
13 |
54 |
|
|
Пол |
1,00 |
||||
|
муж. |
22 |
76 |
18 |
75 |
|
|
жен. |
7 |
24 |
6 |
25 |
|
|
Локализация |
0,63 |
||||
|
опухоли |
|||||
|
КЭП II тип |
6 |
21 |
3 |
12 |
|
|
КЭП III тип |
6 |
21 |
4 |
17 |
|
|
желудок |
17 |
58 |
17 |
71 |
|
|
Индекс Т |
0,34 |
||||
|
T1 |
0 |
17 |
0 |
4 |
|
|
T2 |
5 |
38 |
1 |
54 |
|
|
T3 |
11 |
42 |
13 |
38 |
|
|
T4 |
12 |
3 |
9 |
4 |
|
|
неясно |
1 |
1 |
|||
|
Индекс cN |
0,49 |
||||
|
N0 |
2 |
7 |
0 |
0 |
|
|
N1–3 |
27 |
93 |
24 |
100 |
|
|
Тип по класси- |
0,23 |
||||
|
фикации Лаурен |
|||||
|
диффузный |
11 |
38 |
12 |
50 |
|
|
кишечный |
15 |
52 |
12 |
50 |
|
|
смешанный |
2 |
7 |
0 |
0 |
|
|
нет данных |
1 |
3 |
0 |
0 |
|
|
Наличие |
0,76 |
||||
|
перстневидных |
|||||
|
клеток в опухоли |
|||||
|
есть |
7 |
24 |
7 |
29 |
|
|
нет |
22 |
76 |
17 |
71 |
|
ОВ в 45%. Учитывая высокую эффективность режима mFOLFIRINOX у пациентов с диссеминированным РЖ, мы предположили, что его применение позволит увеличить 5-летнюю ОВ до 57%. Было проведено определение размера выборки: при α = 0,05, мощности 80 %, двустороннем уровне значимости 0,05 и рандомизации в соотношении 1:1 с учетом потери 10% данных в исследование необходимо включить 538 пациентов, по 269 участников в группы периоперационной химиотерапии в режиме FLOT или mFOLFIRINOX. Рандомизация — блоковая (размер блока = 4), производилась центрально по телефону со стратификацией в зависимости от локализации опухоли (желудок и кардиоэзофагеальный переход), типа опухоли по классификации Лаурен (кишечный, диффузный, смешанный), медицинскому центру. После рандомизации пациенту присваивался уникальный идентификационный номер. Исследование является открытым и результат рандомизации известен и пациенту, и врачу.
Статистический анализ выполнен с использованием программной среды IBM SPSS Statistics 26, R. Для описания качественных переменных использовались такие характеристики, как абсолютные значения и проценты. Для сравнения качественных данных использовали точный
Собственные исследования. Вопросы онкохирургии
Таблица 2. Результаты хирургических вмешательств и патоморфологического исследования после операции.
* Рассчитывали исходя из 23 оперированных пациентов cN0 в группе FLOT и 23 в группе FOLFIRINOX.
критерии Фишера, хи-квадрат Пирсона. Общая выживаемость и выживаемость без прогрессирования болезни оценены методом Каплана–Майера в ITT популяции.
РЕЗУЛЬТАТЫ
С января 2019 по декабрь 2020 периоперационную химиотерапию по схеме FLOT получил 91 пациент. Медиана наблюдения составила 11 месяцев. Завершили лечение 53 пациента (рис. 1). Данные о больных, завершивших лечение, приведены в таблице 1.
Предоперационный блок химиотерапии был начат у 91 пациента.
В группе FOLFIRINOX (n = 24) 22 пациентам (92%) завершен полный блок предоперационной терапии. Досрочно прекратили лечение 2 больных (8%) по причине токсичности у 1 пациента (4%) и летального исхода в 1 случае (4%) (шигеллез) (рис. 1).
Хирургический этап выполнен 48 пациентам (91 %): в группе FLOT 25 из 29 больных (86%), в группе FOLFRIRINOX
23 из 24 (96%). Среди больных группы FLOT причинами отказа от вмешательства были прогрессирование заболевания (2 случая, 7%), отказ пациента (1 случай, 3%), изменение плана лечения — проведение химиолучевого лечения после химиотерапии у больного раком пищевода (1 случай, 3%). В группе FOLFIRINOX 1 пациент (4%) умер в процессе химиотерапии от кишечной инфекции (табл. 2).
В группе FLOT R0 операция выполнена всем 25 оперированным пациентам (86%), частота полного регресса опухолевого процесса (Mandard 1) отмечена у 7% (n = 2), среднее количество исследованных лимфоузлов — 28, санация пораженных опухолевым процессом регионарных лимфоузлов отмечена в 9 случаях (31%). В группе FOLFIRINOX R0 операция проведена 22 пациентам (96%), частота полного регресса опухолевого процесса (Mandard 1) — у 8% (n = 2), среднее количество исследованных лимфоузлов — 27, санация пораженных опухолевым процессом регионарных лимфоузлов выявлена в 7 случаях (30%).
Послеоперационные осложнения выявлены у 2 больных (8%) в группе FLOT и у 4 (17%) в группе FOLFRIRNOX. От послеоперационных осложнений умер 1 больной (4%), получивший химиотерапию по схеме FOLFIRINOX, оперированный симультанно в объеме аортокоронарного шунтирования и гастрэктомии в связи с выявлением критического стеноза коронарных сосудов.
Сорок пациентов (76%) начали проходить послеоперационной блок химиотерапии: 23 (79%) по схеме FLOT и 17 (71%) в режиме FOLFIRINOX; 33 пациента (62%) получили все запланированные курсы лечения после операции (FLOT n = 19, 66%, и FOLFIRINOX n = 14, 58%, соответствен-
Собственные исследования. Вопросы онкохирургии
Таблица 3. Токсичность химиотерапии.
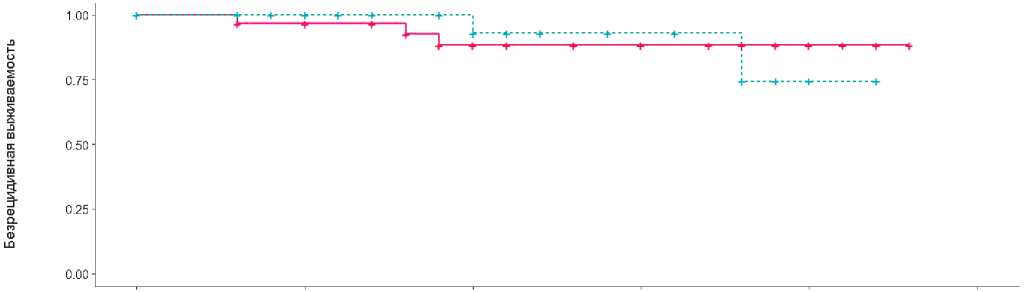
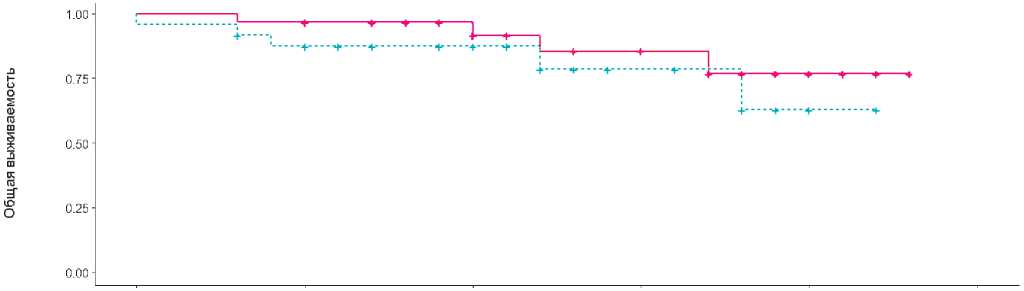
Медиана общей и безрецидивной выживаемости не достигнуты (рис. 2,3).
ОБСУЖДЕНИЕ
Частота послеоперационных осложнений среди больных, получивших режим FOLFIRINOX, была выше, чем у пациентов, которым проведены курсы химиотерапии по схеме FLOT (17% и 8%), при этом частота осложнений 3 и более степени в соответствии с классификацией Clavien–Dindo составила 12% и 8%, частота релапаротомий — 4% и 0%, летальность — 4% и 0%, соответственно. В группе FOLFIRINOX умер один больной от панкреоне-кроза и аррозивного кровотечения, пациенту по жизненным показаниям выполнена симультанная операция: гастрэктомия и аортокоронарное шунтирование на работающем сердце в связи с высоким риском кровотечения из язвенного компонента опухоли и критическим стенозом коронарных сосудов. В немецком исследовании частота осложнений и повторных операций составила 55% и 10% соответственно, что было выше показателей в нашем исследовании. Летальность в стационаре составила 2%, что соответствует нашим предварительным результатам.
ПРОФИЛЬ ТОКСИЧНОСТИ
Нежелательные явления, связанные с химиотерапией, оценивались у всех включенных в исследование пациентов (табл. 3).
Токсичность была приемлемой, ожидаемой и управляемой. Наиболее частым НЯ была гематологическая токсичность в обеих группах, в частности нейтропения, что требовало назначения Г-КСФ и удлинению межкурсовых интервалов.
В обеих группах НЯ 1–2 степени были сопоставимы по частоте встречаемости и преимущественно представлены тошнотой (41 % в группе FLOT, 45% в группе FOLFIRINOX), диареей (34 % в группе FLOT, 33% в группе FOLFIRINOX) и полинейропатией (24% в группе FLOT, 29% в группе FOLFIRINOX). Нейтропения 1–2 степени выявлена у 24% пациентов в группе FLOT и 12% в группе FOLFIRINOX, 3–4 степени — у 48% и 41% в группах FLOT и FOLFIRINOX соответственно.
Медиана общей и безрецидивной выживаемости не достигнуты. Двухлетняя ОВ в группе FLOT составила 78%, тогда как в исследовании FLOT-AIO4 в группе FLOT — 68%; 2-летняя БРВ составила 88% и 53% соответственно.
Ряд непосредственных результатов лечения больных, получивших режим FLOT в нашем исследовании, в сравнении с результатами немецкого исследования оказались хуже, что скорее связано с более распространённым опухолевым процессом у пациентов, включенных в наше исследование.
ИЛИ КАРДИОЭЗОФАГЕАЛЬНОГО ПЕРЕХОДА (II–III ТИП ПО КЛАССИФИКАЦИИ SIEWERT) cT4aN0M0, T1–4cN+cM0
ВЫВОДЫ
Предварительные результаты исследования FOLFIRI-NOX/FLOT показывают сопоставимую переносимость режимов и частоту полных патоморфологических регрессов опухоли. Однако отмечается более высокая частота послеоперационных осложнений среди больных, получивших режим FOLFIRINOX, в сравнении с группой больных, получивших режим FLOT.
|
0 |
5 10 15 20 25 Время(месяцы) |
|
I FLOT J 29 Ф FOLFIRINOX 24 |
27 16 11 5 0 20 14 6 2 0 |
|
0 |
5 10 15 20 25 Время(месяцы) |
Режим ■+■ PLOT ■ FOLFIRINOX
Рисунок 2. Безрецидивная выживаемость больных, получивших периоперационные курсы химиотерапии по схеме FLOT/FOLFIRINOX.
|
0 |
5 10 15 20 25 Время(месяцы) |
|
I FLOT J 29 Ф FOLFIRINOX24 |
28 19 12 5 D 20 14 6 2 0 |
|
0 |
5 10 15 20 25 Время(месяцы) |
Режим +- PLOT ■+• FOLFIRINOX
Рисунок 3. Общая выживаемость больных, получивших периоперационные курсы химиотерапии по схеме FLOT/FOLFIRINOX.
Собственные исследования. Вопросы онкохирургии
Список литературы Предварительные результаты исследования по оценке эффективности периоперационной химиотерапии в режиме FOLFIRINOX в сравнении с режимом FLOT у больных операбельной аденокарциномой желудка или кардиоэзофагеального перехода (II–III тип по классификации SIEWERT) cT4aN0M0, T1–4cN+cM0
- Al-Batran SE, Homann N, Pauligk C. et al. Perioperative chemotherapy with fluorouracil plus leucovorin, oxaliplatin, and docetaxel versus fluorouracil or capecitabine plus cisplatin and epirubicin for locally advanced, resectable gastric or gastro-oesophageal junction adenocarcinoma (FLOT4) : a randomised, phase 2 / 3 trial. Lancet. 2019 May 11 ; 393 (10179) : 1948-1957. https://doi.org/10.1016/S0140-6736(18)32557-1. Epub 2019 Apr 11. PMID: 30982686.
- Al-Batran SE, Hofheinz RD, Pauligk C et al. Histopathological regression after neoadjuvant docetaxel, oxaliplatin, fluorouracil, and leucovorin versus epirubicin, cisplatin, and fluorouracil or capecitabine in patients with resectable gastric or gastro-oesophageal junction adenocarcinoma (FLOT4-AIO) : results from the phase 2 part of a multicentre, open-label, randomised phase 2 / 3 trial. Lancet Oncol. 2016 Dec ; 17 (12) : 1697-1708. https://doi.org/10.1016/S1470-2045(16)30531-9. Epub 2016 Oct 22. PMID: 27776843.
- Stark AP, Ikoma N, Chiang YJ et al. Characteristics and Survival of Gastric Cancer Patients with Pathologic Complete Response to Preoperative Therapy. Ann Surg Oncol. 2019 Oct ; 26 (11) : 3602-3610. https://doi.org/10.1245/s10434-019-07638-8. Epub 2019 Jul 26. PMID: 31350645.
- Mandard AM, Dalibard F, Mandard JC, Marnay J, Henry-Amar M, Petiot JF, et al. Pathologic assessment of tumor regression after preoperative chemoradiotherapy of esophageal carcinoma. Clinicopathologic correlations. Cancer. 1994 ; 73 : 2680-6.
- Lauren P. The two histological main types of gastric carcinoma : diff use and so-called intestinal-type carcinoma. An attempt at a histo-clinical classifi cation. Acta Pathol Microbiol Scand 1965 ; 64 : 31-49.
- Dindo D, Demartines N, Clavien PA. Classification of surgical complications : a new proposal with evaluation in a cohort of 6336 patients and results of a survey. Ann Surg 2004 ; 240 (2) : 205-213.
- Ferlay J., Soerjomataram I., Dikshit R., Eser S., Mathers C., Rebelo M. et al. Cancer incidence and mortality worldwide : sources, methods and major patterns in GLOBOCAN 2012. Int J Cancer. 2015 ; 136 : E359-86).
- Cunningham D, Allum WH, Stenning SP, Thompson JN, et al.Perioperative chemotherapy versus surgery alone for resectable gastroesophageal cancer. N Engl J Med 2006 ; 355 : 11-20.
- Ychou,M, Boige, V, Pignon,J-P, Conroy T,et al. Perioperative Chemotherapy Compared With Surgery Alone for Resectable Gastroesophageal Adenocarcinoma : An FNCLCC and FFCD Multicenter Phase III Trial. J Clin Oncol 29 : 1715-1721).
- Трусилова, Е. Эффективность и токсичность химиотерапии по схеме FOLFIRINOX у больных диссеминированным раком желудка. Предварительные результаты / Е.В. Трусилова, Н.С. Бесова, В.А. Горбунова и др. // Эффективная фармакотерапия. Онкология, гематология, радиология .- 2013 .- Т. 46 (4) .- С. 6-13.
- International Union Against Cancer (UICC). TNM Classification of Malignant Tumours, 7th ed. Sobin L.H., Gospodarowicz M.K., Wittekind Ch., eds. New York : Wiley-Blackwell ; 2009.


