Предварительный анализ гемоцианинов в гемолимфовой плазме эндемичных амфипод Байкала
Автор: Бедулина Д.С., Гурков А.Н., Бадуев Б.К., Борвинская Е.В., Димова М.Д., Тимофеев М.А.
Журнал: Журнал стресс-физиологии и биохимии @jspb
Статья в выпуске: 1 т.12, 2016 года.
Бесплатный доступ
Двумерный электрофорез белков плазмы гемолимфы нескольких эндемичных видов байкальского амфипод показал, что гемоцианин является основным основным белком в плазме этих видов. Изоформы гемоцианинов образуют на гелях максимум 24 отдельных пятна с несколько иной молекулярной массой и меняются по их изоэлектрическим точкам. Анализ транскрипционных последовательностей гемоцианина байкальского амфиполя Eulimnogammarus verrucosus выявил широкую гетерогенность изоформ гемоцианина, которые были разделены на две различные группы по их аминокислотной последовательности и имеют разную расчетную молекулярную массу и изоэлектрические точки. Бета-тип гемоцианина впервые описан для перкаридных ракообразных.
Короткий адрес: https://sciup.org/14323987
IDR: 14323987
Текст научной статьи Предварительный анализ гемоцианинов в гемолимфовой плазме эндемичных амфипод Байкала
Возрастающая антропогенная нагрузка и глобальные климатические изменения негативно сказываются на состоянии водных экосистем. Одним из критических факторов, подвергающихся существенным изменениям, для гидробионтов является температурно-кислородный режим. В этой связи для своевременной оценки состояний водных сообществ необходимо понимание физиологических и биохимическо-молекулярных основ кислородного метаболизма водных организмов. Одними из наиболее чувствительных к содержанию кислорода гидробионтов являются ракообразные, что связано с ограниченным поступлением растворенного кислорода в жидкости организма через хитинизированные покровы этих беспозвоночных (Vaquer-Sunyer and Duarte, 2008).
Ракообразные, представленные преимущественно амфиподами (Amphipoda: Crustacea), являются доминирующим таксоном в бентосных сообществах озера Байкал, главной особенностью экосистемы которого является высокая степень биоразнообразия и эндемизма фауны (Bajkalovedenie, 2012; Takhteev, 2015). Столь высокая степень эндемизма отражается на широте границ толерантности доминантных гидробионтов, поскольку известно, что эндемики являются узкоспециализированными к определенному комплексу абиотических параметров экосистемы (Timofeyev, 2010). Как показали данные 70-летнего мониторинга, а также последние сообщения, экосистема озера Байкал претерпевает значительные изменения, связанные с возрастающей хозяйственной деятельностью человека и глобальными климатическими изменениями (Kravtsova et al., 2014; Hampton et al. 2009; Moore et al., 2009).
Известно, что транспорт кислорода в ткани и органы ракообразных обеспечивается за счёт белков-гемоцианинов, которые представляют собой крупные, многокомпонентные комплексы, состоящие из разнородных по составу полипептидных цепей, каждая из которых несёт высококонсервативный кислород-связывающий домен (van Holde and Miller, 1995; Decker et al ., 2007; Decker and van Holde, 2011). Полиморфизм комплексов гемоцианина зачастую видоспецифичен и отражает кислородную ёмкость этого транспортного белка, что напрямую связано с уровнем толерантности организма к стрессовым нагрузкам, сопряжённым с гипоксией. Изучение структуры изоформ гемоцианина ракообразных важно для понимания функциональных особенностей и эволюции белковых семейств транспортёров кислорода у беспозвоночных.
Кристаллографический анализ отдельных субъединиц гемоцианина настоящего лангуста Panulirus interruptus (Randall, 1840) и мечехвоста Limulus Polyphemus (Linnaeus, 1758) показал, что каждая субъединица представлена тремя доменами — N-терминальный домен, формирующий за счёт спиральных α-цепей узкий канал для входа молекулы O2, центральный домен, содержащий сайт связывания с кислородом, представленный двумя атомами меди в комплексе с тремя остатками гистидина, и С-терминальный домен, содержащий мотив β-складчатости. Шесть таких субъединиц с молекулярной массой около 75 кДа объединяются в комплекс из двух тримеров, образуя гексамер с молекулярной массой около 450 кДа. Количество субъединиц, формирующих этот комплекс, варьирует в зависимости от таксономического положения ракообразного. Как было показано, каждая из формирующих комплекс гемоцианина субъединиц, представлена продуктом уникального гена (Voit et al., 2000; Terwilliger et al., 2006).
В 1986 г. Markl продемонстрировал, что различные субъединицы гемоцианина высших ракообразных могут быть классифицированы, в зависимости от их роли в агрегации комплекса и различной иммуноспецифичности. В частности, им было выделено три типа субъединиц — α, β и γ. Позднее, в ряде работ было показано, что помимо описанных, существуют также и другие типы субъединиц гемоцианина высших ракообразных (Hagner-Holler et al ., 2005; Scherbaum et al ., 2010). Однако, к настоящему моменту, вопрос разнообразия и эволюции субъединиц гемоционина у ракообразных, остаётся недостаточно изученным, что особенно актуально для амфипод. Так, например, в базе данных GenBank на данный момент доступны лишь две последовательности гемоцианинов, принадлежащие двум видам амфипод.
Целью настоящего исследования явилось выявление и описание белков плазмы гемолимфы байкальских литоральных амфипод с акцентом на анализ количества и разнообразия субъединиц гемоцианина в протеоме плазмы и их транскриптов в транскриптоме амфипод. В данной работе проведён предварительный анализ белковых спектров гемоцианина с помощью метода двумерного электрофореза, а также анализ последовательностей транскриптов гемоцианина одного из исследуемых видов, полученных на основе полногеномного секвенирования транскриптома.
MATERIALS AND METHODS
Для исследования были выбраны три наиболее массовых вида литорали юго-западного побережья озера Байкал, принадлежащие одному роду: Eulimnogammarus verrucosus (Gerstfeldt, 1858), E. vittatus (Dybowsky, 1874) и E. cyaneus (Dybowsky, 1874). Амфипод отлавливали в сентябре 2015 г. при помощи гидробиологического сачка с глубины 0-1 м. в прибрежной зоне югозападного побережья оз. Байкал (пос. Большие Коты; 51° 54' 6,5" СШ, 105° 3' 58,8" ВД). Непосредственно после вылова, амфиподы были доставлены в лабораторию в термостатируемых контейнерах и помещены раздельно по видам для акклимации в аквариумы с аэрируемой байкальской водой при температуре 6-7°С. В качестве корма использовали высушенную и измельчённую смесь водорослей, беспозвоночных, макрофитов и детрита с места вылова.
Отбор гемолимфы производили после 3-4 дней акклимации из половозрелых особей амфипод, избегая самок 3-й и 4-й стадий линочного цикла. Отбор гемолимфы осуществляли на льду при помощи стеклянных капилляров. Для отбора одного образца использовали как минимум 2 особей E. verrucosus, 5 особей E. vittatus и 10 особей E. cyaneus. Непосредственно после отбора образцы гемолимфы помещали (1:1) в стоящий на льду антикоагуляционный раствор для высших раков (19,3 мМ цитрат натрия, 239,8 мМ NaCl, 182,5 мМ глюкоза, 6,2 мМ ЭДТА, pH 7,3 по (van de Braak et al., 1996)) с добавлением 1 % коктейля ингибиторов протеаз (Amresco). Отобранные образцы гемолимфы центрифугировали при 1500 g 10 мин при 4 °С для осаждения клеток. Осадки были просмотрены под световым микроскопом для проверки наличия осажденных клеток гемолимфы.
Содержание белка в плазме определяли по методу Bradford (1976). Белок из плазмы гемолимфы выделяли при помощи осаждения трихлоуксусной кислотой (конечная концентрация — 10 %), после чего осадки дважды промывали 98 % холодным этанолом, ресуспендировали в ультрачистой воде и осаждали добавлением двух объёмов холодного ацетона. После удаления ацетона осадки, содержащие очищенный белок, растворяли в буфере по О'Фаррелл (O'Farrell, 1975) (8 M мочевина, 2 % Triton X-100, 0,05 M дитиотриетол, 0,5 % амфолиты, рН 3,5-10 (BioRad, США)).
Образцы, содержащие 400-450 мкг общего белка наносили на 3,84 % полиакриламидный гель с добавлением амфолитов с диапазоном pH 1-10 и 5-7 (BioRad, США). Изоэлектрофокусирование проводили в стеклянных капиллярах (внутренний диаметр — 3 мм, длина геля — 13,5 см) при помощи модифицированной системы BioRad Protean II Xi cell (США) при 4 °С в течение 18 ч, постепенно повышая силу тока от 100 до 900 мА. После проведения изоэлектрофокусирования гели извлекали из капилляров, инкубировали в растворе Лэммли (9 % SDS (вес/объём), 6 % β-меркаптоэтанол (объём/объём), 10 % глицерин (объём/объём), и 2-5 мг бромфенолового синего в 0,196 M Трис-HCl (pH 6,7)). Второе направление электрофореза проводили по Лэммли (Laemmli, 1970) в 10 % полиакриламидном геле (размер разделяющего геля составил 16х20 см), используя систему BioRad Protean II Xi cell (США) с охлаждением. После проведения электрофореза гели были окрашены в растворе, содержащем 0,2 % Кумасси бриллиантовый синий G-250 в 25 % изопропаноле и 10 % уксусной кислоте в течение 0,5 ч и отмывали в 25 % изопропаноле и 10 % уксусной кислоте 2 раза по 0,5 ч, после чего помещали гели в дистиллированную воду на ночь. Гели фотографировали при помощи системы гель-документации MiniLumi (Berthold Technologies). Анализ изображений гелей производили при помощи программы ImageJ (Schneider et al., 2012).
Идентификацию белков в выявленных на гелях белковых пятнах производили при помощи масс-спектрометрии. Для этого пятна были вырезаны из гелей и белки были подвержены трипсинолизу в 4
мкл раствора модифицированного трипсина (Promega) в 0,05 М NH 4 HCO 3 с концентрацией 15 мкг/мл. Гидролиз проводили в течение 6 ч при 37 °С, затем к раствору добавляли 7 мкл 0,5 % трифторуксусной кислоты в 10 % растворе водного ацетонитрила и тщательно перемешивали. Надгелевый раствор использовали для получения MALDI-масс-спектров. Подготовка образцов для масс-спектрометрии проводилась следующим образом: на мишени смешивали по 2 мкл раствора образца и 0,5 мкл раствора 2,5-дигидроксибензойной кислоты (Aldrich; 10 мг/мл в 20 % водном ацетонитриле, 0,5 % трифторуксусной кислоте), полученную смесь высушивали на воздухе.
Масс-спектры были получены на MALDI-времяпролетном масс-спектрометре UltrafleXtreme BrukerDaltonics (Германия), оснащённом УФ-лазером (Nd) в режиме положительных ионов с использованием рефлектрона; точность измеренных моноизотопных масс после докалибровки по пикам автолиза трипсина составляла 0,003 % (30 ррм). Спектры получали в диапазоне масс 700-4500 m/z, выбирая мощность лазера оптимальную для достижения наилучшего разрешения. Идентификацию белков осуществляли при помощи программы Mascot (. Масс-спектры были обработаны с помощью програмного пакета FlexAnalysis 3.3 (Bruker Daltonics, Германия), созданы пик-листы формата htm. При помощи программы Mascot (опция «пептидный фингерпринт») провели поиск в базе данных NCBI nr среди белков всех организмов с указанной выше точностью, с учётом возможного окисления метионинов кислородом воздуха и возможной модификации цистеинов акриламидом геля. Кандидатные белки, имеющие параметр достоверности score >87 в базе данных NCBI nr считали определенными довольно надежно (p<0,05). Масс-спектрометрические работы выполняли на приборной базе Центра коллективного пользования «Протеом человека» ИБМХ РАМН (г. Москва).
Предполагаемые белковые последовательности изоформ гемоцианина байкальского эндемичного вида амфипод E. verrucosus были определены на основе ранее полученных сборок транскриптомов данного вида (данные не опубликованы). Сборки транскриптомов трёх индивидуумов амфипод были объединены в базу данных, в которой осуществляли поиск последовательностей, схожих с известными последовательностями гемоцианинов ракообразных типов α, β и γ, с помощью алгоритма TBLASTX (Camacho et al., 2009). В базе транскриптомов E. verrucosus было обнаружено около 40 контигов, имеющих протяжённые участки (длиной не менее 100 аминокислотных остатков), схожие (не менее 60 % идентичных аминокислот) с известными последовательностями гемоцианина ракообразных. Обнаруженные контиги были объединены с помощью алгоритма CAP3 (Huang and Madan, 1999) в 7 уникальных транскриптов гемоцианина, 6 из которых содержали полную рамку считывания. Полные и частичная рамки считывания были определены на основе схожести с белковыми последовательностями гемоцианинов других ракообразных, обнаруженной с помощью алгоритма BLASTX при поиске против базы данных NCBI nr, после чего обнаруженные транскрипты гемоцианина E. verrucosus были транслированы.
Изоформы гемоцианина E. verrucosus были выровнены при помощи алгоритма CLUSTALW (Larkin et al., 2007) вместе с белковыми последовательностями изоформ гемоцианина других видов ракообразных, часть которых была ранее использована для поиска контигов в сборках транскриптомов E. verrucosus, после чего методом ближайших соседей было построено древо рассматриваемых изоформ гемоцианина (500 бутстреп-реплик) при помощи программы MEGA 6.0 (Tamura et al., 2013). Были использованы доступные белковые последовательности гемоцианинов двух видов амфипод: GroHc1, Gammarus roeseli (идентификационный номер в GenBank: CAI78901.1); CscHc1, Cyamus scammoni (ABB59715.1). Кроме того, были использованы следующие последовательности изоформ гемоцианина других ракообразных:
HamHcA_partial, Homarus americanus (CAB75960.1, неполная); PleHc, Pacifastacus leniusculus (AAM81357.1); MmaHc1–6,
Metacarcinus magister (AAW57889.1, AAW57890.1,
AAW57891.1, AAW57892.1, AAW57893.1,
AAA96966.2); PvuHc1–4, Palinurus vulgaris
(CAC69243.1, CAC69244.1, CAC69245.1,
CAD56697.1); CsaHc, Callinectes sapidus (AAF64305.1); LvaHc1_partial, Litopenaeus vannamei (CAB85965.1, неполная). Изоформы гемоцианина E. verrucosus помечены как EveHc1-7. Гемоцианин насекомого Acromyrmex echinatior (EGI65377.1) был использован в качестве аутгруппы.
Для последующего предсказания молекулярного веса и изоэлектрической точки шести полных изоформ гемоцианина E. verrucosus в их белковых последовательностях был произведён поиск и удаление сигнальных пептидов с помощью сервиса SignalP 4.1 (Petersen et al., 2011). Молекулярный вес и изоэлектрическую точку полных изоформ предсказывали с помощью сервиса IPC , для изоэлектрической точки использовали рекомендуемое сервисом предсказание обозначенное как «IPC Protein». Предсказание положения основных доменов проводили при помощи online сервиса NCBI Conserved Domain Search (Marchler-Bauer et al., 2011).
RESULTS AND DISCUSSION Полиморфизм белкового состава гемолимфы амфипод
Концентрация общего белка в плазме гемолимфы в среднем составила 10 мг/мл. Как показали результаты анализа 2D-гелей (Рис. 1), протеом гемолимфы амфипод представлен несколькими основными группами белков. В частности, для E. verrucosus отмечали наличие 12 белковых пятен, среди которых можно выделить в качестве мажорных группы пятен под номерами 1,
2, 3 и 4. Те же белковые пятна преобладали на гелях другого близкородственного вида E. vittatus . Помимо выявленных у E. verrucosus , на гелях E. vittatus отмечали наличие ещё двух белковых пятен — пятна 13 с молекулярной массой примерно 80 кДа и белка 14, находящегося в щелочной зоне (pI = 10, Mr = 30 кДа).
Для другого близкородственного вида — E. cyaneus характерна несколько иная картина белков плазмы гемолимфы. В частности, помимо также преобладающих высокомолекулярных белков из групп 1, 2, 3, 4 и 5, для этого вида характерен иной набор низкомолекулярных белков гемолимфы. Так, вместо белкового пятна 8 (Mr = 37 кДа для E. verrucosus и 49 кДа для E. vittatus ) на гелях отмечали пятно 16, с молекулярной массой 42 кДа, смещённое в сторону более щелочного pH, чем пятно 8. Вместо группы из двух белковых пятен 11 и 10 в кислой области геля с молекулярной массой 25 кДа для E. verrucosus и 28 кДа для E. vittatus на гелях плазмы E. cyaneus в этой области присутствовало одно белковое пятно 15 с молекулярной массой 27 кДа. Отмечали отсутствие белкового пятна 6 у этого вида, по сравнению с двумя другими.
После проведённого масс-спектрометрического анализа, было выявлено, что преобладающая на гелях всех видов группа пятен 2 и 3 представлена гемоцианином. Соседствующие группы пятен 4, 5 и 13 достоверно идентифицировать не удалось по причине отсутствия гомологичных последовательностей в общедоступных базах данных. Более детальный анализ позволил выявить на гелях всех видов до 24 субъединиц гемоцианина, отличающихся по изоэлектрической точке. Все эти изоформы образуют максимум 4 группы с различными молекулярными массами (Рис. 2).
Полная открытая рамка считывания выявленных в транскриптах субъединиц гемоцианина EveHc1 и EveHc4 - EveHc7 состояла из 645 аминоксислотных остатков (а.о.), и включала в себя три домена – N-терминальный (126 а.о.), медь-связывающий (257 а.о.) и С-терминальный (252 а.о.). Помимо этого, была выявлена изоформа EveHc3, содержащая укороченную рамку считывания (641 а.о.) и немного отличающаяся по длине основных доменов (128 а.о. – N-терминальный, 254 а.о. – медь-связвающий и 249 а.о. – С-терминальный). Полученное филогенетическое древо последовательностей гемоцианинов ракообразных (Рис. 3) показывает, что шесть из семи изоформ гемоцианина E. verrucosus наряду с известными последовательностями гемоцианинов двух других видов амфипод не принадлежат к типам α, β, или γ, и вместе формируют отдельную кладу древа, специфичную для надотряда высших раков Перкарида (Percarida Calman 1904), к которым относятся амфиподы, группу изоформ (Terwilliger, 2015). В то же время, оказалось, что изоформа EveHc3 принадлежит к типу β. Ранее субъединицы
β-типа были обнаружены только у представителей надотряда высших раков Эвкарида (Eucarida Calman, 1904) и подкласса Гоплокарида (Hoplocarida Calman, 1904) (Terwilliger, 2015). По данным молекулярно-филогенетического анализа с использованием метода «молекулярных часов» ранее было установлено, что β-тип является наиболее эволюционно древним, возникшим при образовании подкласса Eumalacostraca (Grobben, 1892). Дальнейшая эволюция этого белкового семейства привела к формированию перкаридного типа субъединиц, которые вместе с этим приобрели новую дополнительную функцию — фенолоксидазы. Наиболее поздним по времени образования типом является типы α и γ, возникшие при диверсификации эвкарид (Scherbaum et al ., 2010).
Изоформы гемоцианина E. verrucosus, для которых удалось получить полные белковые последовательности (все кроме EveHc2), формируют следующий градиент молекулярных масс: EveHc1 и EveHc3 обладают наибольшей и наименьшей массами — около 75950 Да и 73730 Да соответственно, что может соответствовать пятнам из группы 1-5 и 18-24 (Рис.2), в то время как изоформы EveHc4-7 по этому параметру очень близки между собой — их вес находится в диапазоне 74600-74830 Да, что позволяет предположить их соответствие пятнам из группы 917 (Рис.2). По изоэлектрической точке наблюдается несколько иная картина: изоформа β-типа EveHc3 вновь выделяется и имеет наименьшую pI — 4,86. Принадлежность этой изоформы к типу эволюционно-отдаленному β позволяет предположить её соответствие белковой группе 4 на Рис. 1, однако к настоящему моменту идентифицировать белки этой группы не удалось. Дальнейшие исследования будут направлены на более точные методы идентификации белков из группы 4 с целью проверки предложенной гипотезы. Изоформы EveHc1,4,5,7 группируются по pI в диапазоне 5,04-5,08 и изоформа EveHc6 обладает наибольшим значением pI — 5,12, что может свидетельствовать о ее соответствии пятну 9.
Показанное несоответствие количества различных типов транскриптов количеству обнаруженных на гелях изоформ можно объяснить наличием модификаций имеющихся изоформ. Помимо этого, известно, что большая структурная и функциональная гетерогенность изоформ гемоцианина ракообразных существенно влияет на состав изоформ при различных физиологических состояниях организма. В частности, показано, что абиотические факторы среды, такие как температура, кислород, pH, соленость, а также стадия отногенеза вызывают изменение состава изоформ гемоцианина у ракообразных (deFur et al., 1990; Mangum et al., 1991; Mangum, 1997; Decker and Foll, 2000). Так, изменение солёности среды приводило к усилению экспрессии отдельных субъединиц гемоцианина у амфиподы Chaetogammarus marinus (Leach, 1815), что увеличивало афинность гемоцианина к кислороду (Spicer and Hodgson, 2003). Таким образом, можно предположить, что описанное на гелях максимальное количество субъединиц гемоцианина (24) может быть обусловлено физиологическим состоянием организма и может варьировать, что было показано при анализе гелей. Тем не менее, проведённое исследование демонстрирует большую структурную гетерогенность транскриптов и белков субъединиц гемоцианина у байкальских амфипод. Такая гетерогенность, показанная также и для других ракообразных, может существенно сказаться на адаптивных способностях видов в условиях глобального изменения климата и возрастающей антропогенной нагрузки, поскольку состав изоформ гемоционина и их экспрессионная активность у разных видов может отличаться. Nora B. Terwilliger (2015) предположила возможность эпигенетических модификаций генов субъединиц гемоцианина у ракообразных под влиянием изменений окружающей среды, что может сказаться на эволюции структуры и функции этого важного белка.
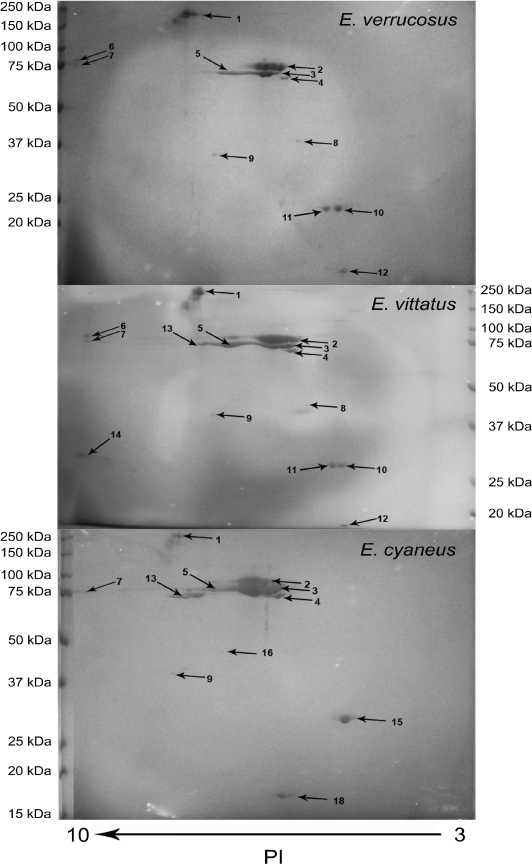
Figure 1. Двумерные электрофореграммы белков плазмы гемолимфы байкальских амфипод после
изоэлектрофокусирования и денатурирующего ПААГ-электрофореза, окрашенные кумасси.
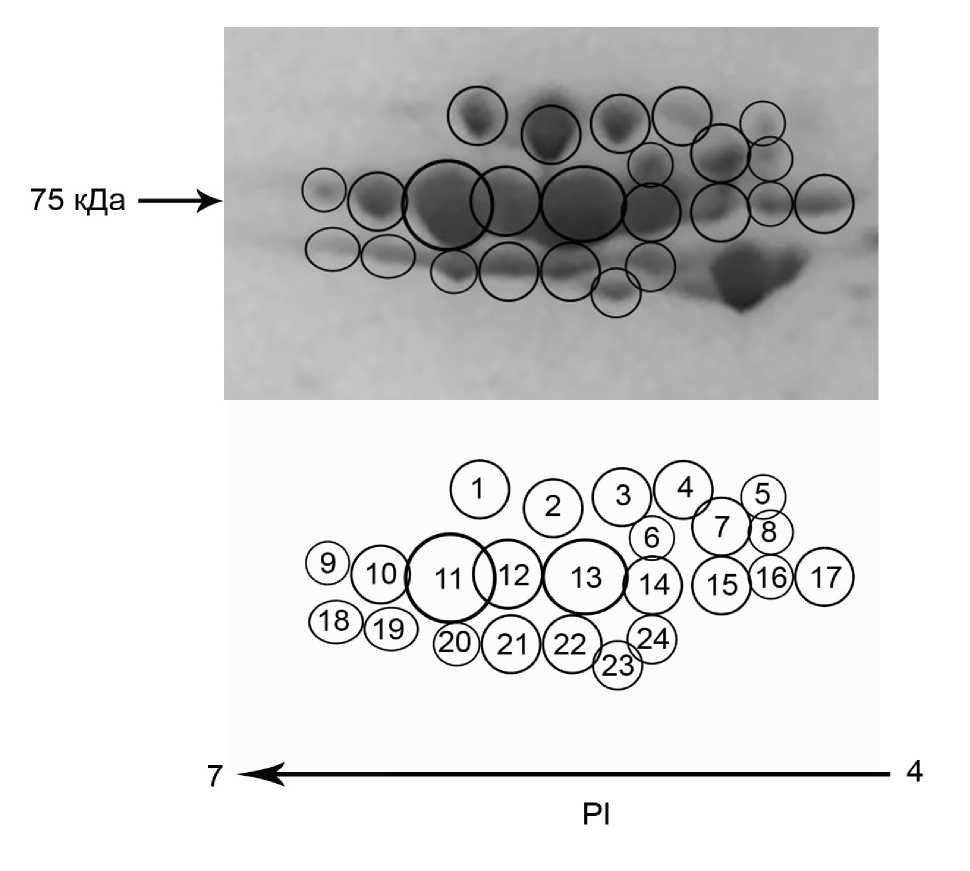
Figure 2. Схема расположения субъединиц гемоцианина на двумерных электрофореграммах байкальских амфипод на примере E. verrucosus .
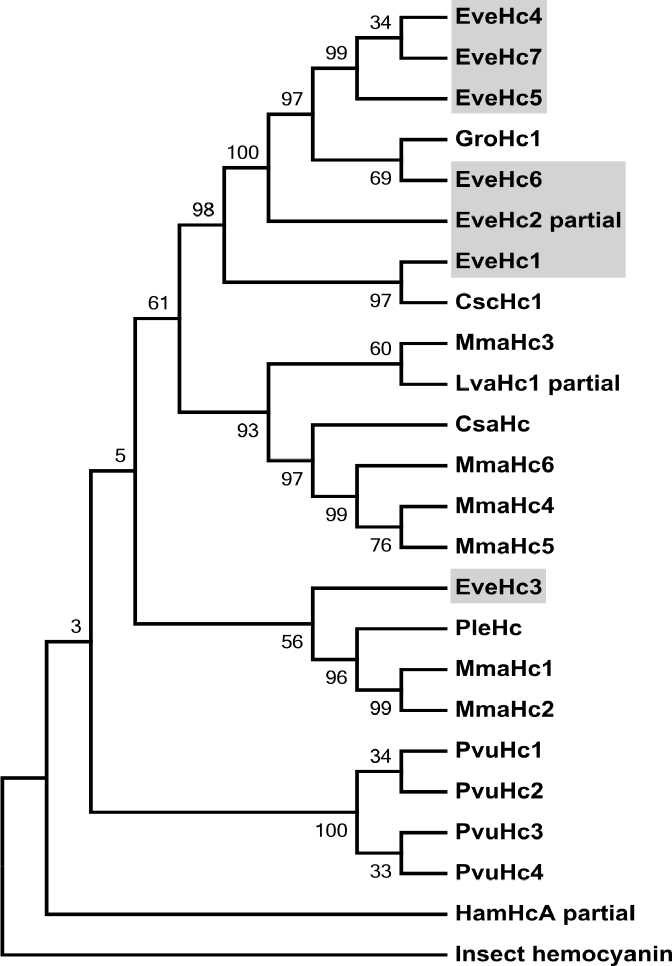
Figure 3. Филогенетическое древо белковых последовательностей различных типов гемоцианинов некоторых ракообразных. Изоформы гемоцианина амфипод E. verrucosus выделены
Y-type
P-type
a-type
серым цветом.
CONCLUSIONS
Таким образом, в ходе проведённого исследования впервые была описана высокая гетерогенность транскриптов и изоформ гемоцианина у байкальских эндемичных амфипод. Выявленные особенности демонстрируют необходимость проведения более детального исследования, направленного на установление функционального разнообразия гемоцианина в норме и при воздействии критических значений абиотических факторов среды у разных видов байкальских амфипод.
ACKNOWLEDGMENT
Список литературы Предварительный анализ гемоцианинов в гемолимфовой плазме эндемичных амфипод Байкала
- Bajkalovedenie (Baicalogy) (2012) Nauka, Novosibirsk. 1114 p.
- Bradford M.M. (1976) A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem, 72, 248-254
- Camacho C., Coulouris G., Avagyan V., Ma N., Papadopoulos J., Bealer K. & Madden T.L. (2009) BLAST+: architecture and applications. BMC Bioinformatics, 10(1), 421
- Decker H. and Foll R. (2000) Temperature adaptation influences the aggregation state of hemocyanin from Astacus leptodactylus. Comp Biochem Physiol A Mol Integr Physiol., 127(2), 147-54
- Decker H. and van Holde K. (2011) Oxygen and the evolution of life. Springer-Verlag Berlin Heidelberg. 172 p
- Decker H., Hellmann N., Jaenicke E., Lieb B., Meissner U. and Markl J. (2007) Recent progress in hemocyanin research. Integrative and Comparative Biology, 47, 631-644
- deFur P., Mangum C. and Reese J. (1990) Respiratory responses of the blue crab Callinectes sapidus to long-term hypoxia. Biological Bulletin, 178, 46-54
- Hagner-Holler S., Kusche K., Hembach A. and Burmester T. (2005) Biochemical and molecular characterisation of hemocyanin from the amphipod Gammarus roeseli: complex pattern of hemocyanin subunit evolution in Crustacea. Journal of Comparative Physiology B, 175, 445-452
- Hampton S.E., Izmest'eva L.R., Moore M.V., Katz S.L., Dennis B. & Silow E.A. (2008) Sixty years of environmental change in the world's largest freshwater lake-Lake Baikal, Siberia. Global Change Biology, 14(8), 1947-1958
- Huang X. and Madan A. (1999) CAP3: A DNA sequence assembly program. Genome Res., 9, 868-877
- Kozlowski L.P. (2007-2016) Isoelectric Point Calculator. http://isoelectric.ovh.org
- Kravtsova L.S., Izhboldina L.A., Khanaev I.V., Pomazkina G.V., Rodionova E.V., Domysheva V.M., Sakirko M.V., Tomberg I.V., Kostornova T.Ya., Kravchenko O.S. & Kupchinsky A.B. (2014). Nearshore benthic blooms of filamentous green algae in Lake Baikal. Journal of Great Lakes Research, 40(2), 441-448
- Laemmli U.K. (1970) Most commonly used discontinuous buffer system for SDS electrophoresis. Nature, 227, 680-685
- Larkin M.A., Blackshields G., Brown N.P., Chenna R., McGettigan P.A., McWilliam H., Valentin F., Wallace I.M., Wilm A., Lopez R., Thompson J.D., Gibson T.J. and Higgins D.G. (2007) ClustalW and ClustalX version 2. Bioinformatics, 23(21), 2947-2948
- Mangum C.P. (1997) Adaptation of the oxygen transport system to hypoxia in the blue crab, Callinectes sapidus. American Zoologist, 37, 604-611
- Mangum C.P., Greaves J. and Rainer J.S. (1991) Oligomer composition and oxygen binding of the hemocyanin of the blue crab Callinectes sapidus. Biological Bulletin, 181, 453-458
- Marchler-Bauer A., Lu S., Anderson J. B., Chitsaz F., Derbyshire M. K., DeWeese-Scott C.,... & Gwadz M. (2011) CDD: a Conserved Domain Database for the functional annotation of proteins. Nucleic acids research, 39 (suppl 1), D225-D229
- Moore M.V., Hampton S.E., Izmest’eva L.R., Silow E.A., Peshkova E.V. & Pavlov B.K. (2009) Climate Change and the World’s ‘Sacred Sea’ -Lake Baikal, Siberia. BioScience, 59(5), 405-417
- O'Farrell P.H. (1975) High resolution two-dimensional electrophoresis of proteins. Journal of biological chemistry, 250(10), 4007-4021
- Petersen T.N., Brunak S., von Heijne G. & Nielsen H. (2011) SignalP 4.0: discriminating signal peptides from transmembrane regions. Nature Methods, 8, 785-786
- Scherbaum S., Ertas B., Gebauer W. and Burmester T. (2010) Characterization of hemocyanin from the peacock mantis shrimp Odontodactylus scyllarus (Malacostraca: Hoplocarida). Journal of Comparative Physiology B, 180, 1235-1245
- Schneider C.A., Rasband W.S., Eliceiri K.W. (2012) NIH Image to ImageJ: 25 years of image analysis. Nat Methods, 9, 671-675
- Spicer J. and Hodgson E. (2003) Structural basis for salinity-induced alteration in oxygen binding by haemocyanin from the estuarine amphipod Chaetogammarus marinus (L). Journal of the Marine Biological Association of the UK, 83, 945-947
- Takhteev V.V., Berezina N.A., Sidorov D.A. (2015) Checklist of the Amphipoda (Crustacea) from continental waters of Russia, with data on alien species. Arthropoda Selecta, 24(3), 335-370
- Tamura K., Stecher G., Peterson G., Filipski A., Kumar S. (2013) MEGA6: Molecular Evolutionary Genetics Analysis version 6.0. Molecular Biology and Evolution, 30, 2725-2729
- Terwilliger N.B. and Ryan M. (2006) Functional and phylogenetic analyses of phenoloxidases from brachyuran (Cancer magister) and branchiopod (Artemia franciscana, Triops longicaudatus) crustaceans. Biological Bulletin, 210, 38-50
- Terwilliger, N.B. (2015) Oxygen transport proteins in Crustacea: hemocyanin and hemoglobin. Physiology, 4, Oxford University Press. 512 p
- Timofeyev M.A. (2010) Ecological and Physiological Aspects of Adaptation to Abiotic Environmental Conditions of Endemic Baikalian and Palearctic Amphipods. Thesis for Dr.Sci. degree. Tomsk, 384.
- van de Braak C.B.T., Faber R. & Boon J.H. (1996) Cellular and humoral characteristics of Penaeus monodon (Fabricius, 1798) haemolymph. Comparative haematology international, 6(4), 194-203
- van Holde K.E. and Miller K.I. (1995) Hemocyanins. Advances in Protein Chemistry, 47, 1-81
- Vaquer-Sunyer R. and Duarte C. (2008) Thresholds of hypoxia for marine biodiversity. Proceedings of the National Academy of Sciences of the USA, 105, 15452-15457
- Voit R., Feldmaier-Fuchs G., Schweikardt T., Decker H. and Burmester T. (2000) Complete sequence of the 24mer hemocyanin of the tarantula Eurypelma californicum: structure and intramolecular evolution of the subunits. The Journal of Biological Chemistry, 275, 39338-39344


