Прибор для исследования эндотоксикоза на основе биотестирования
Автор: Ваганов А.В.
Журнал: Научное приборостроение @nauchnoe-priborostroenie
Рубрика: Оригинальные статьи
Статья в выпуске: 3 т.13, 2003 года.
Бесплатный доступ
Рассматривается турбидиметрический фотометр, позволяющий проводить исследование эндотоксикоза с использованием инфузорий по сыворотке крови человека. Описывается конструкция прибора на уровне блок-схемы. Приводятся экспериментальные зависимости.
Короткий адрес: https://sciup.org/14264304
IDR: 14264304 | УДК: 615.
Текст научной статьи Прибор для исследования эндотоксикоза на основе биотестирования
Исследование эндотоксикоза (Э), возможность определения его на ранней стадии, контроль течения заболевания представляют собой актуальную задачу в наши дни.
В последнее время многие специалисты по изучению Э используют биологический контроль и как его разновидность — биотестирование [1]. При этом тест-организмом могут быть экспериментальные животные (кролики, мыши и т. д.), культуры клеток, получаемые из тканей человеческого или животного происхождения, или простейшие.
Использование простейших, например, инфузорий для диагностики Э имеет неоспоримые преимущества: легкость культивирования, относительная дешевизна эксперимента, стабильность характеристик тест-объекта, безопасность культуры для человека.
В настоящее время известны два типа тест-реакций инфузорий, используемые при исследовании Э: угнетение прироста и гибель [2].
Тест-реакция "гибель инфузорий" является наиболее экспрессной, так как анализу подвергается неразведеная центрифугированная сыворотка крови больных и здоровых людей (контрольная группа). Сыворотка и культура инфузорий берется в соотношении 1:1. Оценивается время от начала воздействия сыворотки крови на клетки инфузорий до гибели (прекращения движения) последних. Максимальное время проведения опыта не превосходит 20 минут, что наряду с принципиальной простотой проведения свидетельствует о перспективности данного способа исследования Э. Однако широкое внедрение его в медицинскую практику сдерживают сложности реализации (микроскопный счет, секундомер), субъективный фактор и т. д.
Существующий турбидиметрический измеритель концентрации инфузорий "Биотестер" не может быть применен для исследования Э, т. к. в нем не учтены оптические и физико-химические особенности сыворотки крови, отсутствует адаптация инфузорий к солевому составу сыворотки, используется слишком большой объем тестируемой пробы (2 мл), отсутствует термостатирование пробы при измерении, недостаточна обнаруживающая способность прибора к инфузориям малых размеров (например, Tetrahimena pyriforms).
Все вышеизложенное послужило основанием для создания прибора контроля токсичности сыворотки крови, который позволит автоматически производить оценку изменения концентрации живых (подвижных) инфузорий в исследуемой биожидкости.
ПРИНЦИП ИЗМЕРЕНИЯ
Для регистрации изменения концентрации живых инфузорий в исследуемой среде предпочтение отдано турбидиметрическому способу, т. к. взвесь инфузорий как крупных частиц в оптически "мягкой" среде имеет сжатую вперед индикатрису рассеяния. Поэтому, с одной стороны, взвесь рассеивает малый поток излучения под углом 90 градусов к оси источника излучения, с другой стороны, проходящий через частицу поток излучения уменьшает величину экстинкции взвеси. При нефелометрической схеме построения прибора необходимо использовать методы фотометрии малых потоков, что неизменно приводит к усложнению конструкции [3].
Взвесь инфузорий образует хаотически подвижную, рассеянную взвесь прозрачных эллипсоидальных тел размерами 30–300 мкм.
Для описания взаимодействия светового излучения с инфузориями лучше всего подходит модель геометрической оптики. Она применима, если р > 100, где р = 2пг / Л. Здесь r — диаметр частицы, Л — длина волны светового излучения. Существенной качественной особенностью ослабления света частицами с большим р = 2пг / Л (или большим радиусом r) является появление вместе с рассеянием света в малых углах эффекта дифракции Фраунгофера в параллельных лучах. Фронт плоской волны образует "тень" за частицей и при условии r << R (R — расстояние от частицы до приемника) дифракционную картину, такую же какую создает отверстие радиуса r.
При работе с сывороткой крови в оптическом диапазоне возникает увеличение поглощения и рассеяния светового излучения по сравнению с водной средой вследствие возможной большой концентрации липопротеидов в исследуемой биожидкости (визуально это оценивается по степени ее мутности), а также возможности гемолиза сыворотки (полного или частичного разрушения гемоглобина), из-за чего она приобретает красный цвет.
Возможным диапазоном для регистрации изменения концентрации подвижных инфузорий при исследовании токсичности сыворотки крови является ближний инфракрасный спектр (720 1100 нм), т. к. значение оптической плотности в нем минимально (рис. 1). Оптимальной длиной волны для проведения измерений считается X = 810 нм: поглощение окисигемоглобином (HbO 2 ) и дезоксигемоглобином (HbR) одинаково [4].
Сыворотка крови является оптически более сложной средой, чем водная. Компоненты с наибольшими размерами до 600 нм оказывают влияние в виде помехи на формирование информационного сигнала из-за перемещения их в кювете конвекционными потоками. Наиболее полно ослабление и рассеяние света элементами сыворотки крови описывает теория Ми, учитывающая вторичные волны, распространяющиеся от частицы-осциллятора, на которую воздействует фронт плоской волны излучения.
Исследуемая среда (взвесь инфузорий и сыворотка крови) может быть промоделирована взвесью малых подвижных частиц (инфузории) в среде очень малых частиц различной концентрации и размеров (элементы сыворотки крови).
Увеличенное значение вязкости сыворотки крови по сравнению с водной средой приводит к некоторому снижению начальной скорости перемещения простейших. Однако это не влияет на конечный результат измерения (время полной остановки всех инфузорий в пробе).
С целью уменьшения влияния солевого состава сыворотки крови (в частности, NaCl) на простейших, что может привести к росту погрешности измерения, в проводимых экспериментах в качестве тест-объекта используются инфузории, адаптированные к 0.7 % раствору NaCl.
Уменьшение объема тестируемой пробы с 2 до 0.3 мл позволило не только сократить расход
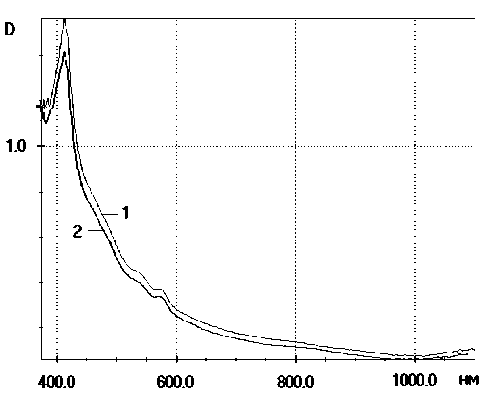
Рис. 1. Зависимость оптической плотности (D) от длины волны в исследуемом растворе (сыворотка крови + среда Лозин-Лозинского 1 : 1) на примере одной из сывороток (1). Та же сыворотка, но инактивированная — 2
биоматериала, но и сформулировать условия максимизации потока частиц (инфузорий) через контролируемый объем (датчик).
Для термостатирования кюветного модуля с исследуемой средой выбрана стандартная температура для медицинских исследований — 30 градусов.
Для работы с инфузориями малых размеров произведено повышение обнаруживающей способности прибора. По сравнению с "Биотестер" интенсивность импульсного излучения светодиода увеличена в 5 раз, общее усиление — в 2.5 раза.
ОПИСАНИЕ КОНСТРУКЦИИ ПРИБОРА
Оптоэлектронный датчик представлен на рис. 2. Оптическое излучение, создаваемое светодиодом СД, проходит через кювету с исследуемой пробой и проецируется на фотодиод ФД. Полученный сигнал изменения освещенности фотодиода преобразуется в электрический сигнал и усиливается фотоусилителем ФУ. Электрический сигнал на выходе датчика имеет переменную составляющую, т. к. учитываются как входящие в контролируемую зону, так и выходящие из нее инфузории из приграничных слоев е. Объем приграничных слоев можно вычислить по формуле
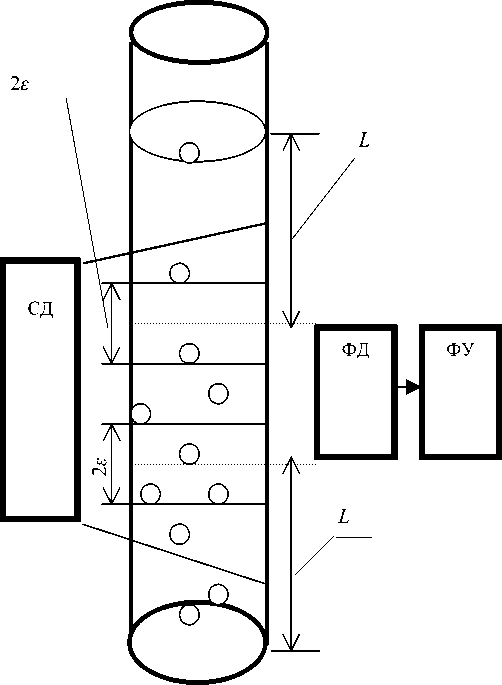
Рис. 2. Модель оптоэлектронного датчика.
СД — светодиод, ФД — фотодиод, ФУ — фотоусилитель, 2 е — высота приграничных слоев, L — расстояние от измерительного объема до границ сред
V = 2 Lf ■ е ■ d, где Lf — периметр датчика, е — толщина приграничных слоев, d — расстояние между светодиодом и фотодиодом.
Перемещаемые конвекционными потоками микрочастицы сыворотки крови создают сигнал помехи или сигнал-фон. Характер движения инфузорий дискретно-хаотичный, состоящий из прямолинейных перемещений со случайной сменой направлений. Поэтому для потока дискретно движущихся частиц через поверхность датчика (инфузории и микрочастицы сыворотки крови) подходит модель пуассоновских потоков. Полезный сигнал на выходе датчика имеет вид:
U ( t ) = n i ■ U о ■ f ( t - t i ) .
Здесь n i — число элементарных импульсов, возникающих за достаточно малый интервал времени 8 1 ; t i — случайный момент появления импульса, имеющего форму, описываемую функцией f ( t - t i )= | «при t < t , ;
[± 1, при t > t i .
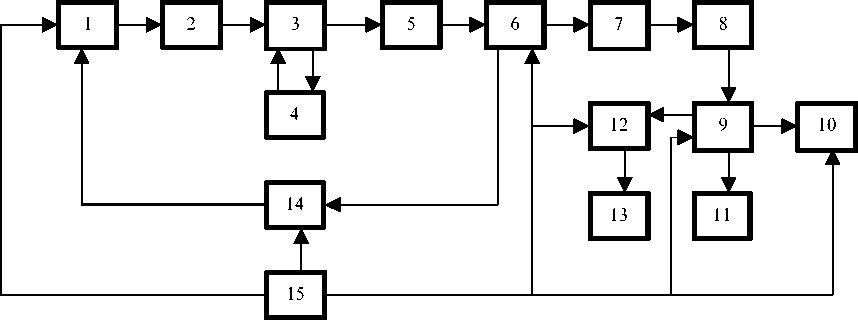
Рис. 3. Блок-схема измерителя токсичности сыворотки крови.
1 — усилитель, 2 — светодиод, 3 — кюветный модуль, 4 — блок термостабилизации, 5 — фотоусилитель, 6 — усилитель, 7 — фильтр, 8 — детектор, 9 — аналогово-цифровой преобразователь (АЦП), 10 — устройство для передачи измерительной информации в компьютер, 11 — блок индикации концентрации инфузорий, 12 — устройство отсчета времени, 13 — блок индикации минут, 14 — схема компенсации яркости светодиода, 15 — блок генератора
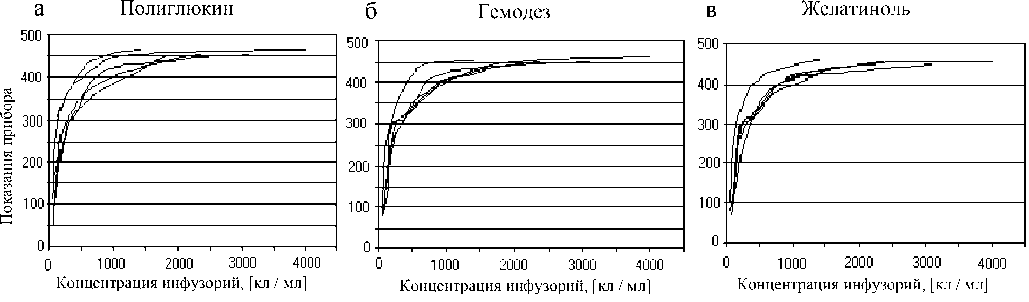
Рис. 4. Калибровочные кривые по заменителям сыворотки крови
Случайные величины n i и t i считаются независимыми.
Блок-схема измерителя представлена на рис. 3.
ПРАКТИЧЕСКИЕ РЕЗУЛЬТАТЫ
В ходе проведенных экспериментов построены калибровочные кривые (зависимость показаний прибора от концентрации живых инфузорий) с использованием заменителей сыворотки крови рис. 4. По этим кривым произведен выбор оптимальной рабочей концентрации взвеси инфузорий ( C ≈ 500 кл/мл), обоснованной относительно ли- нейной зависимостью показаний прибора от концентрации живых клеток в кювете. Выработан алгоритм проведения исследований.
Произведены пробные замеры, которые показали хорошую повторяемость результатов измерений (времени гибели), а также подтвердили корреляцию данного метода с методом оценки токсичности сыворотки крови по М.Я. Малаховой.
Список литературы Прибор для исследования эндотоксикоза на основе биотестирования
- Захаров И.С., Пожаров А.В. Биотехнические методы охраны окружающей среды: Учебн. пособие. СПб.: Изд-во СПбГЭТУ "ЛЭТИ", 2001. 80 с.
- Виноходов Д.О., Виноходов В.О., Гипан Л.И., Земляникина Т.А. Использование инфузорий в исследовании внутренних сред высших организмов//Архив ветеринарных наук. 1999. Т. 1, № 3. С. 551-557.
- Захаров И.С. Метод и аппаратура для измерений концентраций инфузорий в медико-экологических исследованиях. Автореф. дис. … канд. тех. наук. СПб., 1996. 16 с.
- Крепс Е.М. Оксигемометрия: техника, применение в физиологии и медицине. Л.: Изд-во Медгиз, 1959. 222 с.


