Приборы для диагностики биологических объектов на основе метода полимеразной цепной реакции в реальном времени (ПЦР-РВ)
Автор: Алексеев Я.И., Белов Ю.В., Варламов Д.А., Коновалов С.В., Курочкин В.Е., Маракушин Н.Ф., Петров А.И., Петряков А.О., Румянцев Д.А., Скоблилов Е.Ю., Соколов В.Н., Фесенко В.А., Чернышев А.В.
Журнал: Научное приборостроение @nauchnoe-priborostroenie
Рубрика: Приборы для биотехнологии
Статья в выпуске: 3 т.16, 2006 года.
Бесплатный доступ
Разработаны анализаторы нуклеиновых кислот АНК-16 и АНК-32, в которых используется наблюдение сигналов флуоресценции в реальном масштабе времени в ходе полимеразной цепной реакции. Анализаторы снабжены реагентами и тест-системами и могут быть применены для выявления и количественного определения РНК и ДНК.
Короткий адрес: https://sciup.org/14264445
IDR: 14264445 | УДК: 543.426;
Текст научной статьи Приборы для диагностики биологических объектов на основе метода полимеразной цепной реакции в реальном времени (ПЦР-РВ)
В настоящее время одним из наиболее перспективных подходов к молекулярной диагностике различных болезней человека, животных и растений и к анализу различных биологических объектов является использование амплификационной технологии специфической детекции ДНК или РНК. В России на сегодняшний день практически в 100 % лабораторий, занимающихся лабораторной диагностикой, используется метод ПЦР. По нашим данным, около 80–90 % этих лабораторий используют электрофорез в агарозном геле в качестве метода для детекции продуктов амплификации. Это трудоемкий метод, обладающий множеством недостатков.
В рамках данной технологии наиболее современным методом детекции нуклеиновых кислот является полимеразная цепная реакция в реальном времени (ПЦР-РВ). Одним из основных достоинств ПЦР-РВ является возможность получения информации о наличии, количестве и возможных изменениях в последовательности нуклеиновых кислот непосредственно в ходе реакции, что существенно упрощает, укорачивает и удешевляет ПЦР-анализ. Кроме того, количественные измерения, проводимые с помощью ПЦР-РВ, отличает рекордно низкий коэффициент вариации и наиболее широкий линейный диапазон, что позволяет рассматривать данный метод (среди любых альтернативных) в качестве приоритетного метода определения концентрации ДНК/РНК в исследуемых пробах.
Для реализации условий полимеразной цепной реакции анализируемые образцы смешиваются в пробирках с реакционной смесью, в состав которой входят:
-
• праймеры — искусственно синтезированные
олигонуклеотиды, которые обеспечивают специфичность реакции;
-
• ДНК-полимераза — термостабильный фермент, обеспечивающий достраивание 3´-конца второй цепи ДНК;
-
• смесь дезоксинуклеотидтрифосфатов, используемых ДНК-полимеразой для синтеза второй цепи ДНК;
-
• интеркалирующий краситель или специфические зонды;
-
• буфер — смесь катионов и анионов, обеспечивающих оптимальные условия для реакции.
Для ПЦР-РВ используются одноразовые полипропиленовые пробирки с герметичными крышками, таким образом, снижается риск контаминации помещений. Пробирки устанавливаются в термостат, работающий в циклическом температурном режиме. При нагревании пробирок до 95°С молекулы анализируемых образцов ДНК расплетаются с образованием двух одноцепочечных молекул. Праймеры присоединяются к одноцепочечной ДНК-мишени и ограничивают искомый фрагмент. При температуре порядка 60 °С ДНК-полимераза достраивает вторую цепь ДНК с 3´-конца праймера.
При малой концентрации анализируемых образцов температурный цикл амплификации повторяется до 50 раз. Реактивы обеспечивают избирательность полимеразной цепной реакции и позволяют выделить искомую ДНК на фоне других. При каждом цикле амплификации синтезированные ранее фрагменты вновь копируются ДНК-полимеразой. При этом происходит экспоненциальное увеличение количества копий фрагмента исходной ДНК. Концентрация исходных специфических фрагментов ДНК увеличивается приблизительно как 2 N , где N — количество циклов.

Рис. 1. Анализатор АНК
В основе используемого нами метода ПЦР-РВ лежит наблюдение сигналов флуоресценции в ходе реакции. Увеличение сигналов происходит благодаря использованию специфического для данной ДНК зонда, который, подобно праймеру, в ходе реакции связывается с одной из цепей ДНК. В ходе синтеза комплементарной цепи благодаря 5´– 3´-нуклеазной активности ДНК-полимеразы зонд расщепляется. Он содержит на 5’-конце флуоресцентный краситель, а на 3’-конце — гаситель флуоресценции. После расщепления происходит разобщение красителя и гасителя, что приводит по мере накопления продукта реакции к возрастанию сигнала флуоресценции.
По изменению сигнала флуоресценции можно проследить кинетику ПЦР и использовать полученные данные для расчета значения порогового цикла — величины, позволяющей судить об исходном количестве копий ДНК и сравнивать об- разцы между собой. Чем больше количество ДНК в образце, тем раньше наблюдается начало роста сигнала флуоресценции и тем меньше значение порогового цикла. При использовании многоцветного флуориметра можно использовать до четырех красителей и обнаружить до четырех разных специфических фрагментов ДНК в каждой пробирке одновременно. Например, для обнаружения и определения процентного содержания генетически модифицированной (ГМ) сои Roundup Ready™ используются две независимые реакции в одной пробирке. Первая реакция позволяет обнаружить присутствие ДНК гена лектина, который присутствует как в ГМ, так и в обычной сое. Вторая реакция позволяет обнаружить присутствие в геноме сои генетической модификации. Наличие положительной динамики для обеих реакций говорит о наличии ГМ сои, а сравнение значений порогового цикла позволяет определить процентное содержание ГМ в общем количестве ДНК сои. Каждая реакция имеет свой флуоресцентный краситель. Для обнаружения лектина сои используется зонд, меченный R6G, а для ГМ — зонд, меченный ROX.
Имея целый ряд преимуществ, метод ПЦР-РВ тем не менее не внедрен в России в полной мере. Первые попытки как зарубежных, так и отечественных компаний, направленные на продажу оборудования для ПЦР-РВ, сталкиваются в настоящее время с определенными трудностями, связанными в первую очередь с крайне высокими ценами на импортные приборы, практически полным отсутствием на российском рынке импортной реагентной базы, а также отсутствием клинической апробации для недавно появившихся отечественных тест-систем и оборудования для ПЦР-РВ.
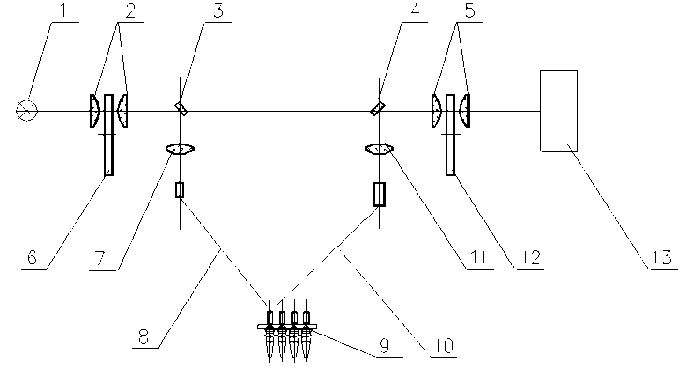
Рис. 2. Упрощенная оптическая схема анализатора АНК.
1 — источник излучения; 2 и 5 — двухлинзовые конденсоры; 3 и 4 — вращающиеся зеркала; 6 и 12 — сменные интерференционные светофильтры; 7 и 11 — линзы; 8 и 10 — световодные жгуты; 9 — пробирки; 13 — приемник излучения
ОПИСАНИЕ ПРИБОРОВ
Созданы анализаторы нуклеиновых кислот АНК-16 и АНК-32, позволяющие выполнить одновременно генетический анализ 16 и 32 образцов; производится разработка более производительного прибора АНК-96 (анализ 96 образцов одновременно), не уступающего по характеристикам и производительности лучшим мировым аналогам.
Анализаторы АНК-16 и АНК-32, внешний вид которых показан на рис. 1, имеют следующие компоненты.
-
• Нижний блок — амплификатор [1–4] — выполняет функцию прецизионного циклического термостата и обеспечивает возможность экспоненциального увеличения количества продуктов амплификации при наличии в образце искомой ДНК (РНК) (разработчик — МГТУ им. Н.Э. Баумана).
-
• Верхний блок — оптический [5–7] — измеряет сигнал флуоресценции образцов. В этой оптимизированной конструкции для одновременного контроля в реальном масштабе времени множества амплификаций нуклеиновых кислот применена оригинальная оптическая система (рис. 2), содержащая источник излучения 1 (галогеновая лампа) и приемник излучения 13 (фотоэлектронный умножитель). Между линзами конденсоров 2 и 5 установлены сменные интерференционные светофильтры возбуждения 6 и эмиссии 12. Для передачи света возбуждения от источника и излучений флуоресценции из пробирок 9, расположенных в амплификаторе, используются световодные жгуты 8 и 10. Переключение световых пучков между световодами обеспечивается с помощью вращающихся зеркал 3 и 4 и линз 7 и 11. Световодные жгуты выполнены в виде оптических волокон с коаксиально расположенными центральной частью для возбуждения реакционной смеси в пробирках и периферийной частью для сбора флуоресценции.
Диаметры центральной части световода d1 и периферийной части d2 были выбраны из соотношения d1 / d2 = 1/3.
Условия апертурного согласования центральной части световода с количеством реакционной смеси в пробирке 10 были определены по формуле α = 2 arctg ( d / 2 l ), где α — угол светового пучка на выходе из центральной части световода; d — диаметр поверхности реакционной смеси в пробирке; l — расстояние от торца центральной части световода до реакционной смеси в пробирке.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
-
• При испытаниях анализаторов АНК было определено, что изменение количества продуктов амплификации в реакционной смеси пропорцио-
- нально изменению сигнала в ходе амплификации. Ниже приведены последние результаты, подтверждающие высокие технические характеристики анализаторов АНК и их эксплуатационные возможности.
-
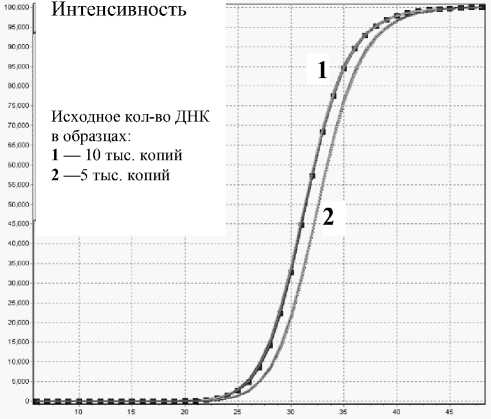
• Анализаторы АНК позволяют идентифицировать незначительные различия в исходном количестве ДНК (на рис. 3 показаны кривые амплификации для 5 и 10 тысяч копий).
-
• Широкий динамический диапазон определения количества ДНК — от единичных до 5∙109 копий (рис. 4).
-
• Высокая точность и воспроизводимость результатов анализов показаны на рис. 5. Разброс значений пороговых циклов для 32 одинаковых образцов составляет 0.11 единиц пороговых циклов.
-
• Четырехцветное измерение сигнала флуоресценции обеспечивает возможность постановки мультиплексной ПЦР. Например, нами проводились три одновременные независимые реакции в одном образце, при этом была использована тест-система для обнаружения ДНК М. tuberculosis.
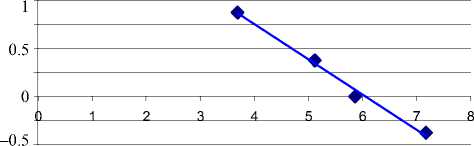
Количественный анализ выполняется методом сравнения с использованием калибровочных образцов с известной концентрацией специфических фрагментов ДНК. В частности, количественное определение ГМО растительного происхождения основано на расчете отношения количества ДНК определенной линии ГМ растения к общему количеству ДНК анализируемого растения, выраженного в процентах. Для построения калибровочной прямой используется разность значений пороговых циклов двух реакций. На рис. 6 показан график, полученный в результате автоматического расчета на основании экспериментальных данных от калибровочных образцов. В верхнем углу рисунка приведено аналитическое выражение калибровочной прямой. С помощью калибровочной прямой рассчитывается процентное содержание ДНК ГМО в анализируемых образцах [8]. На графике рис. 6 разности значений пороговых циклов двух реакций, равной 6, соответствует величина lg (ГМИ [%]) = 0 и содержание ГМО, равное 1 %.
Для анализаторов разработано программное обеспечение, которое рассчитано на работу в среде Windows NT, 95/98, 2000 и XP и позволяет проводить автоматический анализ одновременно всех образцов по четырем длинам волн возбуждения флуоресценции, автоматически обрабатывать и анализировать результаты, создавать, сохранять и архивировать протоколы исследования в заданном виде.
Анализаторы могут быть применены для выявления и количественного определения РНК и ДНК с использованием реагентов и тест-систем (разработчик — ЗАО "СИНТОЛ"), более дешевых, чем тест-системы других производителей. Для этих целей разработаны:
Число циклов
Рис. 3. Кинетические кривые амплификации фрагмента ДНК гена иммуноглобулина G человека
Интенсивность
5*10»
Число циклов
Рис. 4. Тест-система для обнаружения ДНК генетически модифицированных организмов (ГМО), (35S-промотор). Кривые помечены исходным кол-вом ДНК в образцах
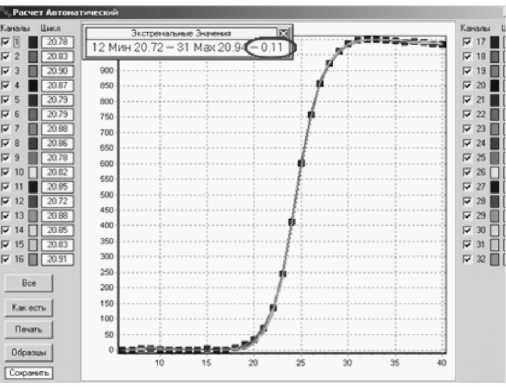
Рис. 5. Кинетические кривые амплификации 32 одинаковых образцов. Разброс результатов — 0.11
y = 0.2924 x + 1.7716
lg (ГМИ [%] ) R 2 = 0.9913
Разница циклов
Рис. 6. Результат построения калибровочной прямой при определении процентного содержания генетически модифицированной сои
-
• ДНК и РНК — олигонуклеотиды и реактивы для их синтеза, флуоресцентные красители, модифицированные олигонуклеотиды, зонды и наборы реактивов для проведения ПЦР в реальном времени;
-
• адаптированные тест-системы молекулярной диагностики социально-значимых инфекционных болезней, например наборы реагентов для диагностики туберкулеза;
-
• тест-системы для анализа ГМО в пищевых продуктах и продовольственном сырье [8].
ЗАКЛЮЧЕНИЕ
Подтверждены высокие эксплуатационные и технические характеристики анализаторов АНК:
-
• количественное определение ДНК/РНК — от единичных до 109 копий;
-
• 4-цветная детекция красителей, возможность детектировать все основные красители — SYBR Green 1, FАМ, R6G, НЕХ, JОЕ, RОХ, ТАМRA, Сy5 и др.;
-
• возможность сравнительного количественного анализа 4 различных ДНК в одной пробирке одновременно;
-
• высокая чувствительность по всем каналам детекции, позволяющая работать с очень малым количеством зонда (от 0.5 пмоль на реакцию);
-
• удобное программное обеспечение, современные алгоритмы расчета значений пороговых циклов
и широкий выбор вариантов анализа данных;
-
• экономия времени, снижение риска контаминации, упрощение организации ПЦР-лаборатории;
-
• стоимость существенно ниже импортных аналогов, т. к. приборы, программное обеспечение, реагенты и тест-системы отечественного производства.
Анализаторы АНК-16 и АНК-32 были разработаны в результате выполнения НИОКР "Приборы для определения числа и последовательности нуклеиновых кислот" в рамках Государственного контракта № 40.032.11.13 от 1 апреля 2002 г. по заказу Минпромнауки России: раздел "Научное приборостроение" блока "Ориентированные фундаментальные исследования" федеральной целевой научно-технической программы "Исследования и разработки по приоритетным направлениям развития науки и техники" на 2002–2006 годы.


