Причины рецидива рака желудка у больных после радикального лечения
Автор: Барышев Александр Геннадьевич, Порханов Владимир Алексеевич, Попов Арсен Юрьевич, Лищенко Алексей Николаевич, Хачатурьян Николай Вячеславович, Валякис Денис Анатольевич, Бодня Максим Вадимович
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 1 т.16, 2017 года.
Бесплатный доступ
Рак желудка остаётся одним из наиболее значимых онкологических заболеваний, поскольку занимает 3-е место в структуре причин смертности от злокачественных опухолей. Последние достижения в хирургическом лечении больных раком желудка связаны с применением расширенной лимфодиссекции (D2), однако отдалённые результаты лечения во многом зависят от распространённости карциномы, поражения регионарных лимфоузлов, дифференцировки и глубины инвазии опухоли. Цель исследования - изучить выживаемость радикально пролеченных больных раком желудка в зависимости от объема лимфодиссекции и индивидуальных характеристик опухоли. Материал и методы. При помощи метода Каплана - Мейера и дисперсионного анализа изучены отдалённые результаты лечения 662 больных раком желудка с минимально допустимой (D1) - контрольная группа - и расширенной лимфодиссекцией (D2) - основная группа - в зависимости от влияния 10 различных особенностей опухолевого процесса. результаты. При изучении отдалённых результатов лечения установлено достоверное преимущество пациентов основной группы по общей и безрецидивной пятилетней выживаемости, медиана которой в контрольной группе составила 32,0 мес, в основной - 46,0 мес. Эффект от расширенной лимфодиссекции (D2) был получен независимо от любой из характеристик опухоли, однако такие факторы, как стадия заболевания, метастатическое поражение регионарных лимфоузлов и низкая дифференцировка опухоли, выполнение комбинированной операции, оказали большее влияние на выживаемость больных, чем объем лимфодиссекции. Заключение. Хирургическое лечение больных раком желудка обязательно должно сопровождаться расширенной лимфодиссекцией (D2), эффект от которой проявляется на любом клиническом фоне опухоли.
Рак желудка, расширенная лимфодиссекция, выживаемость больных, гистологическая структура опухоли, регионарное метастазирование
Короткий адрес: https://sciup.org/140254089
IDR: 140254089 | УДК: 616.33-006.6-089-036.65 | DOI: 10.21294/1814-4861-2017-16-1-23-31
Текст научной статьи Причины рецидива рака желудка у больных после радикального лечения
таблица 1
характеристика клинического материала
|
Стадия |
TNM |
СДРЖ |
ГЭ |
ТАГЭ |
Всего |
||||
|
Контроль |
Основная |
Контроль |
Основная |
||||||
|
Контроль |
Основная |
Контроль |
Основная |
||||||
|
IA |
T1N0M0 |
8 |
8 |
3 |
5 |
0 |
0 |
11 (3,7 %) |
13 (3,5 %) |
|
IB |
T2N0M0 |
14 |
6 |
4 |
8 |
0 |
0 |
18 (6,1 %) |
14 (3,8 %) |
|
T1N1M0 |
1 |
1 |
0 |
3 |
0 |
0 |
1 (0,3 %) |
4 (1,1 %) |
|
|
IIA |
T 3 N 0 M 0 |
13 |
7 |
7 |
22 |
1 |
1 |
21 (7,1 %) |
30 (8,2 %) |
|
T 2 N 1 M 0 |
5 |
2 |
2 |
2 |
0 |
1 |
7 (2,4 %) |
5 (1,4 %) |
|
|
T 4a N 0 M 0 |
19 |
13 |
8 |
21 |
2 |
5 |
29 (9,9 %) |
39 (10,6 %) |
|
|
IIB |
T3N1M0 |
12 |
4 |
2 |
15 |
0 |
4 |
14 (4,8 %) |
23 (6,3 %) |
|
T2N2M0 |
0 |
0 |
0 |
1 |
0 |
0 |
0 |
1 (0,3 %) |
|
|
IIIA |
T4aN1M0 |
21 |
18 |
37 |
38 |
2 |
9 |
60 (20,4 %) |
65 (17,7 %) |
|
T 3 N 2 M 0 |
7 |
1 |
13 |
19 |
0 |
0 |
20 (6,8 %) |
20 (5,4 %) |
|
|
T4bN0M0 |
4 |
2 |
7 |
3 |
0 |
6 |
11 (3,7 %) |
11 (3,0 %) |
|
|
IIIB |
T4bN1M0 |
5 |
7 |
10 |
21 |
4 |
5 |
19 (6,5 %) |
33 (9,0 %) |
|
T4aN2M0 |
10 |
8 |
19 |
27 |
3 |
14 |
32 (10,9 %) |
49 (13,3 %) |
|
|
T3N3M0 |
2 |
2 |
6 |
5 |
0 |
0 |
8 (2,7 %) |
7 (1,9 %) |
|
|
T4bN2M0 |
9 |
5 |
8 |
6 |
0 |
9 |
17 (5,8 %) |
20 (5,4 %) |
|
|
IIIC |
T 4a N 3 M0 |
5 |
3 |
3 |
5 |
0 |
1 |
8 (2,7 %) |
9 (2,5 %) |
|
T4bN3M0 |
6 |
2 |
3 |
11 |
0 |
0 |
9 (3,1 %) |
13 (3,5 %) |
|
|
IV |
T1–4N1–4M1 |
7 |
4 |
2 |
6 |
0 |
2 |
9 (3,1 %) |
12 (3,3 %) |
Всего 148 93 134 218 12 57 294 368
М.И. Давыдов с соавт. на основании изучения обширной литературы и анализа своего материала показали, что, с одной стороны, многим хирургам удалось улучшить отдаленные результаты при хирургическом лечении рака, достигнув трехлетней выживаемости в 44–47 % за счет широкого применения расширенных и сверхрасширенных вмешательств (D2–D3). При этом крайне низкая выживаемость получается при лечении пациентов с инфильтративным, низкодифференцированным раком 3-го типа по Борманну, когда быстро идет развитие канцероматоза брюшины и метастазирование в парааортальные лимфатические коллекторы [11, 12].
Математическая обработка полученных результатов проводилась при помощи метода Каплана-Мейера и дисперсионного анализа, при котором наилучшим образом раскрывается структура изменчивости всех трёх категорий изучаемых признаков: показателей выживаемости за 5-летний послеоперационный период наблюдений; комплекса характеристик раковых опухолей; разнообразия методов хирургических операций. Его математическая модель обеспечивает возможность разложения всей наблюдаемой (общей) дисперсии признака на компоненты, соответствующие учтенным в эксперименте факторам изменчивости (факториальная дисперсия) и неучтённым (остаточная дисперсия).
Для анализа взаимодействия количественных признаков с непрерывной изменчивостью, которыми являются продолжительность жизни и влияющие на неё переменные (характеристики опухоли, особенности операции и т.д.), структура их изменчивости наилучшим образом раскрывается в дисперсионном анализе. Его математическая модель обеспечивает возможность разложения всей наблюдаемой (общей) дисперсии признака на компоненты, соответствующие учтенным в эксперименте факторам изменчивости (факториальная дисперсия) и неучтённым (остаточная дисперсия).
При учёте двух факторов (двухфакториальная модель) уравнение разложения принимает вид:
σ2 = σ2А+ σ2В+ σ2АB+ σ2е, где σ2 – общая дисперсия; σ2А – дисперсия, обусловленная фактором А (собственный эффект А); σ2В – то же фактором В (собственный эффект В); σ2АB – дисперсия, обусловленная взаимодействием А×В; σ2е– остаточная дисперсия, аккумулирующая совокупный эффект всех неучтенных факторов.
Вклад факторов в общую дисперсию оценивали по отношению σ2 А / σ2; σ2 B / σ2; σ2 АВ / σ2 и выражали в процентах.
Результаты и обсуждение
Предшествующий анализ полученных данных строился на последовательном сравнении групп оперированных со стандартным или расширенным объемом ЛД, выполнялась главная задача исследования – выявление и оценка терапевтического эффекта РЛД (D2).
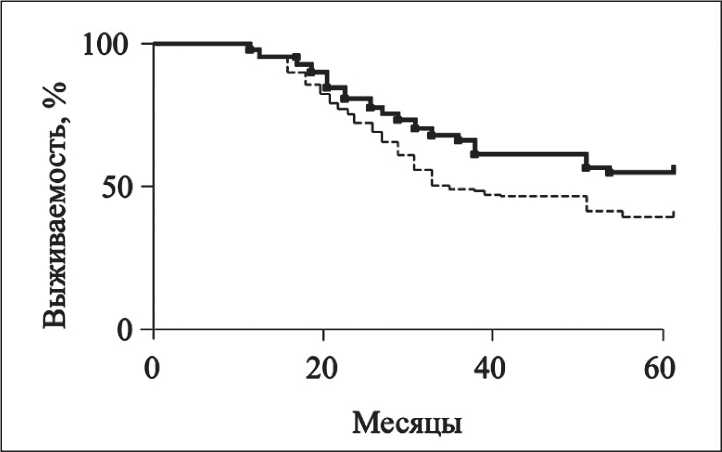
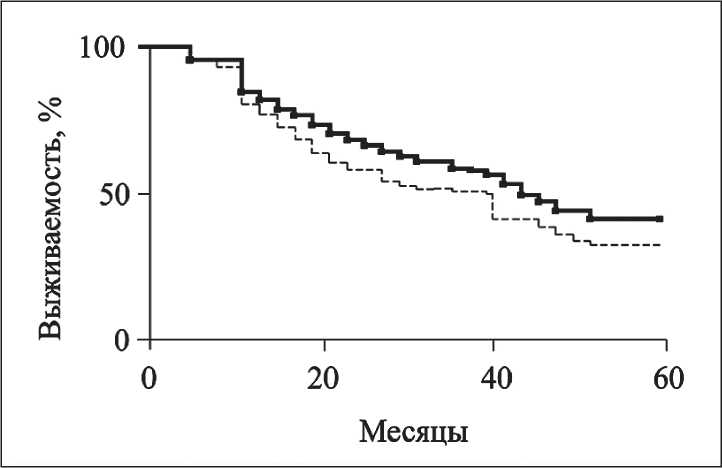
При сравнении результатов оценки выживаемости после лечения установлено значимое преимущество этого показателя у пациентов основной группы перед больными контрольной (χ2=13,3; р>0,01) (рис. 1). Медиана времени жизни в контрольной группе – 40 мес, в основной – ещё не достигнута (т.е. >60 мес). Показатели без-рецидивной выживаемости также были выше в основной группе (p<0,05). Медиана безрецидивной выживаемости в контрольной группе составила 32,0 мес, в основной – 46,0 мес (рис. 2). Веский аргумент в пользу выраженного лечебного эффекта РЛД получен также при сравнении частот больных, проживших без рецидива опухоли весь период наблюдения. В контрольной группе этот показатель составил 33,9 %, в основной – 42,7 %. Различия между группами статистически значимы: t=2,3 > > t 05 =1,98; p<0,05.
При подробном анализе межгрупповых различий установлено, что главными отличающимися показателями были число прожитых месяцев,
|
Фактор |
df |
mS |
F |
p |
Дисперсия |
Вклад в общую дисперсию |
|
Объем лимфодиссекции |
1 |
2461,1 |
10,0* |
0,00 |
6,7 |
2,0 % |
|
Стадия рака |
7 |
7148,0 |
29,1* |
0,00 |
83,5 |
24,8 % |
|
Взаимодействие факторов |
7 |
101,4 |
0,4 |
0,89 |
0,0 |
0,0 % |
|
Неучтенные факторы (остаточная дисперсия) |
547 |
246,0 |
- |
- |
246,0 |
73,2 % |
Примечание: df – число степеней свободы, S – средний квадрат, F – фактическое значение критерия Фишера (* – отмечены превышающие стандартное значение для 5 % уровня значимости), р – вероятность «нуль гипотезы» об отсутствии эффекта фактора.
частота летальных исходов и время возникновения рецидивов рака. Всё это привело к рабочей гипотезе о связи этих показателей с комплексом характеристик опухоли и разновидностью операции. Её и следовало проверить с использованием методов корреляционного анализа, потому что без ответа остаются очень важные вопросы: каков по величине лечебный эффект РЛД по сравнению с эффектами других факторов, влияющих на продолжительность жизни; сопряжен ли этот эффект с какими-либо характеристиками опухоли?
Особенности получаемой в дисперсионном анализе информации об изменчивости признака и способы ее интерпретации иллюстрируем на примере двухфакторного анализа продолжительности жизни после операции. Факторы: объем ЛД и стадия рака (табл. 2). Из приведенных результатов дисперсионного анализа следует, что статистически значимый эффект на изменчивость продолжительности жизни устанавливается для обоих учтенных в данном случае факторов. Поскольку вероятность Н 0 об отсутствии эффекта меньше критической 0,05, нуль-гипотеза отвергается. Собственный эффект факторов измерен (2 и 24,8 % соответственно), но их взаимодействие не выявляется: р=0,89>0,05. Необходимо подчеркнуть, что в статистическом анализе результат «взаимодействие не выявляется» не равнозначен доказательству его отсутствия. Наиболее вероятная причина отсутствия взаимодействия в данном случае заключается в неравномерности дисперсионного комплекса. Вклад РЛД (D2) в общую дисперсию продолжительности жизни после операции наименьший - 2,0 % и на порядок величин уступает вкладу «стадии рака». Но он перестает казаться малым, если учесть большое число факторов, определяющих её изменчивость. В данной работе их учтено более десятка, а в числе неучтенных остались такие, безусловно, важные, как: возраст больного, сопутствующие заболевания, режим и качество питания, жилищные условия и материальная обеспеченность, семейное положение больного и психологический климат в семье, вредные привычки, социальный статус и т. д.
Естественно, что совокупный эффект неучтённых факторов (остаточная дисперсия) абсолютно доминирует по величине вклада (73,2 %).
Все двухфакторные дисперсионные анализы были выполнены по единой схеме. К главному в данной работе фактору - объему лимфодиссек-ции (далее обозначен А) – подключали второй, а именно, одну из характеристик опухоли или разновидность операции. Стремились «не пропустить» возможное взаимодействие двух учитываемых факторов. Но достоверного эффекта взаимодействия ни в одной из пар так и не было выявлено (табл. 3).
Данные сводной таблицы результатов дисперсионных анализов приводят к двум важным заключениям. Во-первых, собственный эффект РЛД установлен во всех двухфакторных анализах, т.е. выявляется на фоне любого другого фактора изменчивости; его колебания в пределах 0,7–4,8 % вполне ожидаемы и определяются различием собственных вкладов вторых факторов. Во-вторых, эффекты характеристик опухоли (прежде всего, её распространённости, т.е. стадии заболевания, метастатического поражения регионарных ЛУ и гистологической структуры опухоли) и особенностей операции (кроме её разновидностей, СДРЖ, ГЭ, ТАГЭ) всегда больше эффекта РЛД (D2). В совокупности эти заключения свидетельствуют об универсальной полезности РЛД при любых радикальных операциях, выполняемых по поводу всех разновидностей РЖ (по форме роста, гистологической структуре, локализации и т. д.). Одновременно стала ясной необходимость более детального исследования эффекта факторов на заключительном этапе дисперсионного анализа – сравнении групповых средних. Поскольку речь идёт о группах, отвечающих разным градациям основного и сопутствующих факторов, здесь можно узнать, каким из них соответствуют относительно высокие или, наоборот, низкие значения продолжительности жизни. Иными словами, открывается возможность интерпретировать полученный статистический результат с медицинских позиций. Сравнение таблица 3
Групповые средние по фактору «гистологическая структура опухоли» и их сравнение
Доказанная в дисперсионном анализе эффективность фактора «стадия рака» не означает, что достоверно отличаются друг от друга средние продолжительности жизни после лечения всех групп, выделенных по этому фактору. Поэтому дисперсионный анализ и должен быть завершён сравнением групповых средних, для этого использовали множественный критерий Стьюдента. Здесь разность между средними в каждой конкретной паре сравнения групп оценивалась на фоне внутригрупповой (остаточной) дисперсии во всём изученном комплексе данных, что повысило разрешающую способность метода.
Проведенный нами анализ влияния гистологической структуры опухоли на результат лечения установил отсутствие значимых различий в результатах лечения контрольной и основной групп. В обеих группах больных было обнаружено, что результаты лечения ухудшаются по мере уменьшения дифференцировки опухоли. Значимые отличия зафиксированы между группами с высоко-, умеренно- и низкодифференцированной аденокарциномой. Нет значимых различий между слизеобразующими раками: перстневидно-клеточным и муцинозным, а самым неблагоприятным в плане прогноза оказался недифференцированный РЖ (табл. 4).
При анализе групповых средних по регионарному метастазированию прослеживается интересная закономерность, отражающая влияние количественного поражения ЛУ на 5-летнюю выживаемость пациентов. Наилучшие результаты закономерно наблюдались в группе N0, значимо в худшую сторону отличались итоговые показатели в группах Nj и N2, одинаково плохими были ре- таблица 5
|
№ группы |
Регионарное метастазирование |
Средняя продолжительность жизни, мес |
Ранговый тест |
|
4 |
N3b |
٭ 22,0 |
|
|
3 |
N3a |
٭ 24,5 |
|
|
2 |
N2 |
37,8 |
٭ |
|
1 |
N |
46,1 |
٭ |
|
5 |
N0 |
52,0 |
٭ |
|
таблица 6 |
|
Фактор |
Продолжительность жизни |
Длина периода без рецидива |
||
|
Вклад |
Ранг вклада |
Вклад |
Ранг вклада |
|
|
Гистотип опухоли |
30,7 % |
1 |
5,3 % |
5 |
|
Стадия рака |
24,8 % |
3 |
14,5 % |
1 |
|
Локализация опухоли |
8,4 % |
7 |
3,1 % |
6 |
|
Форма роста опухоли |
18,2 % |
4 |
7,5 % |
3 |
|
Глубина инвазии опухоли |
12,1 % |
6 |
7,0 % |
4 |
|
Поражение регионарных ЛУ |
25,6 % |
2 |
2,2 % |
7 |
|
Объем операции |
17,1 % |
5 |
11,9 % |
2 |
Примечание: в таблице 7 факторов, которые внесли значимый вклад в дисперсию обоих признаков.
Групповые средние по фактору «регионарное метастазирование» и их сравнение
зультаты лечения больных с N 3а и N 3в (табл. 5). Этот факт подтверждает необходимость выполнения РЛД (D2).
К интересным результатам привело сравнение вкладов сопутствующих факторов в общую дисперсию продолжительности жизни всех пролеченных, с одной стороны, и проживших 5-летний период наблюдений без рецидива опухоли – с другой (табл. 6). Во-первых, вклады всех без исключения факторов в изменчивость выживаемости без рецидива оказались меньше, чем вклады в общую выживаемость. Во-вторых, ранги факторов, т.е. их место по значимости, не обнаружили сходства. Коэффициент корреляции рангов (Спирмена) близок к нулю (–0,07) и, естественно, недостоверен (р>0,05). Наиболее сильно изменились эффекты гистологической структуры опухоли (5-й ранг вместо 1-го) и поражения регионарных ЛУ (7-й вместо 2-го). Заметно возрос относительно других эффект объема операции (2-й вместо 5-го).
Это означает, что состав ведущих факторов изменчивости безрецидивной выживаемости (в сравнении с общей) изменился и, главное, не исчерпывается 7 учтёнными сопутствующими факторами. Возрастание роли фактора «объема операции» в изменчивости длительности периода безрецидивной выживаемости получило объяснение в специфичном дисперсионном анализе.
Он выполнен только для больных РЖ III или IV стадий, когда особенно часто выполняются комбинированные операции. Выявилось достоверное взаимодействие объема операции с РЛД (вклад в общую дисперсию 9 %). Сравнение групповых средних показало, что если при выполнении стандартной операции объем ЛД практически не сказывался на отдалённых результатах, то длительность безрецидивного периода у больных, перенесших комбинированную операцию, увеличилась за счёт РЛД с 18,8 до 24,0 мес, т.е. в 1,3 раза.
Выводы
Список литературы Причины рецидива рака желудка у больных после радикального лечения
- Ferlay J., Soerjomataram I., Dikshit R., Eser S., Mathers C., Rebelo M., Parkin D.M., Forman D., Bray F. Cancer incidence and mortality worldwide: Sources, methods and major patterns in GLOBOCAN 2012. Int J Cancer. 2015 Mar 1; 136 (5): E359-86. DOI: 10.1002/ijc.29210
- Каприн А.Д., Старинский В.В., Петрова Г.В. Злокачественные новообразования в России в 2014 году. М., 2016; 250 с.
- Каприн А.Д., Старинский В.В., Петрова Г.В. Состояние онкологической помощи населению России в 2012 году. М., 2013; 232 с.
- Huang C.M., Lin J.X., Zheng C.H., Li P., Xie J.W., Lin B.J., Lu H.S. Prognostic impact of dissected lymph node count on patients with node-negative gastric cancer. World J Gastroenterol. 2009 Aug 21; 15 (31): 3926-30.
- Hundahl S.A., Wanebo H.J. Changing gastric cancer treatment in the United States and the pursuit of quality. Eur J Surg Oncol. 2005 Aug; (6): 605-15. DOI: 10.1016/j.ejso.2005.02.011


