Применение аппарата искусственных нейронных сетей в прогнозировании фибрилляции предсердий у мужчин с ишемической болезнью сердца
Автор: Ярославская Е.И., Дьячков С.М., Горбатенко Е.А.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Цифровые технологии поддержки решений в медицине
Статья в выпуске: 4 т.35, 2020 года.
Бесплатный доступ
Цель исследования: с помощью математического аппарата искусственных нейронных сетей (ИНС) отобрать наиболее чувствительные параметры для создания модели ИНС с целью прогнозирования фибрилляции предсердий (ФП) у мужчин с ишемической болезнью сердца (ИБС).Материал и методы. Материалом служили данные обследования пациентов регистра коронарной ангиографии с ангиографически доказанной ИБС: 180 мужчин с ФП - основная группа, 713 мужчин без ФП - группа сравнения, сопоставимая по возрасту с основной. Для оценки риска наличия ФП использовали математическую модель ИНС - многослойный персептрон с одним скрытым слоем. Исходное количество пациентов было разделено на 3 выборки: обучающую, тестовую и контрольную.Результаты. Пациенты с ФП статистически значимо реже были трудоустроены в бюджетных организациях (55,0 против 63,7%; р = 0,040), чаще демонстрировали более высокие (III-IV) функциональные классы (ФК) хронической сердечной недостаточности (ХСН) по NYHA (49,2 против 21,1%; р
Искусственные нейронные сети, фибрилляция предсердий, ишемическая болезнь сердца
Короткий адрес: https://sciup.org/149126202
IDR: 149126202 | УДК: 616.12-005.4-06:616.12-008.313.2-037: | DOI: 10.29001/2073-8552-2020-35-4-119-127
Текст научной статьи Применение аппарата искусственных нейронных сетей в прогнозировании фибрилляции предсердий у мужчин с ишемической болезнью сердца
Фибрилляция предсердий (ФП) – одно из самых часто встречающихся нарушений ритма сердца, до 50 лет диагностируется в 0,14%, в 60–70 лет – в 4% и у лиц старше 80 лет – в 14% случаев [1]. Частота выявления ФП у больных с ишемической болезнью сердца (ИБС), по зарубежным данным, составляет 6,7% [2]. По данным нашего регистра коронарной ангиографии (КАГ), эта цифра ниже более чем вдвое – 2,9%, что объясняется относительно молодым возрастом наших пациентов с ИБС и ФП: 62 ± 8 против 70 ± 9 лет за рубежом [3]. Разработано достаточно большое количество способов прогнозирования ФП в различных популяциях, однако определение места коронарного стенозирования в развитии ФП затруднено из-за влияния сопутствующих факторов риска, с которы- ми связаны и ФП, и коронарный атеросклероз: возраст, мужской пол, артериальная гипертония (АГ), хроническая сердечная недостаточность (ХСН), ожирение. Влияние этих факторов (конфаундеров) затрудняет изучение взаимосвязей коронарного атеросклероза и ФП. С использованием различных математических методов обработки данных было установлено, что в смешанной по полу группе больных ИБС ФП связана с поражениями правой коронарной артерии (ПКА) [3, 4]. Ранее мы показали, что у мужчин с постинфарктным кардиосклерозом поражение ПКА является независимым предиктором значимой митральной регургитации (МР) [5]. Это позволяет говорить о потенциальном вкладе поражения ПКА в развитие ФП в этой гендерной группе и посредством значимой МР, а также создает предпосылки для исследования взаимо- связей ФП изолированно у мужчин и женщин с ИБС. Разработка модели прогнозирования ФП поможет предотвратить развитие данного нарушения ритма у пациентов с коронарным атеросклерозом.
Цель исследования: с помощью математического аппарата искусственных нейронных сетей (ИНС) отобрать наиболее чувствительные параметры для создания модели ИНС с целью прогнозирования ФП у мужчин с ИБС.
Материал и методы
Исследование является ретроспективным одномоментным срезом электронной базы данных – регистра КАГ, который ведется в Тюменском кардиологическом научном центре с 1991 г. [6]. Из 6978 пациентов регистра с гемодинамически значимым коронарным стенозированием (50% просвета и более) как минимум одной артерии были отобраны и разделены на группы мужчины в зависимости от наличия или отсутствия ФП. Основную группу составили 180 мужчин с ФП. Чтобы создать сопоставимую по основному конфаунд-фактору (возрасту) группу сравнения без ФП, был использован метод, основанный на выравнивании частотных распределений. Исключив с его помощью влияние возраста, мы создали группу сравнения – 713 мужчин с ИБС без ФП.
Всем пациентам регистра проводили клиническое, лабораторное и инструментальное обследование. Массу тела оценивали по критериям Всемирной организации здравоохранения. Курение, употребление алкоголя, занятость в бюджетных или внебюджетных организациях учитывали при опросе [7]. Всем обследованным была выполнена селективная КАГ по методу Judkins (1967). Учитывали количество, локализацию и степень поражения коронарных артерий; наряду с гемодинамически значимыми оценивали и гемодинамически незначимые поражения (до 50% просвета и неровности внутреннего контура). Диагностику клинических синдромов проводили по отечественным руководствам, действовавшим во время госпитализации, и рекомендациям, актуальным в настоящее время [8, 9]. Результаты эхокардиографии (ЭхоКГ) оценивали по стандартным критериям: cисто-лическую функцию левого желудочка (ЛЖ) считали сниженной при фракции выброса (ФВ) ЛЖ менее 50%, ЛЖ считали дилатированным при индексе его конечно-диастолического размера более 31 мм/м² у мужчин и более 32 мм/м² у женщин, левое предсердие (ЛП) – независимо от пола при индексе его диастолического размера более 23 мм/м² [10–12].
Анализ включенных в исследование данных проводили с помощью языка программирования для статистической обработки данных R (v. 3.6.1) в пакете прикладных программ R Studio (v. 1.2.1335) программы STATISTICA (StatSoft, версии 10 с дополнительным пакетом Automated Neural Networks). Распределение на нормальность для количественных показателей оценивали с помощью теста Шапиро – Уилка. Для выявления статистически значимых различий количественных показателей в независимых группах при отсутствии нормального распределения использовали критерий Манна – Уитни с указанием медианного значения и интерквартильного интервала ( Me [ Q25; Q75 ]). Для сравнения категориальных переменных использовали критерий χ 2 Пирсона. Различия считали статистически значимыми при р < 0,05.
Для оценки риска наличия ФП использовали математическую модель ИНС [13], тип которой можно охаракте- ризовать как многослойный персептрон с одним скрытым слоем. Исходное количество пациентов было разделено на 3 выборки: обучающую, тестовую и контрольную. При построении оптимальной модели ИНС отбор факторов в пакете Automated Neural Networks программы STATISTICA производили методом последовательного исключения: строили 1000 нейронных сетей, из них выбирали 100 лучших по общей точности классификации на всех трех выборках, затем из 100 лучших выбирали 10 нейронных сетей, которые на контрольной выборке показывали наивысшую чувствительность (в среднем отличались на ±5%). Для отобранных 10 нейронных сетей проводили анализ чувствительности на основе суммы квадратов ошибок прогнозирования при принятии значения исследуемого показателя за среднее в общей выборке (Residual Sum of Square – RSS). Если по результатам оценки средних значения RSS были меньше единицы, исключали показатель с наименьшей оценкой. Если все показатели имели оценку больше единицы, выбирали модель с наилучшей точностью. В качестве функции активации скрытого слоя использовали функцию «гиперболический тангенс», в качестве функции активации выходного слоя – Softmax. Классификационные показатели выходного слоя – определяли наличие или отсутствие ФП: наличие ФП – ‖AF(1)‖, отсутствие ФП – ‖AF(0)‖. Если ‖AF(1)‖ больше или равно ‖AF(0)‖, по данным модели, можно говорить о наличии ФП; если ‖AF(1)‖ меньше ‖AF(0)‖, можно говорить об отсутствии ФП. Для определения диагностической точности модели применялся ROC-анализ.
Результаты
Нормального распределения признаков в обеих группах не было, коррекция выборки для достижения нормального распределения не проводилась. Группы были сопоставимы не только по возрасту, но и по частоте и степени АГ, частоте острого инфаркта миокарда и сахарного диабета (табл. 1). В группе мужчин с ФП был статистически значимо ниже процент работающих в бюджетных организациях, выше – индекс массы тела и средняя частота сердечных сокращений (ЧСС) в минуту, достоверно чаще выявляли более тяжелые (III–IV) функциональные классы (ФК) ХСН по классификации NYHA. В группе с ФП прослеживались тенденции к более редким нестабильным формам стенокардии и анамнестическому инфаркту миокарда, курению, употреблению алкоголя, к более частым заболеваниям щитовидной железы.
При сравнении лабораторных показателей статистически значимых межгрупповых различий выявлено не было (табл. 2).
При ЭхоКГ (табл. 3) размеры полостей сердца, толщина стенок и масса миокарда ЛЖ в абсолютных значениях были больше у больных с ФП. После индексирования к площади поверхности тела эти различия сохранились для всего перечисленного за исключением толщины стенок ЛЖ. Дилатацию ЛЖ и ЛП в группе пациентов с ФП регистрировали чаще.
У 37 из 180 мужчин (21%) с ФП наблюдали ее пароксизмальную форму, и у большинства из них (у 34 из 37 мужчин) на фоне синусового ритма выявляли диастолическую дисфункцию ЛЖ. У большинства мужчин без ФП (78%) также определяли нарушение диастолической функции ЛЖ. У мужчин с ФП чаще выявляли гемодинамически значимую МР. Средняя ФВ ЛЖ у них была ниже, снижение сократительной способности ЛЖ отмечалось чаще.
Таблица 1. Сравнительная клиническая характеристика мужчин с ишемической болезнью сердца в зависимости от наличия фибрилляции предсердий
Table 1. Comparative clinical characteristics of men with coronary artery disease depending on the presence of atrial fibrillation
|
Показатели Parameters |
Мужчины с ФП ( n = 180) Men with AF ( n = 180) |
Мужчины без ФП ( n = 713) Men without AF (n = 713) |
P |
|
|
Возраст, лет, Me [Q 25 ; Q 75 ] Age, years, Me [Q 25 ; Q7j |
61 [55; 67] |
61 [55; 66] |
0,412 |
|
|
Индекс массы тела, кг/м2, Me [Q 25 ; Q 75 ] Body mass index, kg/m2, Me [Q 25 ; Q 75 ] |
30,2 [27,4; 33,2] |
29,0 [26,1; 32,3] |
0,002 |
|
|
Работа в бюджетной организации, % Work in a budgetary organization, % |
55,0 |
63,7 |
0,040 |
|
|
Частота сердечных сокращений в минуту, Me [Q 25 ; Q 75 ] Heart rate, beats per minute, Me [Q 25 ; Q 75 ] |
83 [70; 94] |
70 [65; 78] |
<0,001 |
|
|
Курение, % Smoking, % |
48,0 |
56,0 |
0,079 |
|
|
Употребление алкоголя, % Alcohol consumption, % |
16,9 |
23,7 |
0,097 |
|
|
Сахарный диабет 2-го типа, % Diabetes mellitus type 2, % |
15,6 |
12,7 |
0,669 |
|
|
Заболевания щитовидной железы, %: Thyroid diseases, %: |
11,8 |
7,7 |
||
|
– эутиреоз, % euthyroidism, % |
9,5 |
5,4 |
0,062 |
|
|
– гипотиреоз, % hypothyroidism, % |
1,7 |
1,3 |
||
|
Стенокардия, % Angina pectoris, % |
76,1 |
80,8 |
||
|
Стенокардия, % |
Стабильная Stable |
67,8 |
60,1 |
0,071 |
|
Angina pectoris, % |
Нестабильная Unstable |
8,3 |
20,7 |
|
|
ФК стенокардии напряжения, % |
I–II |
46,3 |
47,1 |
0,808 |
|
Angina functional classes, % |
II–IV |
52,7 |
53,6 |
|
|
Острый инфаркт миокарда, % Acute myocardial infarction, % |
15,6 |
19,7 |
0,65 |
|
|
Инфаркт миокарда в анамнезе, % History of myocardial infarction, % |
44,7 |
52,0 |
0,094 |
|
|
Артериальная гипертония, % Arterial hypertension, % |
91,1 |
88,5 |
0,53 |
|
|
Степень артериальной гипертонии, % |
1–2 |
37,2 |
40,9 |
0,16 |
|
Arterial hypertension degree, % |
3 |
62,8 |
59,1 |
|
|
ФК ХСН по классификации NYHA, % |
I–II |
50,8 |
78,9 |
< 0,001 |
|
NYHA class of HF, % |
III–IV |
49,2 |
21,1 |
|
Примечание: р - уровень значимости различий между группами пациентов при отсутствии нормального распределения величин, Me [Q 25 ; Q 75 ] -медианное значение и интерквартильный размах, интервал между 25- и 75-м процентилями, ИБС – ишемическая болезнь сердца, ФП – фибрилляция предсердий, ФК – функциональный класс, ХСН – хроническая сердечная недостаточность, NYHA – Нью-Йоркская ассоциация сердца.
Note: p - level of significance of differences between groups of patients for not normally distributed values, Me [Q 25 ; Q 75 ] - median values and interquartile range and the interval between the 25th and 75th percentiles, IHD – ischemic heart disease, AF – atrial fibrillation, HF – heart failure, and NYHA – New York Heart Association.
Таблица 2. Сравнительная характеристика лабораторных показателей больных ишемической болезнью сердца в зависимости от наличия фибрилляции предсердий
Table 2. Comparative characteristics of laboratory parameters in ischemic heart disease patients depending on the presence of atrial fibrillation
|
Показатели Parameters |
Пациенты с ФП ( n =180) Men with AF ( n = 180) |
Пациенты без ФП (n = 713) Men without AF ( n = 713) |
P |
|
Дислипидемия, % Dyslipidemia, % |
92,6 |
95,2 |
0,221 |
|
Общий холестерин, ммоль/л, Me [Q 25 ; Q 75 ] Total cholesterol, mmol/L, Me [Q 25 ; Q 75 ] |
5,27 [4,51; 5,98] |
5,15 [4,32; 6,02] |
0,269 |
|
ХС ЛПВП, ммоль/л, Me [Q 25 ; Q 75 ] HDL cholesterol, mmol/L, Me [Q 25 ; Q 75 ] |
1,09 [0.96; 1,27] |
1,08 [0,91; 1,28] |
0,614 |
|
ХС ЛПНП, ммоль/л, Me [Q 25 ; Q 75 ] LDL cholesterol, mmol/L, Me [Q 25 ; Q 75 ] |
3,4 [2,78; 4,01] |
3,2 [2,42; 3,97] |
0,125 |
Окончание табл. 2
End of table 2
|
Показатели Parameters |
Пациенты с ФП ( n =180) Men with AF ( n = 180) |
Пациенты без ФП (n = 713) Men without AF ( n = 713) |
P |
|
Триглицериды, ммоль/л, Me [Q 25 ; Q 75 ] Triglycerides, mmol/L, Me [Q 25 ; Q 75 ] |
1,49 [1,09; 2,01] |
1,56 [1,14;2,18] |
0,205 |
|
Индекс атерогенности, Me [Q 25 ; Q 75 ] Atherogenic index, Me [Q 25 ; Q7J |
4,00 [3,27; 4,89] |
4,01 [3,19; 5,05] |
0,951 |
|
Глюкоза крови натощак, ммоль/л, Me [Q 25 ; Q 75 ] Fasting blood glucose, mmol/L, Me [Q 25 ; Q 75 ] |
5,70 [4,89; 6,51] |
5,59 [5,00; 6,40] |
0,800 |
|
Фибриноген, г/л, Me [Q 25 ; Q 75 ] Fibrinogen, g/L, Me [Q 25 Q 75 ] |
3,50 [2,99; 3,90] |
3,32 [2,97; 3,80] |
0,712 |
Примечание: ХС ЛПВП – холестерин липопротеинов высокой плотности, ХС ЛПНП – холестерин липопротеинов низкой плотности.
Note: HDL cholesterol – high density lipoprotein cholesterol, LDL cholesterol – low density lipoprotein cholesterol.
Таблица 3. Сравнительная характеристика эхокардиографических показателей больных ишемической болезнью сердца в зависимости от наличия фибрилляции предсердий
Table 3. Comparative characteristics of echocardiographic parameters in patients with coronary artery disease depending on the presence of atrial fibrillation
|
Показатели Parameters |
Пациенты с ФП (n = 180) Men with AF ( n = 180) |
Пациенты без ФП (n = 713) Men without AF ( n = 713) |
P |
||
|
Диаметр корня аорты, Me Q 25 ; Q 75 ] Aortic root diameter, Me Q 25 ; Q 75 ] |
мм |
mm |
36 [34; 39] |
36 [34; 38] |
0,319 |
|
мм/м² |
mm/m² |
17,7 [16,4; 19,0] |
18,3 [17,8; 20,0] |
0,002 |
|
|
Размер левого предсердия, Me [Q 25 ; Q 75 ] Left atrial dimension, Me [Q 25 ; Q 75 ] |
мм |
mm |
48 [45; 52] |
41 [39;44] |
<0,001 |
|
мм/м² |
mm/m² |
23,6 [21,7; 25,7] |
21,1 [19,7; 22,7] |
<0,001 |
|
|
Дилатация левого предсердия, % Left atrial dilation, % |
59,1 |
23,1 |
<0,001 |
||
|
Размер правого желудочка, Me Q/. Q 75 ] Right ventricular dimension, Me Q/. Q 75 ] |
мм |
mm |
27 [25; 30] |
25 [24; 26] |
<0,001 |
|
мм/м² |
mm/m² |
13,1 [12,2; 14,9] |
12.9 [12,0; 13,9] |
<0,001 |
|
|
Конечно-диастолический диаметр левого желудочка, Me [Q 25 ; Q7J Left ventricular end-diastolic diameter, Me [Q25; Q75] |
мм |
mm |
53 [49; 59] |
50 [47; 53] |
<0,001 |
|
мм/м² |
mm/m² |
25,8 [24,1; 29,1] |
25,6 [23,9; 27,5] |
0,020 |
|
|
Дилатация левого желудочка, % Left ventricular dilatation, % |
14,9 |
6,1 |
<0,001 |
||
|
Толщина межжелудочковой перегородки, Me [Q25; Q75] Interventricular septum thickness, Me [Q25; Q75] |
мм |
mm |
13 [12; 14] |
12 [11; 14] |
0,006 |
|
мм/м² |
mm/m² |
6,4 [5.8; 7,0] |
6,5 [5,8; 7,2] |
0,586 |
|
|
Толщина задней стенки левого желудочка, Me [Q25; Q75] Left ventricular posterior wall thickness, Me [Q25; Q 7J |
мм |
mm |
12 [10; 12] |
11 [10; 12] |
<0,001 |
|
мм/м² |
mm/m² |
5,6 [5,1; 6,1] |
5,6 [5,1; 6,1] |
0,722 |
|
|
Масса миокарда левого желудочка, Me [Q25; Q75] Left ventricular myocardial mass, Me [Q25; Q75] |
г |
g |
344,8 [289,5; 406,1] |
282,2 [241,9; 330,8] |
<0,001 |
|
г/м² |
g/m² |
163,7 [144,5; 192,4] |
143,9 [126,1; 169,0] |
<0,001 |
|
|
Признаки атеросклеротического поражения аорты, % Signs of atherosclerotic lesions of the aorta, % |
92,0 |
90,2 |
0,551 |
||
|
Митральная регургитация 2-й степени и более, % Mitral regurgitation grade 2 or more, % |
48,2 |
14,1 |
<0,001 |
||
|
Размер асинергии левого желудочка, %, Me [Q25; Q75] Left ventricular wall abnormality size, %, Me [Q25; Q75] |
10 [0; 25] |
15 [0; 25] |
0,077 |
||
|
Индекс асинергии левого желудочка, Me [Q 2 ; Q 75 ] LV wall abnormality index, Me [Q25; Q75] |
1,15 [1,0; 1,5] |
1,2 [1,0; 1,5] |
0,639 |
||
|
Постинфарктная аневризма левого желудочка, % Postinfarction LV aneurysm, % |
7,6 |
12,4 |
0,102 |
||
|
Тромб левого желудочка, % LV thrombus, % |
1,8 |
2,6 |
0,699 |
||
|
Фракция выброса левого желудочка, %, Me [Q25; Q75] LV ejection fraction, %, Me [Q 25 ; Q7J |
49 [42; 56] |
56 [47; 60] |
<0,001 |
||
|
Фракция выброса левого желудочка <50%, % LVEF < 50%, % |
51,4 |
30,7 |
<0,001 |
||
Не было различий по частоте выявления признаков атеросклеротического поражения аорты, постинфарктной аневризмы и тромбов ЛЖ, индексу асинергии ЛЖ. Тенденция к большему размеру асинергии ЛЖ наблюдалась у мужчин без ФП.
При КАГ у мужчин с ФП чаще определяли поражения ПКА, причем проксимальных отделов, а также кальциноз коронарных артерий (табл. 4). В группе пациентов с ФП были обнаружены тенденции к более редким поражениям передней нисходящей ветви левой коронарной артерии и правому типу коронарного кровообращения.
В качестве исходных данных в прогностическую модель включали только статистически значимо различавшиеся между группами признаки, исключая тесно связанные, например, индекс конечно-диастолического диаметра ЛЖ и дилатация ЛЖ.
Таблица 4. Сравнение частоты локализации, выраженности и распространенности коронарных поражений в зависимости от наличия фибрилляции предсердий, %
Table 4. Comparison of the frequency of localization, severity, and prevalence of coronary lesions depending on the presence of atrial fibrillation, %
|
Показатели Пациенты с ФП ( n = 178) Пациенты без ФП ( n = 331) Parameters Men with AF ( n = 180) Men without AF ( n = 713) р |
|||||
|
Ствол левой коронарной артерии* Left main coronary artery * |
19,9 |
20,0 |
0,669 |
||
|
Передняя нисходящая ветвь левой коронарной артерии* Anterior descending coronary artery * |
82,7 |
87,5 |
0,052 |
||
|
Огибающая ветвь левой коронарной артерии* The circumflex coronary artery * |
61,1 |
63,4 |
0,834 |
||
|
Правая коронарная артерия* Right coronary artery * |
88,9 |
80,8 |
0,008 |
||
|
Локализация поражения правой коронарной артерии* Localization of lesion of the right coronary artery * |
проксимальная proximal |
28,3 |
22,7 |
0,025 |
|
|
среднего отдела и дистальная middle and distal |
60,6 |
58,1 |
|||
|
Нет поражения No lesion |
11,1 |
19,2 |
|||
|
Ветвь тупого края* Blunt edge branch * |
29,3 |
26,0 |
0,520 |
||
|
Диагональная ветвь* Diagonal branch * |
15,6 |
18,5 |
0,538 |
||
|
Интермедиальная ветвь* Intermedial branch * |
4,5 |
8,6 |
0,155 |
||
|
Гемодинамически значимые поражения (>50% просвета сосуда) Significant lesions (>50% of the lumen) Двухсосудистые Bilateral Множественные (3 сосуда и более) Multiple (3 vessels or more) |
Однососудистые Single-vessel |
32,4 |
30,2 |
0,361 |
|
|
31,7 |
28,1 |
||||
|
33,9 |
39,6 |
||||
|
Кальциноз коронарных артерий Coronary artery calcification |
23,2 |
15,7 |
0,024 |
||
|
Тип коронарного кровообращения Coronary circulation type |
Сбалансированный Balanced |
6,9 |
7,2 |
0,107 |
|
|
Левый Left |
7,5 |
13,0 |
0,062 |
||
|
Правый Right |
85,5 |
79,7 |
0,105 |
||
Примечание: * – любые поражения коронарных артерий, включая неровности просвета и окклюзии.
Note: * – any damage to the coronary arteries, including irregularities in the lumen and occlusion.
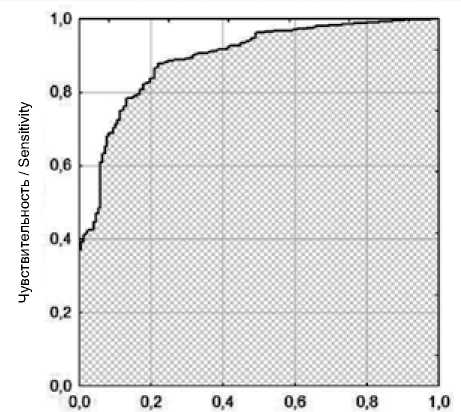
В модель вошли: 7 количественных (индексы массы тела, размеров левых отделов сердца, правого желудочка, корня аорты и массы миокарда ЛЖ, ФВ ЛЖ) и 5 ка-тегориальныx (занятость в бюджетной сфере, значимая МР, III–IV ФК ХСН по NYHA, кальциноз коронарных артерий и проксимальное поражение ПКА) – итого 12 признаков на входе, на выходе – признак наличия ФП. По результатам пошагового отбора были выбраны 10 факторов, оказывающих наибольшее влияние на риск наличия ФП: 5 количественныx (индексы массы тела, размеров левых отделов сердца и корня аорты, ФВ ЛЖ) и тех же 5 категориальныx признаков. Общая диагностическая точность модели на контрольной выборке пациентов составила 85%, чувствительность – 85%, специфичность – 86%, что свидетельствует о высокой диагностической ценности модели. Площадь под ROC-кривой составила 0,895 (рис. 1).
Для выбранной ИНС был также проведен анализ чувствительности (восприимчивости) модели к изменениям каждого конкретного ее параметра по показателю RSS – чем он меньше, тем меньше изменение точности определения ФП при замене исследуемого параметра его средним значением, а значит, тем менее модель восприимчива к изменениям исследуемого параметра (табл. 5).
Неспецифичность / Non-specifity
Рис. 1. Результаты ROC-анализа прогностической модели Fig. 1. ROC-analysis of prognostic model
Таблица 5. Чувствительность искусственных нейронных сетей к изменению значения параметров модели
Table 5. Artificial neural network sensitivity to changes in model parameter values
|
Параметры Parameters |
RSS |
|
Гемодинамически значимая митральная регургитация Hemodynamically significant mitral regurgitation |
4,930322 |
|
Занятость во внебюджетной сфере Extrabudgetary employment |
4,281858 |
|
III–IV ФК ХСН по классификации NYHA NYHA CHF III–IV classes |
4,171349 |
|
Кальциноз коронарных артерий Coronary artery calcification |
3,45945 |
|
Индекс размера левого предсердия Left atrial dimension index |
3,26239 |
|
Проксимальное поражение правой коронарной артерии Proximal right coronary artery disease |
3,01575 |
|
Индекс размера корня аорты Aortic root dimension index |
2,130741 |
|
Индекс массы тела Body mass index |
1,515117 |
|
Фракция выброса левого желудочка Left ventricular ejection fraction |
1,331619 |
|
Индекс конечно-диастолического диаметра левого желудочка Left ventricular end-diastolic diameter index |
1,243085 |
Обсуждение
Ранее для определения роли коронарного стенозирования в развитии ФП с помощью метода псевдорандомизации мы создали сопоставимую по основным характеристикам (полу, возрасту, индексу массы тела, выраженности ХСН, частоте АГ и инфаркта миокарда в анамнезе) группу сравнения больных ИБС без ФП [4]. Это доказывало связь ФП с поражением ПКА, но не позволяло создать полноценную модель прогнозирования ФП. На следующем этапе для формирования группы сравнения мы применили метод, основанный на выравнивании частотных распределений [3]. С его помощью мы нивелировали влияние основного по значимости конфаундера – возраста, группы были сопоставимы по частоте сахарного диабета, острого инфаркта миокарда, тяжести АГ, а также по частоте атеросклеротического поражения аорты и индексу асинергии ЛЖ.
Однако наблюдались значимые различия по индексу массы тела, тяжести ХСН, частоте нестабильных форм ИБС и анамнестического инфаркта миокарда, индексам размеров полостей сердца и массы миокарда ЛЖ, ФВ ЛЖ, частоте значимой МР, поражений ПКА и коронарному кальцинозу [5]. Аналогично вели себя эти параметры в группах мужчин настоящего исследования. Наличие ФП объясняет выявленные межгрупповые различия по ЧСС, размерам левых отделов сердца, правого желудочка, ФВ ЛЖ и т. д. Модель прогнозирования ФП у мужчин во многом пересекается с разработанной нами моделью для смешанной по полу группы [3]. В обеих моделях большое значение имели параметры, связь которых с ФП очевидна и не вызывает вопросов: гемодинамически значимая МР, более тяжелые проявления ХСН, а также показатели, характеризующие состояние левых отделов сердца и массу тела. Однако диагностическая точность оказалась выше у модели, прогнозирующей ФП у мужчин (84,9 против 69,7%).
Основной причиной клинических проявлений при ФП является рассогласование предсердно-желудочкового взаимодействия, что ведет к неравномерному наполнению ЛЖ и развитию МР. Гемодинамически значимая МР оказалась самым сильным параметром нашей модели, что говорит о ее важной роли в патогенезе ФП, реализуемой через усугубление структурного ремоделирования миокарда ЛП, прогрессирование фиброза и потенцииро-вание существования аритмии.
Все пациенты, включенные в исследование, имели ангиографически доказанную ИБС. Однако изучая связи коронарного стенозирования и ФП, стоит учитывать не только гемодинамически значимые, но и незначимые изменения коронарных артерий, поскольку функциональная значимость поражения далеко не всегда соответствует степени коронарной обструкции [14]. Необструктивные изменения коронарных артерий часто сопровождаются ишемией миокарда [15] и могут влиять на развитие ФП [16], поэтому в анализ были включены как значимые, так и незначимые коронарные поражения.
В обе модели прогнозирования ФП вошло поражение ПКА, но в смешанной по полу группе ФП не показала связи с уровнем поражения этой артерии [3]. Обнаруженная у мужчин связь ФП именно с проксимальным поражением ПКА объясняется тем, что ее ветвь, кровоснабжающая синусовый узел, в большинстве случаев отходит именно от проксимального отдела ПКА [17], а ишемия в бассейне артерии, снабжающей синусовый узел, является одной из причин его дисфункции и ФП. Вероятно, вклад проксимального поражения ПКА в развитие ФП у мужчин усиливается посредством значимой МР, также связанной с поражением ПКА в этой гендерной группе [5].
По нашим результатам одним из предикторов ФП у мужчин с ИБС оказался коронарный кальциноз, выявленный при КАГ. Известно, что кальциноз коронарных артерий, обнаруженный при компьютерной томографии, характерен для больных ИБС с ФП, и включение его в шкалу
CHA2DS2-VASc может существенно реклассифицировать результат [18]. Важно, что исключение влияния возраста в нашем исследовании не только не привело к выравниванию групп по частоте коронарного кальциноза при КАГ, но и сохранило его высокую прогностическую значимость.
Тот факт, что группы мужчин не различались по индексу асинергии ЛЖ и количеству пораженных артерий, дает основания говорить о том, что ФП у больных ИБС не связана с выраженностью и распространенностью коронарного атеросклероза. Это позволяет объяснить часто наблюдаемое после реваскуляризации миокарда отсутствие уменьшения количества пароксизмов ФП или их прекращение. Тенденция к более редким в группе пациентов с ФП анамнестическим инфарктам миокарда и меньшему размеру асинергии ЛЖ согласуется с тенденцией к более редким поражениям передней нисходящей ветви левой коронарной артерии в этой группе.
Вторым по величине показателем RSS в модели оказался такой не учитывавшийся ранее параметр, как занятость во внебюджетной сфере (см. табл. 5). Вероятно, это связано с отсутствием диспансеризации в большинстве внебюджетных организаций, неудовлетворительными ус- ловиями труда, более высокой его интенсивностью, более частыми стрессовыми ситуациями и пр. Возможно, этот дополнительный социальный фактор можно учитывать при прогнозировании риска развития ФП и у других групп лиц.
К ограничениям исследования относится отсутствие у ряда пациентов регистра КАГ сведений о давности ИБС и ФП, что не дает возможности оценить вклад стажа ИБС в формирование ФП, а также отсутствие данных о приеме антикоагулянтов и антиаритмической терапии.
Полученная модель может быть использована для поддержки принятия врачебных решений с целью оценки риска ФП в виде программного модуля на базе медицинской информационной системы 1С.
Заключение
Развитие ФП у мужчин с ИБС можно прогнозировать с помощью модели ИНС, включающей наличие значимой МР, занятость во внебюджетной сфере, ФК ХСН по NYHA, коронарный кальциноз, проксимальное поражение ПКА, индексы массы тела, размеров левых отделов сердца и корня аорты, а также ФВ ЛЖ.
Список литературы Применение аппарата искусственных нейронных сетей в прогнозировании фибрилляции предсердий у мужчин с ишемической болезнью сердца
- Kirchhof P., Benussi S., Kotecha D., Ahlsson A., Atar D., Casadei B. et al. 2016 ESC Guidelines for the management of atrial fi brillation developed in collaboration with EACTS. Eur. Heart J. 2016;37(38):2893-2962. https://doi.org/10.1093/eurheartj/ehw210.
- Schnabel R.B., Yin X., Gona P., Larson M.G., Beiser A.S., McManus D.D. et al. 50 year trends in atrial fi brillation prevalence, incidence, risk factors, and mortality in the Framingham Heart Study: А cohort study. Lancet. 2015;386(9989):154-162. https://doi.org/10.1016/S0140-6736(14)61774-8.
- Ярославская Е.И., Кузнецов В.А., Бессонов И.С., Горбатенко Е.А., Марьинских Л.В. Связь фибрилляции предсердий с поражениями коронарного русла (по данным регистра коронарной ангиографии). Российский кардиологический журнал. 2019;(7):12-18. https://doi.org/10.15829/1560-4071-2019-7-12-18.
- Ярославская Е.И., Кузнецов В.А., Горбатенко Е.А., Марьинских Л.В. Связь фибрилляции предсердий с поражением коронарного русла у больных ишемической болезнью сердца. Кардиология. 2019;59(9)5-12. https://doi.org/10.18087/cardio.2019.9.2641.
- Ярославская Е.И., Кузнецов В.А., Пушкарев Г.С., Криночкин Д.В., Зырянов И.П., Колунин Г.В. Митральная регургитация и локализация коронарных стенозов у больных с постинфарктным кардиосклерозом. Кардиология. 2013;53(2):55-60.
- Кузнецов В.А., Зырянов И.П., Колунин Г.В., Криночкин Д.В., Семухин М.В., Панин А.В. и др. Регистр проведенных операций коронарной ангиографии (база данных). Свидетельство № 2010620075 о государственной регистрации базы данных, зарегистр. 01.02.2010 г.
- Huang S., Li J., Shearer G.C., Lichtenstein A.H., Zheng X., Wu Y. et al. Longitudinal study of alcohol consumption and HDL concentrations: a community-based study. Am. J. Clin. Nutr. 2017;105(4):905-912. https://doi.org/10.3945/ajcn.116.144832.
- Мареев В.Ю., Фомин И.В., Агеев Ф.Т., Беграмбекова Ю.Л., Васюк Ю.А., Гарганеева А.А. и др. Клинические рекомендации ОССН - РКО - РНМОТ. Сердечная недостаточность: хроническая (ХСН) и острая декомпенсированная (ОДСН). Диагностика, профилактика и лечение. Кардиология. 2018;58(S6):8-158. https://doi.org/10.18087/cardio.2475.
- Kirchhof P., Benussi S., Kotecha D., Ahlsson A., Atar D., Casadei B. et al. Рекомендации ESC по лечению пациентов с фибрилляцией предсердий, разработанные совместно с EACTS. Российский кардиологический журнал. 2017;(7):7-86. https://doi.org/10.15829/1560-4071-2017-7-7-86.
- Karatasakis G., Athanassopoulos G.D. Cardiomyopathies. In book: The EAE textbook of echocardiography; L. Galiuto, L. Badano (ed.). Oxford: Oxford University Press; 2011:477.
- Lang R., Bierig M., Devereux R., Flachskampf F., Foster E., Pellikka P. et al. Recommendations for chamber quantifi cation. Eur. J. Echocardiography. 2006;7(2):79-108. https://doi.org/10.1016/j.euje.2005.12.014.
- Nagueh S.F., Appleton C.P., Gillebert T.C., Marino P.N., Oh J.K., Smiseth O.A. et al. Recommendations for the Evaluation of Left Ventricular Diastolic Function by Echocardiography. Eur. J. Echocardiography. 2009;10(2):165-193. https://doi.org/10.1093/ejechocard/jep007.
- Хайкин С. Нейронные сети: полный курс; 2-е изд. М.: Вильямс; 2018:1104.
- Petretta M., Costanzo P., Acampa W., Imbriaco M., Ferro A., Filardi P.P. et al. Noninvasive assessment of coronary anatomy and myocardial perfusion: going toward an integrated imaging approach: J. Cardiovasc. Med. (Hagerstown). 2008;9(10):977-986. https://doi.org/10.2459/JCM.0b013e328306f311.
- Thelin J., Melander O. Dynamic high-sensitivity troponin elevations in atrial fi brillation patients might not be associated with signifi cant coronary artery disease. BMC Cardiovasc. Disord. 2017;17(1):169. https://doi.org/10.1186/s12872-017-0601-7.
- Nucifora G., Schuijf J.D., van Werkhoven J.M., Trines S.A., Kajander S., Tops L.F. et al. Relationship between obstructive coronary artery disease and abnormal stress testing in patients with paroxysmal or persistent atrial fi brillation. Int. J. Cardiovasc. Imaging. 2011;27(6):777-785. https://doi.org/10.1007/s10554-010-9725-x.
- Бокерия Л.А., Макаренко В.Н., Юрпольская Л.А., Александрова С.А., Шляппо М.А. Визуализация артерии синусного узла с помощью многосрезовой компьютерной ангиографии. Вестник рентгенологии и радиологии. 2014;(1):19-22. https://doi.org/10.20862/0042-4676-2014-0-1-19-22.
- Chen L.Q., Tsiamtsiouris E., Singh H., Rapelje K., Weber J., Dey D. et al. Prevalence of coronary artery calcium in patients with atrial fi brillation with and without cardiovascular risk factors. Am. J. Cardiol. 2020;125(12):1765-1769. https://doi.org/10.1016/j.amjcard.2020.03.018.


