Применение биоактивного биодеградируемого имплантата из поликапролактона для лечения остеохондральных дефектов: экспериментальное исследование
Автор: Попков А.В., Горбач Е.С., Горбач Е.Н., Кононович Н.А., Киреева Е.А., Попков Д.А.
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 6 т.29, 2023 года.
Бесплатный доступ
Введение. Повреждение суставного хряща крупных суставов является частой патологией опорно-двигательного аппарата. Однако до настоящего времени восстановление пораженной суставной поверхности остается нерешенной проблемой травматологии и ортопедии.Цель. Оценить эффективность применения эластичного биоактивного биодеградируемого имплантата из поликапролактона, импрегнированного частицами гидроксиапатита, для заживления остеохондрального дефекта мыщелка бедренной кости у крыс.Материалы и методы. У 76 крыс линии Вистар, разделенных на 2 группы, моделировали костно-хрящевой дефект медиального мыщелка бедренной кости. В опытной группе дефект замещали биоразлагаемой биоактивной мембраной из поликапролактона с гидроксиапатитом. В контрольной группе смоделированный дефект не замещали. Он заживал естественным путем.Результаты были оценены в течение года клиническими, анатомическими, гистологическими, биомеханическими и статистическими методами.Результаты. Диапазон движений в коленном суставе у животных опытной группы на всех этапах эксперимента был существенно лучше, чем в контроле. Имплантат обеспечивал целостность и конгруэнтность суставной поверхности. На 180-е сутки на месте замещенного имплантатом дефекта наблюдался новообразованный участок суставной поверхности органотипического строения с восполнением субхондральной кости костной тканью, а суставной поверхности - хрящевой тканью. Имплантат к этому периоду полностью биодеградировал. Биомеханические свойства поврежденной суставной поверхности в опытной группе восстанавливались через 60 дней до уровня интактных животных. В контрольной группе, даже через год, оставались ниже на 27-29 %.Обсуждение. Восполнение дефекта эластичным имплантатом из поликапролактона с гидроксиапатитом обеспечивало раннюю функциональную нагрузку на сустав. Структура имплантата, имитирующая внеклеточный матрикс, способствовала росту, пролиферации и направленной дифференцировке клеток в области остеохондрального дефекта. Умеренная скорость биодеградируемости материала позволяла постепенно заместить имплантат органоспецифическими тканями.Заключение. Биодеградируемый имплантат из поликапролактона, импрегнированный частицами гидроксиапатита, эффективен для заживления костно-хрящевых дефектов.
Суставной хрящ, остеохондральный дефект, биодеградируемые имплантаты, поликапролактон, гидроксиапатит
Короткий адрес: https://sciup.org/142240032
IDR: 142240032 | УДК: 616.71-018.3-004.8-089.844-092.9 | DOI: 10.18019/1028-4427-2023-29-6-615-628
Текст научной статьи Применение биоактивного биодеградируемого имплантата из поликапролактона для лечения остеохондральных дефектов: экспериментальное исследование
Повреждение суставного хряща крупных суставов является частой патологией опорно-двигательного аппарата. Анализ более 30000 артроскопических вмешательств, связанных с повреждениями и заболеваниями крупных суставов, показал в 63 % наблюдений патологические изменения хряща различной степени [1, 2].
Локальные нарушения хрящевой выстилки и подлежащей субхондральной кости мыщелков бедренной кости в большинстве случаев являются следствием травм или заболеваний коленного сустава, а несвоевременное или неадекватное лечение может приводить к развитию дегенеративно-дистрофических поражений суставов [3].
Как правило, костно-хрящевые дефекты крупных суставов требуют хирургического лечения [4].
Несмотря на внедрение в клиническую практику широкого спектра хирургических методик лечения повреждений суставного хряща, на современном этапе развития медицины и биотехнологий поиск методов восстановления суставных поверхностей остается очень актуальной и нерешённой задачей [5].
Низкая способность хряща к регенерации отмечена многими исследователями и связана с отсутствием в нем кровоснабжающих и иннервирующих составляющих. В связи с этим проводилось и проводится множество исследований, направленных разработку новых методов, которые, как правило, направлены на стимуляцию и восстановление суставного хряща [6, 7].
На сегодняшний день одним из наиболее распространенных эффективных и не затратных методов является метод микрофрактурирования в различных модификациях. Однако образующийся в зоне субхон-дального дефекта регенерат у пациентов старше 35 лет часто подвергается лизису [8, 9].
Использование мозаичной хондропластики способствует успешному долговременному замещению поврежденного участка костно-хрящевыми столбчатыми аллотрансплантатами, забранными из ненагру-жаемых зон суставной поверхности [10, 11], но может вызывать болезненность и дегенеративные изменения в этих участках, либо требуется их восполнение другими имплантационными материалами, что влечет дополнительные затраты и увеличивает время операции.
В последние коды успешно внедряются клеточные технологии c внедрением в область хрящевого дефекта аутологичных хондроцитов (АCI) и сочетанием применения аутологичных хондроцитов и коллагеновых матриц (MACI) [12]. Недостатком методов является их трудоемкость и высокая стоимость.
Альтернативой вышеперечисленных методов лечения остеоартроза являются матрикс-индуцированные технологии (аутологичный хондрогенез, индуцированный коллагеновой мембраной AMIC), когда собственные клетки костного мозга и малодифференцированные периваскулярные клетки, проникающие в область дефекта в результате предварительного микрофрак-туринга, заселяют имплантируемые биосовместимые биодеградируемые матрицы. Cовременные публикации посвящены преимущественно результатам замещения хрящевых дефектов коллагеновыми матрицами. Однако матрицы из природного коллагена достаточно дорогостоящи, а их применение не всегда результативно в отдаленных периодах наблюдения [13, 14, 15].
В последние годы появились публикации об успешном применении синтетических полимерных биодеградируемых имплантационных материалов, которые гораздо дешевле и не вызывают иммунных реакций [16-21].
Однако требуется проведение комплексных экспериментальных исследований с долгосрочным периодом наблюдения для объективного обоснования применения подобного рода материалов и технологий в клинической практике.
Цель – оценить эффективность применения эластичного биоактивного биодеградируемого имплантата из поликапролактона, импрегнированного частицами гидроксиапатита, для заживления остеохондрального дефекта мыщелка бедренной кости у крыс.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование выполнено на 76 крысах линии «Ви-стар», возраст которых в начале эксперимента соответствовал 7 месяцам.
Все животные были распределены в 2 группы. Животным моделировали остеохондральный дефект суставной поверхности. В опытной группе дефект замещали биодеградируемой мембраной из поликапролактона с добавлением гидроксиапатита.
Оперативные вмешательства осуществлялись в стерильных условиях операционной под общим обезболиванием (Рометар 2 % – 1-2 мг/кг, Биовета, Чехия; Золе-тил 100 – 10-15 мг/кг, «Virbac Sante Animale», Франция).
Осуществляли хирургический доступ к коленному суставу, с помощью фрезы диаметром 2 мм моделировали остеохондральный дефект медиального мыщелка бедренной кости шириной 1,5-2 мм, глубиной 2 мм. У животных опытной группы полость дефекта заполняли биодеградируемым эластичным имплантатом из поликапролактона с содержанием гидроксиапатита. Экспериментальная модель выбрана в соответствии с принципами тестирования имплантационных материалов на лабораторных животных [22, 23].
Клинические методы
В течение эксперимента за всеми животными осуществляли клиническое наблюдение.
Оценивали их общее состояние и физическую активность. При помощи электронных весов измеряли массу тела, общую температуру и локальную температуру в области оперативного вмешательства и в аналогичной зоне контралатеральной конечности измеряли дистанционным медицинским инфракрасным термометром (ВWell Swis AG, Швейцария). Оценивали внешнее состояние мягких тканей голени в области повреждения и функциональное состояние конечности. Сантиметровой лентой измеряли окружность голени в верхней трети. Углы пассивного разгибания и сгибания конечности измеряли стандартным угломером.
Заживление дефекта изучали при помощи микро-анатомических и гистологических методов. Для этого животных выводили из опыта передозировкой барбитуратов после предварительной премедикации общепринятыми фармакологическими препаратами через 14, 60, 180 и 360 суток эксперимента.
Исследование проводилось с соблюдением принципов Европейской Конвенции по защите позвоночных животных, Директивы 2010/63/EU Европейского парламента и Совета Европейского союза по охране животных, одобрено этическим комитетом учреждения.
Анатомические методы
После эвтаназии животных вычленяли бедро оперированной конечности и препарировали от мягких тканей бедренную кость. В области метафиза фрезой отпиливали ее дистальный суставной конец. Оценивали особенности области дефекта суставной поверхности и суставную по- верхность в целом, обращая внимание на восстановление конгруэнтности. Использовали стандарты макроскопической оценки Международного общества восстановления хряща (ICRS) [23]. Макроскопическая оценка остеохон-дрального восстановления ICRS широко используется в качестве индикатора для оценки восстановления костно-хрящевого дефекта in vivо [24, 25, 26]. Два хирурга-ортопеда и исследователь-гистолог провели «слепую» оценку эффекта восстановления дефекта. Осуществляли фотодокументирование анатомических препаратов при помощи цифровой фотокамеры.
Биомеханические методы
Для анализа биомеханических характеристик суставной поверхности регенерата, формирующегося в области остеохондрального дефекта, на свежих нефиксированных анатомических препаратах определяли ее податливость (П) (замер величины приложенного усилия в результате принудительного внедрения индентора в исследуемую ткань). Для этого использовали стрелочный индикатор с пределами измерения от 0 до 10 мм и ценой деления 0,01 мм (ГОСТ 577-68) со сферической формой индентора. Величину кривизны хрящевой поверхности определяли радиусомером в интервале радиуса 0,5-10 мм. Измерения выполняли следующим образом: радиусoмером измеряли кривизну хрящевой поверхности, устанавливая измерительное устройство на шаблон, соответствующий радиусу кривизны хрящевой поверхности (установившееся показание индикатора – Мо), аналогично производили измерение величины внедрения индентора в хрящ (М – по показанию стрелки индикатора). Время соприкосновения индентора с хрящом – 3-5 секунд. Каждое из измерений повторяли 3 раза. Для расчета брали средние величины. По формуле P = 10,5 М + 70 (где P – усилие пружинного механизма, измеряемое в грамм-силы (гс)) определяли величину усилия Р, с которым подвижная ножка устройства внедрялась в хрящ.
Определив величину внедрения индентора (d) (в со-отвестствии с показаниями цифрового индикатора, где d = Мo-М), рассчитывали податливость (П): П = d/P в мм/гс, учитывая, что 1 м/Н = 0,102 мм/гс.
Гистологические методы
Отпрепарированные от мягких тканей фрагменты дистального суставного конца бедренной кости фиксировали в 10 % растворе нейтрального формалина в те- чение 3-5 суток. Деминерализацию образцов осуществляли в декальцинирующем растворе на основе ЭДТА при постоянном встряхивании и смене растворов каждые сутки в течение 7-10 суток. Для дегидратации костно-хрящевых фрагментов использовали спирты восходящей крепости (от 70 до 100°). Далее образцы пропитывали и заливали в парафин.
Гистологические срезы толщиной 5-7 мкм готовили при помощи санного микротома (Rieahard, Германия), размещали на предметных стеклах и высушивали. Депарафинизированные препараты окрашивали гематоксилином и эозином, а также альциановым синим – сафранином-О. Осуществляли постановку иммуногистохимической реакции к антителам CD34 с докрашиванием гематоксилином и эозином (протокол и антитела фирмы Abcam, Великобритания).
Светомикроскопическое исследование и оцифровку гистологических препаратов осуществляли при помощи микроскопа «AxioLab.A1» и цифровой камеры «AxioCam (Carl Zeiss MicroImaging GmbH, Германия). В программе «ВидеоТесТ Мастер-Морфология 4.0» (ООО «НПК “Зенит”», Россия) измеряли площади тканевых компонентов в регенерате, образующемся в зоне дефекта, и вычисляли их долевую составляющую в общей площади регенерата в различные периоды эксперимента. Проводили измерение толщины костных трабекул субхондральной кости. На оцифрованных изображениях гистологических препаратов животных опытной серии и интактных животных измеряли толщину хрящевой ткани в зоне дефекта через 180 и 360 суток. Проводили полуколичественную гистологическую оценку слепым методом по системе, предложенной О'Дрисколлом [27] и адаптированной для оценки восстановления тканей при заживлении субхондральных дефектов [28, 29].
Статистические методы
Статистический анализ выполняли в программе Attestat версия 9.3.1 (разработчик И.П. Гайдышев, сертификат о регистрации в Роспатенте № 2002611109). Значения показателей представляли в виде медиан (Me) и квартилей (Q1-Q3). Значимость различий определяли критерием Манна – Уитни. При р < 0,05 различия считались статистически значимыми.
Наблюдения осуществляли через 14, 28, 60 и 90, 180 и 360 суток после операции.
РЕЗУЛЬТАТЫ
Результаты клинических наблюдений и физикальной оценки
Через 2 недели крысы активно пользовались прооперированной конечностью. Поведение, прием пищи и физическая активность у всех экспериментальных животных не отличалась от здоровых не прооперированных животных. Визуально определяемая отечность тканей сохранялась в течение 7 суток.
Измерения окружности верхней трети голени показало, что на всех этапах эксперимента в прооперированных конечностях животных контрольной группы объем мягких тканей был незначительно меньше, чем в опытной (рис. 1).
В течение всего экспериментального наблюдения потери веса и критических изменений общей температуры тела у животных обеих групп не наблюдалось (табл. 1).
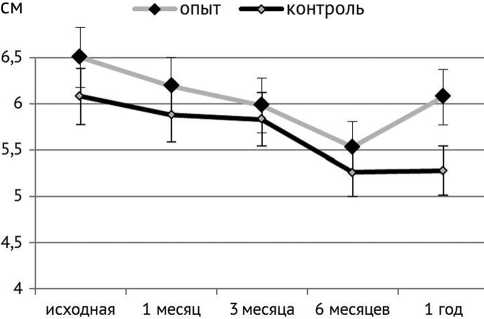
Рис. 1. Диаграмма динамики изменений мягких тканей голени
Таблица 1
Динамика физиологических показателей животных (вес, локальная и общая температура тела) на этапах эксперимента
|
Период эксперимента |
Серия |
Параметры |
||
|
Вес (гр.) |
Температура тела (°С) |
Локальная температура (°С) |
||
|
Норма |
– |
397,0 (342-406) |
34,6 (34,5-35,1) |
31,1 (30,1-31,8) |
|
14 дней |
контроль |
402,3 (331-409) |
36,9 (36,4-36,9)* |
33,7 (31,0-33,5) * |
|
эксперимент |
403,8 (344-409) |
37 (36,7-36,9) * |
33,8 (32,4-33,8) * |
|
|
30 дней |
контроль |
408 (328-410) |
36,2 (36,1-36,4) * |
32,2 (31,2-32,2) |
|
эксперимент |
408 (344-416) |
36,4 (35,8-36,5) * |
31,2 (30-31,4) |
|
|
60 дней |
контроль |
408,4 (343-412) |
35,1 (34,7-35,4) |
28,8 (28,5-28,9) * |
|
эксперимент |
409,0 (348-419) |
35,6 (34,7-35,5) |
31,1 (30,4-31,5) |
|
|
90 дней |
контроль |
410,0 (338-410) |
34,9 (33,5-35,05) |
30,2 (28,85-31,2)* |
|
эксперимент |
410,0 (350-434) |
35,03 (34,4-35,1) |
31,3 (30,8-31,3) |
|
|
180 дней |
контроль |
393(391-395) |
35,1 (34,9-35,3) |
30,8 (29,8-31,8) |
|
эксперимент |
413 (411-415) |
34,9 (34,7-35,1) |
30,7 (30,1-31,8) |
|
|
360 дней |
контроль |
401 (398-404) |
35,6 (35,5-35,7)* |
30,4(29,7-31)* |
|
эксперимент |
418 (410-426) ) |
35,1 (34,9-35,3) |
30,9(30,4-31,4) |
|
* – р < 0,05
Исключение составило незначительное повышение общей температуры в первые две недели после операции у всех прооперированных животных и ее незначительное, но достоверное понижение относительно нормы у крыс контрольной группы. Показатели локальной температуры в области повреждения сустава наблюдались в течение месяца после операции в обеих группах на 2,3-2,4 °C выше, а в контрольной группе и через 1 год наблюдений (табл. 1).
На всех этапах эксперимента показатели функции разгибания конечности в коленном суставе у опытных и контрольных животных достоверно не отличалась друг от друга и от интактных крыс (рис. 2). Исключение составил период через год наблюдений, когда значения углов разгибания в обеих группах были снижены относительно предыдущих сроков эксперимента: на 8,1 % – в опыте, на 16,5 % – в контроле. При этом в опытной группе значения не имели достоверных отличий от интактных животных и были выше, чем в контрольной группе на 11 %. В контрольной группе в данный период показатели были ниже, чем в интактной группе на 19 %.
Показатели функции сгибания конечности в коленном суставе крыс в обеих сериях во все периоды эксперимента не отличались от таковых у интактных животных. Однако их незначительное снижение было отмечено через 30 суток эксперимента в обеих сериях
(в опыте – на 3 %, в контроле – на 1,5 %) и через год в контрольной группе (на 1,5 %). При этом в периоды с 90 суток до 360 суток показатели опытной группы превышали таковые в контроле на 2-2,9 %.
Таким образом, несмотря на то, что существенных различий по сравнению с интактными животными не выявлено, тем не менее, амплитуда движений в коленном суставе крыс опытной группы была более полной, чем в контрольной.
Результаты анатомических и гистологических исследований
Исследование анатомических препаратов дистального суставного конца бедренной кости показало, что у животных опытной серии, благодаря имплантированному материалу, заполняющему объем дефекта, уже через 14 суток наблюдалась ровная блестящая суставная поверхность с сохранением анатомического рельефа прооперированного мыщелка. Область дефекта была покрыта слоем прозрачного тканевого детрита, под которым визуализировался имплантационный материал, замещающий созданный дефект (рис. 3, и). Признаков отторжения имплантата, воспалительной реакции окружающих его тканей и полостей вокруг него не наблюдалось. На 60 сутки слой тканевого детрита на поверхности имплантата был более выражен, сохранялась конгруэнтность поверхности (рис. 3, к).
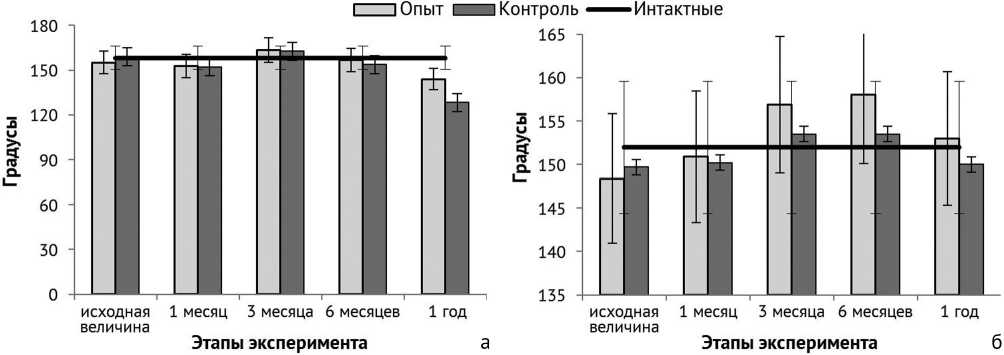
Рис. 2. Динамика углов разгибания (а) и сгибания (б) коленного сустава на этапах эксперимента
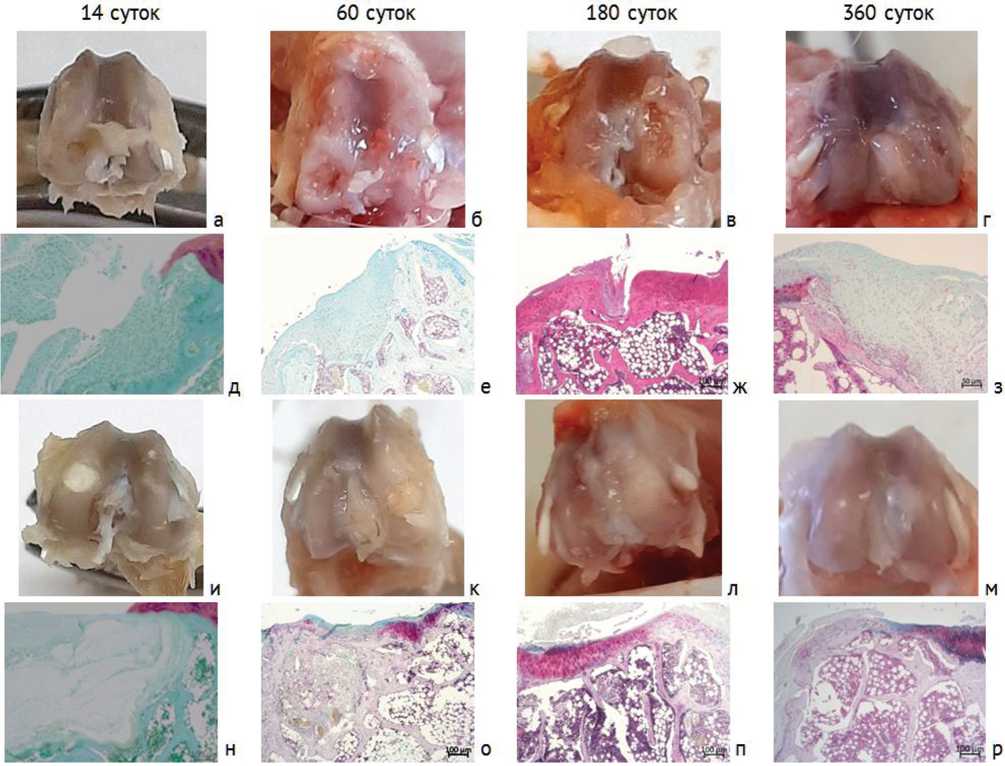
Рис. 3. Анатомические и гистотопографические макро- и микрофото остеохондрального дефекта в различные периоды эксперимента: а-г – анатомические препараты дистального суставного конца бедреной кости (контроль); д-з – гистотопографические срезы области остеохондрального дефекта мыщелка бедренной кости (контроль); и-м – анатомические препараты дистального суставного конца бедреной кости (опыт); н-р – гистотопографические срезы области остеохондрального дефекта мыщелка бедренной кости (опыт); ж – окраска гематоксилином и эозином; д, з, л, н-р – окраска альциановым синим-сафранином. Увеличение (д-з, н-р) – 50×
На всех остальных этапах, включая отдаленные, анатомический рельеф поверхности в области повреждения также сохранялся (рис. 3, л, м). Визуализация имплантата с каждым последующим периодом становилась меньше (рис. 3, к, л, м), Через полгода место операции было полностью замещено биологическими тканями.
Неоперированный мыщелок бедренной кости сохранял анатомическую форму, эрозий и растрескиваний не наблюдалось. Цвет и блеск поверхности был аналогичен норме (рис. 3, м).
В контроле дно дефекта во все периоды было выстлано гладким тканевым слоем, более плотным и менее прозрачным по периметру края дефекта (рис. 3, а-г). Однако объем дефекта не восполнялся даже через 180 суток эксперимента (рис. 3, в).
Через 360 суток дефект неравномерно был заполен соединительнотканным субстратом (рис. 3, г). Конгруэнтность поверхности была нарушена во все периоды эксперимента (рис. 3, а-г). В неоперированном мыщелке, начиная с 60 суток эксперимента, визуализировались участки с наличием эрозий на поверхности хряща (рис. 3, б, в, г).
На всех этапах эксперимента показатели макроскопической оценки по стандартам ICRS в опытной группе были достоверно выше, чем в контрольной (табл. 2).
Максимальные баллы были отмечены в опытной группе через полгода и год эксперимента. В эти периоды восстановление хряща было приближено к нормальному и соответствовало II степени восстановления. Тогда как в контроле результат соответствовал III и IV степени, которые характеризуются как «ненормальное» и «крайне ненормальное» восстановление. Полученные результаты совпадают с результатами описательной морфологии.
Таблица 2
Результаты макроскопической оценки восстановления остеохондральных дефектов в соответствии со стандартами ICRS
Гистологические методы показали, что через 14 суток область дефекта в опытной группе была плотно заполнена имплантационным материалом, вокруг которого определялась грануляционная и рыхлая волокнистая соединительная ткань и микрососуды (рис. 3, н). Тяжи рыхлой волокнистой соединительной ткани, содержащей микрососуды, скопление малодифференцированных фибробластоподобных клеток, клеток моноцитарно-макрофагального ряда и лимфоцитов врастали со стороны окружающей субхондальной кости в пространства между структурами имплантата (рис. 4, б). Среди них встречались клетки в состоянии деления (рис. 4, в) Воспалительных инфильтратов вокруг структур имплантационного материала не наблюдалось. В межтрабекулярных промежутках субхондральной кости, примыкающей к дефекту, определяли преимущественно красный (гемопоэтический) костный мозг. Снаружи на заполняющий дефект имплантационный материал со стороны сохранившегося гиалинового хряща наползали небольшие участки гиалиноподобного хряща, соединяющиеся с бессосудистой волокнистой соединительной тканью с небольшими участками грануляций, покрывающую большую часть поверхности дефекта (рис. 3, н; рис. 4, а).
В контрольной группе дефект был заполнен преимущественно рыхлой волокнистой с очагами грануляционной тканями (рис. 3, д; рис. 4, г, д). В межтрабекулярных промежутках отмечались воспалительные инфильтраты, рыхлая волокнистая соединительная ткань, очаги кроветворения (рис. 4, д).
Через 60 суток эксперимента объем имплантационного материала существенно уменьшался в результате его биодеградации и замещения тканевыми компонентами: в проекции субхондральной кости – ретикуло-фиброзной костной и рыхлой волокнистой соединительной тканями с многочисленными микрососудами, а в проекции хрящевой выстилки со стороны неповрежденного гиалинового хряща – небольшими очагами гиалиноподобной ткани, в срединной части – волокнистой хрящевой тканью (рис. 5, а, б).
Костные трабекулы по периферии области дефекта были более зрелыми и минерализованными
(рис. 5, в). В срединной части – слабоминерализованными (рис. 5, в). Для клеточного состава были характерны клетки эпителиального, фибробластического, остеогенного и моноцитарно-макрофагального дифферонов. Определялись остеокласты (рис. 5, г). Гигантские клетки инородных тел не обнаружены. Микрососуды в области дефекта и прилежащих участков субхондральной кости были полнокровны и расширены. В проекции хряща сосуды не обнаруживались. Разрежения субхондральной кости за областью дефекта не происходило. В межтрабекулярных промежутках визуализировались сосуды и гемопоэти-чески-жировой костный мозг.
В контрольной группе в данный период со стороны субхондральной кости дефект частично закрывался трабекулярной костью (рис. 6, а). В центральной части – был заполнен фиброзной тканью (рис. 6, а, б). Конгруэнтность поверхности не достигалась. Отмечено образование полулунной впадины (рис. 3, б, ж; рис. 6, а). Со стороны хрящевой выстилки наползания гиалиновой хрящевой ткани в область дефекта не обнаружено (рис. 6, б). Сосуды в межтрабекулярных промежутках были расширены. По их периферии определялись лимфоцитарные инфильтраты (рис. 6, в). Отмечено утолщение субхондральной компактной пластинки у краев дефекта (рис. 6, б). Костный мозг в межтрабекулярных пространствах был преимущественно гемопоэтически-жировым.
Через 180 суток в опытной и контрольной сериях в проекции субхондральной кости дефект замещался трабекулярной костью с гемопоэтически-жировым костным мозгом в межтрабекулярных промежутках (рис. 3, ж, п; рис. 7, а, в; рис. 8, а, г). В контроле, ближе к наружной поверхности мыщелка, формировались уплотненные костные конгломераты по типу остеофитов (рис. 3, ж).
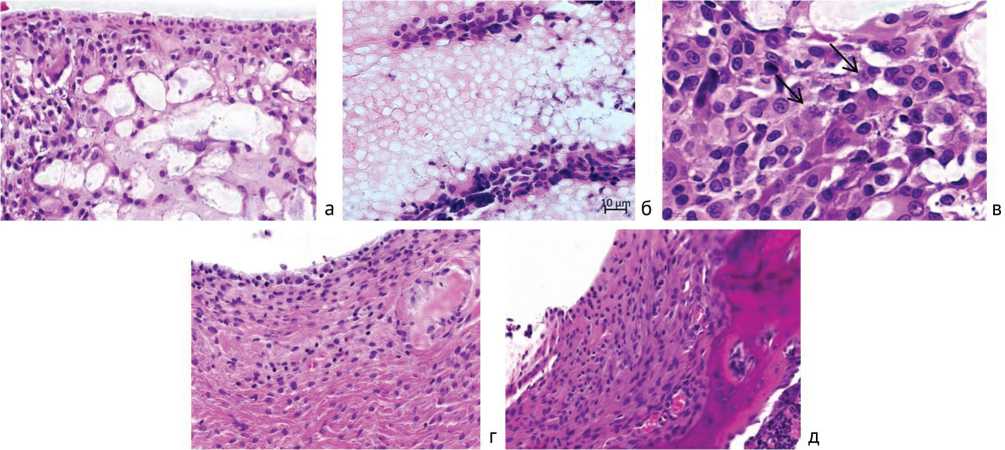
Рис. 4. Особенности регенерата в области остеохондрального дефекта через 14 суток эксперимента: а – суставная поверхность в области дефекта, замещенного имплантатом в опытной серии; б – врастание тяжей рыхлой волокнистой соединительной ткани в сруктуру имплантата (опыт); в – митотически делящиеся клетки в регенерате, формиующемся в области остеохондрального дефекта опытной серии (стрелки); г – суставная поверхность в области дефекта (контроль); д – рыхлая волокнистая соединительная ткань, заполняющая дефект, и трабекулярная субхондральная кость, образующая ложе дефекта (контроль); а-д – окраска гематоксилином и эозином. Увеличение: а, б, г, д – 400×; в – 1000×
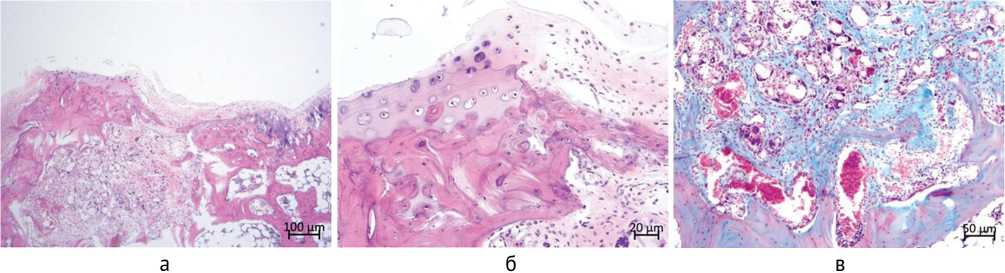
Рис. 5. Особенности регенерата в области остеохондрального дефекта через 60 суток эксперимента. Опытная группа: а – гистотопографическое изображение прооперированного мыщелка бедренной кости; б – незначительное наползание гиалиновой хрящевой ткани на поверхность дефекта. Формирование волокнистой хрящевой ткани в поверхностной зоне дефекта; в – формирование трабекул ретикулофиброзной костной ткани в области имплантации. Визуализация остатков имплантационного материала. Расширенные микрососуды. Отсутствие воспалительных инфильтратов; г – частичная биодеградация имплантационного материала, увеличенное количество клеток макрофагального ряда. Окраска: а, б, г – гематоксилином и эозином; в – сафранином-О и альциановым синим. Увеличение: а – 50×; б, г – 200×; в – 100×
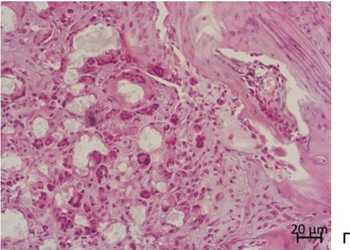
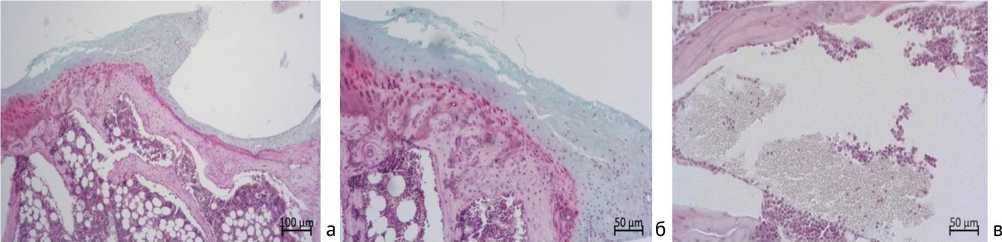
Рис. 6. Особенности регенерата в области остеохондрального дефекта через 60 суток эксперимента. Контрольная группа: а – гисто-топографическое изображение прооперированного мыщелка бедренной кости; б – утолщение компактной пластинки субхондральной кости у краев дефекта. Заполнение дефекта волокнистой соединительной тканью; в – расширенные капилляры синусоидного типа с лимфоцитарным инфильтратом в периваскулярной области. Окраска: а-в – сафранином-О и альциановым синим. Увеличение: а – 50×; б, в – 100×
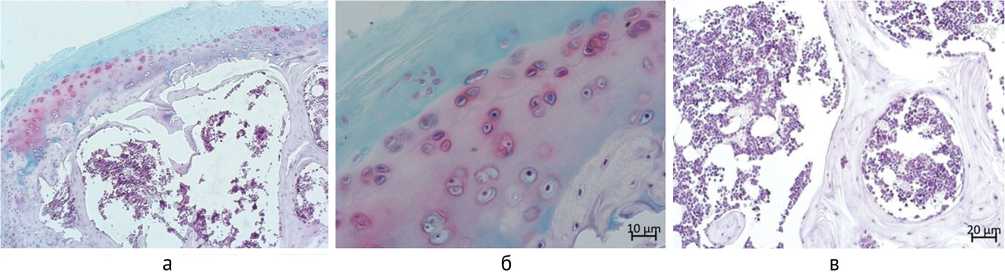
Рис. 7. Особенности регенерата в области остеохондрального дефекта через 180 суток эксперимента, опытная группа: а – формирование хрящевой выстилки на всем протяжении заместившегося остеохондрального дефекта; б – зональное строение новообразованного гиалинового хряща. Разволокнение наружной зоны, появление изогенных групп молодых хондроцитов в срединной зоне, объемная зона кальцифицированного хряща; в – гемопоэтический костный мозг с жировыми клетками в межтрабекулярных промежутках замещенного участка субхондральной кости в области дефекта; г – встроенный в структуру костной трабекулы фрагмент имплантационного материала. Окраска: а-г – сафранином-О и альциановым синим. Увеличение: а – 50×; в – 100×; б, г – 200×
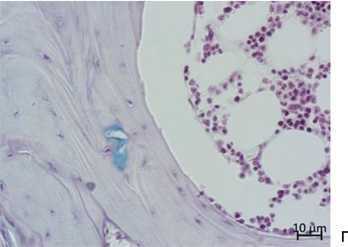
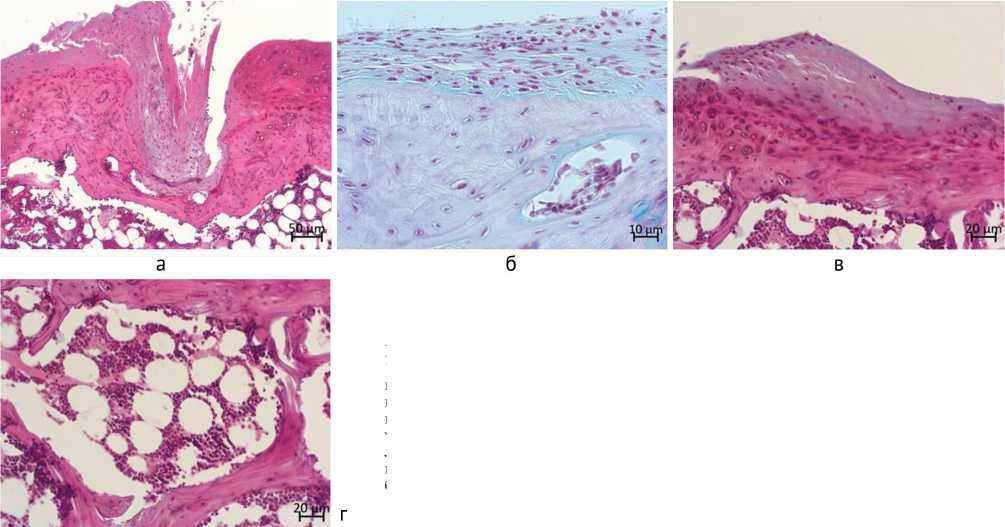
Рис. 8. Особенности регенерата в области остеохондрального дефекта через 180 суток эксперимента. Контрольная группа: а – заполнение участка дефекта волокнистой соединительной тканью. Формирование гиперпластической компактной пластинки субхондральной кости; б – соединительная волокнистая ткань на поверхности замещенного субхондральной костью дефекта; в – формирование участков волокнистой хрящевой ткани на поверхности новообразованной в области дефекта субхондральной кости; г – гемопоэтически-жировой костный мозг в межтрабекулярных промежутках. Окраска: а, в, г – гематоксилином и эозином, б – сафранином-О и альциановым синим. Увеличение: а – 50×; в – 100×, б, г – 200×
В проекции суставного хряща область дефекта в опытной серии замещалась слоем гиалиновой хрящевой ткани (рис. 3, п; рис. 7, а, б), в контроле – слоем волокнистой соединительной ткани (рис. 3, ж; рис. 8, а, б), в отдельном случае – в сочетании с небольшими фрагментами волокнистой соединительной ткани (рис. 8, в). Остатков имплантационного материала в области дефекта у животных опытной серии не обнаружили, что свидетельствует о его полной биодеградации к данному периоду. В одном поле зрения попался участок с небольшим фрагментом имплантационного материала, встроенного в структуру костной трабекулы (рис. 7, г).
При иммуногистохимическом окрашивании на CD 34 новообразованные сосуды были обнаружены в поверхностном соединительнотканном слое у животных контрольной серии (рис. 9, б). В опыте в новообразованной хрящевой ткани, сформированной в зоне дефекта, тест был отрицательным (рис. 9, а).
Через год эксперимента в опытной серии отмечали сохранение целостности хрящевой выстилки. Новообразованный хрящ приобретал зональное строение. В нем определялась поверхностная (более объемная, чем у ин- тактных животных), промежуточная с мелкими изогенными группами и глубокая зоны (рис. 3, р; рис. 10, а).
В контроле поверхностная область дефекта была замещена фиброзной тканью, иногда с небольшими участками волокнистого хряща (рис. 3; рис. 10, б).
Субхондральная кость в опыте практически не отличалась от таковой у интактных животных (рис. 3, р; рис. 10. г, е), в контроле была незначительно разрежена, при утолщенной компактной пластинке в области дефекта (рис. 3; рис. 10, д).
Полуколичественная оценка полноты замещения и восстановления тканей в области остеохондрально-го дефекта показала, что во все периоды эксперимента более полное восстановление было в опытной серии (табл. 3). Через 60 суток медиана опытной серии была выше таковой в контроле в 1,7 раза, через 180 суток – в 3,12 раза, через год эксперимента – в 3,25 раза. Поскольку максимальный показатель при данной системе оценке составляет 28 баллов, то можно говорить, что через 180 суток восполнение дефекта суставной поверхности в опытной серии почти полное, а через год эксперимента – полное. В контроле даже через год восполнение дефекта незначительное.
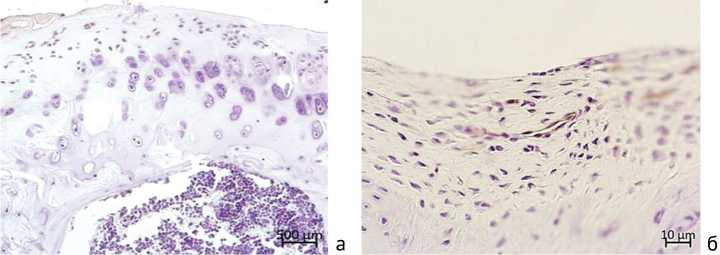
Рис. 9. Иммуногистохимическое окрашивание на выявление сосудов в поверхностной выстилке регенерата остеохондрального дефекта: а – опыт (сосуды не выявлены); б – контроль (выявлены микрососуды – коричневое окрашивание). Окраска – иммуногистохимическая реакция с использованием антител к CD34. Увеличение – 400×
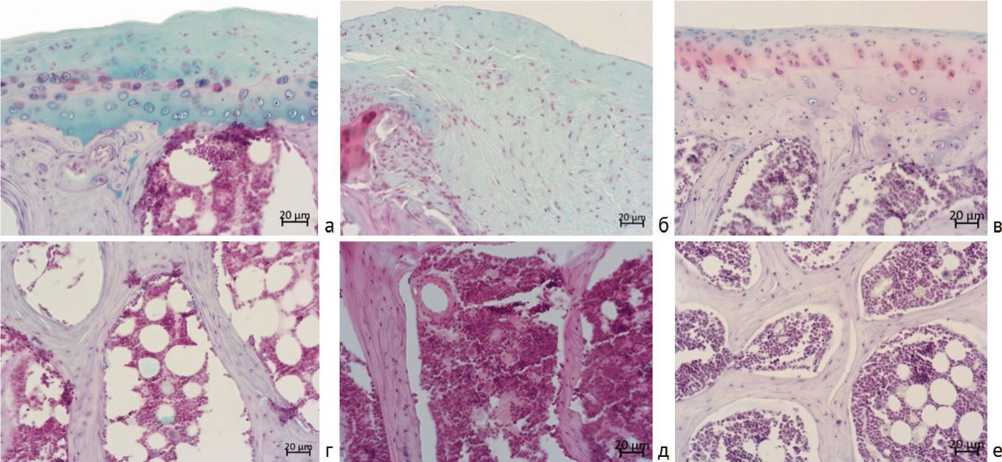
Рис. 10. Особенности регенерата в области остеохондрального дефекта через 360 суток эксперимента: а – непрерывное формирование гиалиновой хрящевой ткани зонального строения в опытной группе; б – заполнение области дефекта волокнистой соединительной тканью в контрольной группе; в – строение суставного хряща у интактных животных аналогичного возраста; г-е – строение субхондральной кости: г – в опытной группе, д – в контрольной группе, е – у интактных животных. Окраска: а-е – сафранином-О и альциа-новым синим. Увеличение: а-е – 200×
Таблица 3
Результаты полуколичественной гистологической оценки полноты замещения остеохондрального дефекта по O'Driscoll (в модификации)
|
Группа |
Количество баллов на этапах эксперимента, Me (Q1-Q3) |
||
|
60 суток |
180 суток |
360 суток |
|
|
Контроль |
4,4 (4,2-4,6) |
7,5 (6,7-8,2) |
8 (7,7-8,3) |
|
Опыт |
7,6 (7,3-8,1) |
23,4 (23,3-23,7) |
26 (25,8-27,3) |
Примечания: максимально возможное количество баллов – 28; p < 0,01 – различия между группами во все периоды достоверны.
Анализ морфометрических данных показал существенные различия долевых составляющих тканевых компонентов регенерата, заполняющего область дефекта в опытной и контрольной группах, практически во все периоды эксперимента (табл. 4). В контрольной серии по определению отсутствовал имплантационный материал, и ни в одном из периодов не было обнаружено формирование гиалиновой хрящевой ткани, их доля в общей структуре регенерата была равна нулю. Однако доли костной ткани и костного мозга в регенератах контрольной и опытной групп не имели достоверных отличий через 2 месяца и через 1 год эксперимента.
Таблица 4
|
Срок эксперимента |
Серии |
Доля тканевых компонентов (%), Ме (Q1-Q3) |
|||||
|
Костный мозг |
Костная ткань |
Волокнистая соединительная ткань |
Волокнистая хрящевая ткань |
Гиалиновая хрящевая ткань |
Имплантационный материал |
||
|
14 сут. |
контроль |
0 2р = 4,26Е-0,5 |
9,9 (8,7-11,1) 1р = 0,035 2р = 0,008 |
90,1 (88,3-91,9) 1р = 5,85Е-07 2р = 0,0006 |
0 1р = 0,011 |
0 2р = 0,011 |
0 1р = 0,00018 3р = 0,000182 |
|
опыт |
0 2р = 4,26Е-0,5 |
6,2 (5,9-6,5) 1р = 0,035 2р = 0,056 |
13,5 (11,2-14,1) 1р = 5,85Е-07 2р = 0,004 |
3,2 (2,6-3,8) 1р = 0,011 2р = 0,004 |
0 2р = 0,011 |
77,1 (75,3-78,9) 1р = 0,00018 2р = 2,5Е-07 |
|
|
2 мес. |
контроль |
24,6 (23,3-27,1) 1р = 0,11 2р = 0,016 3р = 0,019 |
43 (42-47) 1р = 0,78 2р = 0,027 3р = 0,00026 |
28 (24,7-30) 1р = 0,0023 3р = 0,00026 |
0 1р = 0,0014 2р = 0,031 3р = 4,69E-0,6 |
0 1р = 0,0017 2р = 0,011 3р = 4,69E-0,6 |
0 1р = 0,0014 |
|
опыт |
21,7 (21,3-22,2) 1р = 0,11 3р = 00,17 |
44,1 (43,7-45,7) 1р = 0,78 3р = 0,00027 |
21 (43,7-45,7) 1р = 0,0023 3р = 0,003 |
2,8 (2,5-3,3) 1р = 0,0014 3р = 0,43 |
3,5 (3,4-3,7) 1р = 0,0017 3р = 0,0016 |
6,1 (7,1-5,6) 1р = 0,0014 3р = 0,0002 |
|
|
6 мес. |
контроль |
29,2 ( 28,9-33) 1р = 0,08 2р = 0,0033 3р = 0,035 |
57,2 (53,7-62,7) 1р = 0,008 2р = 0,0025 3р = 0,02 |
8,1 (7,4-9,9 ) 1р = 0,013 2р = 0,0084 3р = 0,0016 |
0,68 (0,51-1,74) 1р = 0,013 2р = 0,0084 3р = 0,0015 |
0 1р = 0,08 2р = 0,0015 |
0 1р = 0,42 |
|
опыт |
45,1 (44,5-45,3) 1р = 0,08 2р = 3,18Е-0,5 3р = 4,06Е-07 |
38 (36-45) 1р = 0,008 2р = 0,24 3р = 0,22 |
5,9 (5,7-6,1) 1р = 0,013 2р = 0,000025 3р = 2,98Е-0,5 |
0 1р = 0,013 3р = 0,007 |
9,6 (3,8-13,1) 1р = 0,08 2р = 0,63 3р = 0,043 |
0,46 (0,36-1,38) 1р = 0,42 2р = 0,42 3р = 0,022 |
|
Продолжение таблицы 4
Долевое соотношение тканевых компонентов в регенерате, заполняющем остеохондральный дефект, в различные периоды эксперимента
|
Срок эксперимента |
Серии |
Доля тканевых компонентов (%), Ме (Q1-Q3) |
|||||
|
Костный мозг |
Костная ткань |
Волокнистая соединительная ткань |
Волокнистая хрящевая ткань |
Гиалиновая хрящевая ткань |
Имплантационный материал |
||
|
1 год |
контроль |
39,8 (36-50,7) 1р = 0,16 2р = 0,165 3р = 0,12 |
34 (33-89,1) 1р = 0,31 2р = 0,45 3р = 0,78 |
26,4 (10-40,4) 1р = 0,1 2р = 0,01 3р = 0,19 |
0 3р = 0,013 |
0 1р = 0,02 2р = 0,0015 |
0 |
|
опыт |
52,7 (46,71-54,43) 1р = 0,16 2р = 0,398 3р = 3,18Е-05 |
30,28 (16,58-32,3) 1р = 0,1 2р = 0,21 3р = 0,247 |
0 1р = 0,1 |
0 |
12,86 (9,07-16,65) 1р = 0,02 2р = 0,17 3р = 0,63 |
0 3р = 0,022 |
|
|
Интактные |
54,1 (53,1-54,2) |
36,8 (30,63-37,43) |
0 |
0 |
10,4 (9-12,6) |
0 |
|
Примечание: Me – медиана, Q1-Q3– процентили; 1р – достоверность отличий между экспериментальными группами; 2р – достоверность отличий по сравнению с экспериментальными животными; 3р – достоверность отличий по сравнению с предыдущим периодом эксперимента. Различия значимы при р < 0,05; жирным шрифтом выделены значения, не имеющие достоверных отличий (р < 0,05).
Долевое соотношение тканевых компонентов в регенерате, заполняющем остеохондральный дефект, в различные периоды эксперимента
Содержание соединительной ткани на всех этапах эксперимента в регенератах, заполняющих остеохон-дральные дефекты у животных контрольной группы, была достоверно выше, чем в опытной: через 14 суток на 95 %, через 60 суток – на 25 %, через 180 суток – на 27,2 %, через 360 суток – на 73,6 %. В обеих группах максимальное содержание волокнистой соединительной ткани в составе регенерата отмечалось к 60 суткам эксперимента. К 180 суткам ее долевая составляющая уменьшалась на 71-72 % в обеих группах, при этом в опытной группе ее доля была совсем небольшой, составляя всего 5,9 %.
Через год эксперимента волокнистая соединительная ткань в составе регенерата опытных животных отсутствовала. В контроле – занимала почти 1/3 регенерата.
Гиалиновая хрящевая ткань в опытной серии обнаруживалась уже через 2 месяца (60 суток) эксперимента. Ее содержание к шести месяцам (180 суток) эксперимента достоверно увеличивалось на 36,5 %, а к году (360 суток) – еще на 25,3 %. Анализируемые показатели в данные периоды достоверно соответствовали показателям у интактных крыс.
Через 360 суток эксперимента в регенератах животных опытной группы содержались только костная ткань, костный мозг и гиалиновая хрящевая ткань. Их долевая составляющая была аналогична таковой у интактных животных (норма).
В контрольной группе в этот период содержание костной ткани и костного мозга не имело достоверных отличий от опытной и интактной групп. При этом доля волокнистой соединительной ткани составляла около 30 %, а гиалиновая ткань отсутствовала.
Содержание имплантационного материала в опытной группе с увеличением периода эксперимента достоверно снижалось. С 14 по 60 сутки его содержание уменьшилось на 92 %. К 180 суткам эксперимента имплантационный материал в структуре регенерата в зоне остеохондрального дефекта отсутствовал, т.е. к данному периоду происходила его полная деградация.
Толщина хрящевой выстилки в области остеохон-дрального дефекта через 180 суток была достоверно выше таковой в норме (рис. 11). Через год толщина суставного хряща была сопоставима с величиной у интактных животных аналогичного возраста.
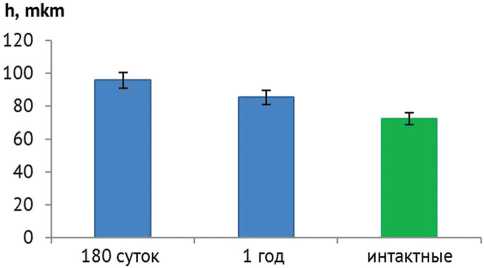
Рис. 11. Толщина суставного хряща в опытной серии через полгода и через год эксперимента
Морфометрия толщины трабекул субхондральной кости показала, что в опытной серии они были толще, чем в контроле. Их толщина через год не отличалась от таковой у интактных крыс (рис. 12).
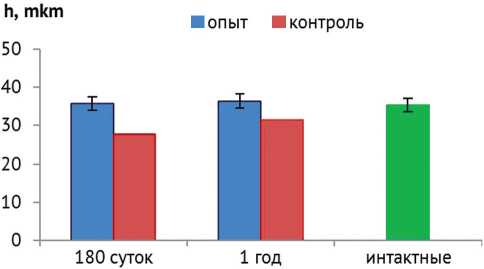
Рис. 12. Толщина трабекул субхондральной кости в области остеохондрального дефекта дефекта через через полгода и через год эксперимента
Биомеханические исследования
Биомеханическими методами установлено, что к 60 суткам эксперимента значения податливости регенерата в области остеохондрального дефекта к контрольной группе были снижены на 29,2 %, в опыте – на 18,5 %, но не имели достоверной разницы по сравнению с аналогичными показателями у интактных животных (табл. 5). Показатели опытной группы превышали таковые в контрольной на 15 %. Через 180 суток эксперимента биомеханические свойства возрастали в обеих сериях: в контроле – несущественно, всего на 3 %, в опыте – на 11,9 %. В опытной серии показатели достоверно не отличались от таковых у интактных животных, в контроле оставались на 26,2 % ниже.
Через 360 суток в опытной серии показатели податливости регенерата, сформированного в области осте-охондрального дефекта, практически не отличались от предыдущего периода. В опыте они несущественно увеличились (на 2 %), а в контроле уменьшились на 1 %. Как и в предыдущий период наблюдения, у животных опытной группы не определялись достоверные различия показателей податливости суставной поверхности от таковых у интактных животных. В контроле они были достоверно ниже (на 27,2 %).
Таблица 5
Показатели биомеханической податливости суставной поверхности регенерата в области остеохондрального дефекта на этапах эксперимента
|
Срок эксперимента (сут.) |
П – податливость, 10 мм3/г*с |
|
|
контроль |
опыт |
|
|
60 суток |
1,956 (1,597-1,982)* |
2,250 (2,167-2,628) # |
|
180 суток |
2,009 (1,580-2,250)* |
2,553 (1,607-2,727) |
|
360 суток |
1,997 (1,898-2,210)* |
2,599 (2,408-2,691)# |
|
Интактные |
2,762 (2,221-2,978) |
|
* – р < 0,05 – различия достоверны по сравнению с интактными животными; # – р < 0,05 – различия достоверны по сравнению с контролем.
ОБСУЖДЕНИЕ
Решением проблемы лечения невосполнимых осте-охондральных дефектов ученые занимаются достаточно продолжительный период времени. Было предложено множество вариантов, в том числе с использованием биоинженерных технологий [30].
Однако до настоящего времени не разработано совершенного метода восстановления тканей в области остеохондрального дефекта с сохранением результата в продолжительном периоде [18].
В связи с этим продолжается поиск способов успешного лечения невосполнимых дефектов суставной поверхности для предотвращения или отсрочки эндопротезирования.
Наибольшее предпочтение оперирующие хирурги отдают менее затратным и одношаговым методикам [17].
Ранее установлено, что наиболее эффективная регенерация гиалиноподобного хряща возможна только при применении коллагеновых матриц, заселенных аутологичными хрящевыми клетками в сочетании с ми-крофрактурингом [31].
Есть данные о положительном применении бесклеточных коллагеновых каркасов [32, 33].
В некоторых исследованиях показано, что коллагеновые матрицы не способствовали восстановлению конгруэнтности поверхности [34].
Альтернативу коллагеновым матрицам в последнее время составляют полимерные имплантаты. Поликапролактон – один из наиболее часто применяемых в тканевой инженерии для восстановления потери костной и хрящевой тканей полимеров [26, 35, 36].
Одним из его недостатков считается невысокая адгезионная способность [37]. Этот недостаток многие авторы компенсируют добавлением в его состав или нанесением на поверхность поликапролактоновых изделий частиц гидроксиапатита. Этот биоматериал обладает индукционными свойствами, может усиливать пролиферацию и влиять на дифференцировку клеток [38, 39].
Известно, что нанокомпозит гидроксиапатита обладает большей биосовместимостью и лучшими адгезионными свойствами поверхности по сравнению с микрокомпозитом [40, 41].
Способ получения эластичного имплантата путем электроспининга способствует созданию объемного волокнистого каркаса с диаметром волокон и межво- локнистыми промежутками, оптимальными для миграции клеток и сосудов [42].
Выявлено, что посттравматические изменения в суставах и развитие остеоартроза связано с температурой кожного покрова в области сустава. При этом выраженность болевого синдрома не коррелирует с болевыми ощущениями пациента [43].
В нашем исследовании повышение температуры кожного покрова в области коленного сустава наблюдалось в раннем послеоперационном периоде, сохраняясь до 2 недель эксперимента, что может быть связано с посттравматическим состоянием тканей после оперативного вмешательства [44].
В контрольной серии достоверное повышение температуры было отмечено через 1 год наблюдений, что в других работах объясняется усугублением развития артрозных изменений [44, 45, 46] и подтверждено результатами анатомических и гистологических исследований настоящего исследования.
Незначительное повышение температуры кожи у животных опытной серии по сравнению с контролем мы связываем с улучшением микроциркуляции в восстановленных тканях в области повреждения [47, 48].
В течение всего эксперимента объем мягких тканей у животных опытной серии был выше, чем у животных контрольной серии. В некоторых исследованиях у пациентов с гонартрозом методом МРТ выявлено уменьшение окружности конечности, связанное с уменьшением диаметра мышц и замещением мышечной ткани жировой [49].
Амплитуда движений у животных в серии с замещением остеохондрального дефекта матрицей из поликапролактона с гидроксиапатитом на всех этапах эксперимента, особенно в отдаленные периоды (через полгода и год наблюдений), была значительно лучше, чем у животных контрольной серии. Мы связываем это с восполненностью дефекта имплантатом и эффективным его заживлением у животных опытной серии и одновременным прогрессированием признаков остеоартроза у животных контрольной серии. Многие авторы объясняют снижение амплитуды движений в коленном суставе с наличием боли и дискомфорта при ходьбе и нагрузке на сустав [50, 51, 52].
Выявленное анатомическими и гистологическими методами восстановление анатомической целостности и полной органотипичности новообразованного реге- нерата в области остеохондрального дефекта животных опытной серии уже через 180 суток эксперимента, по нашему мнению, связано с особенностью строения имплантата, его хорошей адгезионной способностью, достаточной пористостью и упругостью. Начиная с момента операции, эластичный имплантат заполнял область остеохондрального дефекта, обеспечивал целостность и конгруэнтность суставной поверхности, выдерживал функциональную нагрузку. Эти показатели принято считать важными при заживлении остео-хондральных дефектов [53, 54].
Наличие ранней функциональной нагрузки способствовало прорастанию микрососудов в микропоры между волокнами имплантата. Периваскулярные клетки и клетки костного мозга прикреплялись к структурированной поверхности нитей имплантата, благодаря нанесенным на них наночастицам гидроксиапатита. Гидроксиапатит выполнял роль индуктора остеогенеза и способствовал дифференцировке клеток по остеогенному пути [55].
Поскольку сосуды врастали в имплантат со стороны сохранной субхондральной кости, то формирование костной ткани происходило в проекции окружающей дефект губчатой кости, необходимой в качестве основания и питающего фактора для формирования хрящевой ткани на поверхности. В поверхностных слоях имплантата сосуды отсутствовали. В таких условиях проникающие на поверхность недифференцированные клетки костного мозга в проекции окружающего дефект суставного хряща дифференцировались по хондрогенному пути. Дифференцировка клеток в хондробласты и хондроциты продолжалась на протяжении эксперимента при достаточном питании со стороны синовии, производившей достаточный объем синовиальной жидкости, т.к. животные активно пользовались конечностью.
Данные механизмы способствовали полному замещению биодеградируемого имплантата тканевыми структурами типического строения к 180 суткам эксперимента. К этому периоду в проекции субхондральной кости формировалась губчатая кость с хрящевой гиалиноподобной выстилкой на поверхности дефекта.
Выявлено, что с увеличением степени остеоартроза, согласно классификации Международного общества восстановления хряща (ICRS), снижается жесткость хряща, на которую, в первую очередь, влияет целостность внеклеточного матрикса. Следовательно, методы определения жесткости, такие как вдавливание, могут использоваться для характеристики хряща на всех стадиях ОА [56].
Исследование жесткости у пациентов после лечения остеохондральных дефектов методом имплантации в область повреждения хрящевой поверхности аутологичных хондроцитов (ACI) показали восстановление жесткости новообразованного тканевого регенерата через 2 года после имплантации и дальнейшее увеличение этого показателя в течение 5 лет [57].
В нашем исследовании восстановление биомеханической податливости (аналог жесткости) в опытной группе достигал показателей интактных животных уже через 60 суток эксперимента и сохранялся в течение года наблюдений, в контроле оставался ниже на 27-29 % в течение всего периода наблюдения.
В данной работе мы применили стратегию, основанную на том, что эластичный имплантат из поликапролактона с гидроксиапатитом имитировал внеклеточный матрикс, который способствовал кондукции, адгезии, пролиферации и дифференцировке клеток в области осеохондрального дефекта в заданном направлении, используя саморегенеративный потенциал клеток и их взаимодействие с биомолекулами [58].
ЗАКЛЮЧЕНИЕ
Биодеградируемый эластичный имплантат, изготовленный методом электропрядения из поликапролактона и импрегнированный гидроксиапатитом, потенциально может быть использован для лечения костно-хрящевых дефектов. В экспериментальных исследованиях данный тип имплантата обеспечивал замещение и восстановление тканей в области костно-хрящевого дефекта, демонстрируя регенерацию как суставного хряща, так и субхондральной костной ткани.
Список литературы Применение биоактивного биодеградируемого имплантата из поликапролактона для лечения остеохондральных дефектов: экспериментальное исследование
- Айрапетов Г.А., Воротников А.А., Коновалов Е.А. Методы хирургического лечения локальных дефектов гиалинового хряща крупных суставов (обзор литературы). Гений ортопедии. 2017;23(4):485-491. doi: 10.18019/1028-4427- 2017-23-4-485-49
- Pearsall IV A, Madanagopal S, Tucker J. The Evaluation of Refrigerated and Frozen Osteochondral Allografts in the Knee. Surgical Science. Vol. 2011;2(5):232-241. doi: 10.4236/ss.2011.25052
- Брянская А.И., Тихилов Р.М., Куляба Т.А., Корнилов Н.Н. Хирургические методы лечения пациентов с локальными дефектами суставной поверхности мыщелков бедренной кости (обзор литературы). Травматология и ортопедия России. 2010;16(4):84-92. doi: 10.21823/23112905-2010-0-4-84-92
- Советников Н.Н., Кальсин В.А., Коноплянников М.А., Муханов В.В. Клеточные технологии и тканевая инженерия в лечении дефектов суставной поверхности. Клиническая практика. 2013;(1):52-66.
- Божокин М.С., Божкова С.А., Нетылько Г.И. Возможности современных клеточных технологий для восстановления поврежденого суставного хряща (аналитический обзор литературы). Травматология и ортопедия России. 2016;22(3):122-134. doi: 10.21823/2311-2905-2016-223-122-134
- Hafezi-Nejad N, Zikria B, Eng J, et al. Predictive value of semi-quantitative MRI-based scoring systems for future knee replacement: data from the osteoarthritis initiative. Skeletal Radiol. 2015;44(11):1655-1662. doi: 10.1007/s00256-015-2217-2
- Куляба Т.А., Банцер С.А., Трачук П.А. и др. Эффективность различных хирургических методик при лечении локальных повреждений хряща коленного сустава (обзор литературы). Травматология и ортопедия России. 2020;26(3):170-181. doi: 10.21823/2311-2905-2020-26-3-170-181
- Richter DL, Schenck RC Jr, Wascher DC, Treme G. Knee Articular Cartilage Repair and Restoration Techniques: A Review of the Literature. Sports Health. 2016;8(2):153-160. doi: 10.1177/1941738115611350
- Котельников Г.П., Волова Л.Т., Ларцев Ю.В. и др. Новый способ пластики дефектов суставного гиалинового хряща комбинированным клеточно-тканевым трансплантатом. Травматология и ортопедия России. 2010;16(1):150-155. doi: 10.21823/2311-2905-2010-0-1-150-155 10.
- Matsusue Y, Kotake T, Nakagawa Y, Nakamura T. Arthroscopic osteochondral autograft transplantation for chondral lesion of the tibial plateau of the knee. Arthroscopy. 2001;17(6):653-659. doi: 10.1053/jars.2001.22400
- Куляба Т.А., Корнилов Н.Н., Селин А.В., Печинский А.И. Отдаленные результаты мозаичной костно-хрящевой аутопластики при лечении заболеваний и повреждение коленного сустава. Травматология и ортопедия России. 2007;(3):24.
- Filardo G, Kon E, Roffi A, et al. Scaffold-based repair for cartilage healing: a systematic review and technical note. Arthroscopy. 2013;29(1):174-186. doi: 10.1016/j.arthro.2012.05.891
- Schrock JB, Kraeutler MJ, Houck DA, et al. A Cost-Effectiveness Analysis of Surgical Treatment Modalities for Chondral Lesions of the Knee: Microfracture, Osteochondral Autograft Transplantation, and Autologous Chondrocyte Implantation. Orthop J Sports Med. 2017;5(5):2325967117704634. doi: 10.1177/2325967117704634
- Christensen BB, Foldager CB, Jensen J, et al. Poor osteochondral repair by a biomimetic collagen scaffold: 1- to 3-year clinical and radiological follow-up. Knee Surg Sports Traumatol Arthrosc. 2016;24(7):2380-7. doi: 10.1007/s00167-015-3538-3
- Nair LS, Laurencin CT. Biodegradable polymers as biomaterials. Prog Polym Sci. 2007;32(8-9):762-798. doi: 10.1016/j.progpolymsci.2007.05.017
- Козадаев М.Н. Применение матриц на основе поликапролактона для стимуляции регенерации суставного хряща в условиях эксперимента. Теоретические и прикладные аспекты современной науки. 2014;(3-2):128-130.
- Filardo G, Kon E, Roffi A, et al. Scaffold-based repair for cartilage healing: a systematic review and technical note. Arthroscopy. 2013;29(1):174-86. doi: 10.1016-1.arthro.2012.05.891
- Mohan N, Nair PD. A synthetic scaffold favoring chondrogenic phenotype over a natural scaffold. Tissue Eng Part A. 2010;16(2):373-84. doi: 10.1089/ten.TEA.2009.0314
- Levingstone TJ, Ramesh A, Brady RT, et al. Cell-free multi-layered collagen-based scaffolds demonstrate layer specific regeneration of functional osteochondral tissue in caprine joints. Biomaterials. 2016;87:69-81. doi: 10.1016/j.biomaterials.2016.02.006
- Nirmal RS, Nair PD. Significance of soluble growth factors in the chondrogenic response of human umbilical cord matrix stem cells in a porous three dimensional scaffold. Eur Cell Mater. 2013;26:234-251. doi: 10.22203/ecm.v026a17
- Hernigou J, Vertongen P, Chahidi E, et al. Effects of press-fit biphasic (collagen and HA/ßTCP) scaffold with cell-based therapy on cartilage and subchondral bone repair knee defect in rabbits. Int Orthop. 2018;42(7):1755-1767. doi: 10.1007/s00264-018-3999-3
- Meng X, Ziadlou R, Grad S, et al. Animal Models of Osteochondral Defect for Testing Biomaterials. Biochem Res Int. 2020;2020:9659412. doi: 10.1155/2020/9659412
- van den Borne MP, Raijmakers NJ, Vanlauwe J, et al. International Cartilage Repair Society (ICRS) and Oswestry macroscopic cartilage evaluation scores validated for use in Autologous Chondrocyte Implantation (ACI) and microfracture. Osteoarthritis Cartilage. 2007;15(12):1397-1402. doi: 10.1016/j.joca.2007.05.005
- Guo X, Park H, Young S, et al. Repair of osteochondral defects with biodegradable hydrogel composites encapsulating marrow mesenchymal stem cells in a rabbit model. Acta Biomater. 2010;6(1):39-47. doi: 10.1016/j.actbio.2009.07.041
- Caminal M, Moll X, Codina D, et al. Transitory improvement of articular cartilage characteristics after implantation of polylactide:polyglycolic acid (PLGA) scaffolds seeded with autologous mesenchymal stromal cells in a sheep model of critical-sized chondral defect. Biotechnol Lett. 2014;36(10):2143-2153. doi: 10.1007/s10529-014-1585-3
- Zheng P, Hu X, Lou Y, Tang K. A Rabbit Model of Osteochondral Regeneration Using Three-Dimensional Printed Polycaprolactone-Hydroxyapatite Scaffolds Coated with Umbilical Cord Blood Mesenchymal Stem Cells and Chondrocytes. Med Sci Monit. 2019;25:7361-7369. doi: 10.12659/MSM.915441
- O'Driscoll SW, Keeley FW, Salter RB. The chondrogenic potential of free autogenous periosteal grafts for biological resurfacing of major full-thickness defects in joint surfaces under the influence of continuous passive motion. An experimental investigation in the rabbit. J Bone Joint Surg Am. 1986;68(7):1017-1035.
- Moojen DJ, Saris DB, Auw Yang KG, et al. The correlation and reproducibility of histological scoring systems in cartilage repair. Tissue Eng. 2002;8(4):627-634. doi: 10.1089/107632702760240544
- Rutgers M, van Pelt MJ, Dhert WJ, et al. Evaluation of histological scoring systems for tissue-engineered, repaired and osteoarthritic cartilage. Osteoarthritis Cartilage. 2010;18(1):12-23. doi: 10.1016/j.joca.2009.08.009
- McGoldrick NP, Murphy EP, Kearns SR. Osteochondral lesions of the ankle: The current evidence supporting scaffold-based techniques and biological adjuncts. Foot Ankle Surg. 2018;24(2):86-91. doi: 10.1016/j.fas.2017.01.003
- Dorotka R, Windberger U, Macfelda K, et al. Repair of articular cartilage defects treated by microfracture and a three-dimensional collagen matrix. Biomaterials. 2005;26(17):3617-3629. doi: 10.1016/j.biomaterials.2004.09.034
- Schüttler KF, Schenker H, Theisen C, et al. Use of cell-free collagen type I matrix implants for the treatment of small cartilage defects in the knee: clinical and magnetic resonance imaging evaluation. Knee Surg Sports Traumatol Arthrosc. 2014;22(6):1270-1276. doi: 10.1007/s00167-013-2747-x
- Roessler PP, Pfister B, Gesslein M, et al. Short-term follow up after implantation of a cell-free collagen type I matrix for the treatment of large cartilage defects of the knee. Int Orthop. 2015;39(12):2473-2479. doi: 10.1007/s00264-015-2695-9
- Irawan V, Sung TC, Higuchi A, Ikoma T. Collagen Scaffolds in Cartilage Tissue Engineering and Relevant Approaches for Future Development. Tissue Eng Regen Med. 2018;15(6):673-697. doi: 10.1007/s13770-018-0135-9
- De Santis R, Russo A, Gloria A, et al. Towards the Design of 3D Fiber-Deposited Poly(s-caprolactone)/lron-Doped Hydroxyapatite Nanocomposite Magnetic Scaffolds for Bone Regeneration. J Biomed Nanotechnol. 2015;11(7):1236-46. doi: 10.1166/jbn.2015.2065
- Domingos M, Intranuovo F, Russo T, et al. The first systematic analysis of 3D rapid prototyped poly(e-caprolactone) scaffolds manufactured through BioCell printing: the effect of pore size and geometry on compressive mechanical behaviour and in vitro hMSC viability. Biofabrication. 2013;5(4):045004. doi: 10.1088/1758-5082/5/4/045004
- Chen J, Chen H, Li P, et al. Simultaneous regeneration of articular cartilage and subchondral bone in vivo using MSCs induced by a spatially controlled gene delivery system in bilayered integrated scaffolds. Biomaterials. 2011;32(21):4793-4805. doi: 10.1016/j.biomaterials.2011.03.041
- Chen Y, Liu X, Liu R, et al. Zero-order controlled release of BMP2-derived peptide P24 from the chitosan scaffold by chemical grafting modification technique for promotion of osteogenesis in vitro and enhancement of bone repair in vivo. Theranostics. 2017;7(5):1072-1087. doi: 10.7150/ thno.18193
- Wu X, Miao L, Yao Y, et al. Electrospun fibrous scaffolds combined with nanoscale hydroxyapatite induce osteogenic differentiation of human periodontal ligament cells. Int J Nanomedicine. 2014;9:4135-43. doi: 10.2147/IJN.S65272
- Ronca D, Langella F, Chierchia M, et al. Bone Tissue Engineering: 3D PCL-based Nanocomposite Scaffolds with Tailored Properties. Procedia CIRP. 2016;49:51-54. doi: 10.1016/j.procir.2015.07.028
- Domingos M, Gloria A, Coelho J, et al. Three-dimensional printed bone scaffolds: The role of nano/micro-hydroxyapatite particles on the adhesion and differentiation of human mesenchymal stem cells. Proc Inst Mech Eng H. 2017;231(6):555-564. doi: 10.1177/0954411916680236
- Ginestra P., Ceretti E., Fiorentino A. Electrospinning of Poly-caprolactone for Scaffold Manufacturing: Experimental Investigation on the Process Parameters Influence. Procedia CIRP. 2016;49:8-13. doi: 10.1016/j.procir.2015.07.020
- Alfieri FM, Vargas E Silva NCO, Dos Santos ACA, Battistella LR. Cutaneous temperature and pressure pain threshold in individuals with knee osteoarthritis. Reumatologia. 2020;58(5):272-276. doi: 10.5114/reum.2020.100195
- Windisch C, Brodt S, Röhner E, Matziolis G. Effects of Kinesio taping compared to arterio-venous Impulse System™ on limb swelling and skin temperature after total knee arthroplasty. Int Orthop. 2017;41(2):301-307. doi: 10.1007/s00264-016-3295-z
- Edrich J, Smyth CJ. Arthritis inflammation monitored by subcutaneous millimeter wave thermography. J Rheumatol. 1978 Spring;5(1):59-67.
- Oblinger W, Engel JM, Franke M. Thermographische Diagnostik der Arthritis peripherer Gelenke [Thermographic diagnosis of arthritis in peripheral joints]. Z Rheumatol. 1985;44(2):77-81. (In German)
- Windisch C, Brodt S, Roehner E, Matziolis G. Regional differences in temperature course after knee arthroplasty. Knee Surg Sports Traumatol Arthrosc. 2016;24(8):2686-2691. doi: 10.1007/s00167-015-3809-z
- Windisch C, Brodt S, Rohner E, Matziolis G. Effects of Kinesio taping compared to arterio-venous Impulse System™ on limb swelling and skin temperature after total knee arthroplasty. Int Orthop. 2017;41(2):301-307. doi: 10.1007/s00264-016-3295-z
- Mohajer B, Dolatshahi M, Moradi K, et al. Role of Thigh Muscle Changes in Knee Osteoarthritis Outcomes: Osteoarthritis Initiative Data. Radiology. 2022;305(1):169-178. doi: 10.1148/radiol.212771
- Egloff C, Hugle T, Valderrabano V. Biomechanics and pathomechanisms of osteoarthritis. Swiss Med Wkly. 2012;142:w13583. doi: 10.4414/ smw.2012.13583
- Wojcieszek A, Kurowska A, Majda A, et al. The Impact of Chronic Pain, Stiffness and Difficulties in Performing Daily Activities on the Quality of Life of Older Patients with Knee Osteoarthritis. Int J Environ Res Public Health. 2022;19(24):16815. doi: 10.3390/ijerph192416815
- Kiss RM. Effect of severity of knee osteoarthritis on the variability of gait parameters. J Electromyogr Kinesiol. 2011;21(5):695-703. doi: 10.1016/j. jelekin.2011.07.011
- Попков А.В., Попков Д.А., Кобызев А.Е. и др. Положительный опыт полнослойного замещения дефекта суставного хряща при использовании деградируемого имплантата с биоактивной поверхностью в сочетании с обогащенной тромбоцитами плазмой крови (экспериментальное исследование). Гений ортопедии. 2020;26(3):392-397. doi: 10.18019/1028-4427-2020-26-3-392-397
- Dahlin RL, Kinard LA, Lam J, et al. Articular chondrocytes and mesenchymal stem cells seeded on biodegradable scaffolds for the repair of cartilage in a rat osteochondral defect model. Biomaterials. 2014;35(26):7460-7469. doi: 10.1016/j.biomaterials.2014.05.055
- Christensen BB, Foldager CB, Hansen OM, et al. A novel nano-structured porous polycaprolactone scaffold improves hyaline cartilage repair in a rabbit model compared to a collagen type I/III scaffold: in vitro and in vivo studies. Knee Surg Sports Traumatol Arthrosc. 2012;20(6):1192-1204. doi: 10.1007/s00167-011-1692-9
- Kleemann RU, Krocker D, Cedraro A, et al. Altered cartilage mechanics and histology in knee osteoarthritis: relation to clinical assessment (ICRS Grade). Osteoarthritis Cartilage. 2005;13(11):958-963. doi: 10.1016/j.joca.2005.06.008
- Paatela T, Vasara A, Nurmi H, et al. Biomechanical Changes of Repair Tissue after Autologous Chondrocyte Implantation at Long-Term Follow-Up. Cartilage. 2021;13(1_suppl):1085S-1091S. doi: 10.1177/1947603520921433
- Maia FR, Carvalho MR, Oliveira JM, Reis RL. Tissue Engineering Strategies for Osteochondral Repair. Adv Exp Med Biol. 2018;1059:353-371. doi: 10.1007/978-3-319-76735-2_16


