Применение биопластического материала при хронических ранах стопы на фоне сахарного диабета
Автор: Кривощеков Е.П., Ельшин Е.Б., Аляпышев Г.С., Посеряев А.В.
Журнал: Вестник медицинского института "РЕАВИЗ": реабилитация, врач и здоровье @vestnik-reaviz
Рубрика: Клиническая медицина
Статья в выпуске: 6 (54), 2021 года.
Бесплатный доступ
Цель: улучшить результаты лечения и увеличить частоту случаев полной эпителизации хронических ран у пациентов с нейропатической формой синдрома диабетической стопы Wagner I-II степени путем применения биопластического материала «G-derm».Материалы и методы. Было проведено исследование 72-х пациентов, из них 35 человек вошли в группу сравнения, которым проводилось стандартное лечение с применением гидроколлоидных повязок. В основную группу вошли 37 исследуемых, у которых помимо стандартного лечения применяли биопластический материал «G-derm». Состояние пациентов оценивали в динамике на 1-е, 10-е, 30-е сутки от начала лечения.Результаты. К 30-м суткам полная эпителизация хронической раны стопы была зарегистрирована всего у 12 (16,7 %) пациентов. Из них в основной группе это было отмечено в 8 (21,6 %) случаях, а в группе сравнения - в 4 (11,4 %). Неудовлетворительная эпителизация (заживление менее 25 % от первоначальной площади) к 30-м суткам лечения отмечалась у 14 (19,4 %) человек: в основной группе - у 4 (10,9 %) пациентов, в группе сравнения - у 10 (28,5 %) человек. У оставшихся 25 (67,6 %) пациентов основной группы и 21 (60 %) пациента группы сравнения к 30-м суткам лечения отмечалась удовлетворительная эпителизация.Заключение. В соответствии с произведенным исследованием, очевидна эффективность применения биопластического материала «G-derm» в рамках местного лечения хронических ран в комплексе общепринятых мер лечения для пациентов, имеющих нейропатическую форму синдрома диабетической стопы. Применение данного биоматериала у указанной группы пациентов приводит к более быстрому и качественному очищению и регенерации раны, более значимому сокращению площади и глубины раны, а также увеличению частоты случаев полной ее эпителизации.
Биопластический материал, синдром диабетической стопы, хронические язвы
Короткий адрес: https://sciup.org/143178294
IDR: 143178294 | УДК: 616.633.455.623-616 | DOI: 10.20340/vmi-rvz.2021.6.CLIN.2
Текст научной статьи Применение биопластического материала при хронических ранах стопы на фоне сахарного диабета
УДК 616.633.455.623-616
Сахарный диабет (СД) – хроническое заболевание с тенденцией к неуклонному росту [1]. Численность больных СД в мире постоянно увеличивается и в 2017 г. составила 425 миллионов человек. По оценкам экспертов к 2035 году распространенность этого заболевания в мире возрастет до 600 миллионов человек [2]. В РФ по данным федерального регистра СД к концу 2018 года находилось на диспансерном учете 4 585 570 человек, при этом среди них 90 % составляют больные СД 2-го типа. СД сопровождается развитием системных осложнений: поражение магистральных сосудов сердца, мозга, нижних конечностей, сосудов сетчатки и почек. Синдром диабетической стопы (СДС) является частым осложнением СД, он имеет место у 15 % больных [3]. СДС представляет собой тер- минальную стадию развития таких осложнений СД, как нейропатия и макроангиопатия.
Проблема выработки эффективного алгоритма лечения пациентов, имеющих хронические раны совместно с нейропатической формой СДС, является крайне актуальной на современном этапе развития общества [4]. Подобные раны на фоне осложнений, даже с учетом удовлетворительных показателей кровотока по магистральным артериям, отражают слабую динамику лечения. В данном случае основные факторы риска развития СДС: периферическая сенсорная и моторная нейропатия, деформация и травматизация стопы, снижение микроциркуляции стоп. В тоже время, несмотря на то, что научное сообщество предоставляет новые методы терапии СД, в том числе появляются новые методики лечения СДС, динамика числа заболева- ний на фоне хронических ран, включающих осложнения, в том числе СДС, не является положительной.
На данный момент местное лечение хронических ран предполагает использование перевязочных средств, предназначенных для поддержания раны во влажной среде. Это могут быть
-
а) гидрогели;
-
б) гидроколлоиды;
-
в) коллагенсодержащие материалы;
-
г) препараты на основе гиалуроновой кислоты [5].
Клинические рекомендации предполагают использование материалов на основе коллагена в рамках местного лечения хронических ран пациентов с нейропатической формой СДС [6, 7].
Коллаген представляет собой биосубстрат. Он ускоряет процесс эпителизации и другие репаративные механизмы [8]. Включая клеточные механизмы репарации и ангиогенез коллаген формирует новые ткани и предотвращает вторичное инфицирование раны.
В последнее время стали появляться единичные публикации об использовании биопластических материалов, имеющих в составе гиалуроновую кислоту [5]. При попадании этого вещества в рану и взаимодействии его с экссудатом происходит образование геля, что создает оптимальную влажность в ране. За счет введения препаратов гиалуроновой кислоты повышается тургор, гибкость тканей, ускоряется процесс эластогенеза, происходит стимуляция коллагеногенеза и ангиогенеза [9].
Применение биоматериала, состоящего из гиалуроновой кислоты и коллагена, – гистоэквивалентбиопластического материала «G-derm» – в лечении хронических раневых дефектов у пациентов с СДС выглядит весьма перспективным.
Цель исследования: улучшение результативности и эффективности лечения хронических ран у пациентов с нейропатической формой синдрома диабетической стопы Wagner I-II степени путем применения биопластического материала «G-derm», а также увеличение частоты случаев полной эпителизации.
Материалы и методы
Было проведено исследование, в которое вошло 72 пациента с СДС. Испытуемые обследовались и лечились на базе Самарской областной клинической больницы им. В.Д. Середавина, Ульяновской областной клинической больницы, а также городских поликлиник № 1 и № 13 г. Самары в период с февраля 2017 г. по январь 2018 г. Критерии включения в исследование: возраст от 25 до 75 лет, наличие СД 2-го типа, осложненное СДС, глубина поражения по классификации Wagner I-II степени.
Критерии исключения:
-
а) пациенты с поражением 3–5 степени по классификации Wagner и с ишемической формой СДС;
-
б) наличие анаэробной инфекции в ране;
-
в) наличие декомпенсированного облитерирующего атеросклероза артерий нижних конечностей;
-
в) наличие неконтролируемой гипергликемии (более 13 ммоль/л);
-
г) декомпенсация соматических заболеваний, онкологические заболевания.
Фокус-группа включала в себя пациентов в возрастном интервале 35–75 лет (средний возраст 61,2 ± 7,1 года; медиана 62 года). Исследование включало в себя 43 (59,7 %) пациента женского пола и 29 (40,3 %) – мужского. В стационарных условиях было пролечено 40 (55,5 %) пациентов, в амбулаторных – 32 (44,5 %). Хронические раны со степенью поражения Wagner I были у 45 (62,5 %) пациентов, Wagner II – у 27 (37,5 %) человек. Время существования раны на стопе варьировалось от 1,5 до 32 месяцев. Среднее время наличия язвенного дефекта составило 5 ± 2,1 месяца. У 37 (51,3 %) пациентов рана была хронической (более 6 месяцев). У 13 (18 %) пациентов рана на стопе была первичной, а у 59 (82 %) – рецидивной. Рецидив менее, чем через год развился у 7 (9,7 %) пациентов, через 1–2 года – у 22 (30,5 %) пациентов, через 2–3 года – у 27 (37,5 %) человек, спустя 3 года и больше – у 16 (22,2 %) исследуемых. Показатели средней длины язвы составили 6 ± 1,6 см, ширины – 3 ± 1,1 см, глубины – 0,4 ± 0,1 см, площади – 13,0 ± 3,9 см2.
Нормальный статус ходьбы был только у 28 (38,9 %) пациентов. Остальные перемещались при помощи инвалидного кресла – 8 (11,2 %) человек или с помощью костылей – 36 (50 %) человек. Среди исследуемых 10 (13,8 %) пациентов были курильщиками. Повышенный уровень холестерина зарегистрирован у 13 (18 %) пациентов. Длительность течения сахарного диабета у исследуемых пациентов находилась в интервале от 3 до 25 лет, в среднем 8,9 ± 2,8 года. Артериальная гипертензия наблюдалась у 63 (87,5 %) испытуемых. Индекс массы тела был нормальным (20,1–25 кг/м2) у 6 (8,3 %) человек, лишний вес и ожирение 1-й степени (25–30 кг/м2) – у 40 (55,5 %) пациентов, ожирение 2-й степени (более 30 мг/м2 и более) – у 26 (36,1 %) исследуемых. Метаболический синдром наблюдался у 39 (54,2 %) пациентов. Почти половина пациентов, 34 (47,2 %) человека, отражали гибридную патологию: СД с артериальной гипертензией на фоне ожирения. Постинфарктный кардиосклероз наблюдался у 8 (11,1 %) пациентов, а перенесенный инсульт был отражен в анамнезе 5 (6,9 %) человек.
На начало исследования 10 (13,8 %) пациентов не были допущены до сахароснижающей терапии. На постоянной ин-сулинотерапии находились 29 (40,2 %) па-центов, применяли пероральные сахароснижающие препараты – 29 (40,2 %) пациентов, их комбинацию – всего 4 (5,5 %) пациента.
К обеим группами пациентов применялась базовая терапия, включенная в стандартное лечение. На момент поступления каждый из пациентов проходил хирургическую обработку раны, в том числе при по- мощи метода ультразвуковой кавитации у 32 (44,5 %) человек. До начала лечения проводилось исследование плантарного давления, изготавливались специальные разгрузочные стельки и индивидуальные иммобилизирующие разгрузочные повязки Total Contact Cast. Разгрузка стопы выполнялась до полного наступления полной эпителизации хронической раны.
Среди исследуемых 40 (55,5 %) челоек получали инфузионную терапию препаратами, улучшающими микроциркуляцию.
На следующем этапе исследования пациенты были разделены на две группы. Группа сравнения включала в себя 35 (48,6 %) пациентов, из которых было 15 (39,6 %) мужчин и 20 (58,8 %) женщин. Они получали базовое лечение с применением гидроколлоидных повязок, предназначенных для местного лечения хронических ран на стопе. Вторая группа – основная, включала в себя 37 (51,4 %) пациентов – 14 (41,1 %) мужчин и 23 (60,5 %) женщины. Данная группа в рамках местного лечения получала биопластический материал «G-derm».
Первичный осмотр пациентов включал клинический осмотр, сбор жалоб и анамнеза; выясняли наличие сопутствующих и перенесенных заболеваний. Также оценивался социальный и функциональный статус пациентов; измерялся рост, вес, индекс массы тела. Оценивали местный статус: площадь и глубину раны, ее отделяемое. Первый день исследования включал проведение рентгенографии стопы в двух проекциях для всех пациентов. Кроме того, проводилась комплексная оценка состояния кровотока в нижних конечностях посредством ультразвукового дуплексного сканирования. Помимо этого, проводилось микробиологическое исследование отделяемого из раны.
В рамках лабораторных методов исследования применялось исследование уровня сахара крови наряду со скрининговыми показателями клинического анализа крови. Более подробно полученные результаты отражены в таблице 1.
Таблица 1. Характеристика групп пациентов Table 1. Characterization of groups of patients
|
Характеристика |
Статистический параметр |
Основная группа (37) |
Группа сравнения (35) |
Всего |
p |
|
Пол |
Муж.: n (%) |
14 (41,1 %) |
15 (39,6 %) |
29 (40,3 %) |
0,145 |
|
Жен.: n (%) |
23 (60,5 %) |
20 (58,8 %) |
43 (59,7 %) |
||
|
Возраст |
Me 25 %/75 % q |
61 54/65 |
62 60/67 |
62 57/66 |
0,178 |
|
Cтепень поражения |
I ст.; n (%) |
23 |
22 |
45 (62,5 %) |
0,322 |
|
Wagner |
II ст.; n (%) |
14 |
13 |
27 (37,5 %) |
|
|
Стаж сахарного |
Me |
11 |
11 |
10 |
0,199 |
|
диабета |
25/75 % q |
10/16 |
7/12 |
7,5 |
|
|
Инфаркт миокарда в анамнезе |
n (%) |
5 (6,9 %) |
3 (4,2 %) |
8 (11,1 %) |
0,309 |
|
Инсульт в анамнезе |
n (%) |
3 (4,2 %) |
2 (2,8 %) |
5 (6,9 %) |
0,371 |
Для обеих групп был проведен замер площади и глубины раны посредством разработанной полезной модели «Устройство для измерения площади кожного дефекта и глубины раны» (Патент РФ на полезную модель № 2019104771 от 19.02.2019 г).
Устройство включает в себя неподвижную матрицу и подвижные стержни, выполненные из металла. Матрица имеет в составе верхнюю и нижнюю пластины, содержащие 169 круглых отверстия, расположенные в виде квадрата (рис. 1).
Стержни имеют на боковой поверхности градуировку с интервалом 1 мм и могут свободно перемещаться по отверстиям сквозь обе пластины матрицы.
Устройство используется следующим образом. Его переворачивают и приклады- вают к ране пациента таким образом, чтобы стержни покрывали всю ее площадь. Под действием силы тяжести некоторые стержни опускаются ниже других, касаясь дна раны. Далее выполняется фиксация стержней внутри матрицы для того, чтобы была возможность подсчитать результаты измерений. С этой целью сдвигаются пластины матрицы при помощи подвижных винтов. Для точного измерения площади хронической раны необходимо подсчитать количество опустившихся стержней и затем выполнить расчет по формуле Sраны = 17,9xn. Полученный результат выражается в мм2. Чтобы оценить глубину раны необходимо зафиксировать насколько сместились стержни.

Рисунок 1. Устройство для измерения площади кожного дефекта и глубины раны (вид в сборе)
Figure 1. A device for measuring the area of the skin defect and the depth of the wound (general view)
Показатели хронических ран на первом исследовании для обеих групп были статистически однородными. Показатели медианы длины раны для основной группы были в интервале 5,9 ± 1,4 см, а для группы сравнения в интервале 6,0 ± 1,6 см; показатели ширины – 2,8 ± 1,1 см и 3,1 ± 0,1 см соответственно; глубины – 0,4 ± 0,1 см для обеих групп. Исходя из полученных данных был произведен расчет площади хронической раны: для основной группы она находилась в расчетном интервале 12,7 ± 3,7 см2 (межквартильный интервал – 8,9/34,9 см2), для группы сравнения – в интервале 13,2 ± 3,9 см2 (межквартильный интервал – 4,9/42,0 см2) (p > 0,05).
Динамика состояния пациентов обеих групп оценивалась на трех этапах – на 1-е сутки, на 10-е сутки и на 30-е сутки с начала момента лечебного вмешательства.
Результаты
В рамках объективизации результатов лечебного вмешательства для обеих групп проводилось исследование цитограмм на каждой контрольной точке исследования: на 1-е сутки, на 10-е сутки и на 30-е сутки с начала момента лечения.
На 1-е сутки наблюдалось равные доли воспалительного (45,8 ± 0,1 %) и воспалительно-дегенеративного типов (54,2 ± 0,1 %) цитограмм для каждой из исследуемых групп.
Следующее контрольное исследование, проводимое на 10-е сутки, указало на снижение уровня воспалительно-дегенеративного типа на 27,1 % для сравнительной группы и на 34,3 % – для основной. В то же время, 12 (34,3 %) пациентов основной группы отразили регенераторный тип цитограмм, а в группе сравнения – 10 (27,1 %) пациентов (рис. 2).
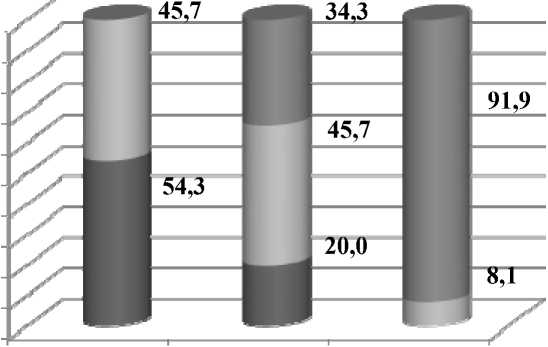
На 30-е сутки в группе сравнения была отмечена значительная доля регенераторного типа цитограмм ран – у 26 (74,3 %) пациентов. Но у многих пациентов этой группы (9 человек – 25,7 %) сохранялся воспалительный тип цитограммы. В отличие от них, в основной группе зафиксировано значительное снижение воспалительного типа цитограмм раны стопы (3 пациента – 8,1 %), а регенераторный тип выявлен у значительного большинства – у 34 (91,9 %) пациентов (рис. 3).


74,3
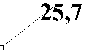
-
■ регенераторный
-
■ воспалительный
-
■ воспалительнодегенеративный
1 сутки 10 сутки 30 сутки
Рисунок 2. Динамика изменения типов цитограмм хронических ран в группе сравнения (%)
Figure 2. The dynamics of the types of foot wound cytograms in the comparison group (%)
10 сутки
30 сутки
1 сутки
регенераторный воспалительный воспалительнодегенеративный
Рисунок 3. Динамика изменения типов цитограмм раны стопы в основной группе (%)
Figure 3. Dynamics of changes in types of foot wound cytograms in the main group (%)
Во время изучения микробного спектра хронических ран на стопе в 1-е сутки было выявлено, что изначально в обеих группах присутствовала флора в виде: Staphyllo-cocc. aureus – 36,8 ± 0,5 %, Staphylococc. epidermidis – 26,6 ± 0,4 %, Enterococcus fecalis – 18,2 ± 0,3 %, Proteus vulgaris – 7,6 ± 0,3 %, Proteus mirabilis – 6,6 ± 0,3 %, Staphylococc. gallinarum – 4,2 ± 0,2 %.
К 10-м суткам исследования в группе сравнения было отмечено уменьшение бактериальной обсемененности раны: Staphyllo-cocc. Aureus – 35,5 % (снижение на 1,3 %), Staphylococc. epidermidis – 19,8 % (снижение на 6,8 %), Enterococcus faecalis – 8,8 % (снижение на 9,4 %), Proteus vulgaris – 7,4 % (снижение на 0,2 %), Staphylococc. gallinarum – 1,4 % (снижение на 2,8 %), отсутствие флоры – 27,1 % (увеличение на 27,1 %). В основной группе были отмечены положительные изменения в микробном спектре раны в виде уменьшения бактериальной об-семененности: Staphyllococc. aureus – 29,3 % (снижение на 7,5 %), Staphylococc. epidermidis – 19,3 % (снижение на 7,3 %), Enterococcus faecalis – 8,7 % (снижение на 9,5 %), Proteus vulgaris – 7,2 % (снижение на
0,5 %), Staphylococc. gallinarum – 1,2 % (снижение на 2,9 %), отсутствие флоры – 34,3 % (увеличение на 34,3 %).
На 30-е сутки в группе сравнения была флора: Staphyllococc. aureus – 23 % (снижение на 13,8 %), Staphylococc. epidermidis – 13,9 % (снижение на 12,7 %), рана стерильна – 63,1 % (увеличение на 63,1 %). В основной группе микробный спектр был представлен: Staphyllococc. aureus – 10,7 % (снижение на 26,1 %), Staphylococc. epidermidis – 3,6 % (снижение на 23 %), рана стерильна – 85,7 % (увеличение на 85,7 %).
В ходе исследования периодически, на 1-е, 10-е и 30-е сутки, в обеих группах определялись площадь и глубина хронической раны стопы. Эти данные представлены в таблице 2.
На последней контрольной точке (30-е сутки) с начала момента лечебного вмешательства была отмечена заметная разница между группами по площади хронической раны. В основной группе площадь раны была значительно меньше. В то же время, динамика глубины раны для обеих групп осталась сопоставимо однородной.
Таблица 2. Динамика уменьшения глубины и площади хронических ран у пациентов обеих групп
Table 2. Dynamics of a decrease in the depth and area of chronic wounds in patients of both groups
|
Размер |
Группа |
1-е сутки |
10-е сутки |
30-е сутки |
|
Площадь, см2 |
Основная группа |
12,7 ± 3,7 8,9/34,9 |
8,5 ± 2,1 1,7/22,2 |
1,9 ± 0,5 0,2/13,2 |
|
Группа сравнения |
13,2 ± 3,9 4,9/42,0 |
9,1 ± 2,3 4,2/30,1 |
6,1 ± 1,1 2,2/27,2 |
|
|
p |
0,311 |
0,522 |
0,046 |
|
|
Глубина, см |
Основная группа |
0,4 ± 0,1 0,3/0,55 |
0,2 ± 0,05 0,1/0,4 |
0,1 ± 0,05 0,1/0,1 |
|
Группа сравнения |
0,4 ± 0,1 0,3/0,6 |
0,25 ± 0,05 0,1/0,45 |
0,15 ± 0,05 0,1/0,2 |
|
|
p |
0,702 |
0,399 |
0,139 |
|
Полученные в ходе исследования результаты дают возможность говорить о том, что динамика заживления раны зависит от размера глубины первоначальной раны. Применение биопластического материала «G-derm» для пациентов основной группы в течение 30 дней привело к значительной положительной динамике, отраженной в уменьшении размеров раневого дефекта как у пациентов с поражением стадии Wagner I (в среднем в 4,4 раза, с 8,9 ± 1,9 см2 до 2,0 ± 0,3 см2), так и при Wagner II (в 2 раза, с 39 ± 5,9 см2 до 19,2 ± 4,1 см2). Кроме того, в группе сравнения значимая динамика выявилась лишь у пациентов с Wagner I (в 2 раза, с 10 ± 1,9 см2 до 4,9 ± 0,8 см2); при стадии Wagner II площадь раневого дефекта за период лечения осталась практически неизменной (в 1-е сутки 29,2 ± 4,8 см2, на 30-е сутки 26,4 ± 4,5 см2).
Примечательно, что процесс эпители-зации проходил быстрее у пациентов, рана у которых существует менее 6 месяцев. Пациенты, включенные в основную группу, отразили снижение площади раны в 4,2 раза (с 15,4 ± 4,5 см2 до 3,6 ± 1,2 см2), а пациенты сравнительной группы – в 3 раза (с 13,9 ± 3,9 см2 до 6,6 ± 1,5 см2). У пациентов, у которых хроническая рана существовала более 6 месяцев, регресс площади за 30 дней составил 4,5 раза (с 12,7 ± 3,7 см2 до 2,8 ± 1,1 см2) в основной группе и 1,5 раза (с 15,4 ± 4,5 см2 до 10,2 ± 1,9 см2) – в сравнительной. Таким образом, независимо от длительности существования хронической раны, к 30-м суткам лечения имеется явное преимущество у пациентов основной группы. Подробно результаты отмечены в таблице 3.
Таблица 3. Уменьшение площади хронической раны через 30 дней лечения у пациентов исследуемых групп в зависимости от давности существования хронической раны и степени поражения стопы по Wagner Table 3. Reduction of the area of a chronic wound after 30 days of treatment in patients of the study groups, depending on the duration of the existence of a chronic wound and the degree of foot damage according to Wagner
|
Размер |
Группа |
Всего |
Wagner I |
Wagner I I |
Рана <6 мес |
Рана >6 мес |
|
Площадь, см2 |
Основная группа |
6,9 ± 1,2 |
19,8 ± 4,1 |
20,7 ± 4,2 |
11,8 ± 2,2 |
10,7 ± 2,0 |
|
Группа сравнения |
5,1 ± 1,2 |
5,1 ± 1,1 |
2,8 ± 1,1 |
7,3 ± 1,8 |
5,2 ± 1,8 |
|
|
p |
0,001 |
0,018 |
0,016 |
0,025 |
0,025 |
|
К 30-м суткам полная эпителизация хронической раны стопы была зарегистрирована всего у 12 (16,7 %) пациентов. Из них в основной группе это было отмечено в 8 (21,6 %) случаях, а в сравнительной – в 4 (11,4 %). Неудовлетворительные показатели эпителизации (показатели заживления до 25 % от первоначальной площади) на данном этапе медицинского вмешательства отражались у 14 (19,4 %) пациентов: для основной группы – 4 (10,9 %) испытуемых, для группы сравнения – 10 (28,5 %) пациентов. Оставшиеся 25 (67,6 %) испытуемых из основной группы и 21 (60 %) пациент из сравнительной группы на данном этапе лечебного процесса показали удовлетворительную динамику эпителизации.
Таким образом, применение биоматериала «G-derm» в рамках лечебного процесса хронических ран пациентов, предполагающих наличие СДС, в сравнении с общепринятыми методами, включающими ис- пользование гидроколлоидных повязок, отразило увеличение случаев полной эпи-телизации ран в 1,9 раза и снижение уровня малорезультативного лечения в 2,6 раза.
Выводы
В ходе исследования были получены данные, позволяющие судить о результативности комбинирования биопластиче-ского материала «G-derm» в рамках местного лечения хронических ран у пациентов, предполагающих нейропатическую форму СД, с комплексной стандартной терапией. Применение биопластического материала при лечении пациентов с СДС позволяет более быстро и качественно запустить процессы очищения и регенерации раны, что приводит к более существенному сокращению площади и глубины раны и увеличению количества случаев полной ее эпителизации.
Список литературы Применение биопластического материала при хронических ранах стопы на фоне сахарного диабета
- Bakker K., Apelqvist J., Lipsky B.A., Van Netten J.J., Schaper N.C. The IWGDF guidance document on prevention and management of foot problems in diabetes mellitus: development of an evidence-based global consensus. Diabetes Metab Res Rev. 2016;32:2-6.
- Frykberg RG, Banks J. Management of Diabetic Foot Ulcers: A Review. Fed Pract. 2016;33(2):16-23.
- Krivoshchekov E., Elshin E., Ganja N., Romanov V. The positive expierence of the local treatment of wounds neuropathic form of diabetic foot syndrome. Dan Sci Jour. 2018;1(13):27-30.
- Кривощёков Е.П., Ельшин Е.Б., Романов В.Е. Патогенетическое лечение осложнений синдрома диабетической стопы. Практическая медицина. 2017;4(105):77-84.
- Burgos-Alonso N, Lobato I, Hernández I, et al. Adjuvant Biological Therapies in Chronic Leg Ulcers. Int J Mol Sci. 2017;18(12):2561. Published 2017 Nov 28. DOI: 10.3390/ijms18122561
- Дедов И.И., Шестакова М.В., Майорова А.Ю. и др. Алгоритмы специализированной медицинской помощи больным сахарным диабетом / под ред. И.И. Дедова, М.В. Шестаковой, А.Ю. Майорова: 9-й выпуск. Сахарный диабет. 2019;22(1S1):1-144. : DOI: 10.14341/DM221S1
- Krivoshchekov E.P., Elshin E.B., Ganja N.F., Romanov V.E. Comparative analysis ot the results of treatment of postoperative wound diabetic foot. The unity of science. 2018;1:91-95.
- Salamone JC, Salamone AB, Swindle-Reilly K, Leung KX, McMahon RE. Grand challenge in Biomaterials-wound healing. Regen Biomater. 2016;3(2):127-128. DOI: 10.1093/rb/rbw015
- Стеценко Б.Г., Дивеев В.А., Сиряков М.В., Иванов Г.Г., Королева К.П. Опыт применения гистоэквивалент-биопластического материала гиалуроновой кислоты в хирургии. Раны и раневые инфекции. 2017;4(3):30-35. DOI: 10.25199/2408-9613-2017-4-2-30-35


