Применение флуоресцентной навигации с 5-аминолевулиновой кислотой в хирургии глиобластомы: метаанализ
Автор: Бывальцев Вадим Анатольевич, Степанов Иван Андреевич
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Обзоры
Статья в выпуске: 4 т.16, 2017 года.
Бесплатный доступ
Глиобластома (ГБМ) является высокозлокачественной первичной глиальной опухолью головного мозга,которая характеризуется устойчивостью к современным методам лечения. Использование флуоресцентной навигации с 5-аминолевулиновой кислотой (5-АЛА-ФН) является современным методом интраоперационной навигации в хирургии ГБМ. Однако широкое применение флуоресцентной навигации приводит к развитию нежелательных явлений, что требует уточнения показаний к её использованию и строгого отбора пациентов. Цель исследования - определить клиническую эффективность, чувствительность и специфичность 5-АЛА-ФН в хирургии ГБМ. Материал и методы. Проведен метаанализ опубликованных с 2000 по 2017 г. клинических серий результатов хирургического лечения ГБМ, в которых использовалась 5-АЛА-ФН. результаты и обсуждение. В метаанализ включены 25 зарубежных и 1отечественное исследование. У 74,8 % пациентов (95 % ДИ: 67,4-83,5 %) удалось достигнуть максимальной степени резекции опухоли. 5-АЛА-ФН увеличивает длительность безрецидивного периода(ДБП) у пациентов с ГБМ в среднем на 8,14 мес (95 % ДИ: 4,36-12,02). Разница в общей выживаемости пациентов с ГБМ при лечении с использованием 5-АЛА-ФН и без нее составляет 4,35-6,17 мес (95 %ДИ: 0,9-13,23). Использование 5-АЛА-ФН обладает высокой специфичностью - 86,6-87,5 % (95 % ДИ:81,6-91,7) и чувствительностью - 79,8-82,2 % (95 % ДИ: 73,5-91,07) в отношении ГБМ. Заключение.Проведенный метаанализ 26 клинических серий, в которых при микронейрохирургическом удалении ГБМ использовалась 5-АЛА-ФН, показал, что данная методика обладает высокой степенью чувствительности и специфичности. Более того, использование 5-АЛА-ФН в хирургии ГБМ даёт значительные преимущества пациентам в отношении увеличения ДБП и степени резекции опухоли.
Глиобластома, 5-аминолевулиновая кислота, флуоресцентная навигация, клиническая эффективность, чувствительность, специфичность, мета-анализ
Короткий адрес: https://sciup.org/140254132
IDR: 140254132 | УДК: 616.831-006.484-089 | DOI: 10.21294/1814-4861-2017-16-4-54-64
Текст обзорной статьи Применение флуоресцентной навигации с 5-аминолевулиновой кислотой в хирургии глиобластомы: метаанализ
Плоскоклеточный рак области головы и шеи (ПРГШ) отличается агрессивным течением. Опухоли этой локализации характеризуются быстрым ростом, часто рецидивируют, дают множественные метастазы в регионарные лимфоузлы и с трудом поддаются лечению. Около 40 % больных ПРГШ погибают в течение первого года после установки диагноза [1]. В современной онкологии существует проблема ранней диагностики и прогноза течения этого социально значимого заболевания. Использование инструментальных методов для диагностики ПРГШ на уровне амбулаторно-поликлинического звена затруднено их трудоемкостью и дороговизной [2]. Поэтому актуально определить доступные, надежные и малоинвазивные показатели для диагностики и прогноза течения ПРГШ.
Ранее протеомным анализом сыворотки крови больных ПРГШ был выделен ряд показателей, которые могут иметь диагностическую ценность для прогноза течения заболевания, – аденилилцилаза ассоциированный протеин 1 (САР1), протеинфос-фатаза 1В (РРМ1В) и др. [1].
Цель исследования – определить содержание РРМ1В в сыворотке крови и ткани у больных ПРГШ (T1–4N0–3M0), чтобы оценить возможность использования этого показателя в качестве дополнительного критерия прогноза течения ПРГШ, для этого в исследование были включены больные с различными хроническими воспалительными заболеваниями гортани и гортаноглотки с морфологически подтвержденной дисплазией слизистой оболочки (ХГЛ, DII–III).
Материал и методы
В исследование включены 43 больных ПРГШ стадии T1–4N0–3M0 с гистологически верифицированным диагнозом, ранее не получавших специального лечения, 12 человек с хроническими воспалительными заболеваниями гортани и горта-ноглотки с морфологически подтвержденной дисплазией слизистой оболочки (ХГЛ, DII–III), группу
таблица 1
Содержание ррМ1в в сыворотке крови больных хГЛ (DII–III), ПрГШ и в контрольной группе
|
Группа больных |
Число больных |
Уровень РРМ1В, нг/мл (Ме (Q1; Q2)) |
р |
|
Контрольная |
12 |
0,268 (0,15; 0,42) |
– |
|
ХГЛ (DII–III) |
12 |
0,403 (0,36; 0,46) |
– |
|
Т1N0M0 |
12 |
0,61 (0,4; 1,24) |
р0=0,006; р1=0,028 |
|
Т2N0–1М0 |
16 |
0,74 (0,36;0,9) |
р0=0,019 |
|
Т3–4N0–2M0 |
15 |
1,1 (0,59;1,7) |
р0=0,003; р1=0,0002 |
Примечание: р0 – значимость различий показателей у больных по сравнению с контрольной группой; р1 – значимость различий по сравнению с показателями у больных с ХГЛ, DII–III.
таблица 2
Содержание ррМ1в в патологически измененной ткани больных хГЛ и плоскоклеточным раком головы и шеи
|
Группа больных |
Число больных |
Уровень РРМ1В, нг/мл (Ме (Q1; Q2)) |
р |
|
ХГЛ (DII–III) |
12 |
1,42 (1,02; 1,5) |
– |
|
Т1N0M0 |
9 |
3,7 (3,1; 4,3) |
р1=0,035 |
|
Т2N0–1М0 |
10 |
3,72 (2,5; 4,2) |
р1=0,002 |
|
Т3–4N0–2M0 |
9 |
4,24 (4,51; 4,6) |
р1=0,0027 |
Примечание: р1 – значимость различий по сравнению с показателями у больных с ХГЛ, DII–III.
контроля составили 12 здоровых волонтеров. Средний возраст больных – 55 ± 5,4 года.
Работа проведена с соблюдением принципов добровольности и конфиденциальности в соответствии с «Этическими принципами проведения научных медицинских исследований с участием человека» и с «Правилами клинической практики в Российской Федерации», получено разрешение этического комитета института. Материалом для исследования явилась сыворотка крови, которую получали в соответствии со стандартным протоколом, и патологически измененная ткань, взятая в ходе выполнения видеоларингоскопии или при проведении операции. Гомогенат опухолевой и смежной морфологически нормальной ткани готовили в соответствии с инструкцией, прилагаемой к наборам ИФА. Результаты выражали как количество исследуемого белка в нг на 1 мл сыворотки крови или гомогената ткани. Анализ образцов проводили с помощью ИФА набора Human protein phosphatase 1B, magnesium-dependent, beta isoform (PPM1B) ELISA Kit (MyBioSource) на микропланшетном ИФА ридере Anthos Reader 2020 (Biochrom).
Статистическую обработку результатов проводили с применением пакета программ Statistica 6.0. Для проверки значимости различий в группах использовали непараметрические критерии: тест Крускала – Уоллиса и тест Манна – Уитни. Результаты, приведенные в табл. 1 и 2, представлены как медиана (Me) с интерквартильным размахом (Q; Q3), где N – количество человек. Значимость различий между группами исследовали с помощью критерия Манна – Уитни (U-test). Корреляционный анализ проведен с использованием непараметрического критерия Спирмена.
Результаты исследования
Анализ содержания РРМ1В в образцах сыворотки крови показал достоверное различие уровня исследуемого белка во всех представленных группах. У больных ПРГШ стадии T1N0M0 уровень РРМ1В в сыворотке крови практически в 2 раза был выше, чем в контрольной группе, и в 1,5 раза выше, чем у пациентов с ХГЛ (DII–III), в обоих случаях различия статистически значимы (р=0,006 и р=0,028 соответственно). С увеличением распространенности первичной опухоли наблюдалось постепенное нарастание уровня РРМ1В в сыворотке крови больных ПРГШ (табл. 1). Корреляционный анализ показал положительную зависимость уровня РРМ1В в сыворотке крови от размера опухолевого узла (r=0,59; p<0,05).
Анализ содержания РРМ1В в опухолевой ткани больных ПРГШ и ткани диспластически измененного эпителия больных ХГЛ (DII–III) показал нарастание уровня исследуемого белка в зависимости от стадии патологического процесса (табл. 2). Межгрупповое сравнение уровня РРМ1В в опухолевой ткани больных ПРГШ со стадиями заболевания Т1–4N0–2M0 выявило значимые различия по сравнению с группой больных с ХГЛ (DII–III). Уровень РРМ1В в опухолевой ткани возрастал с увеличением стадии патологического процесса и был выше почти в 2 раза у больных ПРГШ со стадией T2N0–1M0 по сравнению с группой больных ХГЛ (DII-III) и в 3 раза выше, чем у больных с распространенным опухолевым процессом (со стадией, стратифицированной как T3–4N0–2M0). Было отмечено увеличение содержания этого белка в 2,6 раза (р=0,035) в опухолевой ткани пациентов с ПРГШ T1N0M0 стадии по сравнению с больными ХГЛ с дисплазией эпителия II–III степени.
При сравнении уровней РРМ1В в опухолевой и в смежной морфологически нормальной ткани у больных ПРГШ Т1–4N0–2M0 стадии было установлено, что содержание белка было почти в 2 раза выше в ткани опухоли (рис. 1).
Наличие у больных метастазов в регионарные лимфоузлы также отражалось на содержании РРМ1В как в сыворотке крови, так и в образцах тканей (табл. 3). Значимые различия в содержании РРМ1В были отмечены в опухолевой ткани больных ПРГШ между группами с метастатически пораженными лимфоузлами шеи и без поражения регионарного лимфатического аппарата (р=0,009).
Корреляционный анализ содержания РРМ1В в образцах показал, что в сыворотке крови больных уровень белка был связан с размером первичной опухоли (r=0,38, р≤0,05), в опухолевой ткани – с размером первичного очага (r=0,6, р≤0,05) и состоянием регионарного лимфатического аппарата (r=0,48, р≤0,05) (рис. 2). В исследуемой выборке пациентов более сильная связь была отмечена между содержанием РРМ1В в смежной морфологически нормальной ткани и наличием у больных ПРГШ метастазов в регионарные лимфоузлы (r=0,82, р≤0,05).
Обсуждение
В работе верифицированы данные проведенного ранее протеомного анализа, кроме того, показана зависимость содержания РРМ1В в сыворотке крови от распространенности первичной опухоли и тканевого уровня этого белка от размера первичного опухолевого узла и наличия лимфогенных метастазов у больных ПРГШ. Вероятно, постепенное нарастание уровня РРМ1В в сыворотке крови и тканевом материале может говорить об увеличении интенсивности процессов опухолевой трансформации и прогрессии. Полученные данные о взаимосвязи уровня РРМ1В в нормальной ткани больных ПРГШ с наличием у них метастазов говорят о формировании сложных взаимоотношений между опухолью и ее микроокружением [3, 4]. Также результаты работы свидетельствуют о возможности использования РРМ1В как дополнительного критерия для ранней диагностики ПРГШ и мониторинга групп больных хроническими воспалительными заболеваниями гортани и гортаноглотки с морфологически подтвержденной дисплазией слизистой оболочки.
Несмотря на участие РРМ1В в регуляции различных базовых клеточных процессов [5, 6], исследования роли этого белка в онкогенезе в литературе представлены крайне мало [7–9]. Так, на клеточных линиях рака мочевого пузыря показана возможность использования PPM1B в качестве одного из
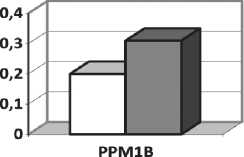
□ нормальная ткань
□ опухолевая ткань
Рис. 1. Содержание РРМ1В (нг/мл) в патологически измененной и условно нормальной ткани у больных ХГЛ и ПРГШ
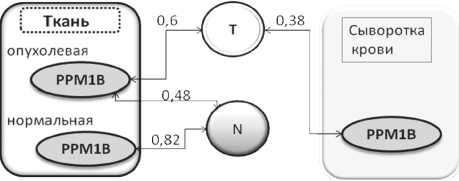
Рис. 2. Зависимость содержания РРМ1В в сыворотке крови и ткани от стадии опухолевого процесса у больных ПРГШ потенциальных диагностических маркеров при раке мочевого пузыря и возможность разработки эффективных терапевтических стратегий при лечении рака этой локализации [8]. Увеличение уровня РРМ1В у больных ПРГШ, вероятно, связано с механизмами, участвующими в «диалоге» опухоль – хозяин. Субстратами для РРМ1В, кроме ингибитора NF-κB IKKβ, могут быть AMPK, CDK2, CDK6, JNKK1, р38 и TAK1 [5] и некроптозокиназа RIP3 [10], модулируя активность которых РРМ1В может участвовать в сложных сигнальных путях опухолевого роста. Увеличение уровня РРМ1В при развитии и прогрессии ПРГШ может быть связано с активацией NF-kappaB по альтернативному пути или быть отражением запуска более сложных сигнальных каскадов, участвующих в опухолевой трансформации и росте.
Данные об увеличении содержания РРМ1В как в сыворотке крови, так и в тканевом материале имеют теоретическое значение для понимания процессов опухолевой трансформации и прогрессии и дают возможность в дальнейшем разработать новый критерий для ранней диагностики и прогноза течения ПРГШ. Кроме того, данные о положительной корреляции РРМ1В в нормальной ткани с наличием метастазов у больных ПРГШ могут дополнить имеющиеся знания о роли микроокружения опухоли в ее развитии. Для выяснения прогностической значимости уровня РРМ1В необходимы дополнительные исследования с увеличением числа больных в группах.
Список литературы Применение флуоресцентной навигации с 5-аминолевулиновой кислотой в хирургии глиобластомы: метаанализ
- Бывальцев В.А., Степанов И.А., Яруллина А.И., Белых Е.Г. Молекулярные аспекты ангиогенеза в глиобластомах. Вопросы онкологии. 2017; 63 (1): 19-27.
- Belykh E., Martirosyan N.L., Yagmurlu K., Miller E.J., Eschbacher J.M., Izadyyazdanabadi M., Bardonova L.A., Byvaltsev V.A., Nakaji P., Preul M.C. Intraoperative Fluorescence Imaging for Personalized Brain Tumor Resection: Current State and Future Directions. Front Surg. 2016 Oct 17; 3: 55.
- Golebiewska A., Bougnaud S., Stieber D., Brons N.H., Vallar L., Hertel F., Klink B., Schröck E., Bjerkvig R., Niclou S.P. Side population in human glioblastoma is non-tumorigenic and characterizes Brain endothelial cells. Brain. 2013; 136 (5): 1462-1475.
- Beier D., Schulz J.B., Beier C.P. Chemoresistance of glioblastoma cancer stem cells-much more complex than expected. Mol Cancer. 2011 Oct 11; 10: 128. DOI: 10.1186/1476-4598-10-128
- Shirai K., Chakravarti A. Towards personalized therapy for patients with glioblastoma. Expert review of anticancer therapy. 2011; 11 (12): 1935-1944.


