Применение фотодинамической терапии при злокачественных новообразованиях внепечёночных желчных протоков и большого дуоденального сосочка у неоперабельных пациентов
Автор: Странадко Е.Ф., Комаров Р.Н., Морозов С.В., Лобаков А.И., Морохотов В.А., Захаров Ю.И., Богомазов Ю.К., Рябов М.В., Шубин В.К., Флегонтов П.Б., Карпов Н.В.
Журнал: Вестник медицинского института "РЕАВИЗ": реабилитация, врач и здоровье @vestnik-reaviz
Рубрика: Клиническая медицина
Статья в выпуске: 2 т.13, 2023 года.
Бесплатный доступ
Введение. В статье представлены результаты применения фотодинамической терапии (ФДТ) рака внепечёночных желчных протоков (ВЖП) и большого дуоденального сосочка (БДС) у неоперабельных пациентов. Описаны методика её проведения и способы доставки лазерных световодов к различным отделам билиарного тракта. Определена эффективность ФДТ рака ВЖП и отдельно рака БДС. Выявлена зависимость продолжительности жизни пациентов от кратности сеансов ФДТ в течение года, а также проведён сравнительный анализ эффективности двух групп фотосенсибилизаторов (ФС).Цель исследования: оценить эффективность фотодинамической терапии (ФДТ) при лечении рака ВЖП и БДС; определить целесообразность выполнения повторных курсов ФДТ и временные интервалы между ними; сравнить эффективность фотосенсибилизаторов Фотодитазин и Фотосенс в лечении данных пациентов.Материалы и методы. Исследование основано на сравнительном анализе продолжительности жизни групп неоперабельных пациентов с раком ВЖП и БДС. Основную группу составили 29 пациентов (из них 20 пациентов с раком БДС), в лечении которых помимо желчеотводящих операций выполнялась ФДТ. Группа контроля - 50 пациентов (из них 14 с раком БДС), в лечении которых применялись только желчеотводящие вмешательства. Количество проведённых курсов ФДТ было от 1 до 3 в течение года. Всего 29 пациентам выполнено 52 курса ФДТ. Нами использовались два фотосенсибилизатора из разных групп: Фотодитазин (производное хлорина Е6) - использовался у 18 пациентов и Фотосенс (производное фталоцианина) - был использован в качестве ФС у 11 пациентов. Оценка эффективности лечения основана на определении медианы дожития по методу Каплана - Меера.Результаты. Медиана времени дожития в основной группе составила 18 месяцев [95 % ДИ: 15,9; 20,1], в группе сравнения (без ФДТ) - 7 месяцев [95 % ДИ: 5,1; 8,9]. В случае с пациентами с раком БДС медиана дожития при применении ФДТ составила 18 месяцев [95 % ДИ: 16; 20], в группе сравнения - 12 месяцев [95 % ДИ: 9,25; 14,75]. Продолжительность жизни пациентов с раком БДС составила от 1 до 60 месяцев. Медиана времени дожития при использовании Фотодитазина составила 17 месяцев [95 % ДИ: 12; 21] в случае использования Фотосенса - 18 месяцев [95 % ДИ: 16; 19]. В группе пациентов, которым выполнялся один сеанс ФДТ в течение года, медиана дожития составила 12,5 месяцев [95 % ДИ: 10; 15], в группе пациентов, которым выполнялось 2 и более сеансов, медиана дожития составила 23 месяца [95 % ДИ: 18; 28].Выводы. Фотодинамическая терапия в сочетании с дренирующими вмешательствами на желчных протоках является эффективным методом терапии неоперабельных форм рака ВЖП и БДС у пациентов высокого риска. Разработаны варианты доставки лазерного излучения для проведения ФДТ. Повторные сеансы ФДТ с интервалом в 4-6 месяцев потенцируют эффективность паллиативной терапии и увеличивают ожидаемую продолжительность жизни пациентов. Выявлена одинаковая эффективность препаратов Фотодитазин и Фотосенс при ФДТ. Фотодитазин показал меньшее число осложнений.
Рак внепеченочных желчных протоков, рак большого дуоденального сосочка, фотодинамическая терапия
Короткий адрес: https://sciup.org/143180203
IDR: 143180203 | УДК: 615.849.19:616.361-089 | DOI: 10.20340/vmi-rvz.2023.2.CLIN.10
Текст научной статьи Применение фотодинамической терапии при злокачественных новообразованиях внепечёночных желчных протоков и большого дуоденального сосочка у неоперабельных пациентов
Competing interests. The authors declare no competing interests.
Funding. This research received no external funding.
Compliance with ethical principles. The authors confirm that they respect the rights of the people participated in the study, including obtaining informed consent when it is necessary.
Cite as: Stranadko E.F., Komarov R.N., Morozov S.V., Lobakov A.I., Morokhotov V.A., Zakharov Yu.I., Bogomazov Yu.K., Ryabov M.V., Shubin V.K., Flegontov P.B., Karpov N.V. Photodynamic therapy use for malignant neoplasms of extrahepatic bile ducts and major duodenal papilla in inoperable patients. Bulletin of the Medical Institute “REAVIZ”. Rehabilitation, Doctor and Health. 2023;13(2):88–98.
Актуальность
Лечение пациентов с онкологическими заболеваниями внепечёночных желчных протоков (ВЖП) и большого дуоденального сосочка (БДС) является одной из нерешенных проблем хирургии XXI века. Анатомические особенности расположения подобных опухолей определяют механическую желтуху как первоначальное проявление клинических симптомов. Период бессимптомного течения является основной причиной позднего обращения пациента к врачу. К моменту манифестации желтухи, новообразование зачастую поражает структуры печеночно-двенадцатиперстной связки, что, само по себе, снижает возможность радикального хирургического пособия до 50 %. Резектабельность злокачественных новообразований проксимальных отделов ВЖП составляет около 30 % [1, 9, 14, 18], дистальных отделов при раке БДС – около 18–55 % [3, 5, 8]. Хирургические методы лечения новообразований БДС и ВЖП сопряжены с высоким риском интраоперационной травмы, что приводит к высокому числу случаев осложнений в послеоперационном периоде (10–55 %), а также к большой смертности 4–38 % [1, 5].
При анализе отдалённых результатов хирургического лечения рака ВЖП и БДС наблюдается высокая летальность, которая обоснована высокой скоростью прогрес- сии онкологического заболевания. Из пациентов, подвергшихся радикальному хирургическому лечению, только 20–30 % демонстрируют уровень выжимаемости более 5-ти лет [1, 5, 7, 12, 14, 16]. Данный факт выступает ограничением выполнения радикальных операций, что зачастую усугубляется тяжёлой сопутствующей патологией, ассоциированной с лицами пожилого возраста [6].
В связи с этим, основная лечебная стратегия на первом этапе сфокусирована на купировании механической желтухи, как непосредственно угрожающего жизни осложнения. На современном этапе предпочтение отдаётся малоинвазивным чрескожно-, чреспечёночным и эндоскопическим способам наружного, наружно-внутреннего или внутреннего дренирования желчных протоков.
После выполнения дренирующих вмешательств на желчных протоках и нормализации показателей билирубина крови пациенты, в большинстве случаев, не получают специфической противоопухолевой терапии, что служит причиной такого мало периода со времени установки диагноза до наступления летального исхода. Данные статистики демонстрируют, что средняя продолжительность жизни с момента верификации онкологического диагноза составляет в среднем один год [8, 10, 15].
Данная когорта пациентов требует комплексного подхода в терапии описанного онкопроцесса, в связи с чем в последнее время начата разработка и успешное внедрение в практическую деятельность различных методик локального и/или системного воздействия: дистанционная лучевая терапия, радиочастотная и микроволновая абляция, селективная радиоэмболизация, химиотреапия.
Учитывая неудовлетворительные результаты химиотерапии в лечении представленных опухолей, в последние годы активно разрабатываются и вводятся в клиническую практику методы локального воздействия на злокачественное новообразование, системные эффекты которых минимальны. Одним из перспективных направлений паллиативного локального воздействия на опухолевые клетки является фотодинамическая терапия.
Фотодинамическая терапия – это метод лечения, основанный на избирательном накоплении лекарственного препарата, называемого фотосенсибилизатором (ФС), тканями опухоли с последующим его инициированием пучком лазера с установленной длиной волны. Вследствие потенцирования фотохимических реакций и высвобождения активных форм кислорода запускается апоптоз мутировавших клеток с разрешением некротического процесса в образование соединительной ткани.
Первопроходцем в данной области по праву считается профессор McCaughan, который к 1991 г. описал случай применения ФДТ при неоперабельном раке общего желчного протока (ОЖП) и последующее 4-летнее наблюдение за пациенткой. Суммарно испытуемая перенесла 7 сеансов ФДТ [20]. Схожий положительный эффект воздействия ФДТ у неоперабельных пациентов при раке ВЖП и БДС демонстрировало большое число авторов. Сочетанное примене- ние ФДТ и дренирующих вмешательств показывают выживаемость в течение первого года в 77–84 % наблюдений. В ряде случаев выживаемость достигала трёх лет [13, 17, 19].
Материалы и методы исследования
Данное исследование представляет собой сравнительный анализ групп пациентов с раком ВЖП, имеющих абсолютные или относительные противопоказания для радикального хирургического лечения. Контрольная группа представлена пациентами, которым выполнялись только дренирующие вмешательства на желчных протоках: 14 лиц мужского пола и 36 лиц женского пола (средний возраст составил 64,2 ± 8,45 года). Основная группа представлена 29 пациентами, среди которых 10 лиц мужского пола и 19 женского пола (средний возраст составил 65,6 ± 8,81 года). В комбинированном лечении пациентов основной группы после эффективного дренирования желчных протоков применялась ФДТ.
В соответствии с основной целью исследования были определены четыре задачи:
-
1. Для оценки эффективности ФДТ рака ВЖП проведён сравнительный анализ продолжительности жизни пациентов основной группы и группы контроля (табл. 1). Пациенты сравнимы по полу, возрасту, стадии процесса, гистологической дифференцировки опухоли и локализации (p > 0,05).
-
2. Оценить эффективность ФДТ в лечении пациентов с раком БДС. Для этого был проведён сравнительный анализ продолжительности жизни двух групп пациентов: основной (20 пациентов), которым было отказано в выполнении радикальной операции и выполнялась ФДТ, и контрольной группы (14 пациентов), которым выполнялись только желчеотводящие вмешательства (табл. 2).
-
3. Оценить эффективность ФДТ в зависимости от частоты манипуляций за 1 год. 14 пациентов перенесли два и более сеансов ФДТ, 15 пациентов перенесли один сеанс ФДТ в течение одного года (табл. 3).
-
4. Провести сравнительный анализ эффективности двух используемых нами ФС: Фотодитазина и Фотосенса. Были сформированы две группы пациентов. В первую вошли 18 (60,7 %) человек, у которых в качестве ФС применялся Фотодитазин, во вторую – 11 (39,3 %) пациентов, в лечении которых применяли Фотосенс (табл. 4).
Таблица 1. Клиническая характеристика пациентов по группам сравнения Table 1. Clinical characteristics of patients in comparison groups
|
Параметр |
Основная группа – выполнялась ФДТ |
Контрольная группа – ФДТ не выполнялась |
P |
|
|
Возраст |
65,6 ± 8,81 года |
64,2 ± 8,45 года |
P = 0,504 |
|
|
Пол |
Мужчины |
10 |
14 |
P = 0,546 |
|
Женщины |
19 |
36 |
||
|
N |
29 |
50 |
||
|
Стадия |
I |
4 |
1 |
P = 0,064 |
|
II |
11 |
16 |
||
|
III |
8 |
11 |
||
|
IV |
6 |
22 |
||
|
N |
29 |
50 |
||
|
Дифференцировка |
Высокодифференцированная |
10 |
21 |
P = 0,733 |
|
Умереннодифференцированная |
4 |
23 |
||
|
Низкодифференцированная |
5 |
6 |
||
|
N |
29 |
15 |
||
|
Локализация |
БДС |
20 |
14 |
P = 0,001 |
|
Холедох |
3 |
9 |
||
|
Ворота печени |
2 |
21 |
||
|
Желчный пузырь |
4 |
6 |
||
|
N |
29 |
50 |
||
Таблица 2. Клиническая характеристика пациентов с раком БДС
Table 2. Clinical characteristics of patients with IBD cancer
|
Параметр |
Основная группа – выполнялась ФДТ |
Контрольная группа – ФДТ не выполнялась |
P |
|
|
Возраст |
67,8 ± 7,2 года |
64,8 ± 10,3 года |
P = 0,418 |
|
|
Пол |
Мужчины |
7 |
5 |
P = 0,996 |
|
Женщины |
13 |
9 |
||
|
N |
20 |
14 |
||
|
Стадии |
I |
4 |
1 |
P = 0,257 |
|
II |
9 |
6 |
||
|
III |
5 |
2 |
||
|
IV |
2 |
5 |
||
|
N |
20 |
14 |
||
|
Дифференцировка |
Высокодифференцированная |
8 |
6 |
P = 0,955 |
|
Умереннодифференцированная |
10 |
7 |
||
|
Низкодифференцированна |
2 |
1 |
||
|
N |
20 |
14 |
||
Примечание. Пациенты сравнимы по полу, возрасту, стадии процесса и гистологической дифференцировки опухоли (p > 0,05).
Таблица 3. Клиническая характеристика пациентов двух групп в зависимости от частоты перенесённых ФДТ в течение 1 года
Table 3. Clinical characteristics of the two groups of patients according to the frequency of PDT performed within 1 year
|
Параметр |
Два и более сеансов ФДТ в течение года |
Один сеанс ФДТ в течение года |
P |
|
|
Возраст |
64,8 ± 9,25 года |
66,4 ± 8,5 года |
P = 0,628 |
|
|
Пол |
Мужчины |
5 |
5 |
P = 0,893 |
|
Женщины |
9 |
10 |
||
|
N |
14 |
15 |
||
|
Стадии |
I |
2 |
1 |
P = 0,527 |
|
II |
5 |
6 |
||
|
III |
3 |
5 |
||
|
IV |
4 |
3 |
||
|
N |
14 |
15 |
||
|
Дифференцировка |
Высокодифференцированная |
5 |
5 |
P = 0,2 |
|
Умереннодифференцированная |
9 |
7 |
||
|
Низкодифференцированна |
0 |
3 |
||
|
N |
14 |
15 |
||
|
Локализация |
БДС |
10 |
10 |
P = 0,347 |
|
Холедох |
1 |
2 |
||
|
Ворота печени |
2 |
0 |
||
|
Желчный пузырь |
1 |
3 |
||
|
N |
14 |
15 |
||
Примечание. Пациенты сравнимы по полу, возрасту, стадии процесса и гистологической дифференцировки опухоли и ее локализации (p > 0,05).
Таблица 4. Клиническая характеристика двух групп пациентов в зависимости от использованных в процессе лечения фотосенсибилизаторов
Table 4. Clinical characteristics of the two groups of patients according to the photosensitizers used during treatment
|
Параметр |
Фотодитазин |
Фотосенс |
P |
|
|
Возраст |
64,5 ± 9,7 года |
67,3 ± 7,2 года |
P = 0,46 |
|
|
Пол |
Мужчины |
4 |
6 |
P = 0,114 |
|
Женщины |
14 |
5 |
||
|
N |
18 |
11 |
||
|
Стадии |
I |
2 |
2 |
P = 0,645 |
|
II |
6 |
5 |
||
|
III |
5 |
3 |
||
|
IV |
5 |
1 |
||
|
N |
18 |
11 |
||
|
Дифференцировка |
Высокодифференцированная |
4 |
6 |
P = 0,199 |
|
Умереннодифференцированная |
12 |
4 |
||
|
Низкодифференцированна |
2 |
1 |
||
|
N |
18 |
11 |
||
|
Локализация |
БДС |
11 |
9 |
P = 0,162 |
|
Холедох |
1 |
2 |
||
|
Ворота печени |
2 |
0 |
||
|
Желчный пузырь |
4 |
0 |
||
|
N |
18 |
11 |
||
Таким образом оцениваемые группы были сравнимы по полу, возрасту, гистологической дифференцировки локализации и стадиям заболевания (p > 0,05).
Статистическая обработка результатов
В качестве основного критерия эффективности проводилось сравнение медианы продолжительности жизни пациентов различных групп. Оценка выживаемости проводилась по методу Каплана – Майера. Достоверность различий в исследуемых группах оценивалась с помощью Log rank критериев (отдаленный период) и критериев Breslow
(ближайший период). Для медианы времени дожития вычисляли 95 % доверительный интервал (ДИ).
Методика фотодинамической терапии опухолей ВЖП и БДС
В качестве ФС использовались препараты двух групп: Фотосенс производства ФГУП «ГНЦ РФ «НИОПИК» (Россия) и Фотодитазин – относится к группе производных вещества Хлорина Е6, производимого ООО «ВЕТА-ГРАНД» (табл. 5).
Таблица 5. Основные сравнительные характеристики используемых фотосенсибилизаторов
Table 5. The main comparative characteristics of the photosensitizers used
|
Фотосенсибилизатор |
Время достижения максимальной концентрации ФС в опухоли |
Время выведения ФС из организма |
Коэффициент контрастности (соотношение концентрации ФС в здоровых тканях и тканях опухоли) |
|
Фотосенс |
24–48 часов |
6–8 недель |
1,5–1,8 |
|
Фотодитазин |
1,5–2,5 часа |
24–28 часов |
3–24 |
В качестве источников лазерного излучения применяли диодный лазер с набором различных диффузоров «Латус 2.662.4», производимый ООО «Аткус» Россия Санкт-Петербург, с длиной волны 662 нм.
Сеанс ФДТ проводился через временной промежуток, когда достигается максимальное накопление препарата в опухоли, индивидуальный для каждого препарата и указанный производителем ФС.
При применении фотодинамической терапии с Фотосенсом лазерное облучение проводилось через 24 часа от момента введения препарата, при применении препарата Фотодитазин – в интервале 2,5–3,5 часа от времени внутривенного введения препарата.
Тип контроля (эндоскопический или рентгентелевизи-онный) сеанса ФДТ определялся топографией опухоли, наличием желчного свища, а также видом применяемого световода.
Предварительно рассчитывалось время облучения в зависимости от используемого световода (тип излучающего диффузора, процент потерь мощности на выходе и необходимой плотности световой энергии, подведённой к опухоли).
Методики лазерного облучения
С использованием эндоскопических технологий:
-
1) внутрипросветное эндоскопическое облучение терминального отдела общего желчного протока (ОЖП) и БДС световодом с цилиндрическим диффузором длиной 2–4 см, введённым через устье БДС или папиллосфинктеротомическое отверстие;
-
2) эндоскопическое поверхностное облучение опухоли БДС со стороны просвета двенадцатиперстной кишки (ДПК) световодом с торцевым диффузором;
-
3) парастентальное облучение опухоли световодом с цилиндрическим диффузором параллельно ранее установленному стенту для декомпрессии биллиарного тракта.
При эндоскопическом внутрипросветном способе облучения используется световод с цилиндрическим диффузором переменной длинны, при этом значение длины зависит от протяженности опухоли. Световод, несущий лазреное излучение, проводится через биопсийный канал эндоскопа, затем, под контролем глаза сквозь устье БДС или папиллосфинктеротомическое отверстие, в просвет холедоха (рис. 1, А).
При поверхностном варианте облучения используется световод с торцевым излучателем. Он аналогично проводится через биопсийный канал, после чего проводится облучение опухоли БДС (рис. 1, Б).
В двух случаях выполнялось парастентальное эндоскопическое облучение световодом с цилиндрическим диффузором (рис. 1).
При наличии ранее сформированного желчного свища используется внутрипросветное чресфистульное облучение световодом, имеющим циллиндрический диффузор длиной 2–5 см и рентгенокрастнные метки. Такой вариант фотодинамической терапии применяется с целью декомпрессии внепеченочных желчевыводящих путей (рис. 2).
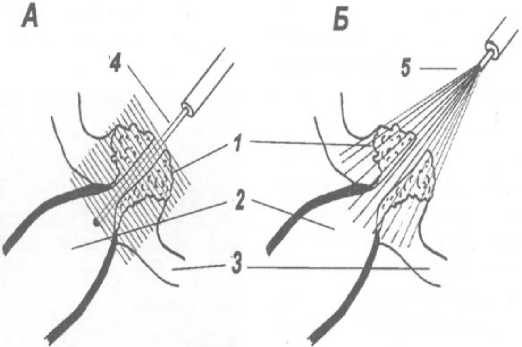
Рисунок 1. Схема вариантов облучения при раке БДС: А – эндоскопический; Б – поверхностный. Обозначения: 1 – опухоль большого луоденального сосочка; 2 – расширенный просвет общего желчного протока; 3 – стенка двенадцатиперстной кишки; 4 – световод с цилиндрическим диффузором; 5 – световод с плоским торцом
Figure 1. Scheme of the variants of irradiation at IBD cancer: А – endoscopic; B – superficial. Markings: 1 – tumor of the large bile duct; 2 – dilated lumen of the common bile duct; 3 – duodenal wall; 4 – fiber optic with a cylindrical diffuser; 5 – fiber optic with a flat end
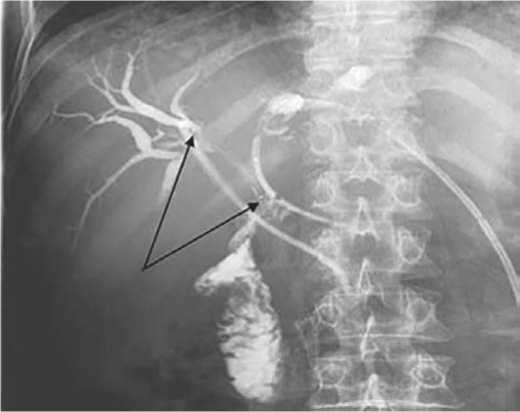
Рисунок 2. Вариант чресфистульного облучения у пациентки с раком ворот печени Bismuth-IV, после раздельного транспечёночного дренирования. Рентгенконтрастные метки по границам цилиндрического диффузора указанны стрелками)
Figure 2. A variant of peristrosternal irradiation in a patient with Bis-muth-IV liver portal cancer, after separate transhepatic drainage. X-ray contrast marks along the borders of the cylindrical diffuser are indicated by arrows
Комбинированные доступы
Примером одномоментного применения как чресфи-стульного, так и эндоскопического доступа, может служить ФДТ рака БДС при наличии желчной фистулы (чресфистульное облучение световодом с цилиндрическим диффузором и эндоскопическое облучение со стороны просвета ДПК световодом с цилиндрическим диффузором).
Имеет место также сочетание эндоскопического внутрипросветного способа с применением цилиндрического диффузора и эндоскопического поверхностного облучения световодом с торцевым диффузором.
В случае чресфистульного облучения проводилась фи-стулография. При данном исследовании оценивалась адекватность позиции дренажа и протяжённость опухолевой стриктуры. Следующим шагом через просвет дренажа проводился световод с цилиндрическим диффузором и рентгенконтрастными метками. Излучающая поверхность световода при этом устанавливаелась вдоль опухолевой стриктуры таким путем, что рентгенконтрастные метки закрывали собой данную стриктуру на 0,5–1 см от её проксимальной и дистальной границ. Затем, после расположения световода в адекватной позиции, дренаж извлекался с целью избежания частичного поглощения стенками последнего доли лазерного излучения. Далее проводился сеанс фотодинамической терапи. По окончании процедуры световод извлекаелся, а по ходу свищевого канала заново устанавливалася дренажная трубка по рентгено-контрасной струне с использованием методики Сельдин-гера. Далее проводился рентгенконтроль позиции дренажа.
Визуальные изменения, наблюдаемые в опухоли, наиболее отчётливо видны при лечении рака БДС при эндоскопическом способе облучения.
Через несколько минут от начала сеанса отмечались отёчность и изменение цвета опухолевой ткани на багрово-синюшный. При этом окружающие здоровые ткани слизистой ДПК цвет не меняли (рис. 3–5).
При гистологическом исследовании через 5 суток после сеанса ФДТ по поводу аденокарциномы БДС (рис. 6) определяется некроз опухолевой ткани и фибринозногнойные наложения (рис. 7).
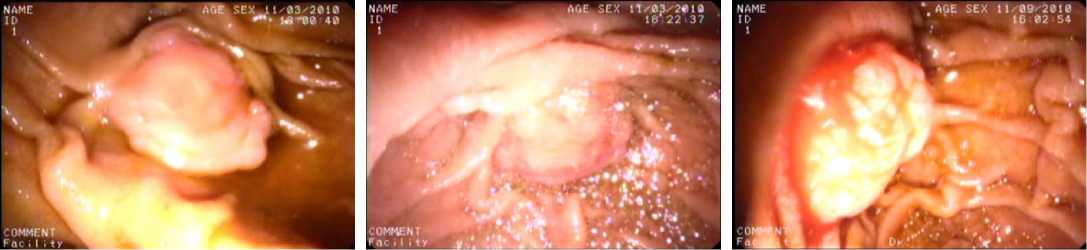
Рисунок 3. Вид БДС до сеанса ФДТ
Figure 3. View of OBD before PDT session
Рисунок 4. Вид БДС непосредственно после сеанса ФДТ. Определяется изменение окраски на цианотично-багровую с петехиальными кровоизлияниями
-
Figure 4. The view of OBD right after PDT session. Color change on cyanotic-black with petechial hemorrhages is defined
Рисунок 5. Вид БДС через 5 суток после ФДТ. Участки некроза, покрытые фибринозными наложениями
-
Figure 5. Type of BD 5 days after PDT. Areas of necrosis covered with fibrinous deposits
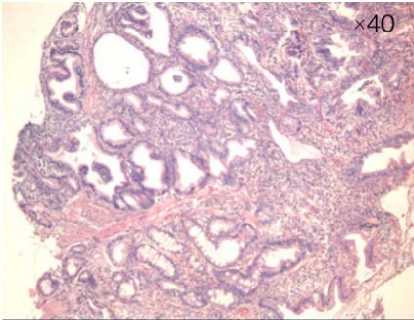
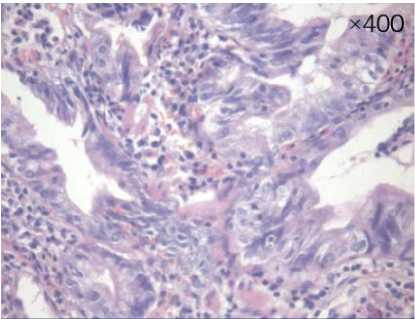
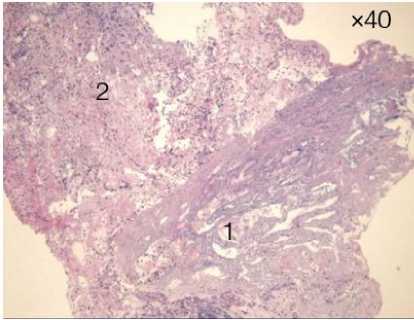
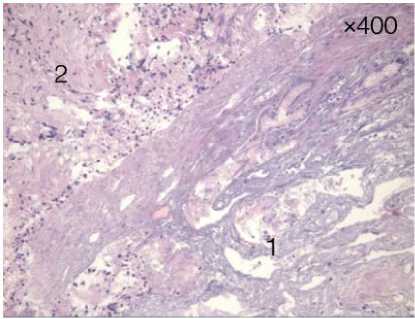
Рисунок 7. Биоптаты слизистой БДС через 5 суток после ФДТ: некроз опухолевой ткани (1) и фибринозно-гнойные наложения (2).
Окраска гематоксилин-эозином, увеличение х 40, х 400
Figure 7. Biopsy specimens of the mucosa of IBD 5 days after PDT: necrosis of tumor tissue (1) and fibrinous-purulent deposits (2).
Hematoxylin-eosin staining, magnification х 40, х 400
Рисунок 6. Биоптаты слизистой БДС до ФДТ: комплексы высокодифференцированной аденокарциномы пред выполнием сеанса ФДТ. Окраска гематоксилин-эозином, увеличение х 40, х 400
Figure 6. Biopsy specimens of CDB mucosa before PDT: complexes of highly differentiated adenocarcinoma before PDT session. Hematoxylin-eosin staining, magnification х 40, х 400
Результаты исследования и их обсуждение
Оценка эффективности ФДТ в лечении неоперабельного рака ВЖП и БДС. С этой целью проведено сравнение продолжительности жизни пациентов, в лечении которых применялась ФДТ (29 человек), и пациентов, в лечении которых применялись только желчеотводящие вмешательства (50 человек). Эти группы были сравнимы по полу, возрасту, локализации опухоли, гистологической дифференцировки и стадии заболевания. В группе, где применялась ФДТ, медиана дожития составила 18 месяцев [95 % ДИ: 15,9; 20,1]. В группе без ФДТ 7 месяцев [95 %ДИ: 5,1; 8,9]. Различия между группами были статистически значимы (log rank и Breslow р < 0,0001) (рис. 8).
Анализ эффективности ФДТ пациентов раком БДС.
В группе пациентов с раком БДС (20 человек), где проводилась ФДТ, медиана времени дожития составила 18 месяцев [95 % ДИ: 16; 20]; в группе, где выполнялись лишь паллиативные желчеотводящие операции (15 пациентов с раком БДС), – 12 месяцев [95 % ДИ: 9,25; 14,75]. Продолжительность жизни пациентов с раком БДС с применение ФДТ составила от 1 до 60 месяцев. Различия между группами были статистически значимы (log rank р < 0,0001, Breslow = 0,001) (рис. 9). Статистический анализ лечения пациентов раком желчного пузыря, общего желчного и общего печёночного протоков не проводился ввиду небольшого количества пациентов. При этом у некоторых больных раком Клацкина, желчного пузыря, дистального отдела общего желчного протока удалось получить практически 2-летнюю выживаемость (табл. 6).
Оценка эффективности ФДТ в зависимости от кратности курсов ФДТ. Количество сеансов варьировало от 1 до 3-х в течение года, что связано как с отсутствием признаков продолжающегося роста опухоли, так и с несоблюдением некоторыми пациентами рекомендаций (не являлись на контрольный осмотр). Эффективность применения ФДТ в зависимости от количества сеансов в течение года также определялась по времени дожития по методу Каплана – Меера (рис. 12). В группе пациентов, которым выполнялись курсы ФДТ не более 1 раза в год медиана дожития составила 12,5 месяцев [95 % ДИ: 10; 15]. В группе, где курсы ФДТ выполнялись регулярно с частотой 2 и более в год, продолжительность жизни составила 23 месяца [95 % ДИ: 18; 28]. Различия между группами были статистически значимы (log rank p = 0,002, Breslow р = 0,002).
Из этого можно сделать заключение, что регулярно проводимые сеансы ФДТ увеличивают продолжительность жизни пациентов.
Анализ эффективности ФДТ в зависимости от используемого ФС. В данном разделе проведена оценка эффективности используемых нами ФС: Фотодитазина и Фотосенса. Результаты также оценивались на основании медианы дожития, рассчитанной по методу Каплана – Меера
(рис. 13). Медиана времени дожития при использовании Фо-тодитазина составила 17 месяцев [95 % ДИ: 12; 21]; в случае использования Фотосенса – 18 месяцев [95 % ДИ: 16; 19]. Различия между группами были статистически незначимы (log rank р = 0,845, Breslow р = 0,911). Следовательно, препараты обеих групп сопоставимы по эффективности. Обобщённые результаты применения ФДТ по критерию продолжительности жизни приведены в таблице 7.
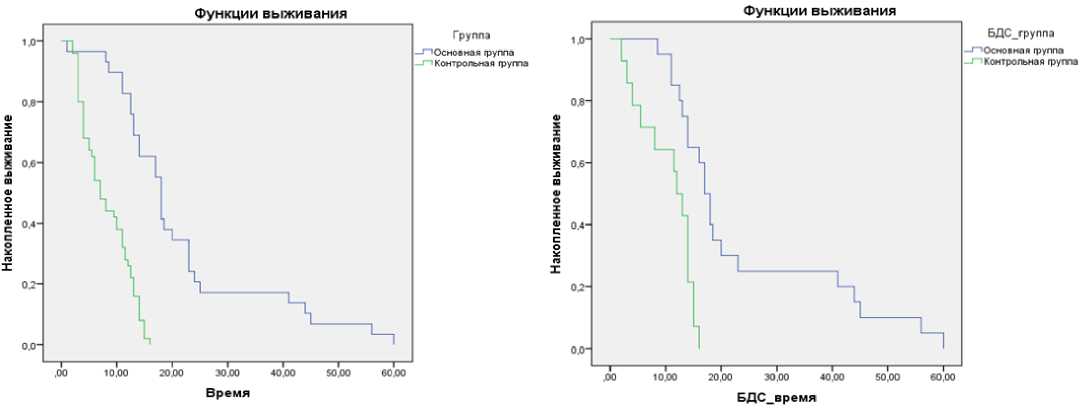
Рисунок 9. Сравнительная выживаемость пациентов с раком БДС с применением ФДТ (основная группа) и без применения ФДТ (контрольная группа)
Figure 9. Comparative survival of patients with IBD cancer with PDT (main group) and without PDT (control group)
Рисунок 8. Медиана дожития при применении ФДТ у пациентов с раком ВЖП и БДС по методу Каплана – Меера
Figure 8. Kaplan-Meier median survival for PDT in patients with VVL and IBD cancer
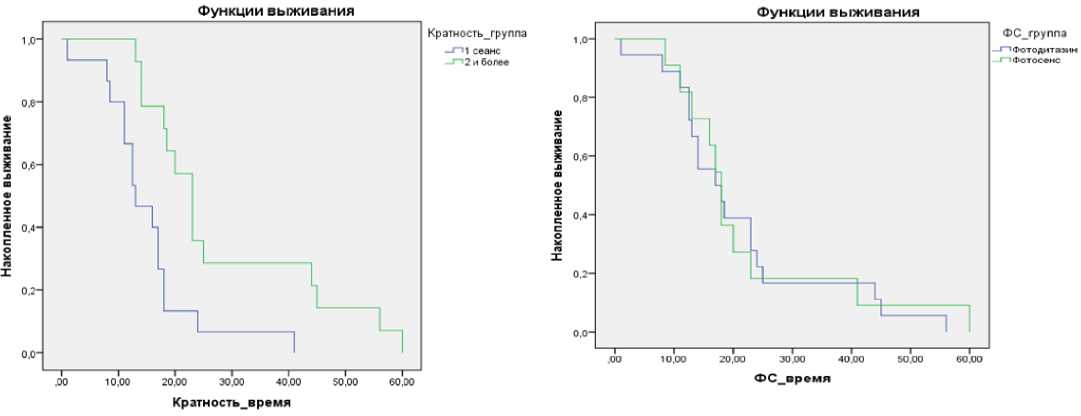
Рисунок 10. Медиана дожития пациентов в зависимости от количества курсов ФДТ в течение года по методу Каплана – Меера Figure 10. Median survival of patients depending on the number of PDT courses during the year by Kaplan-Meer method
Рисунок 11. Медиана дожития пациентов в зависимости от используемого ФС по методу Каплана – Меера
Figure 11. Median survival of patients according to the Kaplan-Meier method of PDT used
Таблица 6. Продолжительность жизни больных раком желчного пузыря, ОЖП, ворот печени Table 6. Lifespan of gall bladder, LC, liver gate cancer patients
|
Локализация |
Кол-во пациентов |
Время наблюдения (месяцы) |
|
Рак желчного пузыря |
4 |
8–25 (17,4) |
|
Рак ОЖП |
3 |
1–23 (14) |
|
Рак Клацкина |
2 |
13–23 (18) |
Таблица 7. Эффективность применения ФДТ в лечении неоперабельного рака внепечёночных желчных протоков и БДС Table 7. Effectiveness of PDT in treatment of inoperable cancer of extrahepatic bile ducts and BVD
|
Эффективность ФДТ при раке ВЖП и БДС |
Основная группа |
18 месяцев |
P < 0,0001 |
|
Группа сравнения |
7 месяцев |
||
|
Эффективность ФДТ при раке БДС |
Основная группа |
18 месяцев |
P < 0,0001 |
|
Группа сравнения |
12 месяцев |
||
|
Эффективность ФДТ в зависимости от кратности сеансов в течение года |
1 сеанс в течение года |
12,5 месяцев |
P = 0,002 |
|
2 и более сеансов в течение года |
23 месяца |
||
|
Эффективность ФДТ в зависимости от используемого ФС |
Фотодитазин |
17 месяцев |
P = 0,845 |
|
Фотосенс |
18 месяцев |
Осложнения и нежелательные эффекты
Рассматривая возникшие в процессе ФДТ реакции организма, следует разделить их на осложнения, побочные и нежелательные эффекты.
Температурную реакцию выше 37 °С, наблюдавшуюся у 25 (89,3 %) пациентов в послеоперационном периоде, следует рассматривать как естественную реакцию организма на воспалительный процесс вследствие фотохимической реакции в тканях опухоли. Данная реакции характерна для ФДТ опухолей любых локализаций и является косвенным подтверждением положительного эффекта данной процедуры.
Боль, манифестирующая к 3–5 часу по окончании сеанса ФДТ, следует отнести к побочным эффектам ФДТ и естественным ответом организма на появление локального воспаления.
Ряд осложнений, отмеченных при ФДТ, были разделены на специфические (причиной которых послужил сеанс ФДТ) и неспецифические (осложнения, регистрируемые при прочих лечебно-диагностических мероприятиях).
Процедура ФДТ переносится пациентами вполне удовлетворительно, однако нежелательные эффекты проявились в 21,1 % случаев (11 сеансов из 53). Максимальное число вышеуказанных явлений отмечалось при эндоскопическом лазерном облучении при раке БДС. Летальные исходы при проведении процедуры и в раннем послеоперационном периоде не зарегистрированы в исследуемых случаях (табл. 8, рис. 12).
Cстатистически значимых различий при анализе нежелательных явлений в исследуемых когортах не зарегистрировано (р = 0,184), однако на представленных диаграммах можно проследить явную зависимость возникновения осложнений от применяемого фотосенсибилизатора.
Таблица 8. Характер оcложнений c учётом иcпользованного ФС Table 8. Character of complications taking into account the used PDT
|
Характер оcложнения |
Фотоcенc |
Фотодита-зин |
Вcего |
|
Панкреатит |
1 |
– |
1 |
|
Холангит |
1 |
4 |
5 |
|
Фибринозно-язвенный дуоденит |
3 |
– |
3 |
|
Фибринозно-язвенный дуоденит c явлениями cтеноза ДПК |
1 |
– |
1 |
|
Фотодерматит |
1 |
1 |
|
|
Вcего (%) |
7 (63,6 %) |
4 (36,4 %) |
11 (100 %) |
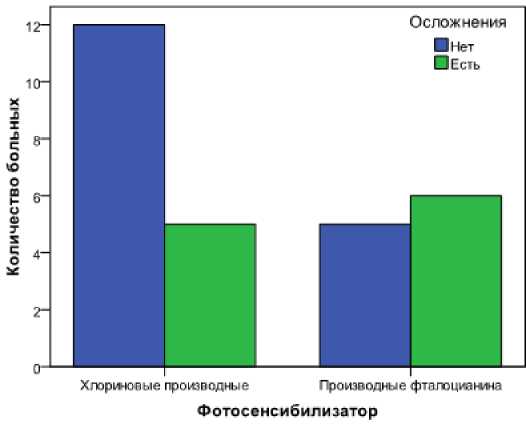
Рисунок 12. Количество осложнений в зависимости от применяемого ФС
Figure 12. Number of complications depending on the FS used
Количество осложнений было больше в случае применения Фотосенса. Кроме того, наиболее тяжёлые осложнения в виде некротически-язвенного дуоденита, с развитием воспалительного стеноза ДПК также наблюдались в случае применения Фотосенса.
Обсуждение
У большинства пациентов с раком ВЖП и БДС к моменту установления диагноза провести радикальное оперативное вмешательство невозможно в связи с распространённостью опухолевого процесса или тяжестью соматической патологии. Способы паллиативного лечения (химиотерапия, лучевая терапия) при данной локализации опухоли малоэффективны и сопровождаются тяжёлыми побочными и системными осложнениями.
30-летний опыт применения ФДТ в терапии нерезекта-бельных злокачественных новообразований ОЖП позволяет судить об эффективности данного метода. Разработанные варианты доставки лазерного излучения к различным отделам ВЖП обеспечивают адекватное облучение тканей опухоли. Варианты доставки лазерного излучения
(эндоскопические, чресфистульные или комбинированные) определяются клинической картиной (топография ЗНО, наличие желчного свища).
Увеличение продолжительности жизни пациентов неоперабельным раком ВЖП и БДС обусловлено снижением темпов роста опухоли вследствие местного воздействия ФДТ. Условием увеличения продолжительности жизни пациентов является выполнение программируемых, повторных сеансов ФДТ не реже чем через 4–6 месяцев.
Вывoды
Список литературы Применение фотодинамической терапии при злокачественных новообразованиях внепечёночных желчных протоков и большого дуоденального сосочка у неоперабельных пациентов
- Вишневский В.А., Тарасюк Т.И. Диагностика и хирургическое лечение рака проксимальных печеночных протоков (опухолей Клат-скина). Практическая онкология. 2004;9(2):65-74. [Vishnevsky V.A., Tarasyuk T.I. Diagnosis and surgical treatment of proximal hepatic ductal cancer (Klatskin tumors). Practical Oncology. 2004;9(2):65-74. (In Russ.)]
- Макаров Е.С., Нечушкин М.И., Долгушин Б.И., Файнштейн И.А. Внутрипросветная лучевая терапия местнораспро-страненного рака внепеченочных желчных протоков. Анналы хирургической гепатологии. 2006; 11(1 ):45-53. [Makarov Ye.S., Nechushkin M.I., Dolgushin B.I., Feinstein I.A. Intraluminal radiotherapy of locally advanced cancer of extrahepatic bile ducts. Annals of surgical hepatology. 2006;11(1):45-53. (In Russ.)]
- Малярчук В.И., Климов А.Е., Пауткин Ю.Ф. Билиопанкреато-дуоденальный рак. М.: Изд. Российского университета дружбы народов, 2006. 448 с. [Malyarchuk V.I., Klimov A.E., Pautkin Y.F. Biliopancreaticoduodenal cancer. Moscow: Ed of the Peoples' Friendship University of Russia, 2006. 448 p. (In Russ.)]
- Масляков В.В., Павлова О.Н., Пронина Е.А., Султонов Ф.П., Бурекешев А.Е. Динамика состояния микрофлоры у пациентов с острым бактериальным простатитом при воздействии комбинированной терапии. Вестник медицинского института «РЕАВИЗ». Реабилитация, Врач и Здоровье. 2022;12(3):60-67. https://doi.org/10.20340/vmi-rvz.2022.3.CLIN.2 [Masljakov V.V., Pavlova O.N., Pronina E.A., Sultonov F.P., Burekeshev A.E. Dynamics of microflora condition in patients with acute bacterial prostatitis exposed to combination therapy. Bulletin of the Medical Institute "REAVIZ" (Rehabilitation, Doctor And Health). 2022;12(3):60-67. (In Russ.) https://doi.org/10.20340/vmi-rvz.2022.3.CLIN.2]
- Патютко Ю.И., Котельников А.Г. Хирургия рака органов билиопанкреатодуоденальной зоны. М.: Медицина, 2007. 448 с. [Patchutko Y.I., Kotelnikov A.G. Surgery of biliopancreaticoduodenal cancer. Moscow: Medicine, 2007. 448 p. (In Russ.)]
- Руководство по хирургии печени и желчевыводящих путей. Под ред. проф. А.Е. Борисова. СПб.: Предприятие ЭФА, 2002. 448 с. [Guidelines for surgery of the liver and biliary tracts. Ed. by prof. A.E. Borisov. SPb.: EFA Enterprise, 2002. 448 p. (In Russ.)]
- Скипенко О.Г., Шатверян Г.А., Мовчун А.А. и др. Панкреатодуоденальная резекция в лечении рака головки поджелудочной железы и периампулярной зоны. Анналы хирургической гепатологии. 2002;7(1):32-36. [Skipenko O.G., Shatverian G.A., Movchun A.A. et al. Pancreatoduodenal resection in the treatment of cancer of the pancreatic head and periampullary zone. Annals of Surgical Hepatology. 2002;7(1):32-36. (In Russ.)]
- Харченко В.П., Лютфалиев Т.А., Харченко Н.В. и др. Комбинированное и лучевое лечение рака большого дуоденального соска. Вест. Росс. НЦРР Минздрава России. 2009;1(9):19-27. [Kharchenko V.P., Lutfaliev T.A., Kharchenko N.V. et al. Combined and radiotherapy of cancer of the large duodenal nipple. Vest. Ross. NCDC of Ministry of Public Health of Russia. 2009;1(9):19-27. (In Russ.)]
- Шерлок Ш., Дулли Дж. Заболевания печени и желчных путей. М.: ГЕОТАР Медицина, 1999. 864 с. [Sherlock S, Dully J. Diseases of the liver and biliary tract. Moscow: GEOTAR Medicine, 1999. 864 p. (In Russ.)]
- Kala Z., Weber P., Hemmelova B. et al. Ampullary tumours (ampullomas) in the elderly - an interdisciplinary problem. Indian J.Med. Res. 2010;131:418-421.
- Marta Bonet Beltran, Arnaud D. Roth, Gilles Mentha and Abdelkarim S. Allal. Adjuvant Radio-chemotherapy for extrahepatic biliary tract cancers. BMC Cancer. 2011; 11:267-273.
- Nimura Y., Kamiya J., Kondo S. et al. Aggressive preoperative management and extended surgery for hilar cholangiocarcinoma: Nagoya experience. J. Hepatobil Pancreat Surg. 2000;7:155-162.
- Ortner M.E., Caca K., Berr F. et al. Successful photodynamic therapy for nonresectable cholangiocarcinoma: a randomized prospective study. Gastroenterology. 2003;5:1355-1363.
- Sander Dinant, Michael F. Gerhards, Rauws E.A.J. et al. Improved Outcome of Resection of Hilar Cholangiocarcinoma (Klatskin Tumor). Ann. Surg. Oncol. 2006;6:872-880.
- Slattery J.M., Sahani D.V. What is the current state of the art imaging for detection and staging of cholangiocarcinoma? The Oncologist. 2006;8:913-922.
- Soonmo Peter Kang, Muhammad Wasif Saif. Ampullary and Periampullary Tumors: Translational Efforts to Meet a Challenge in Diagnosis and Treatment Highlights from the «2011 ASCO Gastrointestinal Cancers Symposium». San Francisco, CA, USA. January 20-22, 2011. Journal of the pancreas. 2011 ;2:123-125.
- Witzigmann H., Berr F., Ringel U. et al. Surgical and palliative management and outcome in 184 patients with hilar cholangiocarcinoma: palliative photodynamic therapy plus stenting is comparable to r1/r2 resection. Ann Surg. 2006;2:230-239.
- Witzigmann Helmut, Frieder Berr, Ulrike Ringel et al. Surgical and Palliative Management and Outcome in184 Patients With Hilar Cholangiocarcinoma. Annals of Surgery. 2006;2:230-239.
- Zoepf T. Photodynamic therapy of cholangiocarcinoma. HPB (Oxford). 2008;3:161-163.
- McCaughan J.S., Mertens B.F., Cho C., Barabash R.D., Payton H.W. Photodynamic therapy to treat tumors of the extrahepatic biliary ducts. A case report, Arch. Surg. 1991;126:111-113.


