Применение индекса модуляции частоты для определения состава микроэмболического материала
Автор: Рыбалко Н.В., Кузнецов А.Н., Виноградов О.И.
Журнал: Вестник Национального медико-хирургического центра им. Н.И. Пирогова @vestnik-pirogov-center
Рубрика: Оригинальные статьи
Статья в выпуске: 1 т.10, 2015 года.
Бесплатный доступ
Чувствительность и специфичность метода, основанного на применении ИМЧ для точки разделения «ИМЧ = 3000», составила 100% и 95%, соответственно, что свидетельствует о хорошей клинической значимости этих тестов. Метод дифференцировки МЭС, основанный на определении ИМЧ, может быть использован в качестве дополнительного средства для выделения состава микроэмболического материала.
Церебральная гемодинамика, микроэмболия, транскраниальный допплер
Короткий адрес: https://sciup.org/140188402
IDR: 140188402 | УДК: 616-005.7:615.837.3
Текст научной статьи Применение индекса модуляции частоты для определения состава микроэмболического материала
Церебральная эмболия – является наиболее частой причиной развития инсульта и неврологических осложнений во время проведения оперативных вмешательств и инвазивных диагностических исследований [1].
Транскраниальная допплерография (ТКДГ) – единственный метод для верификации микроэмболов в церебральном сосудистом русле и мониторинга гемодинамических показателей. ТКДГ может выявлять как твердые, так и газовые микроэмболические частицы [2].
В 1968 году M.P. Spencer и S.D. Campbell датчиком 5 МГц детектировали сигналы от воздушных микроэмболов в сосудах при изменении давления у моряков во время декомпрессии [11]. В 1990 году M.P. Spencer с соавт. методом ТКДГ детектировали сигналы от материальных микроэмболов в средней мозговой артерии (СМА) во время проведения каротидной эндартерэктомии [12].
Важной проблемой, особенно при проведении интраоперационного допплеровского мониторинга, является дифференцировка между газовыми и материальными микроэмболами.
Значимость этой проблемы обусловлена тем, что неврологические осложнения, возникающие после прохождения через церебральное сосудистое русло нескольких материальных микроэмболов, по тяжести могут значительно превышать осложнения, возникающие при прохождении сотен микропузырьков воздуха. Особенно важно четко определить происхождение микрочастиц и источник эмболического материала в клинических ситуациях, когда могут встречаться как газовые, так и материальные микрочастицы (протезированные клапаны сердца, оперативные вмешательства на сердце и сосудах и т.д.). Предложенные ранее методы, основанные на измерении скорости движения микроэмбола [8] и на определении интенсивности сигнала [5–6], не получили убедительной доказательной базы, а чувствительность и специфичность двухчастотного метода как самого многообещающего по данным исследований не превышает 70% [7].
Перспективной методикой дифференцировки микроэмболических сигналов (МЭС) является определение индекса модуляции частоты (ИМЧ). ИМЧ- это параметр, который измеряет малейшую интенсивность модуляции следа микроэмболической частицы и является наиболее важным, так как позволяет оценить траекторию модификации циркуляции микроэмбола в потоке крови. Опытным путем установлено, что ИМЧ для газовых микрочастиц в сотни раз превосходит такой для твердых микрочастиц, что связанно с разной способностью отражать ультразвуковую волну [9].
Данный феномен впервые был описан в исследовании Smith с соавт. [9]. Изучая МЭС у пациентов с протезированными клапанами сердца было отмечено, что ИМЧ значительно выше, чем при регистрации МЭС у пациентов с атеросклеротической бляшкой. Исследование Souchon и соавт. подтвердило тот факт, что газовые микроэмболы продуцируют ИМЧ гораздо больший по сравнению с материальными МЭС [10].
Girault и соавт. проводили оценку эффективности и надежности применения метода ИМЧ для дифференцировки микроэмболических сигналов [5–6].
Цель исследования : оценить точность применения метода на основании ИМЧ, и установить критерии для дифференцировки состава эмболического материала.
Исследование носило двухэтапный характер.
Часть исследования in vitro проводилась с применением экспериментальной установки, состоящей из замкнутой системы прозрачных гибких силиконовых трубок с внутренним диаметром 4 мм и полным объемом 15 мл, используемых в устройствах для гемодиализа «Baxter». Эксперименты проводились с плазмой и цельной кровью. Для получения и регистрации акустического сигнала применялся допплерограф СОНОМЕД-300М фирмы Спек-

тромед (Россия). Моделирование твердых микрочастиц проводилось путем рекальцификации плазмы, газовые микрочастицы были получены после введения взвеси из 9 мл раствора 0,9% изотонического натрия хлорида, 1 мл плазмы и 1 см3 воздуха. Данные записывались в АVI формате на рабочую станцию.
Экспериментально было доказано, что величина ИМЧ меньше или равно 1000 относится к материальным эмболам. ИМЧ более или равно 20000 относится к газовым эмболам. Данные согласуются с теорией Smith и соавт. и соответствуют результатам, полученным Girault и соавт [5–6, 9].
Теоретически разработанная модель была апробирована in vivo на группах пациентов с достоверно известной материальной, достоверно газовой и смешанной эмболией с определением чувствительности и специфичности метода.
Материал и методы
1025 МЭС было получено от пациентов пяти групп при проведении билатерального допплеровского мониторинга СМА с детекцией микроэмболических сигналов.
В состав 1-ой и 2-ой групп (n1 = 34; n2 = 20) вошли пациенты с симптомным гемодинамически значимым (более 50% по шкале NASCET) стенозом экстра- или интракраниальных отделов брахиоцефальных артерий, подтвержденным результатами проведенной ангиографии ветвей дуги аорты.
3-ю группу (n3 = 32) составили пациенты с фибрилляцией предсердий, осложнившейся ишемическим инсультом или ТИА. В первых трех группах предположительно имелись изолированные источники материальной эмболии; у пациентов 4-oй группы (n = 23) с подозрением на открытое овальное окно (ООО) при проведении пробы с контрастированием микропузырьками воздуха предположительно мониторировались только газовые микроэмболы. Диагноз ООО был подтвержден при проведении чреспищеводной эхокардиографии, исключались дополнительные источники кардиогенной и ангиогенной материальной эмболии.
В состав 5-ой группы вошли пациенты с протезированными клапанами сердца и инсультом или ТИА в анамнезе, у которых возможны как материальные, так и газовые микроэмболы.
Об орудование : допплерограф СОНОМЕД-300М фирмы Спектромед (Россия). Проводилась инсонация СМА на глубине 50,3 ± 0,5 мм датчиком 2 МГ. Детекция МЭС проводилась в соответствии с критериями Consensus Committee of the Ninth International Cerebral Symposium [3]. Порог детекции и порог режекции не превышал 7 Дб. Ультразвуковой доступ к лоцируемой СМА осуществлялся через височное акустическое окно. В группе пациентов с симптомным каротидным стенозом проводился допплеровский мониторинг ипсилатеральной СМА в течение часа. У пациентов 2-ой группы запись проводилась в течение 2 минут после инъекции.
Исследование с контрастированием микропузырьками воздуха проводилось в покое и при проведении пробы Вальсальвы путем введения взвеси, состоящей из 9 мл раствора 0,9% изотонического натрия хлорида, 1 мл стерильного воздуха и 1мл крови пациента.
Применяемый допплерограф снабжен программным обеспечением, позволяющим выявлять потенциальные события – НITS (Нigh Intensity Transient Signals). После окончания исследования все HITS анализировались исследователем для выявления артефактов и дифференцировки МЭС в режиме off-line. Только определенные и четко верифицированные МЭС использовались для дальнейшего статистического анализа.
На сегодняшний день для дифференцировки газовых и твердых МЭС не существует «золотого стандарта». Наиболее распространённым является метод разделения МЭС, основанный на измерении порога интенсивности. Согласно данному методу все МЭС менее 14 Дб можно отнести к материальным и все МЭС более или равно 16 Дб можно отнести газовым. МЭС с акустической мощностью в промежутке от 14 до 16 Дб являются неопределенными и требуют проведения дополнительных диагностических алгоритмов [4].
В нашей работе проводилось сравнение чувствительности и специфичности метода, основанном на определении ИМЧ, и метода измерения порога интенсивности. Основным критерием включения пациента в исследование было обнаружение МЭС в церебральном сосудистом русле одним или двумя из вышеописанных методов.
Статистическая обработка полученных данных проведена с помощью программы SPSS 13 с использованием бинарной логистической регрессии (ROC- анализа).
Результаты
На рис. 1. представлен Rос-анализ чувствительности и специфичности метода на основании ИМЧ относительно заключения специалиста.
Для точки разделения «ИМЧ = 1000» чувствительность метода составила 86%; специфичность – 95%. Чувствительность метода по отношению к точке разде-
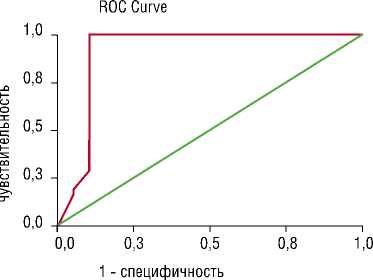
Рис. 1. Roc-кривая чувствительности и специфичности метода на основании ИМЧ по отношению к мнению эксперта
ления «ИМЧ = 3000» составила 100%, а специфичность осталась прежней.
Оценка чувствительности и специфичности метода на основании ИМЧ по отношению к методу определения порога интенсивности представлена на рис. 2. Точка разделения «ИМЧ = 1000» выявила чувствительность метода 86%, специфичность 100%. Для точки разделения «ИМЧ = 3000» чувствительность составила 100%, специфичность значительно снизилась до уровня 67%.
Таким образом, исследуемый метод обладает достаточными диагностическими возможностями для разделения состава МЭС на материальные и газовые и не опровергает метод измерения порога интенсивности. Снижение специфичности метода измерения порога интенсивности на точке разделения «ИМЧ = 3000» возможно вследствие диагностических расхождений.
На рис.3. представлена Roc-кривая для метода, основанного на измерении порога интенсивности МЭС. Точка разделения «14 Дб» выявила чувствительность и специфичность 70% и 99%, соответственно. Для точки разделения «16 Дб» чувствительность составила 89% и специфичность – 90%.
На рис. 4. представлен сравнительный анализ метода порога интенсивности относительно исследуемого. Для точки разделения «14 Дб» чувствительность составила 74%, специфичность – 84%; точка разделения «16 Дб» выявила чувствительность и специфичность 91% и 84%, соответственно.
Очевидно, что метода измерения порога интенсивности как чувствительность, так и специфичность являются недостаточными для проведения достоверных клинических исследований.
Выводы
-
1. Оптимальной точкой разделения для газовых и материальных эмболов является ИМЧ = 3000. МЭС, превышающие данное значение, относятся к газовым.
-
2. Чувствительность и специфичность метода, основанного на применении ИМЧ для точки разделения «ИМЧ=3000», составила 100% и 95%, соответственно, что свидетельствует о хорошей клинической значимости этих тестов.
-
3. Чувствительность и специфичность для точки разделения «16Дб» метода, основанного на измерении порога интенсивности, составила 89% и 90%, соответственно.
Очевидно, что исследуемый метод обладает способностью разделять МЭС лучше метода с применением порога интенсивности. Несмотря на обнадеживающие результаты, существует ряд ограничений использования данного метода. Специфичность метода 95% является недостаточной для использования в клинических ситуациях с массивной смешанной микроэмболией с большим числом газовых микрочастиц (например, у пациентов с протезированными клапанами сердца, при проведении операций на сердце в условиях ИК). В таких случаях выявление даже
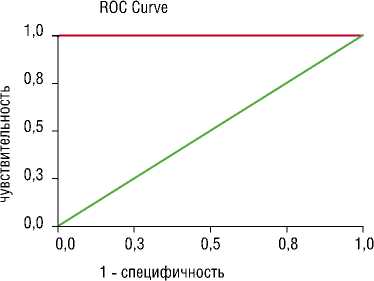
Рис. 2. Roc-кривая чувствительности и специфичности метода на основании ИМЧ по отношению к методу порога интенсивности
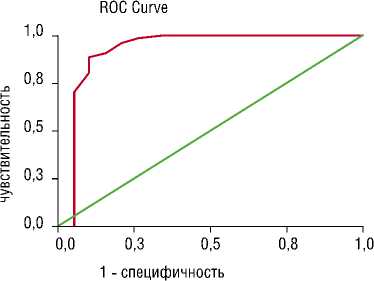
Рис. 3. Roc-кривая чувствительности и специфичности метода порога интенсивности по отношению к мнению эксперта
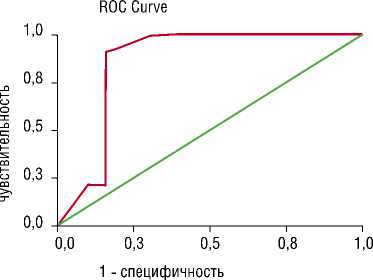
Рис. 4. Roc-кривая чувствительности и специфичности метода порога интенсивности по отношению к методу на основании ИМЧ нескольких МЭС материальной природы изменяет диагностическую значимость метода и тактику дальнейших мероприятий. Например, у пациента выявлено 1000 МЭС, из них только 5% являются материальной природы. При специфичности метода 95% 50 из 1000 МЭС могут быть рассмотрены как ложноположительные. Даже если все МЭС были классифицированы правильно, а 50 ложноположительных МЭС относятся к газовым МЭС, диагностическая значимость метода значительно страдает.

Исследование двухчастотного метода дифференцировки микрочастиц в церебральном сосудистом русле выявило чувствительность и специфичность 96% и 58%, соответственно [7]. Очевидно, что для данной проблемы существует своеобразный предел метода, превзойти который на современном этапе развития диагностической медицины невозможно. Это связано, прежде всего, с неоднородностью и крайней лабильностью отражения ультразвукового луча материальных и газовых микрочастиц.
Таким образом, метод дифференцировки МЭС, основанный на определении ИМЧ, может быть использован в качестве дополнительного средства для выделения состава микроэмболического материала. Дальнейшие исследования и применение дополнительных физических критериев необходимо для совершенствования данной методики.
Список литературы Применение индекса модуляции частоты для определения состава микроэмболического материала
- Кузнецов А.Н. Кардиогенная артерио-артериальная церебральная эмболия. Этиология. Патогенез. Клиника. Диагностика. Лечение и профилактика: Автореф. дис...д-ра мед. наук. -СПб, 2001. -32с.
- Aly A., Babikian V.L., Barest G. et al. Brain microembolism//Journal of Neuroimaging. -2003. Vol. 13. -P. 140-146.
- Consensus Committee of Ninth International Cerebral Hemodynamics Symposium/Basic identification criteria of Doppler microembolic signals//Stroke. -1995. Vol. 26. P. 1123.
- Devuyst G., Darbellay G.A., Vesin J.-M., Kemeny V. et al. Automatic Classification of HITS Into artifacts or solid or gaseous emboli by a wavelet representation combined with dual-gaye TCD//Stroke. -2001. Vol. 32. № 7. P. 2803-2809.
- Girault. Jean-Marc., Kouame D., Menigot S. Analysis of Index modulation in microembolic Doppler signals Part I: Radiation force as a new hypothesis-simulations//Ultrasound in Med & Biol. -2011. Vol. 37, № 1. P. 87-101.
- Girault. Jean-Marc., Kouame D., Menigot S., Analysis of Index modulation in microembolic Doppler signals Part II: In Vitro discrimination//Ultrasound in Med & Biol. -2011.Vol. 37, № 1. P. 102-111.
- Markus H., Punter M. Can Transcranial Doppler Discriminate Between Solid and Gaseous Microemboli?: Assesment of Dual-Frequency Trancducer System//Stroke. -2005. Vol. 36, № 8. P. 1731-1734.
- Russell D, Brucher R. Online automatic discrimination between solid and gaseous cerebral microemboli with the first multifrequency transcranial Doppler//Stroke. -2002. Vol. 33, № 8. P. 1975-1980.
- Smith J., Evans., Naylor R. Analysis of frequency modulation present in Doppler ultrasound signal may allow differentiation between particular and gaseous cerebral emboli//Ultrasound Med. Biol. -1997. № 23. P. 727-734.
- Souchon G., Girault J-M., Biard M., Kouame D. et al. Gaseouse and solid emboli differentiation using radiation force//IEEE Ultrason Symp Rotterdam. -2005. P. 2070-2073.
- Spencer M.P., Campbell S.D. Development of bubbles in venous and arterial blood during hyperbaric decompression//Bull Mason. Clinic. -1968.Vol. 22. P. 26-32.
- Spenser M.P., Thomas G.I., Nicholls S.C., Sauvage L.R. Detection of middle cerebral artery emboli during carotid endarterectomy using transcranial Doppler ultrasonography//Stroke. -1990. Vol. 21. P. 415-423.


