Применение интраоперационного фильтрационного плазмафереза в условиях искусственного кровообращения у пациентов с инфекционным эндокардитом
Автор: Музычин А.Л., Хавандеев М.Л., Мошкин С.В., Залюбовская Л.В., Гительзон Е.А., Файбушевич А.Г.
Журнал: Вестник Национального медико-хирургического центра им. Н.И. Пирогова @vestnik-pirogov-center
Рубрика: Оригинальные статьи
Статья в выпуске: 3 т.19, 2024 года.
Бесплатный доступ
Обоснование: Применение различных эфферентных методов зарекомендовало себя с положительной стороны в комплексе лечения пациентов с кардиохирургической патологией. В работе представлен способ проведения фильтрационного плазмафереза в процессе оперативного вмешательства в условиях искусственного кровообращения (ИК) у пациентов с инфекционным эндокардитом (ИЭ).Цель: Оценить эффективность разработанного метода интраоперационного плазмафереза в условиях ИК у пациентов с ИЭ.Материалы и методы: В материалах исследования описывается способ интеграции плазмофильтра непосредственно в контур аппарата ИК без применения дополнительного оборудования для проведения плазмафереза. Исследование настоящего метода проводилось на базе отделения кардио - и рентгенэндоваскулярной хирургии ГБУ ДНР «РКБ имени М.И. Калинина», г. Донецк в период с 2014 по 2024 гг. В исследовании приняли участие 96 пациентов, которые были разделены на две группы (52 и 44 пациента соответственно). В Группе I выполнялась процедура интраоперационного плазмафереза. В Группе II процедура плазмафереза не выполнялась. Пациентам выполнены следующие оперативные вмешательства: протезирование аортального клапана (ПАК) - 28 (29,17%), протезирование митрального клапана (ПМК) - 30 (31,25%), протезирование трикуспидального клапана (ПТК) - 33 (34,38%), протезирование аортального и митрального клапанов - 5 (5,2%).
Инфекционный эндокардит, плазмаферез, искусственное кровообращение
Короткий адрес: https://sciup.org/140307879
IDR: 140307879 | DOI: 10.25881/20728255_2024_19_3_38
Текст научной статьи Применение интраоперационного фильтрационного плазмафереза в условиях искусственного кровообращения у пациентов с инфекционным эндокардитом
Плазмаферез (ПА) является эстракорпоральным методом терапии и представляет из себя процесс удаления части плазмы крови пациента гравитационным или фильтрационным способом. Официальное использование термина ПА впервые было предложено американским врачом J.J. Abel в 1914 г. [1]. С тех пор данный эфферентный метод вошел в медицинскую практику, и в том или ином виде применяется по сегодняшний день. Несомненно, как сама методика, так и принципы ее проведения за всю более чем столетнюю историю претерпели немало изменений [2]. Это позволило опытным путем выработать общие современные подходы как к проведению самой процедуры, так и к выбору оборудования и расходных материалов для проведения ПА, которые широко представлены производителями всего мира. Тем не менее модификации данного метода находят свою актуальность и в современных условиях. Поиск способов улучшения и адаптации классических подходов к проведению ПА позволяет расширить традиционные границы применения данного метода.
Актуальность
ПА успешно применяется в стационарных и амбулаторных условиях, является частью комплексного лечения многих заболеваний и синдромов [2–4]. Экстракорпоральная гемокоррекция в кардиологической и кардиохирургической практике применяется часто, и позволяет снизить риски послеоперационных септических осложнений, системного воспалительного ответа, полиорганной недостаточности. ПА применяется при ИБС, лечении аритмий и синдрома дилатационной кардиомиопатии [5–9]. Применение экстракорпоральной терапии вызывает доказанное замедление прогрессирования атеросклероза, снижает риск развития рестенозов в послеоперационном периоде реваскуляризации миокарда, что связывают с уменьшением уровня липопротеидов. У пациентов с кардиальной патологией после курса ПА в комплексе основного лечения отмечается снижение титров антикардиальных антител и значимый прирост фракции выброса [10–12].
При анализе опыта применения ПА в современной практике амбулаторий и стационаров установлено, что проведение данной процедуры требует наличия специализированного оборудования и подготовки специалиста [13; 14]. Аппарат для ПА, одноразовые расходные материалы в виде плазмофильтра и комплекта магистралей, катетеры, инфузионные растворы и антикоагулянт – необходимый минимум для проведения ПА.
В отделениях кардиохирургии ПА проводится часто, однако подобные процедуры выполняются либо в дооперационном, либо послеоперационном периоде. В свою очередь, использование таких методов гемоконцентрации и гемокоррекции как ультрафильтрация (УФ) и модифицированная ультрафильтрация (МУФ) в отделениях кардиохирургии, выполняющих оперативные вмешательства в условиях ИК, является рутинной интраоперационной практикой.
Цель
Оценить эффективность разработанного метода интраоперационного ПА в условиях ИК у пациентов с ИЭ.
Материалы и методы
Исследование проводилось на базе отделения кар-дио – и рентгенэндоваскулярной хирургии ГБУ ДНР «РКБ имени М.И.Калинина», г. Донецк. В период с 2014 по 2024 гг. прооперировано 96 пациентов (50 мужчин и 46 женщин) в возрасте от 26 до 68 лет по поводу ИЭ. Средний возраст составил 39,3±7,9 лет. Пациенты поступали в отделение с результатами данных ЭхоКГ, коронарографии (у пациентов старше 45 лет), КТ органов грудной клетки, функции внешнего дыхания, УЗИ органов брюшной полости и сосудов шеи, эзофагофиброгастродуоденоскопии. При госпитализации пациентам выполняли стандартный набор анализов крови: группа крови и резус фактор, общий клинический анализ крови, биохимический анализ крови (мочевина, креатинин, глюкоза, билирубин и его фракции, АЛТ, АСТ, электролиты), коагулограмма, общий клинический анализ мочи.
Описание метода
Предложенный метод дает техническую возможность для проведения плазмафереза в интраоперационном периоде кардиохирургических операций в условиях ИК без применения специализированного оборудования для ПА. Модификация традиционного контура аппарата ИК расширяет возможности использования эфферентных методов и позволяет производить интраоперационную гемокоррекцию в условиях ИК.
За основу взят способ проведения мембранного аппаратного ПА, выполняемого на оборудовании «АПФ1-Гемофер» или «Гемофеникс» с применением стандартного набора магистралей и плазмофильтра ПФМ-800 или ПФМ-01-ТТ РОСА, стандартный протокол перфузии в условиях ИК, а также принципы проведения интраоперационных процедур УФ и МУФ.
Как известно, в основе работы аппаратуры для мембранного ПА лежит принцип фильтрации крови пациента, приводимой в движение насосом. Роликовый или перистальтический насос создает движение жидкости в магистрали вращением. Аппарат, оснащенный шаговым двигателем, совершает поступательные движения и производит сжатие фрагмента магистрали, а система обратных клапанов обеспечивает движение жидкости в нужном направлении. Данная процедура, как правило, проводится по принципу забора и возврата в одну и ту же вену. Кровь из катетерезированной вены под действием насоса, приводимого в движение шаговым двигателем, по магистралям через систему однонаправленных клапанов поступает в плазмофильтр. Структура фильтра ПФМ-800

Музычин А.Л., Хавандеев М.Л., Мошкин С.В. и др.
ПРИМЕНЕНИЕ ИНТРАОПЕРАЦИОННОГО ФИЛЬТРАЦИОННОГО ПЛАЗМАФЕРЕЗА В УСЛОВИЯХ ИСКУССТВЕННОГО КРОВООБРАЩЕНИЯ У ПАЦИЕНТОВ С ИНФЕКЦИОННЫМ ЭНДОКАРДИТОМ
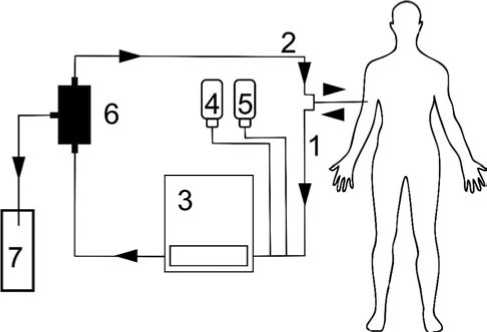
Рис. 1. Принципиальная схема работы аппарата ПА. 1 – магистраль забора крови; 2 – магистраль возврата крови; 3 – аппарат ПА с шаговым двигателем; 4 – антикоагулянт; 5 – раствор натрия хлорида 0,9%; 6 – плазмофильтр; 7 – емкость для эксфузата.
или ПФМ-01-ТТ РОСА, в основе которой лежит трековая мембрана, позволяет разделять протекающую через него кровь на плазму и сгущенную клеточную эритромассу по действием трансмембранного давления. В процессе процедуры ПА регулируется поступление в систему антикоагулянта и раствора натрия хлорида 0,9% для предотвращения тромбирования контура, поддержания необходимых реологических свойств крови и водного баланса пациента. После фильтрации кровь возвращается пациенту. Принципиальная схема работы аппарата ПА приведена на рис. 1.
Суть предлагаемого метода заключается в интеграции плазмофильтра в контур аппарата ИК. Внедрение данного метода в практику расширяет возможности применения ПА в его классическом виде и может быть предметом выбора для специалиста, как дополнительный инструмент гемокоррекции. С одной стороны, метод включает в себя все преимущества ПА, с другой – позволяет в условиях ИК снижать объем цирклирующей крови, проявляя свойства гемоконцентрации. Интраоперационный ПА не заменяет ультрафильтрацию, однако данная процедура имеет схожие технические особенности и принципы проведения.
В условиях ИК для проведения мембранного ПА дополнительного оборудования не требуется. Современный аппарат ИК оснащен всеми необходимыми датчиками давления в магистралях, скорости потока и температуры. Системы защиты включают в себя контроль наличия воздуха в магистралях и датчик контроля уровня жидкости в кардиотомном резервуаре. АИК и анестезиологическая мониторинговая система предоставляют широкий спектр данных. Высокая интраоперационная частота контроля лабораторных показателей позволяют практически постоянно анализировать состояние пациента и выполнять необходимую коррекцию. Конструкция оксигенатора рассчитана на подключение рециркуляционных и деаэрационных шунтов, гемофильтра, прочего оборудования.
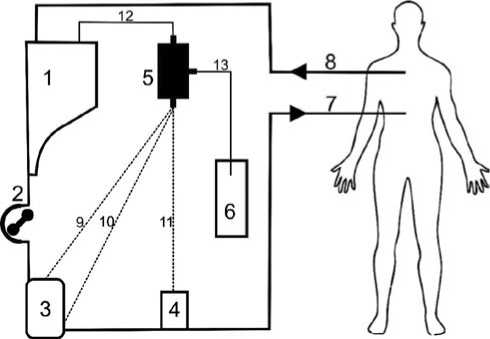
Рис. 2. Варианты интеграции плазмофильтра в контур ИК. 1 – кардиотом-ный резервуар; 2 – основной насос АИК; 3 – оксигенатор; 4 – артериальный фильтр; 5 – плазмофильтр; 6 – емкость для эксфузата;
7 – артериальная магистраль контура ИК; 8 – венозная магистраль контура ИК; 9–11 – варианты подключения приводящей магистрали плазмофильтра; 12 – отводящая магистраль плазмофильтра; 13 – магистраль эксфузата.
Все в комплексе – дает техническую возможность для выполнения интраоперационного ПА.
Интегрирование плазмофильтра в контур ИК не представляет сложности, сравнимо с удобством применения гемоконцентратора и может быть выполнено как в момент сборки контура ИК до начала оперативного вмешательства, так и в любой момент работы АИК. Аппаратура, применяемая для проведения ИК позволяет использовать весь спектр датчиков, применяемых в процедурах классического аппаратного ПА (фото).
Для обеспечения процедуры ПА потребуется: непосредственно плазмофильтр и емкость для эксфузата. В зависимости от особенностей конструкции оксигенатора, способов его расположения и удобства проведения процедуры ПА – возможны различные варианты интеграции плазмофильтра в контур ИК. Общие принципы модификации контура ИК для проведения ПА идентичны принципам УФ. Варианты принципиальной схемы подключения приведены на рис. 2.
Пример интеграции плазмофильтра в контур ИК приведен на рис. 3.
Несмотря на то, что основной принцип работы и функции плазмофильтра в процедурах классического и интраоперационного ПА сохраняется, существует ряд особенностей.
В случае интеграции плазмофильтра в контур ИК, контроль давления на входе в него не требуется, так как показатели давления, фиксируемые в артериальной магистрали и всех шунтах оксигенатора сопоставимы по значению. Давление перфузата на выходе из плазмофиль-тра в данной системе возможно отслеживать датчиком давления аппарата ИК, однако это имеет второстепенное значение. Дополнительные антикоагулянты не применяются, поскольку ИК проводится в условиях тотальной
Музычин А.Л., Хавандеев М.Л., Мошкин С.В. и др. ПРИМЕНЕНИЕ ИНТРАОПЕРАЦИОННОГО ФИЛЬТРАЦИОННОГО ПЛАЗМАФЕРЕЗА В УСЛОВИЯХ ИСКУССТВЕННОГО КРОВООБРАЩЕНИЯ У ПАЦИЕНТОВ С ИНФЕКЦИОННЫМ ЭНДОКАРДИТОМ

Рис. 3. Пример интеграции плазмофильтра в контур ИК.
гепаринизации. Скорость фильтрации поддерживается работой основного насоса. Приводящая магистраль фильтра представляет из себя шунт от основного потока крови. Отводящая – производит сброс в кардиотомный резервуар контура ИК. В связи с этим, контроль воздуха в магистралях плазмофильтра не требуется. Стандартная регулировка окклюзии роликовых моторов до начала ИК минимизирует механическое воздействие на эритроциты.
Проведение интраоперационного плазмафереза в условиях ИК
Мы начинали процедуру интраоперационного плазмафереза за 10 минут до предполагаемого снятия зажима с аорты и продолжали до момента достижения требуемого объема полученного эксфузата плазмы. Старт процедуры обеспечивается открытием приводящей магистрали плазмофильта. В результате работы основного роликового насоса, обеспечивающего перфузию, часть крови, проходящей через плазмофильтр, подвергается фильтрации, после чего возвращается по отводящей магистрали в кардиотомный резервуар. Эксфузат удаляется в емкость. Производится контроль скорости фильтрации, объема эксфузата, стандартных параметров ИК.
Объем удаляемой плазмы и режим плазмафереза определяется общими клиническими рекомендациями и подбирается исходя из конкретной клинической и интраоперационной ситуации. Средний объем удаляемой плазмы у пациентов в группе 1 составил 10,7±3,9 мл/кг массы тела.
Результаты и обсуждение
Пациентам выполнены следующие оперативные вмешательства: протезирование аортального клапана (ПАК) – 28 (29,17%), протезирование митрального кла-
Табл. 1. Распределение пациентов по виду оперативного вмешательства в группе I
|
Вид оперативного вмешательства |
Кол-во пациентов |
Процент от общего количества пациентов с ИЭ |
|
Протезирование аортального клапана |
12 |
12,5 |
|
Протезирование митрального клапана |
17 |
17,7 |
|
Протезирование трикуспидального клапана |
20 |
20,9 |
|
Протезирование аортального и митрального клапанов |
3 |
3,1 |
Табл. 2. Распределение пациентов по виду оперативного вмешательства в группе II
В рамках настоящего исследования пациенты были разделены на две группы: в группе I (n = 52) пациентам выполняли интраоперационный ПА, а в группe II (n = 44) – процедуру интраоперационного плазмафереза не проводили. Данные представлены в табл. 1 и табл. 2.
Для инфузионной терапии всем пациентам проводили катетеризацию одной из внутренней яремных или подключичных вен. Артериальное давление во время операций с ИК измеряли инвазивно посредством катетеризации лучевой или бедренной артерии. Операции выполняли в условиях комбинированной общей анестезии с ИВЛ.
Все оперативные вмешательства выполнены в условиях ИК по стандартной схеме: срединная стернотомия, перикардиотомия, подключение аппарата ИК, антеградная фармакохолодовая кардиоплегия раствором «Кустодиол», наложение зажима на аорту. Далее иссекали пораженный клапан, выполняли его протезирование, деаэрацию, герметизацию, снятие зажима с аорты и восстанавливали сердечную деятельность. После нормализации гемодинамики подшивали временные электроды к правому желудочку, дренировали перикард и ретростер-нальное пространство, выполняли тщательный гемостаз, стернометаллоостеосинтез стальной проволокой и послойное ушивание раны.
На этапе премедикации корректировалась оптимальная ЧСС на уровне 80–90 ударов в минуту, посредством дозирования атропина сульфата, внутривенно вводилось: мидазолам – 50 мкг/кг массы тела, фентанил – 1–2 мкг/кг массы тела. Индукция в анестетезию проводилась тиопенталом натрия – 3 мг/кг массы тела либо
Музычин А.Л., Хавандеев М.Л., Мошкин С.В. и др.
ПРИМЕНЕНИЕ ИНТРАОПЕРАЦИОННОГО ФИЛЬТРАЦИОННОГО ПЛАЗМАФЕРЕЗА В УСЛОВИЯХ ИСКУССТВЕННОГО КРОВООБРАЩЕНИЯ У ПАЦИЕНТОВ С ИНФЕКЦИОННЫМ ЭНДОКАРДИТОМ пропофолом – 2 мг/кг массы тела. С целью релаксации, перед интубацией трахеи, использовался рокурония бромид – 0,6 мг/кг массы тела. В качестве базисного наркоза использовался севофлюран, из рассчёта 1–1,2 МАК, проводилась непрерывная инфузия фентанила – 0,1–0,3 мг/час. Релаксация поддерживалась дробным введением рокуро-ния бромида 0.15 мг/кг массы тела либо его непрерывной инфузией – 0,3 мг/кг/час. Гемодинамическая поддержка осуществлялась непрерывной инфузией норадреналина, допамина, адреналина, добутамина в различных комбинациях и расчетных дозировках, либо изолированно, в зависимости от исходных функциональных параметров сердечной деятельности, а также интраоперационных факторов, воздействующих на сердечную сократимость. Перфузия проводилась с использованием аппаратов ИК Terumo System I (Япония), Stockert S5 (Германия). Оксигенаторы Medtronic Affinity NT (США), Euroset Skipper, Euroset Skipper AF (Италия). Комплекты магистралей к оксигенаторам в модификации custom pack или standard pack с последующей адаптацией по длине в контур ИК. В исследовании применялся мембранный плазмофильтр ПФМ 800 с площадью фильтрации 800 см2 (Россия).
Первичный объем заполнения (ПОЗ), оксигенатора и магистралей во всех группах пациентов по составу и объему идентичный, и включал в себя: натрия хлорид 0,9% – 1000,0 мл, Натрия гидрокарбонат 5% – 100,0 мл, Маннит 15% – 200,0 мл. Гепарин из расчёта 500 ЕД на 100 мл ПОЗ. Растворы, применяемые дополнительно во время перфузии по необходимости: натрия гидрокарбонат 5%, калия хдорид – 7,5%, Гелофу-зин, натрия хлорид 0,9%. Объемная скорость перфузии рассчитывалась исходя из площади поверхности тела пациента и перфузионного индекса 2,5 л/мин/м2. ИК проводилось в условиях умеренной гипотермии (t – 34 °C).
Средние значения длительности ИК и пережатия аорты в группах приведены в табл. 3.
После окончания операции больных переводили в отделение интенсивной терапии. Протокол лечения больных в отделении интенсивной терапии, помимо проведения респираторной поддержки, включал коррекцию показателей гемодинамики (введение инотропных средств, вазопрессоров и вазодилататоров, инфузионных сред), электролитных расстройств, антибиотикотерапию, гемотрансфузию при необходимости и профилактику стрессовых язв. На 2-е сутки послеоперационного периода пациентов переводили в отделение кардиохирургии для дальнейшего лечения и наблюдения.
Пациентам регулярно проводили термометрию. Температура тела в послеоперационном периоде достоверно отличалась в группах. В диаграмме 1 представлены данные средних значений температуры тела с 1-х по 3-е сутки после оперативного вмешательства в группах 1 и 2.
Больным регулярно выполнялись лабораторные методы исследования для достижения целевого уровня МНО, контроля уровня гемоглобина, коррекции электролитных нарушений (при необходимости). В общем кли-
Табл. 3. Распределение пациентов по длительности ИК и пережатия аорты в группах
|
Вид оперативного вмешательства |
Группа I Время ИК среднее |
Группа II Время ИК среднее |
Группа I Время пережатия аорты среднее |
Группа II Время пережатия аорты среднее |
|
Протезирование аортального клапана |
42,6±7,3 |
40,4±6,9 |
35,7±9,2 |
33,8±8,9 |
|
Протезирование митрального клапана |
49,1±11,3 |
48,3±10,2 |
37,2±7,7 |
36,5±8,7 |
|
Протезирование трикуспидального клапана |
49,3±10,8 |
43,3±10,1 |
34,5±8,1 |
32,4±7,9 |
|
Протезирование аортального и митрального клапанов |
79,2±11,3 |
83,1±11,7 |
73,4±10,7 |
75,1±12,1 |
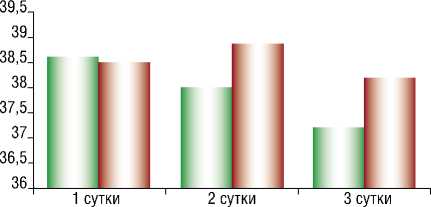
I Температура тела, °C Группа 1
■ Температура тела, °C Группа 2
Диаграмма 1.
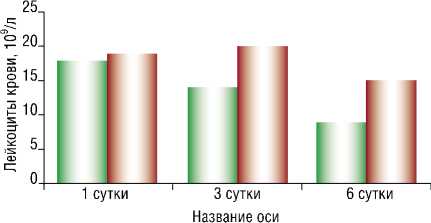
I II Группа! ■ ■ Группа2
Диаграмма 2.
ническом анализе крови также отмечалась достоверная разница между показателями уровня лейкоцитов в группах. Данные наблюдений за 6 суток представлены в виде диаграммы 2.
Мы можем отметить, что в группе 1 показатели СОЭ, абсолютное количество лейкоцитов, процентное содержание юных, палочкоядерных, сегментоядерных нейтрофилов, лейкоцитарный индекс интоксикации статистически ниже по сравнению с группой 2.
Нормализация температуры тела в раннем послеоперационном периоде у пациентов в группе 1 наступала в более ранние сроки по сраввнению с группой 2.
Музычин А.Л., Хавандеев М.Л., Мошкин С.В. и др. ПРИМЕНЕНИЕ ИНТРАОПЕРАЦИОННОГО ФИЛЬТРАЦИОННОГО ПЛАЗМАФЕРЕЗА В УСЛОВИЯХ ИСКУССТВЕННОГО КРОВООБРАЩЕНИЯ У ПАЦИЕНТОВ С ИНФЕКЦИОННЫМ ЭНДОКАРДИТОМ
В ходе исследования установлено, что в группе 1 самостоятельное восстановление сердечного ритма после снятия зажима с аорты наблюдалось в 81,6% случаев, что на 13,7% превышает данный показатель во 2 группе пациентов (67,9%).
Кардиотоническая поддержка в раннем послеоперационном периоде применялась у пациентов 1 группы в 58%, а в группе 2 – в 76% случаев.
Выводы
Применение метода итраоперационного фильтрационного ПА в условиях ИК технически осуществимо, не представляет сложности и не требует приобретения дополнительного оборудования.
В условиях ИК данный метод сохраняет все преимущества ПА, а также позволяет осуществлять волемическую коррекцию и гемоконцентрацию.
Интраоперационный ПА способствует улучшению выхода из ИК путем самостоятельного восстановлению ритма без применения дефибрилляции и снижения потребности в применении адреномиметиков для нормализации артериального давления.
Применение метода интраоперационного ПА демонстрирует улучшение протекания послеоперационного периода, проявляющегося в снижении кардиотонической поддержки, ранней нормализации температуры тела и лабораторных показателей, а именно: абсолютного количества лейкоцитов, относительно содержания палочкоядерных и сегментоядерных лейкоцитов, скорости оседания эритроцитов, С – реактивного белка и лейкоцитарного индекса интоксикации.
Список литературы Применение интраоперационного фильтрационного плазмафереза в условиях искусственного кровообращения у пациентов с инфекционным эндокардитом
- Abel JJ, Rowntree LG, Turner BB. Plasma removal with return of corpuscles (plasmapheresis). J. Pharmacol. Exp. Ther. 1914; 5: 625–627.
- Калинин Н.Н., Варламова С.В. Гемаферез в клинической практике // Альманах клинической медицины. – 2009. – №20. – С.3–9.
- Клиническое применение экстракорпоральных методов лечения / Под ред. Калинина Н.Н. – М.: Трекпортехнолоджи, 2006.
- Воинов В.А. Эфферентная терапия. Мембранный плазмаферез. – М.: Медицина, 2002.
- Куликова В.А., Недоступ А.В., Благова О.В. и др. Эффективность лечения аритмий и синдрома дилатационной кардиомиопатии иммунно – воспалительного генеза с помощью плазмафереза // Российский кардиологический журнал. – 2018. – №12. – С.32–43.
- Мальчевский Ю.Е., Рагимов А.А., Каспаров Э.В. Некоторые клинико – лабораторные показатели при различных режимах плазмафереза у больных стабильной стенокардией напряжения III–IV функционального класса. // Здоровье в XXI веке. – 2018 – Т.20. – №2. – С.55–59.
- Соловьева И.Н., Михайлов Ю.Е., Андрианова М.Ю. Дискретный плазмаферез при ишемической болезни сердца // Терапевтический архив. – 2014. – Т.86. – №8. – C.13–17.
- Шевченко Ю.Л. Хирургическое лечение инфекционного эндокардита и основы гнойно-септической кардиохирургии. – 2-е изд. – М.: Династия, 2020. – 448 с.
- Шевченко Ю.Л. Хирургическое лечение эндокардита: 35-летний опыт // Анналы хирургии. – 2016. – Т.21. – №1-2. – С.42-51.
- Тишко В.В., Тыренко В.В., Козлов К.Л. и др. Мультидисциплинарный подход к ведению пациентов высокого риска после повторных реваскуляризаций миокарда // Клиническая геронтология. – 2014. – №9–10. – С.40–44.
- Erqou S, et al. Lipoprotein(a) concentration and the risk of coronary heart disease, stroke, and nonvascular mortality. Jama. 2009; 302(4): 412–423.
- Куликова В.А., Недоступ А.В., Благова О.В. и др. Эффективность лечения дилатационной кардиомиопатии иммуновоспалительного генеза с помощью плазмафереза // Клин. и эксперимент. хир. Журн. им. акад. Б.В. Петровского. – 2019. – Т.7. – №1. – С.6–16.
- Ворыханов А.В. Ресурсное обеспечение деятельности отделения экстракорпоральных методов лечения // Современные проблемы здравоохранения и медицинской статистики. – 2015. – №3. – С.9–17.
- Соловьева И.Н., Полякова Ю.В., Марченко Т.В. Организация экстракорпоральной помощи в многопрофильной медицинской организации // Менеджер здравоохранения. – 2020. – №2. – С.2 –26.


