Применение ипилимумаба у больных диссеминированной меланомой кожи
Автор: Новик А.В., Комаров Ю.И., Проценко С.А., Семенова А.И., Балдуева И.А., Дубинина Э.В., Пипиа Н.П., Ахаева З.Ю.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Медицинские науки
Статья в выпуске: 3 (10), 2014 года.
Бесплатный доступ
Введение: Применение ипилимумаба (ИПИ) для лечения больных диссеминированной меланомой кожи, впервые продемонстрировавшее увеличение выживаемости, явилось важным событием в иммунотерапии злокачественных опухолей. Мы представляем результаты лечения больных в рамках программы расширенного доступа к препарату (СА184-ЕАР).Материалы и методы: В ФГБУ «НИИ онкологии им. Н. Н. Петрова» Минздрава России в программу с сентября 2012 г. по август 2014 г. включен 71 больной диссеминированной меланомой, с признаками прогрессирования опухолевого процесса, получивших ранее от 1 до 6 линий лекарственной терапии. Средний возраст составил 51 год (21-76 лет). У 39 (60%) больных установлена IV стадия M1c, 25% пациентов имели метастатическое поражение головного мозга, 28% - метастазы в печени, 19% - метастазы в костях. Все больные получали ИПИ в дозе 3 мг/кг 1 раз в 3 недели, всего 4 введения. Результаты: У 71 больного проведено 229 введений ИПИ (в среднем-3,2). Тридцать девять больных (59%) получили 4 введений, 21 (35%) - 1-2 введения. Большинство пациентов имело хотя бы одно нежелательное явление (НЯ), связанное с лечением. У 15 больных (21%) нежелательных явлений не наблюдалось.Трое больных умерло от нежелательных явлений, возможно связанных с проводимой терапией: 1 - от почечной недостаточности, 1 - от тромбоэмболии легочной артерии, 1 - от отека головного мозга на фоне прогрессирования опухолевого процесса. НЯ 3-4 ст. наблюдались у 10 (14,1%) больных: сыпь 3 ст.- у 3 (4,2%), диарея 3 ст. у 2 (2,8%), слабость 3 ст. у 2 (2,8%), одышка 3 ст. у 1(1,4%), повышение уровня АЛТ и АСТ 4 ст. у 1 (1,4%), гипокалиемия 3 ст. у 1 (1,5%) больных. Эффективность лечения оценена у 54 больных, полный регресс выявлен у 3 (6%) больных, частичный - у 6 (11%) больных. Объективный ответ на терапию наблюдался у 28% пацинентов, стабилизация процесса у 6 (11%). Средняя длительность наблюдения составила 144 дня. Медиана времени до прогрессирования - 81 (95% ДИ 73-105) дней. Медиана общей выживаемости составила 411 дней (95% ДИ - 303-519). Заключение: Терапия ИПИ удовлетворительно переносится большинством больных и обладает значимой клинической эффективностью в качестве второй и последующих линий лекарственной терапии у пациентов диссеминированной меланомой кожи.
Ипилимумаб, меланома, эффективность, нежелательные явления
Короткий адрес: https://sciup.org/14045503
IDR: 14045503
Текст научной статьи Применение ипилимумаба у больных диссеминированной меланомой кожи
Ипилимумаб (ИПИ) представляет собой человеческое моноклональное антитело класса иммуноглобулинов G1 (IgG1) к четвертому антигену цитотоксиче-ских-лимфоцитов (CTLA4) [2]. Этот препарат является первым зарегистрированным представителем нового класса противоопухолевых средств – блокаторов негативных (тормозных) сигналов в иммунологическом синапсе. Известно, что для активации Т-лимфоцита необходима презентация специфического для него антигена в контексте молекулы главного комплекса гистосовместимости.
Результат такого взаимодействия зависит от ко-стимули-рующих молекул на поверхности антиген-презентующей клетки и Т-лимфоцита. Одной из таких молекул является CTLA-4. Этот рецептор конкурирует с рецептором СD28 за связывание с антиегном CD80 на поверхности Т-лимфоцита. В результате взаимодействия CD28 и CD80 происходит активация Т-лимфоцита. CTLA-4 имеет более высокую аффинность к CD80. Из связывание приводит к остановке иммунного ответа и гибели лимфоцита. Экспериментальные исследования, которые проводились с 1987 г., показали высокую значимость данного антигена в качестве мишени для иммунотерапии [3]. В резуль-
Применение ипилимумаба у больных диссеминированной меланомой кожи тате этих исследований были разработаны препараты, блокирующие данный антиген. ИПИ оказался первым препаратом, успешно показавшим возможность увеличения выживаемости больных диссеминированной меланомой с помощью иммунотерапии в исследовании III фазы [2]. В этом исследовании ИПИ вводился в дозе 3 мг/кг либо в монотерапии, либо в сочетании с вакциной gp100 и сравнивался с монотерапией вакциной gp100. Исследование показало снижение риска смерти больных на 32% и увеличение медианы выживаемости с 6,4 до 10,1 мес. На основании этого исследования препарат был зарегистрирован для лечения диссеминированной меланомы. По образцу регистрационного исследования была запущена программа расширенного доступа для получения большей информации о применении препарата в клинической практике. Мы представляем результаты лечения больных в рамках данной программы в ФГБУ «НИИ онкологии им. Н. Н. Петрова» Минздрава России.
Материалы и методы
В программу с сентября 2012 г. по август 2014 г. включено 100 больных. 22 пациента не прошли скрининг, 71 больной получил терапию ИПИ, из них 12 человек продолжали лечение на момент анализа.
Основными критериями включения в исследования были: – морфологически верифицированный диагноз диссеминированной или местно распространенной не-резектабельной меланомы;
-
– проведение ранее как минимум 1 линии системной терапии;
-
– допускалось наличие бессимптомных или стабильных на фоне ранее проведенного лечения (преимущественно – стереотаксической лучевой терапии) метастазов в головном мозге;
-
– общее удовлетворительное состояние больных;
-
– наличие адекватной функции печени и почек;
-
– отсутствие аутоиммунных заболеваний.
Характеристика больных, включенных в исследование, представлена в таблице 1.
Только у 1 больного на момент начала терапии сохранялась IIIc стадия без отдалённых метастазов. Остальные больные получали лечение по поводу IV стадией заболевания. При этом подстадия M1a наблюдалась у 14% больных, M1b – e 16%, M1c – у 66% больных. Как видно из таблицы 1, значительная доля пациентов имели метастазы в печени (28%), головном мозге (24%) и костях (17%). Такая локализация поражений считается неблагоприятной для проведения иммунотерапии.
Все больные получали ранее системную противоопухолевую терапию. Шесть больных, получавших ИПИ в качестве первой линии лекарственного лечения по поводу метастатического процесса, подвергались ранее адъювантной химио-и иммунотерапии.
В рамках программы ИПИ вводился в дозе 3 мг/кг 1 раз в 21 день. Всего каждому пациенту проводилось не более 4 введений препарата – индукционный курс лечения. Лечения продолжали до достижения 4 циклов терапии, появления несомненных признаков прогрессирования процесса (в сочетании с симптоматическим ухудшением состояния больного) или непереносимой токсичности лечения. В случае достижения клинического эффекта (т.е. отсутствия признаков прогрессирования болезни) по окончании терапии (после 12 недель лечения) и развитии прогрессирования процесса впоследствии допускалось повторное включение больного в данную программу (реиндукция эффекта). Из 71 больного реиндукцию получили 4 больных. При наличии признаков прогрессирования процесса по системе RECIST [1] в случае отсутствия при этом клинических признаков ухудшения состояния проводилась повторная оценка эффективности через 1 мес. Новое лечение начиналось только при подтверждении дальнейшего прогрессирования процесса.
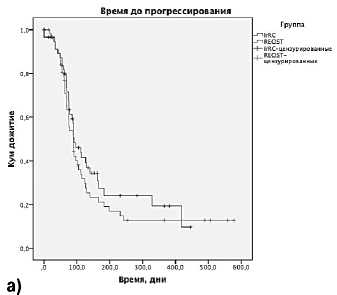
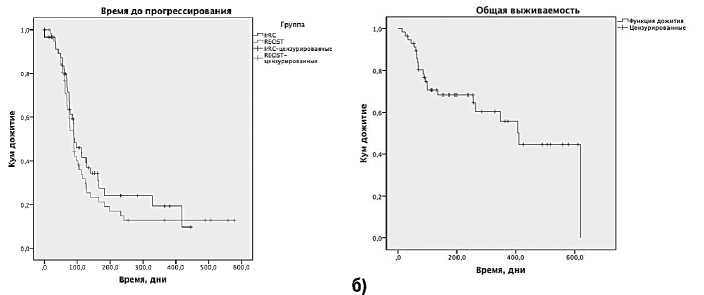
Оценка эффективности лечения ИПИ проводилась по системе RECIST 1.1 [1] и irRC [5]. Оценка времени до прогрессирования заболевания (ВДП) проводилась от начала терапии до первых признаков прогрессирования или до смерти больного от основного заболевания. Оценка общей выживаемости (ОВ) проводилась от начала терапии до смерти больного от любой причины. Медиана наблюдения за больными составила 144 дня. При анализе ВДП и ОВ цензурировано 28% и 57% наблюдений, соответственно.
Таблица 1. Характеристика больных, включенных в исследование по программе расширенного доступа 184-ЕАР в НИИ онкологии им. Н. Н. Петрова
|
Характеристика |
Абс. число |
% |
|
Всего больных |
71 |
100 |
|
Пол: |
||
|
Мужской |
44 |
61 |
|
Женский |
27 |
39 |
|
Средний возраст |
52 года |
|
|
диапазон |
28–76 лет |
|
|
Линия лечения: |
||
|
1 |
6 |
9 |
|
2 |
41 |
59 |
|
3 |
11 |
15 |
|
4 |
7 |
10 |
|
5 |
2 |
3 |
|
6 |
3 |
4 |
|
Локализация метастазов: |
||
|
Лимфатические узлы |
40 |
57 |
|
Кожа и мягкие ткани |
37 |
52 |
|
Легкие |
38 |
53 |
|
Печень |
20 |
28 |
|
Кости |
12 |
17 |
|
Головной мозг |
17 |
24 |
|
Селезенка |
6 |
9 |
|
Надпочечники |
7 |
10 |
|
Прочие |
4 |
5 |
Отечественные исследования в области фундаментальной и клинической онкологии
Результаты
У 71 больного проведено 229 введений препарата (в среднем-3,2). Тридцать девять больных (59%) получили 4 введения препарата, 12 (6%) – 3 введения, 21 (35%) – 1–2 введения. Среди последних пациентов 12 продолжают терапию в настоящий момент.
Большинство пациентов имело хотя бы одно нежелательное явление (НЯ), связанное с лечением. У 15 больных (21,1%) нежелательных явлений не наблюдалось. 107 введений препарата (46,7%) прошли без нежелательных явлений.
НЯ на фоне терапии ИПИ, связь которых с лечением была возможна, представлены в таблице 2.
Трое больных умерло от НЯ, возможно связанных с проводимой терапией: 1 – от почечной недостаточности, 1 – от тромбоэмболии легочной артерии, 1 – от отека головного мозга на фоне прогрессирования процесса. Влияние терапии ИПИ на танатогенез у этих больных не может быть полностью исключено.
НЯ 3–4 ст. наблюдались у 10 (14%) больных. Развитие у 1 пациентки повышения уровня трансаминаз (АЛТ и АСТ) 4 ст. потребовало прекращения терапии после 2 циклов лечения. Причиной преждевременного прекращения лечения ИПИ стала также аллергическая реакция 2 ст. у 1 больнй после 2 цикла лечения. Все вышеуказанные осложнения успешно контролировались введением высоких доз глюкокортикоидов в соответствии с рекомендациями по лечению иммуноопосредованных нежелательных явлений [4]. При развитии одышки, слабости, сыпи и диареи 3 ст., очередное введение ИПИ откладывалось до снижения уровня НЯ до 1 ст. с последующим продолжением лечения в прежней дозе.
Объективный ответ на проведенное лечение оценен у 54 больных. У 3 больных зарегистрирован полный регресс заболевания (ПР), у 6 – частичный регресс (ЧР), у 6 – стабилизация процесса (СЗ), у 39 – прогрессирование заболевания (ПЗ). По системе RECIST частота объективного ответа составила 17% (6% – ПР, 11% – ЧР), у 11% наблюдалась СЗ. При оценке эффективности по системе irRC отмечено увеличение количества больных со стабилизацией процесса до 16%.
При оценке выживаемости ВДП по системе RECIST составило 81 день (около 2,9 мес.), 95% доверительный
Таблица 2. Нежелательные явления при терапии ИПИ
Таблица 3. Сравнительная оценка нежелательных явлений на фоне терапии ИПИ
|
Нежелательное явление |
Hodi F.S et al, 2011 [2] |
Tarhini A. [4] |
НИИ онкологии им. Н. Н. Перова |
||||||||||
|
N=131 |
N=1498 |
N=71 |
|||||||||||
|
1–2 ст., |
3–4 ст., |
1–2 ст., |
3–4 ст., |
1–2 ст., |
3–4 ст., |
||||||||
|
Слабость |
46 |
35,1% |
9 |
6,9% |
не сообщено |
19 |
26,8% |
2 |
2,8% |
||||
|
Диарея |
24 |
18,3% |
6 |
4,6% |
450 |
30,0% |
104 |
6,9% |
21 |
29,6% |
2 |
2,8% |
|
|
Колит |
3 |
2,3% |
7 |
5,3% |
46 |
3,1% |
74 |
4,9% |
0 |
0,0% |
0 |
0,0% |
|
|
Сыпь |
24 |
18,3% |
1 |
0,8% |
461 |
30,8% |
37 |
2,5% |
32 |
45,1% |
3 |
4,2% |
|
|
Эндокринные нарушения |
7 |
5,3% |
3 |
2,3% |
34 |
2,3% |
34 |
2,3% |
1 |
1,4% |
0 |
0,0% |
|
Применение ипилимумаба у больных диссеминированной меланомой кожи
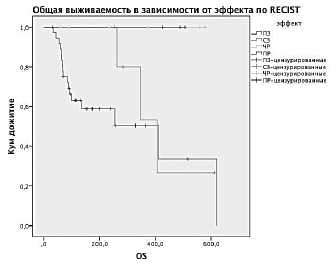
При сравнении выживаемости больных в зависимости от эффекта терапии выявлено, что больные с ПР и ЧР жили существенно дольше, чем больные с ПЗ (р=0,045).
Обсуждение
Анализ НЯ в ходе проведения терапии ИПИ проводился как в регистрационном исследовании и в исследовании F. S. Hodi с соавторами [2], где монотерапию ИПи получали 131 больной, так и в исследовании A. Tarhini [4], в котором проведен объединенный анализ данных о нежелательных явлений у 1498 больных, принимавших участие в различных исследованиях II–III фазы. Сравнительные результаты выявления иммуноопосредованных НЯ в этих исследованиях и у больных, получавших ИПИ в нашем центре, представлены в таблице 3.
Как видно из представленных данных спектр нежелательных явлений внашем исследовании был идентичен таковому в проведенных крупных исследованиях II–III фазы.
При оценке частоты объективных ответов в нашем исследовании отмечалось статистически незначимое увеличение количества полных и частичных регрессов и более низкий уровень стабилизации заболевания по сравнению с регистрационным исследованием F. S. Hodi [2]. Интересно отметить, что существенно большее число больных в нашем исследовании имели метастатическое поражение головного мозга, что не отразилось на результатах применения препарата.
Таким образом, терапия ИПИ удовлетворительно переносится большинством больных и обладает значимой клинической эффективностью в качестве второй и последующих линий лекарственной терапии у пациентов диссеминированной меланомой кожи. Результаты применения препарата в рамках программы расширенного доступа соответствуют таковым регистрационного исследования. Необходим поиск маркеров эффективности терапии ИПИ для лучшего отбора больных и повышения эффективности применения данного лечебного подхода.
в)
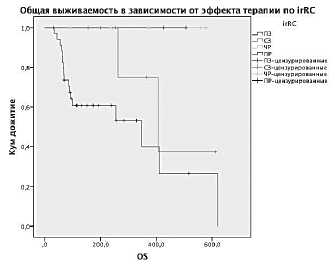
Рисунок 1. Выживаемость больных в программе расширенного доступа к ИПИ.
А – ВДП, Б – ОВ.
В – ОВ в зависимости от эффекта терапии по RECIST,
Г – ОВ в зависимости от эффекта терапии по irRC.
г)
Список литературы Применение ипилимумаба у больных диссеминированной меланомой кожи
- Eisenhauer E. A., Therasse P., Bogaerts J., et al. New response evaluation criteria in solid tumours: Revised recist guideline (version 1.1)//Eur J Cancer.-2009. -V.45-I.2-P.228-247
- Hodi F. S., O’Day S. J., McDermott D. F., et al. Improved survival with ipilimumab in patients with metastatic melanoma//N Engl J Med.-2010.-V.363-I.8-P.711-723
- Postow M. A., Harding J. Wolchok J. D. Targeting immune checkpoints: Releasing the restraints on anti-tumor immunity for patients with melanoma//Cancer J.-2012.-V.18-I.2-P.153-159
- arhini A. Immune-mediated adverse events associated with ipilimumab ctla-4 blockade therapy: The underlying mechanisms and clinical management//Scientifica (Cairo).-2013.-V.2013-I.857519
- Wolchok J. D., Hoos A., O’Day S., et al. Guidelines for the evaluation of immune therapy activity in solid tumors: Immune-related response criteria//Clin Cancer Res.-2009.-V.15-I.23-P.7412-7420


