Применение клеточных технологий при термических ожоговых повреждениях кожи (опыт ФГБУ ГНЦ ФМБЦ им А. И. Бурназяна ФМБА России)
Автор: Самойлов А.С., Астрелина Т.А., Аксененко А.В., Кобзева И.В., Сучкова Ю.Б., Никитина В.А., Усупжанова Д.Ю., Брунчуков В.А., Брумберг В.А., Расторгуева А.А., Махова А.Е., Карасева Т.В., Ломоносова Е.Е., Добровольская Е.И., Удалов Ю.Д.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Научные школы и памятные даты
Статья в выпуске: 4 т.15, 2019 года.
Бесплатный доступ
Цель: проанализировать результаты применения аутологичных регенеративных клеток жировой ткани (ЖТ) в комплексной терапии ожоговых пациентов с глубокими термическими поражениями. Материал и методы. Применение клеточных технологий осуществлено 5 пациентам (4 мужчины и 1 женщина) в возрасте 23-45 лет с термическими ожоговыми повреждениями кожи III-IV степени различной этиологии и локализации, площадью поражения от 1 до 80%. Пациенты получали общепринятую консервативную терапию ожоговых ран. После стабилизации общего состояния и положительной динамики местного процесса в ране во время проведения плановых хирургических обработок ожоговых поверхностей пациенты получали биологический материал ЖТ. Объем липоаспирата ЖТ составил 195,0±74,2 мл. Для клинического применения ЖТ получали стромально-васкулярную фракцию (СВФ)ЖТ Пациентам осуществляли интрадермальное введение СВФЖТ в количестве от 10 млн до 50 млн клеток в объеме 5 мл в 10-15 точек вокруг повреждения кожных покровов. Результаты. При осмотре через 2,5 месяца с момента введения СВФ ЖТ у пациентов отмечались хорошие косметические и функциональные результаты. Кожа мягкая, эластичная, отсутствуют грубые гипертрофические и келоидные рубцы, а также контрактуры. Рубцы не выделяются. Движения в суставах сохранены. Заключение. Применение СВФ ЖТ в ранние сроки после травмы способствовало активизации репаративных процессов в дерме, что снижало местную воспалительную реакцию, ускоряло сроки эпителизации, восстановления эластичности кожных покровов с уменьшением выраженности фиброзных рубцов и приводило к отсутствию ограничений подвижности в суставах.
Аутологичная стромально-васкулярная фракция жировой ткани, клеточная терапия, ожоговая травма
Короткий адрес: https://sciup.org/149135496
IDR: 149135496 | УДК: 60.606,61.617-089,61.616-08-031.84,61.616-08-039.34
Текст научной статьи Применение клеточных технологий при термических ожоговых повреждениях кожи (опыт ФГБУ ГНЦ ФМБЦ им А. И. Бурназяна ФМБА России)
1Введение. Ожоговые повреждения — одни из самых распространенных в мире травматических поражений кожи, представляющих собой серьезную социальную проблему. Каждый год в России регистрируют более 600 тыс. случаев ожоговых травм, общая летальность которых составляет 2,3-8,6% [1–5]. Обширные глубокие ожоги, локализованные на открытых частях тела или в области проекции суставов могут сопровождаться образованием гипертрофических рубцов, контрактур, значительными функциональными и косметическими дефектами, устойчивыми к стандартной терапии, что приводит к длительному процессу реабилитации, существенному снижению качества жизни и является основной причиной инвалидизации таких пациентов.
Новейшая специализированная медицинская помощь ожоговым пациентам с глубокими термическими поражениями кожи должна базироваться на комплексном подходе, способном привести не только к спасению их жизни, но и к полноценному восстановлению поврежденного кожного покрова, с целью достижения максимального косметического и функционального результата. Это необходимо для полноценной реабилитации пациента, его возвращения в общество как в физическом, так и в социально-трудовом аспекте. Современные способы пластической хирургии не всегда позволяют достичь удовлетворительного результата. В ряде случаев у пациентов после проведения кожно-пластического оперативного лечения сохраняются такие неблагоприятные последствия, как отторжение трансплантатов, формирование патологических рубцов, контрактур и/или сохранение рубцовых деформаций.
В связи этим разработка новых способов усовершенствования комплексного консервативного лечения ожоговых для улучшения результатов реконструктивно-восстановительного лечения пациентов с обширными повреждениями кожных покровов является важной задачей современной медицины.
На сегодняшний день показана высокая эффективность применения клеточной терапии мультипо-тентными мезенхимальными стволовыми клетками (ММСК) для заживления кожных ран различной этиологии [6–11]. При клиническом применении доказана безопасность клеточной терапии, а также установлено, что трансплантация ММСК прерывает патологическую воспалительную фазу воспаления, приводя к ускорению темпов заживления, а также к полному закрытию всех кожных дефектов. Однако предложенный метод лечения требует длительного культивирования ММСК.
В последние годы одним из наиболее перспективных направлений в клеточной терапии является применение аутологичных регенеративных клеток жировой ткани, которые также могут быть применены для устранения кожных дефектов и имеют характеристики, аналогичные ММСК [12]. Данный тип клеток обладает большим регенераторным потенциалом и не требует предварительного культивирования (готовы к использованию сразу после выделения). Эффект регенеративных клеток жировой ткани реализуется за счет нескольких механизмов, учитывая гетерогенность их популяции. Стволовые клетки, входящие в состав регенеративных клеток жировой ткани, способны к дифференцировке в различных направлениях и замещению поврежденных участков. Кроме того, они вырабатывают большое количество паракринных факторов, обеспечивающих иммуномодулирующий эффект, предотвращают клеточную гибель через апоптоз, способствуют неоангиогенезу, ремоделированию фиброзной и соединительной тканей. На экспериментальных моделях показано, что регенеративные клетки жировой ткани могут быть использованы для ускорения заживления, восстановления повреждений кожи, улучшения ее эпителизации и ангиогенеза [13]. В проведенных доклинических и пилотных клинических исследованиях подтверждены безопасность и положительное влияние регенеративных клеток жировой ткани на течение раневого процесса при нарушении целостности кожных покровов различной этиологии [12–14].
В настоящей статье рассмотрены клинические примеры применения аутологичных регенеративных клеток жировой ткани в комплексной терапии пациентов с термическими ожоговыми повреждениями кожи.
Цель: проанализировать результаты применения аутологичных регенеративных клеток жировой ткани (ЖТ) в комплексной терапии ожоговых пациентов с глубокими термическими поражениями.
Материал и методы. За период с 2015 по 2018 г. в ФГБУ ГНЦ ФМБЦ им. А. И. Бурназяна ФМБА России пролечены 5 пациентов (4 мужчин и 1 женщина) в возрасте от 23 до 45 лет (средний возраст составил 35,5±12,3 года) с глубокими термическими поражениями кожи и ее придатков III–IV степени различной этиологии и локализации, площадью поражения от 1 до 80% во время проведения комплексной терапии. Основными этиологическими факторами при получении ожогов у пациентов были: горячая жидкость (1 пациентка), пламя от вольтовой дуги (3 пациента) и открытое пламя (1 пациент).
Для оценки глубины поражения кожных покровов в работе придерживались 4-степенной классификация ожогов. Диагностику глубины поражения проводили традиционными методами, определяя в динамике состояние эпидермиса и придатков кожи, цвета ожоговой поверхности, различные виды чувствительности.
Пациенты получали общепринятую консервативную терапию ожоговых ран.
После стабилизации общего состояния пациента и положительной динамики местного процесса в ране, после подписания информированного согласия (выписка этического комитета №8А от 02.03.2016 г.), во время проведения плановых хирургических обработок ожоговых поверхностей с целью получения биологического материала жировой ткани (ЖТ) для клеточной терапии в операционной пациенту под общим наркозом проводили аспирационную липосакцию в нижней трети передней брюшной стенки. Объем аспирируемой жировой ткани составлял от 150 до 250 мл, в среднем 172,8±24,5 мл. Для клинического применения ЖТ отмывали, проводили ферментативную обработку коллагеназой, центрифугировали и получали стромально-васкулярную фракцию (СВФ) ЖТ.
Проводили тестирование СВФ ЖТ на стерильность (инфекционную безопасность); выполняли подсчет количества клеток с помощью автоматического счетчика клеток Counterss Invitrogen (Invitrogen); иммунологическую оценку (иммунофенотип) и жизнеспособность осуществляли методом проточной цитофлюориметрии (BD FACS Canto II, USA). Для исследования фенотипа клеток СВФ использовались моноклональные антитела к следующим антигенным маркерам: CD146, CD31, CD45, CD34, CD105, CD90, CD73, CD11c, CD64 и краситель на жизнеспособность 7-ADD. Окрашивание проводили в соответствии с рекомендациями производителя.
Пациентам в асептических условиях проводили интрадермальное введение аутологичных СВФ ЖТ в количестве от 10х106 до 50х106 клеток в объеме 5 мл в 10–15 точек вокруг повреждения кожных покровов.
Результаты. Пациенты доставлялись в стационар на 1–3 сутки после получения травмы. Пациентам проводились стандартные мероприятия общей интенсивной противошоковой терапии, местной консервативной терапии ожоговых поверхностей в сочетании с радикальными некрэктомиями (рис. 1).
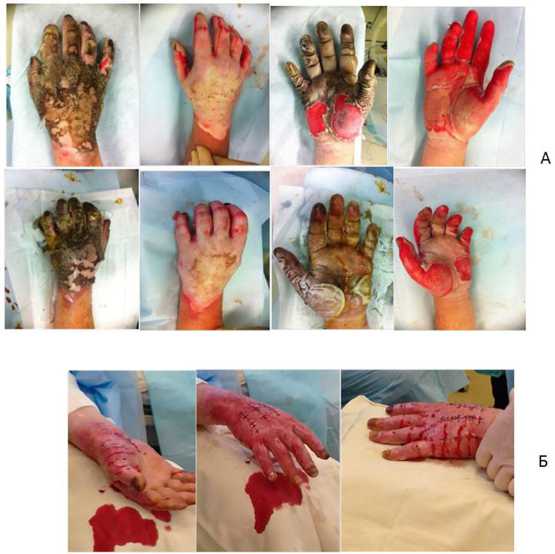
Рис. 1. Состояние кожных покровов кистей рук у пациентов на третьи сутки после получения травмы. Состояние после некрэктомии: А — пациент Е.; Б — пациент К.
В случае нарушения скользящей функции сухожилий проводили комплексную стандартную терапию по восстановлению функции.
За это время общее состояние пациентов стабилизировалось, местный процесс в ожоговых ранах приобрел положительную динамику. Для создания благоприятных условий заживления ран, усиления репаративных процессов, сокращения сроков заживления осуществляли забор жировой ткани. После подсчета количества полученных клеток СВФ, определения иммунофенотипа и их жизнеспособности выполняли в асептических условиях интрадермаль-ные инъекции клеточной суспензии в 10–15 точек раневой поверхности. Объем вводимой клеточной суспензии, содержащей аутологичные регенератив- ные клетки жировой ткани, составлял от 2 до 4 мл. Рекомендуемая доза аутологичных регенеративных клеток ЖТ составляла от 0,5 млн до 1,0 млн см2.
На 15±5 сутки после получения электротравмы с целью создания условий для заживления ран в условиях операционной пациентам было введено от 10х106 до 50х106 аутологичных СВФ ЖТ (рис. 2). Клеточная суспензия была сконцентрирована в 5 мл. В каждую раневую поверхность было введено по 2,5 мл клеточной суспензии.
На 25±5 сутки пациенты были выписаны из стационара в удовлетворительном состоянии. Отмечалось полное восстановление утраченных кожных покровов с хорошим косметическим и функциональным результатом, патологические рубцы отсутствовали (рис. 3).
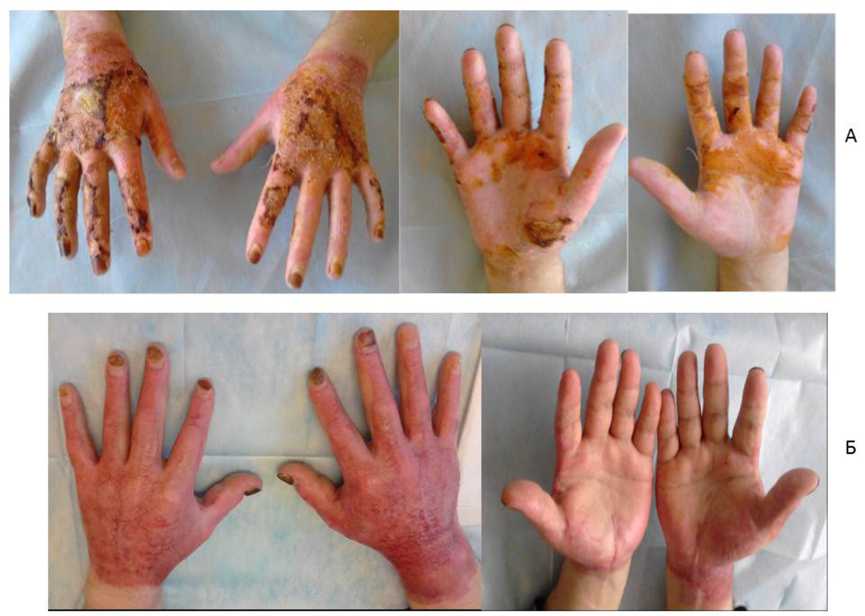
Рис. 2. Состояние кожных покровов кистей рук у пациентов с глубокими ожогами после аутодермопластики: А — пациент Е. на 15-е сутки; Б — пациент К. на 25-е сутки
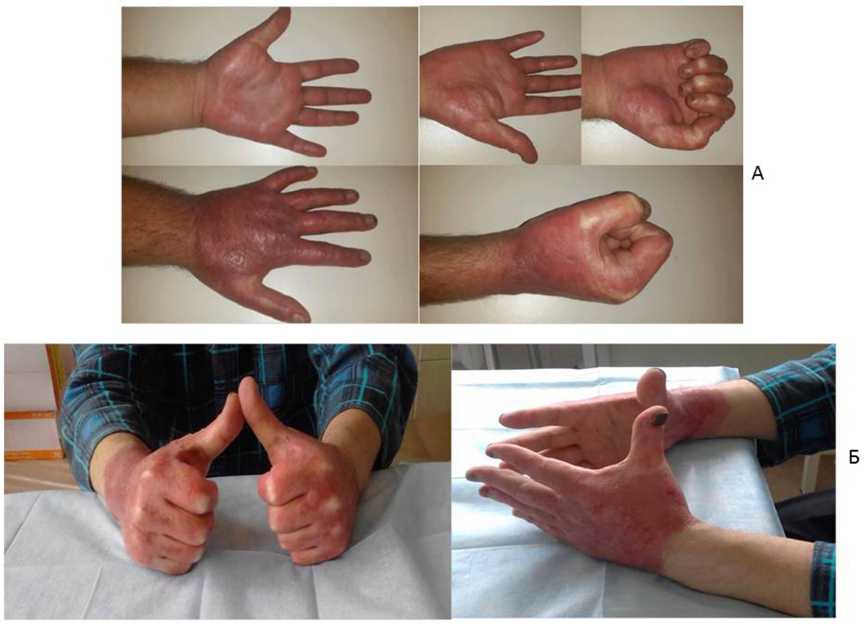
Рис. 3. Состояние кожных покровов после введения регенеративных клеток жировой ткани: А — пациент Е. через 2,5 месяца; Б — пациент К. через 1,5 месяца
При контрольных осмотрах через 2,0 и 2,5 месяца с момента введения СВФ ЖТ у пациентов отмечались хорошие косметические и функциональные результаты. Кожа мягкая, эластичная, отсутствуют грубые гипертрофические и келоидные рубцы, а также контрактуры. Рубцы не выделяются. Движения в кистевых суставах сохранены (см. рис. 3).
Серьезных нежелательных явлений и реакций, связанных с введением аутологичных регенеративных клеток жировой ткани, не отмечено.
Применение аутологичных регенеративных клеток (СВФ ЖТ) в ранние сроки после травмы способствовало активизации репаративных процессов в дерме, что снижало местную воспалительную реакцию, ускоряло сроки эпителизации, восстановления эластичности кожных покровов с уменьшением выраженности фиброзных рубцов и приводило к отсутствию ограничений подвижности и болезненных симптомов.
Обсуждение. Пациенты с глубокими термическими поражениями кожных покровов нуждаются в проведении оперативных пластических вмешательств, так как самостоятельный процесс эпителизации в данной области невозможен. Трансплантация сплошных и перфорированных лоскутов аутологичной кожи остается основным методом хирургического лечения таких пациентов [2, 3, 6]. Однако отторжение трансплантатов, формирование патологических рубцов и контрактур значительно удлиняет весь лечебный процесс, ухудшает результаты лечения и качество жизни пациентов. В связи с этим совершенствование системы оказания медицинской помощи пострадавшим является одной из актуальных проблем современной хирургии повреждений и интенсивной терапии.
Для ускорения сроков заживления поврежденных кожных покровов в настоящее время применяется некрэктомия с одномоментной или отсроченной аутодермопластикой кожным трансплантатом [2, 3, 6]. Трансплантация аутокожи считается наиболее приемлемым вариантом пластики. Однако такого рода пластика не всегда дает удовлетворительные функциональные и косметические результаты. Одним из перспективных методов лечения поражений кожи и ее придатков является клеточная терапия, применение которой в клинической практике может позволить сократить сроки приживления трансплантатов и повысить качество жизни пациентов. Для клеточной терапии используются: мезенхимальные стволовые клетки (МСК) [6, 7]; аутологичные минимально манипулированные продукты (регенеративные клетки) на основе жировой ткани [12–14]; паракринные факторы, полученные из культивированных стволовых клеток [11] и др.
В настоящее время активно применяется жировая ткань в пластической хирургии и клинической практике для лечения дефектов костей и объема мягких тканей, заболеваний опорно-двигательного аппарата и др. Эффект действия регенеративных клеток жировой ткани реализуется за счет дифференцировки их в различные направления и замещения поврежденных участков тканей, выработки паракринных факторов, обеспечивающих иммуномодулирующий эффект, предотвращение клеточной гибели по механизму апоптоза, неоангиогенеза, ремоделирование фиброзной и соединительной тканей [12–14]. Многочисленными исследованиями на лабораторных животных показано, что применение регенеративных клеток жировой ткани улучшает течение воспали- тельного процесса, ускоряет процессы заживления повреждений за счет улучшения неоангиогенеза и усиления пролиферации фибробластов [12–14]. Все это указывает на возможность успешного применения клеток жировой ткани при глубоких ожогах.
В проведенном нами исследовании продемонстрировано, что применение аутологичных регенеративных клеток в ранние сроки после травмы способствовало активизации репаративных процессов в дерме, снижало местную воспалительную реакцию, ускоряло сроки эпителизации, восстановления эластичности кожных покровов с уменьшением выраженности фиброзных рубцов и приводило к отсутствию ограничений подвижности и болезненных симптомов.
Таким образом, для повышения эффективности заживления раневой поверхности и подготовки раневой поверхности к аутодермопластике и при глубоких ожогах кожных покровов в ФГБУ ГНЦ ФМБЦ им. А. И. Бурназяна ФМБА России предложено использовать собственные регенеративные клетки СВФ ЖТ после стабилизации общего состояния пациента и положительной динамики местного процесса в ране во время проведения плановых хирургических обработок ожоговых поверхностей. Данные клетки и продуцируемые ими факторы роста и цитокины принимают участие в репаративных процессах, в восстановлении поврежденной сосудистой сети, а также в регуляции иммунных процессов. Благодаря высокой доступности получения ЖТ в достаточном объеме практически у любого пациента, возможности использовать полученные регенеративные клетки СВФ ЖТ сразу же после выделения без длительного культивирования этот метод представляет высокий интерес при реконструктивно-пластических операциях.
Заключение. Представленные результаты применения СВФ ЖТ при глубоких термических ожогах в комплексной терапии показывают возможность использовать собственные регенеративные клетки СВФ ЖТ непосредственно после стабилизации общего состояния пациента и положительной динамики местного процесса в ране во время проведения плановых хирургических обработок ожоговых поверхностей. Применение СВФ ЖТ при глубоких термических ожогах обеспечивает благоприятные условия для повышения эффективности комплексной терапии, сокращения сроков заживления раневой поверхности, регуляции и активации иммунных и репаративных процессов в дерме; способствует полному восстановлению поврежденной сосудистой сети и утраченных кожных покровов без грубых рубцовых изменений, приживлению пересаженных кожных лоскутов; помогает избежать повторных пластических операций, достичь удовлетворительного косметического и функционального результата, обеспечить достойное качество жизни пациентов.
Список литературы Применение клеточных технологий при термических ожоговых повреждениях кожи (опыт ФГБУ ГНЦ ФМБЦ им А. И. Бурназяна ФМБА России)
- Alekseev AA, Tyurnikov YuI. The main statistical indicators of work of burn hospitals of the Russian Federation for 2009. In: III congress of combustiologists of Russia. Moscow, 2010; p. 4–6. Russian (Алексеев А. А., Тюрников Ю. И. Основные статистические показатели работы ожоговых стационаров Российской Федерации за 2009 год. В кн.: III съезд комбyстиологов России: сб. тез. М., 2010; с. 4–6).
- Alekseev AA, Bobrovnikov AE, Krutikov MG, et al. Local conservative treatment of wounds at the stages of assistance to victims of burns: Clinical recommendations. Moscow, 2014; 22 p. Russian (Алексеев А. А., Бобровников А. Э., Крутиков М. Г. и др. Местное консервативное лечение ран на этапах оказания помощи пострадавшим от ожогов: клинические рекомендации / Общероссийская общественная организация «Объединение комбустиологов «Мир без ожогов». M., 2014; 22 c.).
- Bobrovnikov AE. Technology of local conservative treatment of burned: DSc diss. Moscow, 2012; 312 p. Russian (Бобровников А. Э. Технологии местного консервативной лечения обожженных: дис. … д-ра мед. наук. М., 2012; 312 с.).
- Hoogewerf CJ, Van Baar ME, Hop MJ, et al. Topical treatment for facial burns. In: Cochrane Database of Systematic Reviews. New Jersey: Copyright © 2013, Published by John Wiley & Sons, Ltd, 2013; 48 p. DOI: 10.1002 / 14651858. cd008058. pub2.
- European Practice Guidelines for Burn Care (Minimum Level of Burn Care Provision in Europe). Еdited Brychta P, Magnette A. with contribution of other members of the Executive Committee and РАМ Committee of European Burns Association (EBA), Netherlands, 2011.
- Evteev AA, Tyurnikov YuI, Malyutina NB, et al. Traditions and new in the use of local treatment in patients with deep burns. Electronic scientific and practical journal Combustiology. URL: http://combustiolog.ru / journal / traditsii-i-novoe-v-ispol-zovaniisredstvmestnogo-lecheniya-u-bol-ny-h-s-glubokimi-ozhogami / . (2006; 26) Russian (Евтеев А. А., Тюрников Ю. И., Малютина Н. Б. и др. Традиции и новое в использовании средств местного лечения у больных с глубокими ожогами. Электронный научно-практический журнал Комбустиология. URL: http://combustiolog.ru / journal / traditsii-i-novoe-v-ispol-zovaniisredstvmestnogo-lecheniya-u-bol-ny-h-s-glubokimi-ozhogami / . (2006; 26).
- Liu L, Yu Y, Hou Y, et al. Human umbilical cord mesenchymal stem cells transplantation promotes cutaneous wound healing of severe burned rats. PLoS One 2014; 20 (2): e88348.
- Liu X, Zhang G, Hou C, et al. Vascularized bone tissue formation induced by fiber-reinforced scaffolds cultured with osteoblasts and endothelial cells. Biomed Res Int 2013; 2013: 854917.
- Venugopal SS, Yan W, Frew JW, et al. A phase II randomized vehicle-controlled trial of intradermal allogeneic fibroblasts for recessive dystrophic epidermolysisbullosa. J Am Acad Dermatol 2013; 69 (6): 898–908.
- Shved IuA, Kukhareva LV, et al. Cultured skin cells interaction with polylactide surface coated by different collagen structures. Tsitologiya 2007; 49 (1): 32–9.
- Wille JJ, Burdge JJ, Pitttelkow MR. Rapid healing of chronic venous stasis leg ulcers treated by the application of a novel serum-free cultured autologous epidermis. Wound Repair Regen 2011 Jul-Aug; 19 (4): 464–74.
- Feisst V, Meidinger S, Locke MB. From bench to bedside: use of human adipose-derived stem cells. Stem Cells Cloning 2015; 2 (8): 149–62.
- Atalay S, Coruh A, Deniz K. Stromal vascular fraction improves deep partial thickness burn wound healing. Burns 2014; 40 (7): 1375–83. DOI: 10.1016 / j. burns. 2014.01.023.
- Guo J, Nguyen A, Banyard DA, et al. Stromal vascular fraction: A regenerative reality? Part 2: Mechanisms of regenerative action. Journal of Plastic, Reconstructive & Aesthetic Surgery 2016; 69 (2): 180–8. DOI: 10.1016 / j. bjps. 2015.10.014.


