Применение клеточных технологий в лечении ран различной этиологии
Автор: Крайнюков П.Е., Арцимович И.В., Зиновьев Е.В., Гостимский А.В., Костяков Д.В., Кокорин В.В., Вахаев Д.С.
Журнал: Вестник Национального медико-хирургического центра им. Н.И. Пирогова @vestnik-pirogov-center
Рубрика: Обзоры литературы
Статья в выпуске: 2 т.16, 2021 года.
Бесплатный доступ
Активное развитие тканевой инженерии и клеточных технологий позволило разработать новые методики лечения ран различной этиологии. Успехи, достигнутые в изучении биологии стволовых клеток человека in vitro и на экспериментальных моделях in vivo в последние десятилетия, не могли не привлечь к себе внимание практических врачей. Наиболее интенсивно в настоящее время исследуются эмбриональные, мезенхимальные, адипогенные мезенхимальные и гемопоэтические стволовые клетки. Постепенно возможности биотехнологического восстановления кожного покрова внедряются в практику как в нашей стране, так и за рубежом. С каждым годом количество клинических исследований, проводимых в разных странах мира неуклонно растет. Многие исследователи отмечают эффективность применения стволовых клеток в лечении полнослойных дефектов кожи. Однако, до конца не решенными остаются вопросы выбора идеального источника стволовых клеток и способа их доставки в зону раневого дефекта. Требуются дальнейшие экспериментальные и клинические исследования эффективности применения стволовых клеток и оценки их влияния на репаративный гистогенез.
Стволовая, мезенхимальная, клетка, рана, ожог, репарация, инженерия, технологии
Короткий адрес: https://sciup.org/140260100
IDR: 140260100 | DOI: 10.25881/20728255_2021_16_2_132
Текст научной статьи Применение клеточных технологий в лечении ран различной этиологии
Активное развитие клеточных технологий, которое наблюдается на протяжение последних нескольких десятков лет, способствовало расширению понимания биологии и физиологии стволовых клеток, кератиноцитов и фибробластов. Это позволило разработать инновационные методики лечения ран различной этиологии. Успехи, достигнутые в изучении биологии стволовых клеток человека in vitro и на экспериментальных моделях in vivo, не могли не привлечь к себе внимание практических врачей. Количество клинических исследований, проводимых в разных странах мира, неуклонно растет. Постепенно возможности биотехнологического восстановления кожного покрова внедряются в комбустиологическую практику как в нашей стране, так и за рубежом. Многие авторы показывают в своих работах эффективность применения стволовых клеток в лечении полнослойных дефектов кожи, однако, их использование остается весьма ограниченным, что связанно как с морально-этическими, так и правовыми проблемами.
Стволовые клетки
Стволовые клетки представляют собой популяцию самообновляющихся недифференцированных клеток, которые способны дифференцироваться в различные функциональные клетки [1]. Их принято разделять на три основных типа в зависимости от происхождения: эмбриональные, фетальные и постнатальные стволовые клетки. Они также классифицируются в зависимости от диапазона потенциалов дифференцировки на тотипотентные, плюрипотентные, мультипотентные, олигопотентные и унипотентные. По источнику принято выделять следу-

ющие типы стволовых клеток: эмбриональные и тканеспецифичные (мезенхимальные, эпидермальные и т.д.) (Рис. 1). Стволовые клетки обычно получают из костного мозга, пуповины, жировой ткани или кожи [2].
В последнее время стало все более распространенным применение стволовых клеток для лечения многочисленных заболеваний, таких как травмы спинного мозга, переломы костей, аутоиммунные заболевания, ревматоидный артрит, дефекты кроветворения, сохранение фертильности, восстановление кожных покровов [3].
Доказано, что стволовые клетки реагируют не только на биологические и механические свойства окружающей среды, но и на внешние механические сигналы, такие как сжимающая и растягивающая нагрузка, pH, поток жидкости, что непосредственно влияет на их дифференцировку [4]. Исследователями было показано, что во время воспалительной фазы заживления ран стволовые клетки присутствуют в раневом ложе [5; 6]. Кроме того, показано, что тяжелая травма приводит к увеличению количества циркулирующих стволовых клеток [7]. Наиболее перспективными для применения в медицинских целях представляются мезенхимальные стволовые клетки (МСК) за счет их доступности и адаптивности [8]. МСК способны направляться в область повреждённой ткани из-за экспрессии хемокиновых рецепторов в ответ на увеличение количества хемокинов в области повреждения ткани [9]. K. Akino и соавт. показано, что МСК способствуют миграции к раневому ложу таких клеток как фибробласты и кератиноциты [10]. Установлено, что применение этих клеток способствует ускорению процессов репаративной регенрации, индуцирует неоангиогенез, образование коллагена и грануляционной ткани [11]. Показано, что МСК секретируют в культуральные среды следующие факторы: трансформирующий фактор роста β 1 (TGF- β 1), фактор некроза опухоли α (TNF- α ), простагландин Е2 (PGE2), гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF), сосудистый эндотелиальный фактор роста (VEGF), тромбоцитарный фактор роста (PDGF) и интерлейкины: 6, 7, 8 и 11 [12; 13].
Для стандартизации подходов к применению клеточных культур и избежания недоразумений международным обществом клеточной терапии были признаны стандартные критерии для идентификации МСК:
-
1. Пластически адгезивные клетки;
-
2. Способность дифференцироваться в трилинейные линии, включая кости, хрящи и жиры;
-
3. Экспрессия специфических маркеров, таких как CD105, CD73 и CD90;
-
4. Отрицательная экспрессия CD45, CD34, CD11b, CD14, CD79a и HLA-DR [14].
Стволовые клетки в экспериментальны исследованиях
Большое количество исследователей подтверждают, что местное применение стволовых клеток положительно сказывается на регенерации тканей и заживлении ран. Так, S. Ichioka и соавт. показали в своем экспериментальном
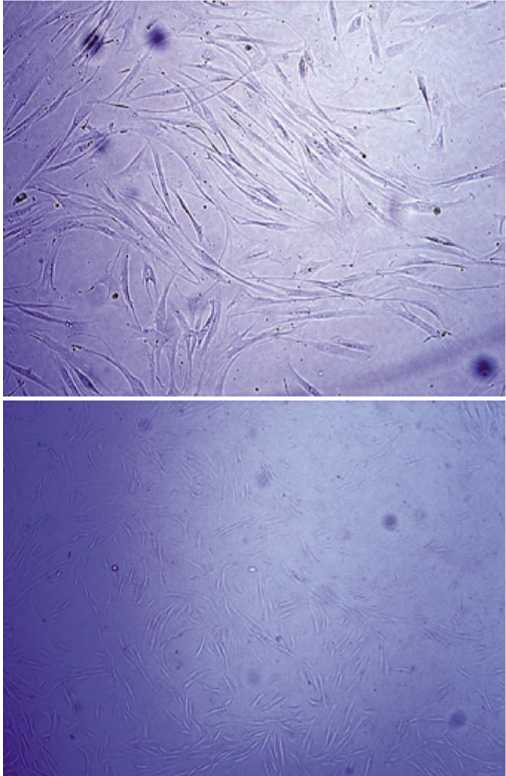
Рис. 1. Мезенхимальные стволовые клетки.
исследовании значительное увеличение количества новообразованный микрососудов в зоне раневого дефекта у лабораторных мышей [15]. V. Falanga и соавт. сообщили об эффективности применения полимерного фибринового спрея с аутологичными МСК, полученными из красного костного мозга. Авторы наблюдали увеличение скорости репаративной регенерации острых кожных ран в экспериментальном исследовании на мышах, а позже и у людей [16]. М.Ф. Расулов в экспериментальном исследовании на крысах показал эффективность местного нанесения МСК на поверхность ожоговых ран [17]. Гистологически было установлено, что происходило ускорение смены фаз процессов регенерации, уменьшался период клеточной инфильтрации и ускорялись темпы формирования грануляционной ткани. J. Li проводил исследование амниотических МСК на лабораторных мышах [18]. Было показано, что культивированные амниотические МСК после внутрикожного введения образовывали монослой адгезивных клеток и демонстрировали веретенообразную, фибробластоподобную морфологию. Авторы заключили, что амниотические МСК за счет своих паракринных эффектов ингибируют апоптоз клеток кожи и способствуют
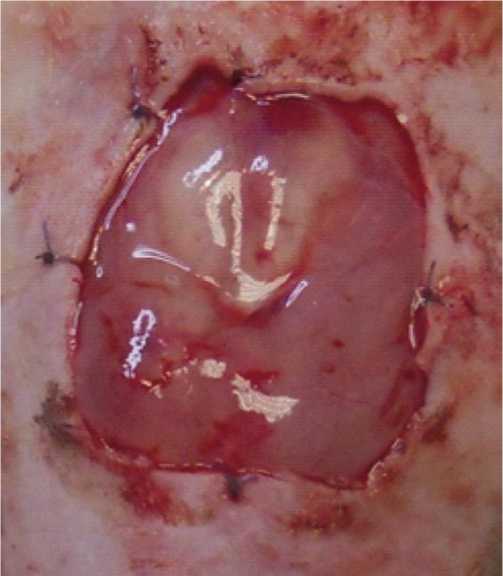
Рис. 2. Субфасциальное введение суспензии адипогенных МСК на модели раны глубокого ожога III степени.
их пролиферации in vitro через активацию сигнального пути PI3K/AKT.
В экспериментальных исследованиях продемонстрирована возможность как местного введения стволовых клеток (Рис. 2), так и внутривенного или в сочетании с носителем либо матрицей, но идеального метода пока не предложено [19].
Применение стволовых клеток в клинике
T. Yoshikawa и соавт. использовали МСК красного костного мозга для лечения группы из 20 пациентов с этиологически различными незаживающими ранами, включая ожоги, язвы нижних конечностей и пролежни. У 18 из 20 пациентов констатировано полное заживление ран. Гистологическое исследование выявило, что применение МСК способствовало ускорению регенерации тканей [20]. Lee было проведено клиническое исследование на 15 пациентах мужчинах, страдающих критической ишемией конечностей с ишемической болью покоя в 1 конечности с незаживающими язвами. Через 6 месяцев после внутримышечного введения культуры МСК, полученных из жировой ткани, наблюдалось значительное улучшение самочувствия пациентов, отмеченное по шкалам оценки боли и хромоты при ходьбе, методом цифровой ангиография установлено образование многочисленных сосудистых коллатеральных сетей поперек пораженных артерий [21]. Marino провел клиническое исследование на группе из 20 пациентов, включавшей 14 мужчин и 6 женщин, страдавших хроническими язвами нижних конечностей [22]. Установлено, что инъекции препарата МСК в края язвенного дефекта привело к уменьшению диаметра и глубины язв, уменьшению болевого синдрома, связанного с язвенным процессом, а в 6 из 10 случаев — полное заживление язвы.
А.И. Колесниковой показана эффективность применения композиции, содержащей МСК, в экспериментальном исследовании на крысах и клиническом исследовании. Установлено, МСК обладают выраженным противовоспалительным и ранозаживляющим лечебным эффектом [23; 24]. К.В. Котенко была показана эффективность лечения радиационных ожогов кожи культурой аллогенных МСК [25]. Описанные клинические наблюдения лечения радиационных ожогов демонстрируют, что применение МСК обеспечило активный рост грануляционной ткани, выраженную краевую эпителизацию и иммуномодулирующий эффект.
Наиболее перспективным в настоящий момент представляется комбинированное применение МСК с природными биополимерами. Лучшими природными биополимерами, выступающими материалом для изготовления раневых покрытий либо скаффолдов, являются: коллаген, хитозан, гиалуроновая кислота и карбоксиме-тилхитозан. Коллаген — фибриллярный белок, являющийся основой соединительной ткани, обладает высокой степенью клеточной адгезии, способностью поддерживать миграцию клеток и хорошую биодеградируемость. Однако, каркасы из коллагена достаточно быстро подвергаются биологической деградации. Для повышения целостности и стабильности каркасов, изготовленных из коллагена, используются химические, ультрафиолетовые и ферментативные методы сшивания, что может снизить скорость его деградации (Рис. 3) [26].
Хитозан — природный полимер, полученный из хитина, широко используемый наряду с коллагеном в комбустиологической практике благодаря высокой биосовместимости, биодеградируемости, гемостатической активности и своим антибактериальным свойствам (Рис. 4) [27]. Также благодаря гибкости и эластичности молекул хитозана, показано значительное уменьшение размеров рубцов при использовании покрытий на основе хитозана для заживления ожоговых ран [28].
На основе хитозана создают пленки, гели, губки, и они были исследованы для использования при лечении полнослойных ожоговых ранах. Однако недостатком его является быстрая биодеградируемость [29; 30]. Также хитозан плохо растворим в водных растворах, что накладывает ограничения на применение хитозана, так как это может существенно замедлить инкапсуляцию клеток [31]. Гиалуроновая кислота путем химического сшивания и модификации поверхности может улучшить механические свойства и клеточное сродство скаффолдов [32]. Доказано, что гиалуроновая кислота усиливает пролиферацию фибробластов и кератиноцитов, поэтому её часто используют в тканевой инженерии для изготовления двухслойных заменителей кожи [33].

Рис. 3. Трансмиссионная электронная микроскопия. Увеличение дано на снимке. А — расположение волокон коллагена (КВ) и протеогликанов (указаны стрелками) в сухожилии. Б — распределение и диаметр коллагеновых фибрилл ахиллова сухожилия, средний диаметр волокна 0,052 мкм. Поперечный срез.

Рис. 4. Электронная микрофотография хитозанового волокна (А), аксиальный срез (Б). Увеличение дано на снимке.
Е.В. Зиновьев и соавт. описали успешные случаи комбинированного лечения глубоких ожогов кожи III–IV степени с применением культур МСК [34–36]. Так, авторы разносторонне применяли МСК, как самостоятельно, так и в сочетании с природными биополимерными раневыми покрытиями и хирургическими методами лечения. Была показана высокая эффективность совместного применения МСК и раневых покрытий на основе природных полимеров, а аппликация геля, содержащего культуру МСК и гиалоурановую кислоту, позволило не только сократить сроки заживления, но и снизить частоту инфекционных осложнений.
Несмотря на большие перспективы применения МСК, как универсального средства для лечения больных, страдающих длительно незаживающими хроническими ранами, и пострадавших от термических ожогов кожи существует ряд ограничений. Одним из таких ограничений, которое нельзя было бы не упомянуть, является онкогенный потенциал стволовых клеток [37; 38]. Прохоровой, Gutierrez-Aranda и рядом других исследователей было показано в экспериментальном исследовании на мышах, что плюрипотентные стволовые клетки могут приводить к образованию тератом [39; 40]. В настоящее время изучаются способы устранения тератогенного потенциала стволовых клеток. Клеточная дифференцировка перед трансплантацией клеток является одним из подходов к снижению риска образования тератомы [41]. Однако, хотелось бы отметить, что в исследованиях, показывающих тератогенный эффект стволовых клеток использовались модели с внутримышечным или системным введением стволовых клеток. До сих пор не было проведено ни одного исследования тератогенного по-
тенциала стволовых клеток при их кожном применении. Данная проблема является ещё не до конца изученной и требует проведения дальнейших экспериментальных исследований.
Заключение
Очевидно, что стволовые клетки обладают огромным потенциалом для регенерации кожи, способствуя ускорению заживления ран паракринным способом. В настоящее время наиболее интенсивно исследуются эмбриональные стволовые клетки, МСК стволовые клетки, адипогенные МСК и гемопоэтические стволовые клетки. Полученные данные о клиническом применении МСК-терапии с целью улучшения репаративной регенерации кожи показали большие перспективы в качестве терапевтического средства в клинической практике. Несмотря на быстрый прогресс и широкую заинтересованность в изучении стволовых клеток, до конца нерешенными остаются вопросы выбора идеального источника стволовых клеток и способа их доставки в зону раневого дефекта. Необходимы дальнейшие экспериментальные и клинические исследования по применению стволовых клеток в заживлении ран различной этиологии.
Авторы заявляют об отсутствии конфликта интересов (The authors declare no conflict of interest).
(In Russ).] doi: 10.17816/PED9412-27.
Список литературы Применение клеточных технологий в лечении ран различной этиологии
- Gluckman E, Broxmeyer HA, Auerbach AD, et al. Hematopoietic reconstitution in a patient with Fanconi's anemia by means of umbilical-cord blood from an HLA-identical sibling. N.Engl.J.Med. 1989; 321: 1174.
- Menasche P, Hagege AA, Scorsin M, et al. Myoblast transplantation for heart failure. Lancet. 2001; 357(9252): 279.
- Murphy MB, Moncivais K, Caplan AI. Mesenchymal stem cells: environmentally responsive therapeutics for regenerative medicine. Exp. Mol Med. 2013; 45(11): e54. Published 2013 Nov 15. doi:10.1038/emm. 2013.94.
- Friedenstein AJ, Chailakhyan RK, Latsinik NV, Panasyuk AF, Keiliss-Borok IV. Stromal cells responsible for transferring the microenvironment of the hemopoietic tissues. Cloning in vitro and retransplantation in vivo. Transplantation. 1974; 17(4): 331 -340. doi:10.1097/ 00007890-197404000-00001.
- Cottler-Fox M.H, Lapidot T, Petit I, Kollet O, DiPersio JF, Link D, Devine S. Stem cell mobilization. Hematology Am Soc Hematol Educ Program. 2003; 1: 419-437. doi: 10.1182/asheducation-2003.1.419.
- Fu S, Liesveld J. Mobilization of hematopoietic stem cells. Blood Rev. 2000; 14(4): 205-218. doi: 10.1054/blre.2000.0138.
- Kucia M, Ratajczak J, Reca R, JanowskaWieczorek A, Ratajczak MZ. Tissue-specific muscle, neural and liver stem/progenitor cells reside in the bone marrow, respond to an SDF-1 gradient and are mobilized into peripheral blood during stress and tissue injury. Blood Cells Mol Dis. 2004; 32(1): 52-57. doi: 10.1016/j. bcmd.2003.09.025.
- Haynesworth SE, Baber MA, Caplan AI. Cell surface antigens on human marrow-derived mesenchymal cells are detected by monoclonal antibodies. Bone. 1992; 13(1): 69-80. doi:10.1016/8756-3282(92)90363-2.
- Mito M, Kusano M, Kawaura Y. Hepatocyte transplantation in man. Transplant. Proc. 1992; 24: 3052.
- Akino K, Mineda T, Akita S. Early cellular changes of human mesenchymal stem cells and their interaction with other cells. Wound Repair Regen. 2005; 13(4): 434-440. doi: 10.1111/j.1067-1927.2005.130411.x.
- Raper SE, Grossman M, Rader DJ, et al. Safety and feasibility of liver directed ex vivo gene therapy for homozygous familial hypercholesterolemia. Ann. Surg. 1996; 223: 116.
- Prichard HL, Reichert W, Klitzman B. IFATS collection: Adipose-derived stromal cells improve the foreign body response. Stem Cells. 2008; 26(10): 2691-2695. doi:10.1634/stemcells.2008-0140.
- Kilroy GE, Foster SJ, Wu X, et al. Cytokine profile of human adipose-derived stem cells: expression of angiogenic, hematopoietic, and pro-inflammatory factors. J Cell Physiol. 2007; 212(3): 702-709. doi:10.1002/jcp.21068.
- Dominici M, Le Blanc K, Mueller I, et al. Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement. Cytotherapy. 2006; 8(4): 315-317. doi:10.1080/14653240600855905.
- Ichioka S, Kouraba S, Sekiya N, Ohura N, Nakatsuka T. Bone marrow-impregnated collagen matrix for wound healing: experimental evaluation in a microcirculatory model of angiogenesis, and clinical experience. Br J Plast Surg. 2005; 58(8): 1124-1130. doi: 10.1016/j.bjps.2005.04.054.
- Falanga V, Iwamoto S, Chartier M, Yufit T, Butmarc J, Kouttab N. Autologous bone marrow-derived cultured mesenchymal stem cells delivered in a fibrin spray accelerate healing in murine and human cutaneous wounds. Tissue Eng. 2007; 13(6): 1299-1312. doi: 10.1089/ten.2006.0278.
- Расулов М.Ф. Использование мезенхимальных стволовых клеток костного мозга и эмбриональных фибробластов в лечении ожоговых ран // ТМЖ. — 2004. — №1. — С. 7-9. [Rasulov MF. Ispol'zovaniye mezenkhimal'nykh stvolovykh kletok kostnogo mozga i embrional'nykh fibroblastov v lechenii ozhogovykh ran. Pacific medical journal. 2004; 1: 7-9. (In Russ).]
- Li JY, Ren KK, Zhang WJ, et al. Human amniotic mesenchymal stem cells and their paracrine factors promote wound healing by inhibiting heat stress-induced skin cell apoptosis and enhancing their proliferation through activating PI3K/AKT signaling pathway. Stem Cell Res Ther. 2019; 10(1): 247. Published 2019 Aug 9. doi:10.1186/s13287-019-1366-y.
- Francis E, Kearney L, Clover J. The effects of stem cells on burn wounds: a review. Int J Burns Trauma. 2019 Feb 15; 9(1): 1-12. PMID: 30911430; PMCID: PMC6420705.
- Yoshikawa T, Mitsuno H, Nonaka I, Sen Y, Kawanishi K, Inada Y, Takak-ura Y, Okuchi K, Nonomura A. Wound therapy by marrow mesenchymal cell transplantation. Plast Reconstr Surg. 2008; 121(3): 860-877. doi: 10.1097/01 .prs.0000299922.96006.24.
- Lee HC, An SG, Lee HW, et al. Safety and effect of adipose tissue-derived stem cell implantation in patients with critical limb ischemia: a pilot study. Circ J. 2012; 76(7): 1750-1760. doi:10.1253/circj.cj-11-1135.
- Marino G, Moraci M, Armenia E, et al. Therapy with autologous adipose-derived regenerative cells for the care of chronic ulcer of lower limbs in patients with peripheral arterial disease. J Surg Res. 2013; 185(1): 36-44. doi: 10.1016/j.jss.2013.05.024.
- Колесникова И.А. Мезенхимальные (стромальные) стволовые клетки костного мозга человека в медицинской практике: обоснование, результаты и перспективы // Гематология и трансфузиология. — 2008. — Т.53. — №5. — С.36-39. [Kolesnikova IA. Mezenkhimal'nyye (strom-al'nyye) stvolovyye kletki kostnogo mozga cheloveka v meditsinskoy prak-tike: obosnovaniye, rezul'taty i perspektivy. Hematol. and transfusiol. 2008; 53(5): 36-39. (In Russ).]
- Цыб А.Ф., Коноплянников А.Г., Колесникова А.И., Павлов В.В. Получение и использование в медицине клеточных культур из мезенхимальных стволовых клеток костного мозга человека // Вестник Российской академии медицинских наук. — 2004. — №9. — С.71-76. [Tsyb AF, Konoplyannikov AG, Kolesnikova AI, Pavlov VV. Polucheniye i ispol'zovaniye v meditsine kletochnykh kul'tur iz mezenkhimal'nykh stvolovykh kletok kostnogo mozga cheloveka. Bulletin of the Russian Academy of Medical Sciences. 2004; 9: 71-76. (In Russ).]
- Котенко К.В., Еремин И.И., Мороз Б.Б. и др. Клеточные технологии в лечении радиационных ожогов: опыт ФМБЦ им. А. И. Бурназяна // Гены и клетки. — 2012. — №2 — С. 97-102. [Kotenko KV, Yeremin II, Moroz BB, et al. Kletochnyye tekhnologii v lechenii radiatsionnykh ozho-gov: opyt FMBTS im. A.I. Burnazyana. Genes and cells. 2012; 2: 97-102. (In Russ).]
- Chattopadhyay S, Raines RT. Review collagen-based biomaterials for wound healing. Biopolymers. 2014;101(8):821-833. doi:10.1002/bip.22486
- Ma J, Wang H, He B, Chen J. A preliminary in vitro study on the fabrication and tissue engineering applications of a novel chitosan bilayer material as a scaffold of human neofetal dermal fibroblasts. Biomaterials. 2001; 22(4): 331-336. doi:10.1016/s0142-9612(00)00188-5.
- Baxter RM, Dai T, Kimball J, et al. Chitosan dressing promotes healing in third degree burns in mice: gene expression analysis shows biphasic effects for rapid tissue regeneration and decreased fibrotic signaling. J Biomed Mater Res A. 2013; 101(2): 340-348. doi:10.1002/jbm.a.34328.
- Madihally SV, Matthew HW. Porous chitosan scaffolds for tissue engineering. Biomaterials. 1999; 20(12): 1133-1142. doi:10.1016/s0142-9612(99) 00011-3.
- Shi C, Zhu Y, Ran X, Wang M, Su Y, Cheng T. Therapeutic potential of chitosan and its derivatives in regenerative medicine. J Surg Res. 2006; 133(2): 185-192. doi:10.1016/j.jss.2005.12.013.
- Croisier F, Jérôme C, Chitosan-based biomaterials for tissue engineering. European Polymer Journal. 2013; 49(4): 780-792.
- Park S, Bhang SH, La WG, Seo J, Kim BS, Char K. Dual roles of hyaluron-ic acids in multilayer films capturing nanocarriers for drug-eluting coatings. Biomaterials. 2012; 33(21): 5468-5477. doi: 10.1016/j.biomaterials. 2012.04.005.
- Harris PA, di Francesco F, Barisoni D, Leigh IM, Navsaria HA. Use of hyaluronic acid and cultured autologous keratinocytes and fibroblasts in extensive burns. Lancet. 1999; 353(9146): 35-36. doi: 10.1016/s0140-673-6(05)74873-x.
- Зиновьев Е.В., Юдин В.Е., Асадулаев М.С. и др. Опыт применения стволовых клеток при лечении ожогов кожи // Педиатр. — 2018. — Т.9. — №4. — С.12-27. [Zinov'yev YeV, Yudin VYe, Asadulayev MS, et al. Opyt primeneniya stvolovykh kletok pri lechenii ozhogov kozhi. Pediatrician. 2018; 9(4): 12-27 (In Russ).] doi: 10.17816/PED9412-27.
- Гордиенко В.А., Шабунин А.С., Давлетова Л.А. и др. Микроаутодермо-пластики в сочетании с адипогенными мезенхимальными стволовыми клетками и раневыми покрытиями // Forcipe. — 2020. — Т.2. — С. 426. [Gordiyenko VA, Shabunin AS, Davletova LA, et al. Mikroautodermoplastiki v sochetanii s adipogennymi mezenkhimal'nymi stvolovymi kletkami i ran-evymi pokrytiyami. Forcipe. 2020; 2: 426. (In Russ).]
- Зиновьев Е.В., Крайнюков П.Е., Асадулаев М.С. и др. Клиническая оценка эффективности применения мезенхимальных стволовых клеток при термических ожогах // Вестник Национального медико-хирургического центра им. Н.И. Пирогова. — 2018. — Т.13. — №4. — С. 62-67. [inov'yev YeV, Kraynyukov PYe, Asadulayev MS, et al. Klinich-eskaya otsenka effektivnosti primeneniya mezenkhimal'nykh stvolovykh kletok pri termicheskikh ozhogakh. Vestnik Natsional'nogo mediko-khirur-gicheskogo tsentra im. N.I. Pirogova. 2018; 13(4): 62-67. (In Russ).] doi 10.25881/BPNMSC.2018.88.91.011.
- Gutierrez-Aranda I, Ramos-Mejia V, Bueno C, et al. Human induced pluripotent stem cells develop teratoma more efficiently and faster than human embryonic stem cells regardless the site of injection. Stem Cells. 2010; 28(9): 1568-1570. doi: 10.1002/stem.471.
- Gerami-Naini B, Smith A, Maione AG, et al. Generation of Induced Pluripot-ent Stem Cells from Diabetic Foot Ulcer Fibroblasts Using a Nonintegrative Sendai Virus. Cell Reprogram. 2016; 18(4): 214-223. doi: 0.1089/cell. 2015.0087.
- Gutierrez-Aranda I, Ramos-Mejia V, Bueno C, et al. Human induced plurip-otent stem cells develop teratoma more efficiently and faster than human embryonic stem cells regardless the site of injection. Stem Cells. 2010; 28(9): 1568-1570. doi: 10.1002/stem.471.
- Prokhorova TA, Harkness LM, Frandsen U, et al. Teratoma formation by human embryonic stem cells is site dependent and enhanced by the presence of Matrigel. Stem Cells Dev. 2009; 18(1): 47-54. doi: 10.1089/scd. 2007.0266.
- Gorecka J, Kostiuk V, Fereydooni A, et al. The potential and limitations of induced pluripotent stem cells to achieve wound healing. Stem Cell Res Ther. 2019; 10(1): 87. Published 2019 Mar 12. doi: 10.1186/ s13287-019-1185-1.


