Применение криодеструкции рака поджелудочной железы при невозможности произвести радикальное хирургическое вмешательство
Автор: Ханевич М.Д., Перминова А.А., Манихас Г.М.
Журнал: Вестник Национального медико-хирургического центра им. Н.И. Пирогова @vestnik-pirogov-center
Рубрика: Оригинальные статьи
Статья в выпуске: 4 т.18, 2023 года.
Бесплатный доступ
Представлены результаты применения криодеструкции рака поджелудочной железы при невозможности произвести радикальное хирургическое вмешательство. Результаты исследования показали, что криохирургия может быть эффективной для увеличения продолжительности и улучшения качества жизни неоперабельных больных местнораспространенным раком поджелудочной железы. Использованием криохирургии в отдельных случаях можно добиться перевода неоперабельного рака в операбельный рак поджелудочной железы.
Криодеструкция, криоаппликаторы, местнораспространенный рак поджелудочной железы, криовоздействие на опухоль поджелудочной железы, заморозка опухолевой ткани жидким азотом
Короткий адрес: https://sciup.org/140303522
IDR: 140303522 | DOI: 10.25881/20728255_2023_18_4_36
Текст научной статьи Применение криодеструкции рака поджелудочной железы при невозможности произвести радикальное хирургическое вмешательство
Рак поджелудочной железы (РПЖ) характеризуется быстрым прогрессированием и высокой степенью злокачественности. Количество больных РПЖ в России за последние десять лет неуклонно растет. Так, на 2011 г. показатель заболеваемости был 10,0 на 100 тыс. населения, к 2021 г. он составил уже 14,1 на 100 тыс. населения. Следует отметить, что удельный вес злокачественных новообразований поджелудочной железы, выявленных в I–II стадии за последние десять лет увеличился в два раза и, на 2021 г., составил 23,2% (в 2011 г. — 12%). Тем не менее, летальность больных в течение года с момента установления диагноза остается на высоком уровне и составляет 65,1%. Этот показатель занимает первое место по сравнению с другими локализациями опухолей [1]. В США РПЖ занимает четвертое место по значимости причины смерти. В этой стране по оценкам 2021 г. было диагностировано 60 430 новых случаев заболевания, из которых 48 220 человек умерли, что составило 79,8% [2]. В настоящее время хирургическое вмешательство в объеме R0 считается единственным радикальным методом лечения. Однако, у большинства больных РПЖ диагностируется слишком поздно для хирургического вмешательства. Удельный вес злокачественных новообразований поджелудочной железы, выявленных в запущенной IV стадии, из числа впервые выявленных злокачественных новообразований, в России на 2021 г.
составил 58,2%[1]. Растущая ежегодная заболеваемость (>490 000 во всем мире) и 5-летняя выживаемость <10% (>460 000 смертей на 2021 г.) еще раз доказывает крайне низкую чувствительность РПЖ к химиолучевой терапии, что подтверждает необходимость новых подходов к его лечению [3; 4].
В настоящий момент не существует стандартного подхода в лечении пациентов с распространенным РПЖ. Тем не менее поиск методов воздействия на опухоль продолжается. Одним из таких способов является разрушение опухолевой ткани путем локального применения сверхнизких температур.
Впервые в начале 1970-х г. Myers et al. указали на возможность эффективного использования криохирургии поджелудочной железы в эксперименте на приматах. Эти исследования продемонстрировали, что криохирургическое разрушение панкреатической ткани останется локализованным. Генерализованного отечного и геморрагического панкреатита с его тяжелыми последствиями не наблюдалось ни у одного животного, несмотря на высокие уровни амилазы до 2400 Ед в первый день после замораживания [5]. Ю.В. Патютко с соавт. в 1991 г. сообщили об использовании криохирургии в сочетании с облучением при местнораспространенном РПЖ. В работе представлено 30 пациентов подвергшихся крио- и лучевой терапии. У всех больных отмечен эффективный контроль боли, снижение СА 19-9, улучшение работоспо-

Ханевич М.Д., Перминова А.А., Манихас Г.М.
ПРИМЕНЕНИЕ КРИОДЕСТРУКЦИИ РАКА ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ ПРИ НЕВОЗМОЖНОСТИ ПРОИЗВЕСТИ РАДИКАЛЬНОЕ ХИРУРГИЧЕСКОЕ ВМЕШАТЕЛЬСТВО собности, увеличение выживаемости [6]. В 2002 г. Kovach et al. у 9 пациентов с нерезектабельным РПЖ провели 10 сеансов интраоперационного криовоздействия под ультразвуковым контролем. После лечения у пациентов наблюдалось облегчение боли и снижение дозы анальгетиков. Осложнений, связанных с криодеструкцией, не было [7]. Bhullar et al. и Pecoraro et al. показали, что криодеструкция как метод симптоматической терапии хорошо зарекомендовала при лечении нерезектабельных первичных и метастатических опухолей предстательной железы, почки, печени, молочной железы, кожи [8; 9].
Цель исследования
Дать оценку эффективности интраоперационного криовоздействия на опухоль поджелудочной железы в случаях ее неоперабельности.
Материалы и методы исследования
Проведено исследование, включающее 42 (100%) пациентов, с верифицированным протоковым РПЖ, которым в силу местной распространенности опухолевого процесса, выполнить радикальную операцию не представилось возможным. Было осуществлено интраоперационное кривовоздействие на пораженную опухолью часть поджелудочной железы. Локализация рака у 17 (40,5%) больных наблюдалась в теле поджелудочной железы, у 10 (23,8%) больных в головке с переходом на тело, у 8 (19%) больных в области тела с поражением хвоста поджелудочной железы, у 7 (16,7%) больных имело место тотальное поражение органа. Нерезектабельность во всех случаях была связана с распространением опухолевого процесса на магистральные сосуды: верхнебрыжеечная и воротная вены, чревный ствол и верхнебрыжеечная артерия. Выполнение гибридного характера вмешательства препятствовал неблагоприятный коморбидный фон. Кривовоздействие осуществлялось в качестве паллиативного вмешательства. Цель его состояла в криодеструкции максимального объема опухолевой ткани. Таким образом, возникали условия для снижения болевого и интоксикационного синдромов, замедление прогрессирования опухолевого процесса и, как следствие, продление жизни на фоне улучшения ее качества. Для выполнения процедуры использовали криоустановку КРИО-МТ с жидким азотом [10]. Зона заморозки охватывала всю опухолевую ткань. Принцип кривовоздействия состоял в быстром охлаждении опухоли до -185 °С с последующим ее медленным оттаиванием. Всего за операцию производилось не менее 5 сеансов подачи холода.
Результаты и обсуждение
Результаты лечения сравнивали с группой 28 больных, которым операция не выполнялась и криометод не мог быть применен. К ним относились больные с ECOG 2–3, в случаях повышенной склонности к кровотечениям, наличием сердечно-легочной дисфункции. У всех пациентов имела место аденокарцинома поджелудочной железы. Статистической разницы в клинической стадии РПЖ в двух группах не было (P = 0,9600). Кроме того, также не было существенной разницы в размере опухолей (среднее ± стандартное отклонение, 4,72±2,0 см против 4,23±1,9 см в группе криотерапии; P = 0,6922).
Результаты анализа лечения больных РПЖ после кривовоздействия показали эффективность метода в качестве оказания паллиативной помощи по сравнению с группой больных, которым криодеструкция не применялась. Так, у группы пациентов с криовоздействием в 1,5 раза увеличилась продолжительность жизни, болевой синдром уменьшился через 12 часов после операции, а через 48 часов полностью исчезал. У этой группы больных с первых суток послеоперационного периода отмечено повышение в сыворотке крови уровня амилазы до 2500Ед. Амилаза крови на фоне лечения оставалась повышенной в течение трех суток после криодеструкции. Однако острого панкреатита с поражением большей части поджелудочной железы мы не наблюдали. Следует отметить, что обязательным компонентом хирургического вмешательства при криохирургии опухоли поджелудочной железы является адекватное дренирование зоны криовоздействия. В послеоперационном периоде объем отделяемого по дренажам составлял от 150 до 400 мл. Уровень амилазы в нем колебался от 7000 до 23000 Ед. Однако, к пятым суткам объем отделяемого по дренажам уменьшался до 50–80 мл. Дренажи удалялись на 6–7-е сутки. Послеоперационное пребывание пациентов с криодеструкцией составило 10±2 суток. Двоим больным через 8 месяцев после операции и проведения лечебной химиотерапии удалось добиться резектабельности опухоли.
Механизм криоразрушения опухолевой ткани наиболее полно представлен в работе Korpan et al. (2009). По мнению авторов криодеструкция вызывает внезапное и прогрессирующее повреждение опухолевых клеток поджелудочной железы в посткриохирургической зоне вследствие асептического крионекроза и криоапоптоза. Сосудисто-капиллярные изменения и застой кровообращения демонстрируют механизм антиангиогенеза, который вместе с криоапонекрозом и криоапоптозом является одним из основных механизмов повреждения биологической ткани. Установлено, что одним из аспектов охлаждения клетки до температур ниже их нормальной физиологической температуры является процесс фазового перехода липидов. Бислой липидной мембраны находится в жидком состоянии при нормальных температурах. При более низких температурах и меньшей термодинамической свободной энергии липиды претерпевают фазовый переход в гелевую фазу или в другие трехмерные структуры с меньшей свободной энергией. В ходе этого процесса мембранные белки сегрегируются, и между белками и мембранным бислоем образуются дефекты. При гистологическом исследовании отмечается значительный некроз в центральной и латеральной областях опухолевой ткани, замороженной внутри ледяного шара. При этом вся клеточная структура разрушается и можно

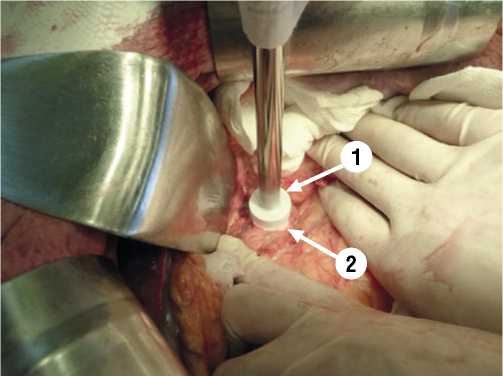
Рис. 1. Интраоперационное фото. 1 — криовоздействие на опухоль головки поджелудочной железы криоаппликатором при помощи криоустановки КРИО-МТ. 2 — край опухоли головки поджелудочной железы.
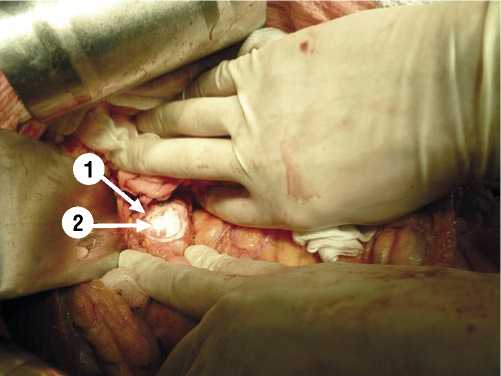
Рис. 2. Интраоперационное фото. 1 — головка поджелудочной железы.
2 — зона заморозки опухолевой ткани после применения криоаппликатора с жидким азотом.
наблюдать только несколько оставшихся ядер со сломанными гребнями, дегранулированными митохондриями и шероховатым эндоплазматическим ретикулумом [11].
Основными принципами при выполнении криовоздействия на опухоль поджелудочной железы является: многократность использования; продолжительность криовоздействия до 10 мин. (зависит от размеров образования и количества используемых криозондов); быстрая заморозка опухолевой ткани с последующим медленным оттаиванием; повторное применение криовоздействия на опухоль не раньше чем через 25 мин. после предыдущего воздействия; распространение зоны заморозки на 1–1,5 см дистальнее от видимой границы опухоли (Рис. 1, 2).
Криохирургия является новым подходом в лечении доброкачественных и злокачественных опухолей, особенно нерезектабельных. Ряд клинических испытаний показал обнадеживающие результаты лечения местнораспространенного рака легких, рака печени, рака предстательной железы, опухолей почек и рака молочной железы [12; 13].
Выводы
-
1. Криохирургия является эффективным паллиативным методом лечения запущенных форм РПЖ. При нере-зектабельных опухолях она может быть предложена для уменьшения объема опухоли и создания более благоприятных условий для проведения таких методов лечения, как лечебная химио- и лучевая терапия.
-
2. Снижение болевого синдрома улучшает качество жизни, нет необходимости в раннем назначении наркотических препаратов, повышается эмоциональный статус и социальная адаптация.
Авторы заявляют об отсутствии конфликта интересов (The authors declare no conflict of interest).
(In Russ.)]
Список литературы Применение криодеструкции рака поджелудочной железы при невозможности произвести радикальное хирургическое вмешательство
- Каприн А.Д., Старинский В.В., Шахзадова А.О. Состояние онкологической помощи населению России в 2021 году. − М.: МНИОИ им. П.А. Герцена, 2022. — 239 с. [Kaprin AD, Starinskij VV, Shaxzadova AO. Sostoyanie onkologicheskoj pomoshhi naseleniyu Rossii v 2021 godu. − M.: MNIOI im. P.A. Gercena, 2022. 239 р. (In Russ.)]
- Siegel RL, Miller KD, Jemal A. Cancer statistics, 2020. CA Cancer J Clin. 2020; 70: 7-30.
- National Cancer Institute. SEER Cancer Statistics Review, 1975–2018. National Cancer Institute; Bethesda, MD, USA: 2021.
- Pancreatic Cancer. Available at: https://www.cancer.gov/types/pancreatic/patient/pancreatic-treatment-pdq. Accessed: 15 Nov. 2021.
- Myers RS, Hammond WG, Ketcham AS. Cryosurgery of primate pancreas. Cancer. 1970; 25(2): 411-4. doi: 10.1002/1097-0142(197002)25:2<411::aid-cncr2820250220-3.0.co;2-7.
- Патютко Ю.И., Барканов А.И., Холиков Т.К. и др. Комбинированное лечение местно-распространенного рака поджелудочной железы с использованием криохирургии // Вопросы онкологии. — 1991. — №37. — С.695-700. [Patyutko YuI, Barkanov AI, Xolikov TK, et al. Kombinirovannoe lechenie mestno-rasprostranennogo raka podzheludochnoj zhelezy’ s ispol’zovaniem krioxirurgii. Voprosy’ Onkologii. 1991; 37: 695-700. (In Russ.)]
- Kovach SJ, Hendrickson RJ, Cappadona CR, et al. Cryoablation of unresectable pancreatic cancer. Surgery 2002; 131: 463-4.
- Bhullar KS, Lagaron NO, McGowan EM et al. Kinase-targeted cancer therapies: Progress, challenges and future directions. Mol. Cancer. 2018; 17: 48. doi: 10.1186/s12943-018-0804-2.
- Pecoraro C, Faggion B, Balboni B, et al. GSK3beta as a novel promising target to overcome chemoresistance in pancreatic cancer. Drug Resist. Updates. 2021; 58: 100779. doi: 10.1016/j.drup.2021.100779.
- Ханевич М.Д., Манихас Г.М. Криохирургия рака поджелудочной железы. СПб.: Аграф+, 2011. 228 с. [Xanevich MD, Manixas GM. Krioxirurgiya raka podzheludochnoj zhelezy’. SPb.: Agraf+, 2011. 228 р. (In Russ.)]
- Korpan NN, Hochwarter G, Sellner F. Cryoscience and cryomedicine: new mechanisms of biological tissue injury following low temperature exposure. Experimental study. Klinicheskaia Khirurgiia. 2009; 7-8: 80-5.
- Niu L, Chen J, Yao F, et al. Percutaneous cryoablation for stage IV lung cancer: a retrospective analysis. Cryobiology. 2013; 67: 151-155.
- Niu L, Mu F, Zhang C, et al. Cryotherapy protocols for metastatic breast cancer after failure of radical surgery. Cryobiology. 2013; 67: 17-22.


