Применение магнитно-резонансной морфометрии у пациентов с рассеянным склерозом в изучении прогрессирования заболевания
Автор: Турчинская И.А., Илюшкина И.И., Ефимцев А.Ю., Труфанов Г.Е., Лукин М.В., Лепехина А.С., Малько В.А., Щукина Т.В., Бисага Г.Н.
Журнал: Вестник медицинского института "РЕАВИЗ": реабилитация, врач и здоровье @vestnik-reaviz
Рубрика: Медицинская визуализация
Статья в выпуске: 4 т.15, 2025 года.
Бесплатный доступ
Актуальность. Рассеянный склероз представляет собой хроническое воспалительное нейродегенеративное заболевание, нередко приводящее к инвалидизации. Современные нейровизуализационные методы, включая магнитно-резонансную морфометрию, позволяют выявлять структурные изменения мозга, ассоциированные с прогрессированием заболевания, и уточнять их связь с клинико-функциональным статусом пациентов. Цель: оценить возможности магнитно-резонансной морфометрии в выявлении церебральной атрофии у пациентов с верифицированным рассеянным склерозом и установить связь между объёмными показателями структур головного мозга и клинико-функциональными данными при разных типах течения заболевания. Материалы и методы. Проведено ретроспективное исследование МР-данных головного мозга 38 пациентов с верифицированным диагнозом «рассеянный склероз» в возрасте от 22 до 67 лет. МР-морфометрия выполнялась на высокопольном МР-томографе с силой индукции магнитного поля 3,0 Тесла. Протокол исследования состоял из импульсных последовательностей T2-ВИ, T2 TIRM, Т1-MPRAGE с толщиной среза 4,0 мм. Постпроцессинговая обработка МР-данных осуществлялась с использованием онлайн-платформы volBrain, предназначенной для автоматической оценки волюметрических показателей структур головного мозга. Оценивались также и данные ранее проведённого неврологического осмотра и тестирования по расширенной шкале инвалидизации, по шкале влияния усталости, когнитивные функции по Монреальской когнитивной шкале и функциональное состояние исследуемых с помощью 9-колышкового теста и 25-футового теста ходьбы. Статистическую обработку результатов выполняли с использованием программ GraphPad Prism 8.00 и Statistica. Результаты. Выявлены значимые межгрупповые различия в общем объёме головного мозга, в объёме серого вещества, мозжечка и затылочных долей. Установлены статистически значимые корреляции между морфометрическими показателями и функциональными шкалами. Выводы. Магнитно-резонансная морфометрия позволяет объективно выявлять церебральную атрофию, ассоциированную с прогрессированием рассеянного склероза, и может быть использована для оценки эффективности терапии и прогнозирования течения заболевания.
Рассеянный склероз [D009103], магнитно-резонансная морфометрия [D056888], церебральная атрофия [D001927], прогрессирование заболевания [D018450], нейродегенерация [D019636], волюметрический анализ [D059629], серое вещество [D066128], белое вещество [D066127], МРТ головного мозга [D008279]
Короткий адрес: https://sciup.org/143185019
IDR: 143185019 | УДК: 616.832-004.2-073.756.8:611.81-073.916 | DOI: 10.20340/vmi-rvz.2025.4.MIM.2
Текст научной статьи Применение магнитно-резонансной морфометрии у пациентов с рассеянным склерозом в изучении прогрессирования заболевания
Рассеянный склероз (РС) — хроническое воспалительное нейродегенеративное заболевание головного мозга. Является гетерогенным и мульти-факторным, влияние на его манифестацию оказывает как генетическая предрасположенность, так и факторы окружающей среды. В основе РС лежит аутоиммунное поражение центральной нервной системы (ЦНС), проявляющееся демиелинизацией, глиозом и потерей нейронов [1]. При этом именно баланс между активностью воспаления, прогрессирующей дегенерацией и репаративными механизмами и определяет клинические проявления РС на каждом конкретном этапе. Данное заболевание характеризуется вариативностью клинических проявлений, поражением людей трудоспособного возраста и возможностью прогрессирующей инвалидизации вплоть до невозможности обслуживать себя самостоятельно [2].
В современной неврологической практике церебральная атрофия рассматривается как один из наиболее патогномоничных нейровизуализацион-ных признаков тяжести рассеянного склероза, выявляемый на ранних этапах независимо от клинического варианта течения заболевания. Атрофия вещества головного мозга при рассеянном склерозе обусловлена не только очаговой и диффузной демиелинизацией, но и аксональной дегенерацией, возникающей в результате хронических нейро-дегенеративных процессов. Это, в свою очередь, отражается в уменьшении объёма коры и подкорковых структур головного мозга [3, 4]. Механизмы атрофии подкорковых структур головного мозга при РС включают как прямое поражение демиелинизирующими очагами, локализованными, в частности в таламуе и стриатуме, так и вторичные дегенеративные изменения, возникающие вследствие аксонального повреждения и непрямого вовлечения серого вещества. Тотальная атрофия головного мозга при РС является более значимым показателем тяжести состояния пациентов, чем локализация и объём очагов демиелинизации [5]. Скорость атрофии мозга у больных с РС значительно превышает таковую при нормальном старении и не зависит от подтипа заболевания, что делает атрофию важной и универсальной характеристикой РС [6].
Также установлено, что при РС могут наблюдаться и краткосрочные колебания изменения объёма вещества головного мозга. Воспаление и отёк, возникающие в результате формирования новых очагов, могут временно увеличивать объём мозга. Напротив, приём глюкокортикостероидов приводит к кратковременному уменьшению объёма, что называется псевдоатрофией. Механизм этого про- цесса не совсем ясен, но предполагается, что он связан с уменьшением воспаления в центральной нервной системе и сопутствующим отёком [4, 7].
Для диагностики РС «золотым стандартом» считается магнитно-резонансная томография (МРТ). Этот метод визуализации является одним из самых информативных и имеет ряд преимуществ при исследовании ЦНС, в том числе из-за способности получать изображения с высокой тканевой контрастностью и пространственным разрешением. Стандартные методики и протоколы МРТ используются для подтверждения характера и определения активности патологического процесса. Однако возможности оценки связи между клиническими симптомами и нейровизуализационными параметрами остаются крайне ограниченными [5, 8].
Изначально наличие атрофии головного мозга у пациентов с РС определялось качественно: фиксировалось расширение желудочков и субарахноидальных пространств, а также уменьшение объёма мозгового вещества [8]. На следующем этапе была внедрена полуавтоматическая количественная оценка атрофии без различия между серым и белым веществом. Однако данные, получаемые с помощью таких специальных методик, характеризуются большим объёмом информации, который практически невозможно проанализировать «вручную», а более 90% изменений, присутствующих на изображениях, невозможно оценить визуально. Поэтому применяют автоматические и полуавтоматические методы анализа для более полного извлечения информации и выполнения сложных количественных измерений. Одним из таких методов является количественная оценка атрофических изменений мозга, которые проявляются при МРТ, как правило в виде уменьшения объёма структур [9, 10]. Этот подход предоставляет важные данные для диагностики, оценки прогрессирования и лечения неврологических заболеваний, а также помогает выявлять морфологические изменения, такие как дегенерация, гипертрофия и персистенция, характерные для нейродегенеративных заболеваний.
Детальная количественная оценка стала возможной благодаря внедрению воксельной МРТ- морфометрии — методики статистического анализа структурных МР-изображений, которая использует компьютеризированную сегментацию серого и белого вещества мозга. Обычно морфометрия головного мозга выполняется на основе трёхмерной Т1-взвешенной МРТ высокого разрешения (T1-ВИ), что обеспечивается хорошим контрастом между серым и белым веществом, например такими последовательностями, как MPRAGE [11, 12].
Цель исследования: оценить возможности магнитно-резонансной морфометрии в выявлении церебральной атрофии у пациентов с верифицированным рассеянным склерозом и установить связь между объёмными показателями структур головного мозга и клинико-функциональными данными при разных типах течения заболевания.
Материалы и методы
Проведено ретроспективное исследование МР-данных головного мозга 38 пациентов с верифицированным диагнозом «рассеянный склероз» в возрасте от 22 до 67 лет. МР-морфометрия выполнялась на высокопольном МР-томографе с силой индукции магнитного поля 3,0 Тесла. Протокол исследования состоял из импульсных последовательностей T2-ВИ, T2 TIRM, Т1-MPRAGE с толщиной среза 4,0 мм (табл. 1).
Постпроцессинговая обработка МР-данных осуществлялась с использованием онлайн-платформы volBrain, предназначенной для автоматической оценки волюметрических показателей структур головного мозга. Алгоритм обработки включает последовательность этапов, направленных на улучшение качества изображения, и приведение его к стандартизированному стереотаксическому пространству, соответствующему библиотеке вручную размеченных шаблонов в данной системе. На следующем этапе volBrain осуществляет автоматическую сегментацию головного мозга с выделением объёмов серого и белого вещества, желудочковой системы, мозолистого тела и других ключевых структур (рис. 1).
Таблица 1. Характеристики импульсных последовательностей в составе протокола МР-исследования Table 1. Characteristics of pulse sequences in the MR examination protocol
|
№ |
Импульсная последовательность |
Время сканирования |
Характеристики импульсной последовательности |
|
1. |
t2 tse 320 (p2) |
2 мин 30 сек |
Поле обзора – 220×220 мм, срез – 4,0 мм, TR – 4710 мс, ТЕ – 93 мс, разрешение – 320×320 пикс., число срезов – 27 |
|
2. |
t2 tirm dark-fluid |
4 мин 30 сек |
Поле обзора –199×220 мм, срез – 4,0 мм, TR – 8000 мс, ТЕ – 93 мс, разрешение – 256×232 пикс., число срезов – 27 |
|
3. |
Т1-MPRAGE |
8 мин |
Поле обзора – 240×256 мм, срез – 1,2 мм, TR – 2300 мс, ТЕ – 93 мс, разрешение – 256×240 пикс., число срезов – 160 |
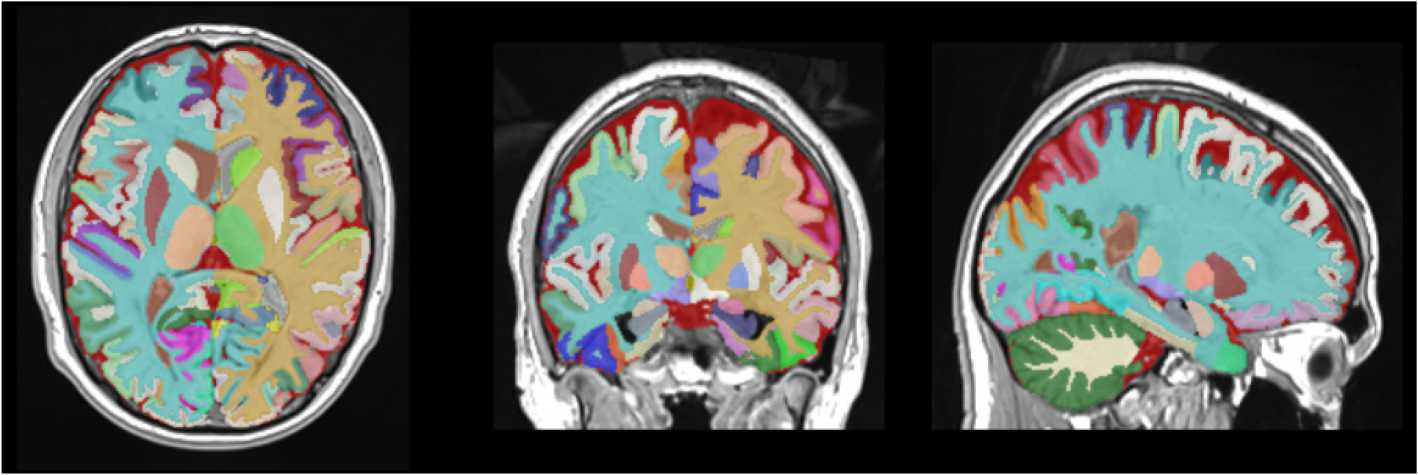
Рисунок 1. Автоматическая сегментация структур головного мозга, выполненная с использованием платформы volBrain: аксиальная, корональная и сагиттальная проекции с цветовой кодировкой серого и белого вещества, подкорковых структур, мозолистого тела, желудочковой системы и коры одного из исследуемых
Figure 1. Automatic segmentation of brain structures performed using the volBrain platform: axial, coronal and sagittal projections with color coding of gray and white matter, subcortical structures, corpus callosum, ventricular system and cortex of one of the subjects
Платформа использует нормативные базы данных, что позволяет оценивать индивидуальные значения в контексте распределения показателей в здоровой популяции. Результаты обработки представлены в виде отчёта с количественными морфометрическими данными в миллилитрах и в процентах от общего объёма мозга, что позволяет объективно оценивать степень атрофии и проводить межгрупповые сравнительные анализы [12].
Оценивались также и данные ранее проведённого неврологического осмотра и тестирования по расширенной шкале инвалидизации (Expanded Disability Status Scale, EDSS), по шкале влияния усталости (Fatigue Impact Scale, FSS). Также оценивались когнитивные функции по Монреальской когнитивной шкале (Monreal Cognitive Assessment, MoCA) и функциональное состояние исследуемых с помощью 9-колышкового теста (9-hole peg test, 9-HPT) и 25-футового теста ходьбы (Timed 25-Foot walk, T25-FW).
Статистическую обработку результатов выполняли с использованием программ GraphPad Prism 8.00 (GraphPad Software Inc.) и Statistica (StatSoft Inc.). Результаты представлены в виде медианы и интерквартильного размаха, Ме (25;75). Различия между группами рассчитывали с помощью непараметрического U-критерия Манна – Уитни. Корреляционные связи между изучаемыми показателями рассчитывали с помощью критерия Спирмена. Различия считали достоверными при р<0,05.
Результаты
В зависимости от типа течения заболевания пациенты были разделены на две группы (по 19 пациентов в каждой группе). Пациенты с прогрессирующим типом течения РС составляли первую группу исследуемых, с ремиттирующим типом течения – вторую группу (табл. 2).
Сравнительный анализ волюметрических показателей вещества головного мозга двух исследуемых групп
Изначально сравнивались волюметрические показатели головного мозга между пациентами разных групп. Было выявлено, что у пациентов первой группы (с прогрессирующим типом течения) атрофия вещества головного мозга достоверно была более выражена, чем у исследуемых второй группы. Средние значения объёмных показателей всех исследуемых зон вещества головного мозга представлены в таблице 3.
Таблица 2. Общая характеристика пациентов с прогрессирующим и ремиттирующим РС
Table 2. General characteristics of patients with progressive and relapsing MS
|
Показатели/тип течения |
Ремиттирующее течение |
Прогрессирующее течение |
p-value |
|
Возраст, годы |
38 (28; 43) |
45 (39; 53) |
0,0047 |
|
Продолжительность заболевания |
1 (0,9; 9,5) |
14 (9; 16,75) |
<0,0001 |
|
Общий балл EDSS |
2 (1,5; 3) |
5,5 (4,5; 6,5) |
<0,0001 |
|
MoCA |
28 (27; 30) |
25 (24; 28) |
0,0057 |
|
25 футовый тест ходьбы |
4,245 (3,785; 4,785) |
10,07 (6,385; 46,81) |
<0,0001 |
|
9 колышковый, правая рука |
18,5 (17,685; 21,3) |
28,22 (22,12; 35,6) |
<0,0001 |
|
9 колышковый, левая рука |
21,25 (18,575; 22,525) |
29,76 (25,235; 38,84) |
<0,0001 |
|
FSS (Fatigue Severity Scale) |
2,88 (1,6; 3,6) |
4,8 (4,3; 6,1) |
<0,0001 |
Примечание: p-value — уровень значимости, EDSS (Expanded Disability Status Scale) - расширенная шкала инвалидизации, МоСА (Monreal Cognitive Assessment) – Монреальская когнитивная шкала, FSS (Fatigue Severity Scale) – шкала влияния усталости.
Таблица 3. Волюметрическое показатели вещества головного мозга у пациентов с РС
Table 3. Volumetric indices of brain matter in patients with MS
|
Показатели/тип течения |
Ремиттирующее течение |
Прогрессирующее течение |
p-value |
|
Общий объём головного мозга |
74,92 (72,15; 75,94) |
72,35 (70,55; 74,68) |
0,0296 |
|
Общий объём белого вещества полушарий головного мозга % |
29,7 (28,25; 30,75) |
28,55 (27,61; 30,3) |
ns |
|
Общий объём серого вещества полушарий головного мозга % |
44,88 (43,75; 45,85) |
43,9 (43,09; 44,37) |
0,0462 |
|
Белое вещество |
31,69 (30,86; 32,65) |
31,54 (30,66; 32,65) |
ns |
|
Серое вещество |
53,02 (52,18; 55,13) |
51,9 (50,83; 52,43) |
0,0032 |
|
Серое вещество коры |
41,62 (40,87; 42,84) |
40,76 (40,51; 41,42) |
ns |
|
Подкорковое серое вещество |
3,08 (2,89; 3,29) |
2,92 (2,61; 3,17) |
ns |
|
Мозжечок |
9,39 (8,96; 9,79) |
8,67 (8,35; 9,64) |
0,0154 |
|
Белое вещество мозжечка |
1,89 (1,79; 2,01) |
1,64 (1,53; 1,78) |
0,0034 |
|
Серое вещество мозжечка |
7,39 (7,16; 7,77) |
7,01 (6,71; 7,58) |
0,0462 |
|
Червь мозжечка |
0,9091 (0,8086; 0,9389) |
0,7668 (0,7266; 0,8063) |
0,0009 |
|
Базальный передний мозг |
0,05113 (0,04937; 0,05385) |
0,05198 (0,04833; 0,05651) |
ns |
|
Прилежащее ядро |
0,06001 (0,04801; 0,06683) |
0,05005 (0,04497; 0,05938) |
ns |
|
Миндалина |
0,1526 (0,1456; 0,1581) |
0,1472 (0,1369; 0,1559) |
ns |
|
Хвостатое ядро |
0,4048 (0,3633; 0,4487) |
0,3993 (0,3514; 0,4313) |
ns |
|
Гиппокамп |
0,5311 (0,4825; 0,5632) |
0,4984 (0,4474; 0,5261) |
ns |
|
Бледный шар |
0,2138 (0,1852; 0,2363) |
0,19 (0,1595; 0,2191) |
ns |
|
Скорлупа |
0,5958 (0,5379; 0,6465) |
0,5913 (0,5047; 0,6526) |
ns |
|
Таламус |
1,102 (1,024; 1,158) |
1,039 (0,8789; 1,148) |
ns |
|
Лобная доля |
13,71 (12,88; 14,14) |
13,64 (12,92; 14,14) |
ns |
|
Височная доля |
8,285 (8,058; 8,567) |
8,115 (7,856; 8,634) |
ns |
|
Теменная доля |
8,117 (7,799; 8,4) |
7,927 (7,647; 8,326) |
ns |
|
Затылочная доля |
6,29 (6,109; 6,503) |
6 (5,8; 6,277) |
0,0051 |
Примечание: p-value — уровень значимости, ns (not significant) – незначимо.
Исходя из полученных при сравнительном анализе данных, значимые различия наблюдались в общем объёме головного мозга, а также в объёме серого вещества полушарий: у пациентов с ремит-тирующим типом течения РС среднее значение объёма головного мозга составляло 74,92% (72,15; 75,94), а у пациентов с прогрессирующим типом – 72,35% (70,55; 74,68); объёмные показатели серого вещества полушарий у группы с прогрессирующим РС составляли 43,9 % (43,09; 44,37), в то время как у второй группы определялось как 44,88% (43,75; 45,85). Это говорит о более выраженной атрофии вещества головного мозга у пациентов с прогрессирующим типом заболевания (рис. 2).
Также у пациентов с прогрессирующим рассеянным склерозом значимо отличался объём мозжечка: общий объём мозжечка у пациентов с прогрессирующим типом РС составлял 8,67% (8,35; 9,64) про- тив 9,39% (8,96; 9,79) у пациентов с ремиттирующим РС; объём червя – 0,7668% (0,7266; 0,8063) против 0,9091% (0,8086; 0,9389); объём белого вещества мозжечка – 1,64% (1,53; 1,78) против 1,89% (1,79; 2,01), объём серого вещества мозжечка – 7,01% (6,71; 7,58) против 7,39% (7,16; 7,77) (рис. 3).
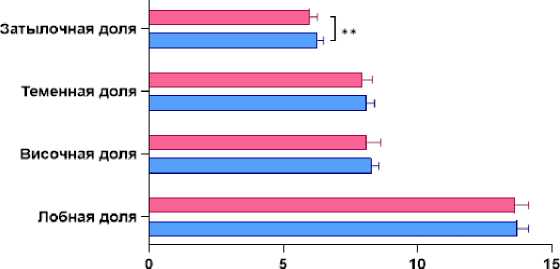
При отдельном сравнении долей головного мозга значимые различия объёмных показателей вещества мозга были выявлены только в области затылочных долей – 6% (5,8; 6,277) у исследуемых с прогрессирующим типом течения РС против 6,29% (6,109; 6,503) у исследуемых с ремиттирующим типом РС (рис. 4).
При сравнительном анализе двух исследуемых групп значимых различий в объемных показателях в области базальных ядер у пациентов выявлено не было.
i ■ Реми 11ирумил i ечение PC
1=1 Грогресоруюцле типы течения PC
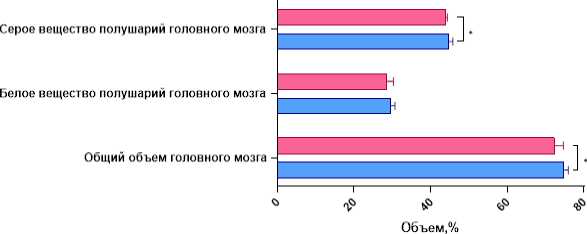
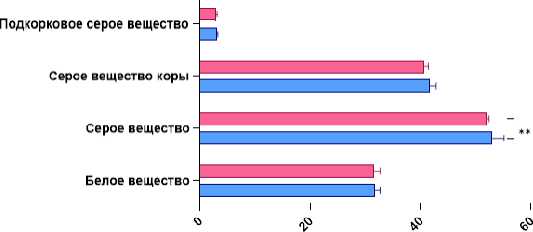
Рисунок 2. Сравнительные гистограммы общих волюметрических показателей вещества головного мозга у пациентов с разным типом течения РС . Примечание: * – p<0,05, ** – р<0,01
Figure 2. Comparative histograms of general volumetric indices of brain matter in patients with different types of MS. Note: * – p<0.05, ** – p<0.01
I 1 Реми 11иру миее I ечение PC 1=1 Грогрессирутоцле типы течения PC
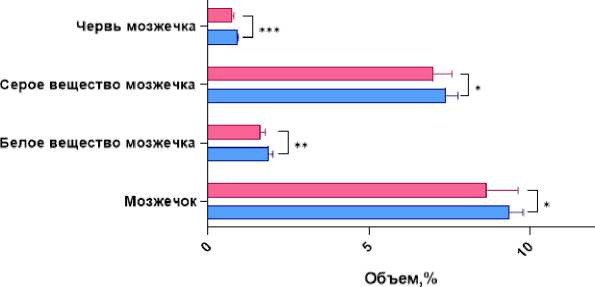
Рисунок 3. Сравнительная гистограмма общих волюметрических показателей вещества мозжечка (в том числе серого и белого вещества, червя) у пациентов с разным типом течения РС. Примечание: * – p<0,05, ** – р<0,01, *** – р<0,001
Figure 3. Comparative histogram of general volumetric indices of cerebellar matter (including gray and white matter, vermis) in patients with different types of MS progression. Note: * – p<0.05, ** – p<0.01, *** – p<0.001
czi Реми 11 иру mutt i ечение PC
= Г регрессирующее inn ы течения PC
Объем,%
Рисунок 4. Сравнительная гистограмма общих волюметрических показателей вещества затылочных, теменных, височных и лобных долей головного мозга у пациентов с разным типом течения РС. Примечание: ** - р<0,01
Figure 4. Comparative histogram of general volumetric indices of the substance of the occipital, parietal, temporal and frontal lobes of the brain in patients with different types of MS. Note: ** - p<0.01
Корреляционный анализ между объёмными показателями и данными функциональных неврологических тестирований у пациентов Для оценки взаимосвязей между клиническими парамерами и объёмными данными структур головного мозга был проведён корреляционный анализ с построением тепловой карты (корреляционной матрицы), основанной на коэффициентах корреляции Пирсона. Цветовое картирование отражает направление и силу корреляционных связей: насыщенный синий цвет соответствует выраженной отрицательной корреляции (до -1), насыщенный розово-красный - выраженной положительной корреляции (до +1), белый - отсутствию статистически значимой связи (значения, близкие к 0). Положительная корреляция свидетельствует о прямой зависимости между переменными, при которой увеличение одного показателя сопровождается ростом другого; отрицательная корреляция указывает на обратную зависимость между величинами.
У пациентов с ремиттирующим типом течения рассеянного склероза проведённый корреляционный анализ выявил статистически значимые связи между параметрами клинического состояния, результатами функционального тестирования и количественными морфометрическими показателями головного мозга (рис. 5).
Возраст достоверно отрицательно коррелировал с общим объёмом головного мозга (r=-0,591), объёмом серого вещества головного мозга (r=-0,496) и объёмом белого вещества головного мозга (r=-0,460). Эти данные отражают возрастное снижение мозгового объёма, что согласуется с существующими представлениями о возрастной атрофии.
Увеличение длительности заболевания достоверно коррелировало с уменьшением общего объёма головного мозга (r=-0,520) и снижением объёма теменной доли (r=-0,546), что свидетельствует о прогрессирующем характере церебральной атрофии в динамике рассеянного склероза.
Уровень неврологического дефицита по шкале EDSS показал статистически значимую отрицательную взаимосвязь с объёмами белого (r=-0,561) и серого вещества (r=-0,543), а также с общим церебральным объёмом (r=-0,529) и объёмом теменной доли (r=-0,571), что подтверждает связь между тяжестью функциональных нарушений и выраженностью структурной атрофии.
Функциональные тесты, в частности 25-футовый тест ходьбы, показали положительную корреляцию с 9-колышковым тестом (правая рука: r=0,647; левая рука: r=0,553), что указывает на взаимосвязь двигательных функций верхних и нижних конечностей. При этом тест на ходьбу также имел отрицательную связь с объёмом белого вещества (r=-0,518), что может указывать на влияние демиелинизации на подвижность.
Возраст Продолжительность заболевания, года общий балл EDSS MoCA 25 футовый тест ходьбы
9 колышковый, правая рука 9 колышковый, левая рука Шкала тяжести усталости (FSS)
Объем белого вещества %
Объем серого вещества %
Объем подкоркового серого вещества % Объем серого вещества коры %
Объем серого вещества мозжечка % Общий объем головного мозга %
Общий объем белого вещества головного мозга % Общий объем серого вещества головного мозга %
Общий объем мозжечка %
Общий объем белого вещества мозжечка % Общий объем серого вещества мозжечка %
Объем червя мозжечка %
Объем ствола головного мозга %
Объем прилежащего ядра %
Общий объем миндалины %
Общий объем базального отдела переднего мозга % Общий объем хвостатого ядра %
Общий объем гиппокампа % Общий объем бледного шара %
Общий объем скорлупы %
Общий объем таламуса %
Общий объем лобной доли % Общий объем височной доли % Общий объем теменной доли % Общий объем затылочной доли %



1.0
0.5
-0.5
-1.0

Рисунок 5. Матрица корреляции между морфометрическими показателями головного мозга и результатами клинико-функциональных тестов у пациентов с ремиттирующим РС. Цвет отражает силу и направление корреляции: от синего (отрицательная связь) до красного (положительная связь), белый - отсутствие корреляции
Figure 5. Correlation matrix between morphometric parameters of the brain and the results of clinical and functional tests in patients with relapsing-remitting MS. Color reflects the strength and direction of the correlation: from blue (negative correlation) to red (positive correlation), white -no correlation
Шкала усталости (FSS) показала умеренные положительные корреляции с объёмами мозжечка и его структур (до r=0,594), однако эта связь требует дальнейшего анализа ввиду возможной компенсаторной перестройки или других нейрофизиологических механизмов.
Корреляции с когнитивной оценкой по шкале MoCA в представленных данных выражены слабо или отсутствуют, что может быть связано с ограниченной вариативностью показателя или недостаточной чувствительностью шкалы к структурным изменениям мозга в выборке.
Таким образом, полученные данные подтверждают важность морфометрических показателей в оценке клинического состояния пациентов и демонстрируют, что структурная атрофия мозга, особенно серого и белого вещества, тесно связана с прогрессированием инвалидизации, продолжительностью заболевания и снижением двигательных функций.
Корреляционный анализ взаимосвязей между клинико-функциональными характеристиками и морфометрическими параметрами головного мозга у пациентов с прогрессирующим рассеянным склерозом (рис. 6) выявил ряд статистически значимых корреляций, отражающих патофизиологические процессы, характерных для данного заболевания.
Продолжительность заболевания показала умеренно выраженные обратные корреляции с рядом морфометрических показателей, включая общий объём головного мозга (r=-0,682), объём серого вещества коры (r=-0,654), объём подкоркового серого вещества (r=-0,544), объём таламуса (r=-0,667), гиппокампа (r=-0,471), хвостатого ядра (r=-0,488), а также с объёмом базальных ганглиев. Эти данные отражают прогрессирующую атрофию мозговых структур с течением заболевания.
Возраст
Продолжительность заболевания, года общий балл EDSS
ВАРС (да-1, нет- 0)
ПИТРС (1 линия, 2 линия, нет)
MoCA
25 футовый тест ходьбы
9 колышковый, правая рука 9 колышковый, левая рука
Шкала тяжести усталости (FSS)
Объем белого вещества %
Объем серого вещества %
Объем подкоркового серого вещества %
Объем серого вещества коры %
Объем серого вещества мозжечка %
Общий объем головного мозга %
Общий объем белого вещества головного мозга % Общий объем серого вещества головного мозга %
Общий объем мозжечка %
Общий объем белого вещества мозжечка %
Общий объем серого вещества мозжечка %
Объем червя мозжечка %
Объем ствола головного мозга %
Объем прилежащего ядра %
Общий объем миндалины %
Общий объем базального отдела переднего мозга %
Общий объем хвостатого ядра %
Общий объем гиппокампа %
Общий объем бледного шара %
Общий объем скорлупы %
Общий объем таламуса %
Общий объем лобной доли %
Общий объем височной доли % Общий объем теменной доли %
Общий объем затылочной доли %


Рисунок 6. Матрица корреляции между морфометрическими показателями головного мозга и результатами клинико-функциональных тестов у пациентов с прогрессирующим РС. Цвет отражает силу и направление корреляции: от синего (отрицательная связь) до красного (положительная связь), белый - отсутствие корреляции
Figure 6. Correlation matrix between morphometric parameters of the brain and the results of clinical and functional tests in patients with progressive MS. Color reflects the strength and direction of the correlation: from blue (negative correlation) to red (positive correlation), white - no correlation
Неврологический дефицит (EDSS) коррелировал с ухудшением двигательных показателей: 25-футовый тест ходьбы (r=0,517), 9-колышковый тест (правая рука r=0,650; левая рука r=0,484), что подтверждает снижение моторных функций с ростом инвалидизации. Также EDSS положительно связан с объёмом лобной доли (r=0,560), что может отражать компенсаторные механизмы или выборку с минимальной фронтальной атрофией на более ранних стадиях.
Использование препаратов, изменяющих течение РС (ПИТРС) имело слабые положительные корреляции с объёмами различных структур мозга, включая белое вещество головного мозга (r=0,537), серое вещество мозжечка (r=0,458), хвостатое ядро и таламус. Это может свидетельствовать о замедлении нейродегенерации на фоне терапии, либо отражать то, что пациенты на терапии находятся в менее прогрессирующих стадиях заболевания.
Когнитивные функции (оценка по шкале MoCA) положительно коррелировали с объёмами серого вещества (r=0,498), мозжечка (r=0,500), белого вещества мозжечка (r=0,502) и таламуса (r = 0,54), подтверждая связь когнитивного статуса с сохранностью подкорковых и мозжечковых структур.
Функциональные тесты демонстрировали между собой высокую взаимосвязь. Например, 9-колышковый тест (правая и левая рука) были тесно связаны между собой (r=0,572), а также отрицательно коррелировали с объёмами червя мозжечка, гиппокампа и скорлупы (до r=-0,574), что может указывать на их значимость для моторного контроля.
Таким образом, результаты корреляционного анализа подчёркивают значимую связь между морфометрическими изменениями мозга и клиникофункциональным состоянием пациентов с рассеянным склерозом. Наибольшие корреляции были выявлены между продолжительностью заболевания и объёмами серого и подкоркового серого вещества, а также между когнитивными функциями и объёмом мозжечковых структур и таламуса.
Обсуждение
Полученные в настоящем исследовании данные подтверждают высокую информативность магнитнорезонансной морфометрии как метода количественной оценки нейродегенеративных изменений при рассеянном склерозе. Использование автоматизированной платформы volBrain позволило достоверно зафиксировать снижение объёмов вещества головного мозга у пациентов с различными типами течения заболевания, что дополняет клинико-функциональную оценку и стандартные МР-протоколы. Установленные различия между группами согласуются с ранее опубликованными данными о диагностической значимости снижения объёма серого вещества и подкорковых структур уже на ранних стадиях РС [4, 13].
Особый интерес представляют выявленные изменения в структурах мозжечка, где у пациентов с прогрессирующим течением наблюдалась более выраженная атрофия как серого, так и белого вещества, включая червь мозжечка. Эти результаты согласуются с опубликованными наблюдениями, в которых подчёркивается вовлечённость мозжечка как в моторные, так и в когнитивные функции [12]. В настоящем исследовании объёмы мозжечковых структур положительно коррелировали с результатами когнитивного теста MoCA и функциональных проб (9-колышковый тест, 25-футовый тест ходьбы), что подтверждает многофункциональную значимость данной зоны.
Корреляционный анализ выявил статистически значимые взаимосвязи между морфометрическими показателями и клинико-функциональным статусом пациентов. У лиц с ремиттирующим течением заболевания объёмы серого и белого вещества отрицательно коррелировали с возрастом, длительностью заболевания и баллами по шкале EDSS, что отражает прогрессирующую атрофию при нарастании клинических проявлений. Сходные законо- мерности описаны ранее, где подчёркивается тесная связь между объёмными показателями мозга и уровнем неврологического дефицита [10].
У пациентов с прогрессирующим типом течения наибольшие корреляции зафиксированы между длительностью заболевания и снижением объёмов серого вещества коры, подкорковых структур (включая гиппокамп, хвостатое ядро и таламус), что соответствует ранее опубликованным результатам [5]. При этом положительная корреляция между объёмами отдельных мозговых структур (в частности, таламуса и мозжечка) и когнитивными функциями может указывать на компенсаторную активацию нейропластических механизмов в ранних стадиях заболевания, что также подтверждается другими работами [1].
Выводы
Применение магнитно-резонансной морфометрии у пациентов с рассеянным склерозом с ремит-тирующим и прогрессирующим типами течения позволяет выявить достоверные различия в объёмах мозгового вещества, как серого, так и белого, а также в структурах мозжечка. Особенно выраженной определена атрофия у пациентов с прогрессирующим течением заболевания, что коррелировало с клинико-функциональными показателями, такими как баллы по шкале EDSS, результаты когнитивных и моторных тестов.
Использование автоматизированных систем анализа МР-изображений, таких как volBrain, позволяет не только точно оценить объёмные характеристики различных структур мозга, но и выявить значимые ассоциации между морфометрическими параметрами и клиническим статусом пациента. Это подчёркивает потенциал МР-морфометрии как инструмента объективной оценки прогрессирования заболевания и эффективности терапии при рассеянном склерозе.


