Применение метода автоматизированной морфометрической оценки экспрессии иммуногистохимических маркеров в диагностике рака предстательной железы и мочевого пузыря
Автор: Попков Владимир Михайлович, Понукалин Андрей Михайлович, Маслякова Галина Никифоровна, Цмокалюк Елена Николаевна, Бучарская Алла Борисовна, Широков Александр Александрович, Буров Андрей Михайлович
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Урология
Статья в выпуске: 4 т.6, 2010 года.
Бесплатный доступ
Диагностическая значимость молекулярных маркеров оценивалась при проведении иммуногистохимиче-ского исследования операционного и биопсийного материала 106 пациентов с заболеваниями мочевого пузыря и 57 пациентов с заболеваниями предстательной железы, проходивших лечение в НИИ фундаментальной и клинической уронефрологии, с моноклональными антителами: Ki67, PCNA, рбЗ (маркерами пролиферативной активности клеток); р53 (супрессором опухолевого роста), Bcl2, Вах (маркерами апоптоза); EGFR (рецептом эпидермального фактора роста), PSA, PSMA, AMACR (простатспецифическими антигенами) и цитокератиново-го профиля. Морфометрическое исследование проводилось на автоматизированной системе анализа цифровых изображений Ariol SL50 (Genetix)
Диагностическая значимость, иммуногистохимия, молекулярные маркеры, рак мочевого пузыря, рак предстательной железы
Короткий адрес: https://sciup.org/14917194
IDR: 14917194
Текст научной статьи Применение метода автоматизированной морфометрической оценки экспрессии иммуногистохимических маркеров в диагностике рака предстательной железы и мочевого пузыря
Адрес: 410012, г. Саратов, ул. Б. Казачья, 112.
Тел.: 669751.
ных, нередко связанным с развитием инвалидности [1]. Среди всех онкоурологических заболеваний на первом месте стоят опухоли рака почки, предстательной железы и мочевого пузыря.
Рак мочевого пузыря является самым частым новообразованием мочевыводящих путей . Ежегодно в мире раком мочевого пузыря заболевают 335,8 тыс.
человек и 132,4 тыс. человек, т.е. каждый третий, умирают от этого заболевания. В России ежегодно выявляется 12,5 тыс. больных раком мочевого пузыря, а смертность от этого новообразования составляет 59,2% [2].
Сегодня в России под динамическим наблюдением находятся около 60 тыс. больных раком мочевого пузыря, и только у 45% болезнь диагностируется на ранних стадиях заболевания. Известно, что именно стадия рака мочевого пузыря определяет вид, характер лечения и прогноз заболевания для пациента. Вместе с тем частота ошибок, при определении стадии рака мочевого пузыря достигает 73% [3].
Рак предстательной железы занимает второе место среди причин смерти от злокачественных новообразований у мужчин. По данным официальной статистики, абсолютное число зарегистрированных больных с заболеваниями предстательной железы в Российской Федерации в последние годы прогрессивно возрастало, увеличившись с 717 800 человек в 2002 г. до 1 124 417 человек в 2008 г., или на 56,6%.
Показатель числа зарегистрированных больных на 100 тыс. взрослого мужского населения за эти годы также увеличился с 1408,5 до 2154,1, т.е. на 52,9%. По регионам максимальные показатели частоты встречаемости заболеваний предстательной железы на 100 тыс. взрослого мужского населения были отмечены в Москве и Санкт-Петербурге.
В Российской Федерации на конец 2008 г. находились под наблюдением 85 215 больных раком простаты. В 2008 г. впервые был установлен диагноз рака простаты 20 887 пациентам.
Триада патологических процессов, развивающихся в предстательной железе, а именно: хронический простатит, доброкачественная гиперплазия и рак предстательной железы составляют у мужчин доминирующую группу заболеваний по сравнению с любыми нозологическими единицами. Эти заболевания имеют общие патогенетические механизмы и сходную клиническую картину, что в значительной степени затрудняет раннюю диагностику онкологического процесса в простате. Несомненно, прорыв в диагностике рака простаты был совершен при внедрении в клинику ПСА-диагностики, но известно, что ПСА является органоспецифическим, но не заболевание-специфическим. Повышение его регистрируется при любой патологии предстательной железы. В связи с этим возникает настоятельная необходимость поиска, разработки и внедрения новых критериев ранней диагностики различных вариантов опухолевого процесса в предстательной железе.
Анализ результатов лечения больных раком мочевого пузыря и предстательной железы показывает, что назрела необходимость поиска новых дополнительных маркеров ранней диагностики, позволяющих прогнозировать характер течения болезни у каждого конкретного больного [4]. К таким новым маркерам относят показатели биологической агрессивности первичной опухоли. До настоящего времени количество работ, в которых проведено исследование диагностического и прогностического значения широкого спектра биомаркеров, характеризующих различные проявления биологической агрессивности рака мочевого пузыря, незначительно. Окончательно не определена панель молекулярных серологических, мочевых и иммуногистохимических маркеров, которая необходима для выбора оптимальной тактики хирургического и патогенетического лечения рака как мочевого пузыря, так и простаты.
В клинических рекомендациях, выпущенных по инициативе Российского общества онкоурологов с разрешения Европейской ассоциации по урологии, сведения за 2009 г. по применению конкретных молекулярных маркеров для диагностики рака мочевого пузыря и простаты отсутствуют.
Все изложенное позволило нам сформулировать цель нашего исследования: разработать панели молекулярно-биологических и иммуногистохимических маркеров ранней диагностики рака мочевого пузыря и простаты.
Методы. Материалом для исследования послужил операционный и биопсийный материал, полученный у 108 пациентов с заболеваниями мочевого пузыря и 57 пациентов с заболеваниями предстательной железы, проходивших лечение в НИИ фундаментальной и клинической уронефрологии ГОУ ВПО «Саратовский государственный медицинский университет Росздрава» в 2007-2010 гг. Операционный и биопсийный материал подвергали обзорному морфологическому анализу, при котором стадию рака определяли в соответствии с классификацией TNM, а степень дифференцировки опухолевых клеток оценивали в соответствии с рекомендациями ВОЗ (2004).
Иммуногистохимические реакции ставили на серийных парафиновых срезах, используя стрепта-видин-биотиновый метод. В качестве детекционной системы применяли систему LSAB2 System, Dako, в качестве хромогена – диаминобензидин (Dako).
Для иммуногистохимического исследования были использованы моноклональные антитела, разделенные на группы по функциональной значимости: маркеры пролиферативной активности – Ki67, PCNA; регуляторы клеточного цикла – р53, р63; маркеры апоптоза Bcl2, Вах; цитокератиновый профиль – ЦК 34 β Е 12, ЦК7, ЦК8, ЦК10/13, ЦК17, ЦК18, ЦК19; про-статспецифичные антигены – PAS, PSMA, AMACR.
Морфометрическое исследование иммуногистохимических препаратов проводили с использованием автоматизированной комбинированной системы для анализа цифровых изображений Ariol SL50 (Genetix, Великобритания, 2009) на базе центра коллективного пользования «Симбиоз» УРАН ИБФРМ. Изображения в автоматическом режиме были получены с применением микроскопа Olympus BX 61 с встроенной цифровой камерой U-CMAD3 с объективами PlanApo N 1.25×/0,04 и MPlanFL N 5×/0,15 для выбора рабочих областей, а также UPlanFL N 20×/0,5 для подсчета иммунопозитивных клеток. В работе были использованы программные модули для ядерных (KiSight) и цитоплазматических маркеров (Aesight).
При морфометрическом исследовании при использовании автоматизированной комбинированной системы для анализа цифровых изображений проводилось выделение клеточных структур на исследуемом гистологическом препарате и объединение их в классы: ядра и цитоплазма клеток; определение количества позитивно окрашенных клеток и степени интенсивности окраски в каждом из классов структур.
Статистический анализ проводили с использованием пакета программ статистической обработки результатов SSPS 13.0 for Windows.
Результаты. Антиген пролиферирующего клеточного ядра (PCNA) экспрессируется в делящихся клетках в конце G1-фазы и в первой трети S-фазы. В тканях с низкой пролиферативной активностью, по данным литературы, экспрессия антитела минимальна, однако результаты нашего исследования по- казали, что маркер пролиферирующего клеточного ядра (PCNA) дает положительную реакцию во всех исследуемых группах. В группе больных раком мочевого пузыря процент экспрессирующих клеток возрастал по мере увеличения глубины инвазии опухоли непосредственно в стенку мочевого пузыря (Т1, Т2). Как только опухоль начинала прорастать в параве-зикальную клетчатку, процент экспрессирующих клеток уменьшался с 73,86% (в стадии Т2) до 46,25% (в стадии Т4), что, возможно, связано с уменьшением дифференцировки клеток (табл. 1).
Такая же тенденция наблюдалась и при определении степени экспрессии маркера РCNA в группе больных с заболеваниями простаты. В группе сравнения пролиферативная активность клеток была втрое ниже, чем в группе больных с раком предстательной железы (табл. 2). Кроме этого, в группе больных с раком предстательной железы мы наблюдали случаи высокой пролиферативной активности клеток стромы. Известно, что в процессе опухолевой трансформации меняются и межклеточные взаимодействия с активацией потенциала пролиферативной активности, поэтому, по нашему мнению, наличие экспрессии указанного маркера в клетках стромы при раке простаты следует считать неблагоприятным фактором прогноза заболевания.
В последнее время ведутся поиски маркеров, позволяющих прогнозировать клиническое течение рака мочевого пузыря и рака простаты у конкретного больного. Подобными молекулярными показателями могут быть регуляторы клеточного цикла р53 и Ki67, поскольку имеются сообщения об их связи с рециди-вированием, метастазированием и низкой выживаемостью [5].
Как показали наши исследования, маркер Ki67 в группе больных раком мочевого пузыря не дает экспрессии в группе сравнения, а также отмечается корреляционная зависимость высокой степени значимости между стадией рака мочевого пузыря, процентом экспрессирующих клеток и интенсивностью иммуногистохимической реакции (рис. 1). Практически в два раза повышается количество экспрессирующих клеток при стадиях заболевания Т3 и Т4, т.е. когда опухоль начинает прорастать за пределы стенки мочевого пузыря (см. табл. 1). Это отличается от результатов, полученных другими авторами [6], которые выявили практически одинаковый уровень экспрессии в группах больных как поверхностным, так и инвазивным раком мочевого пузыря.
При определении маркеров пролиферативной активности Ki67 у больных с заболеваниями простаты было установлено, что экспрессия наблюдалась во всех изучаемых группах, однако количество клеток, экспрессирующих Ki67, было минимальным в группе больных группы сравнения и увеличивалось в группе больных с ДГПЖ, самые высокие значения экспрес-
Таблица 1
Показатели экспрессии иммуногистохимических маркеров с ядерной локализацией у больных с заболеваниями мочевого пузыря (М±m)
|
Показатель экспрессии |
Т0 |
Та |
Т1 |
Т2 |
Т3 |
Т4 |
|
PCNA (% экспрессирующих клеток ) |
20±7,6 |
30,33±10,2 |
55,83±13,5 |
73,86±6,1 |
35,25±14,7 |
46,25±16,5 |
|
PCNA (интенсивность) |
1,75±0,25 |
1,5±0,27 |
2,6±0,25 |
2,43±0,2 |
1,75±0,25 |
1,67±0,33 |
|
Ki67 (% экспрессирующих клеток) |
0 |
2,33±1,7 |
28±9,9 |
24,44±8,2 |
40,75±12,7 |
49±8,4 |
|
Ki67 (интенсивность) |
0 |
1 |
1,8±0,2 |
2,2±0,2 |
2,25±0,25 |
2,2±0,37 |
|
p53(% экспрессирующих клеток) |
0 |
5,45±5,45 |
23,6±14 |
11,5±9,4 |
35±20,6 |
27±18,7 |
|
p53 (интенсивность) |
0 |
1 |
2±0,6 |
1,67±0,7 |
2,5±0,5 |
2,5±0,5 |
|
p63 (% экспрессирующих клеток) |
0 |
37±8,67 |
13,3±7,7 |
31,43±13,7 |
0 |
7,5±7,5 |
|
p63 (интенсивность) |
0 |
1,9±0,2 |
1,7±0,3 |
1,5±0,3 |
0 |
1 |
П р и м еч а н и е : Ta, T1, T2, T3, T4 – стадии рака мочевого пузыря соответственно TNM, T0 - группа сравнения.
Таблица 2
Показатели экспрессии иммуногистохимических маркеров с ядерной локализацией у больных с заболеваниями предстательной железы (М±m)
|
Показатель экспрессии |
Группа сравнения |
Группа больных с ДГПЖ |
Группа больных с раком простаты |
|
PCNA (% экпрессирующих клеток) |
16,6±5,7 |
24,33±9,2 |
48,72±12,1 |
|
PCNA (интенсивность) |
1,67±0,27 |
1,86±0,24 |
3,125±0,75 |
|
Ki67 (% экспрессирующих клеток) |
11,2±1,29 |
27,73±1,7 |
43,1±9,9 |
|
Ki67 (интенсивность) |
1,1±0,29 |
2,4±0,69 |
2,8±0,42 |
|
P53 (% экспрессирующих клеток) |
5,2±0,59 |
78,45±5,45 |
90,1±14,2 |
|
р53 (интенсивность) |
1,14±0,26 |
1,42±0,39 |
2,375±0,67 |
|
р63 (% экспрессирующих клеток) |
73,7±6,49 |
35,5±7,34 |
12,3±4,4 |
|
р63 (интенсивность) |
2,87±0,29 |
1,97±0,44 |
1,11±0,3 |
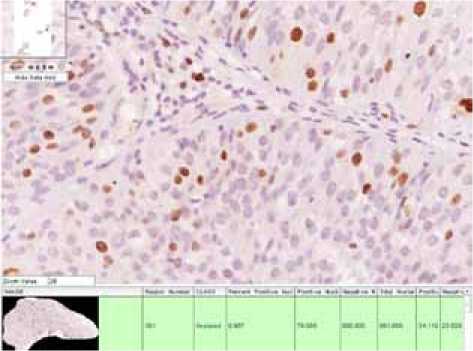
Рис. 1. Иммунопозитивное окрашивание клеток переходного эпителия рака мочевого пузыря на Ki67. Изображение получено на объективе UPlanFL N 20х/0,5, подсчет иммуно-позитивных ядер проведен при использовании программного модуля KiSight
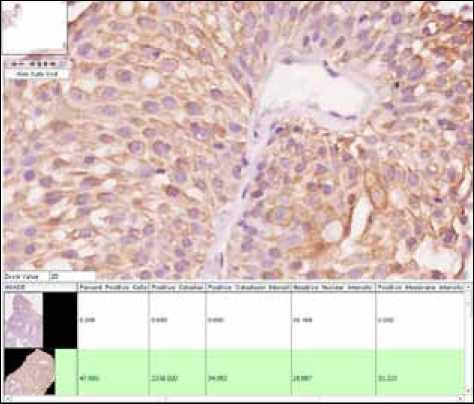
Рис. 2. Иммунопозитивное окрашивание клеток переходного эпителия рака мочевого пузыря на СК18. Изображение получено на объективе UPlanFL N 20х/0,5, подсчет количества клеток с иммунопозитивной цитоплазмой проведен при использовании программного модуля Aesight сии были получены в группе больных с раком простаты. Показатели интенсивности экспрессии увеличивались с повышением количества экспрессирующих клеток. Возможно, это связано с тем, что и простатит и ДГПЖ в основе своей также имеют пролиферативные процессы, что и отражает поведение маркера пролиферации Ki67.
Установлено, что интенсивность экспрессии регулятора клеточного цикла р53 в группе больных раком мочевого пузыря возрастает в группах с увеличением глубины инвазии. Что касается количества экспрессирующих клеток, то более чем в четыре раза увеличивается процент экспрессирующих клеток в группе инвазивного рака, что является весьма обнадеживающим критерием при определении прогноза заболевания. На выявление мутантного гена р53 с повышенной частотой в инвазивных опухолях указывают и другие авторы [6].
При определении маркеров-регуляторов клеточного цикла р53 больных с раком простаты положи- тельная экспрессия была отмечена в 90% случаев. У больных с ДГПЖ в 78% случаев, в группе больных с хроническим простатитом, мы наблюдали положительную экспрессию лишь в единичных клетках. Возможно, это связано с тем, что при хроническом воспалении макрофаги и фагоциты образуют большое количество свободных радикалов, которые прямо или опосредованно нарушают структуру и функциональную активность белков, и в частности белка р53, а также способствуют мутагенной активности клеток.
Обсуждение. В литературе последних лет появились сведения о том, что маркер р63 экспрессируется в стволовых клетках базального эпителия и свидетельствует о наличии клеток, имеющих большой потенциал к самообновлению и дифференцировке [7]. Маркер р63 продемонстрировал положительную экспрессию в базальных клетках желез у больных всех трех групп с заболеваниями простаты. Однако в группе больных с хроническим простатитом подобные клетки были сохранены, и это свидетельствовало о регенераторных способностях железистого эпителия, в группе больных с раком количество их было резко снижено.
Несколько другая картина наблюдалась при использовании маркера р63 в группе больных с раком мочевого пузыря. Исследования показали, что он не дает экспрессии в группе сравнения, однако достоверных различий частоты и интенсивности экспрессии в группах больных с различной стадией рака мочевого пузыря не выявлено.
Использование цитокератинового профиля для дифференциальной диагностики новообразований мочевого пузыря показали, что экспрессия их во всех исследованных группах больных является положительной. Только цитокератин 18 продемонстрировал трехкратное увеличение количества экспрессирующих клеток уротелия между группой сравнения и группой больных с неинвазивным раком мочевого пузыря (рис. 2).
В группе больных с заболеваниями простаты с высокой степени корреляции проявилась экспрессия цитокератина 34 β Е 12, который интенсивно окрашивался в тканях предстательной железы при неопухолевых процесса и снижался при раке простаты.
Bcl2 онкопротеин является блокатором апоптоза, находится на цитоплазматической стороне митохондриальной наружной мембраны, эндоплазматическом ретикулуме, на ядерной мембране. В противоположность ему Bax является активатором апоптотических процессов. В нормальных тканях скорость апоптоти-ческой клеточной гибели уравновешивается пролиферацией клеток. При исследовании маркеров апоптоза в изучаемых группах было отмечено их закономерное поведение в опухолевой ткани: увеличивалась экспрессия маркера блокатора апоптоза Bcl2 и уменьшалась экспрессия активатора Bax, что свидетельствует о закономерном сдвиге канцерогенеза в сторону пролиферативных процессов.
Учитывая обстоятельство, что постоянно возникает необходимость проведения дифференциальной диагностики между раком предстательной железы и мочевого пузыря, так как опухоль одного органа может прорастать в другой, большим подспорьем для ее проведения является использование простат-специфических маркеров. В наших исследованиях наиболее демонстративную картину выявил AMACR (альфа-метилацил-КоА-рацемаза). При иммуногистохимическом исследовании он проявил высокую специфичность при экспрессии в группе больных с раком предстательной железы (рис. 3).
Простатспецифический мембранный антиген – интегральный мембранный белок с ферментативной активностью. В нашем материале отмечалась активная мембранная экспрессия PSMA при раках простаты. В группе больных с ДГПЖ преобладала слабая цитоплазматическая экспрессия. Считаем, что перемещение экспрессии маркера из цитоплазмы к мембране клетки может служить признаком начальной стадии канцерогенеза.
Уровень ПСА в ткани нормальной простаты в миллион раз превышает его показатели в сыворотке крови. ПСА в нашем материале с помощью иммуногистохимического метода определяется во всех структурах как нормальной, так и гиперпластической и неопластической простаты.
В группах больных с раком мочевого пузыря экспрессия этих маркеров была отрицательной.
Заключение. Таким образом, проведенное исследование показало, что в настоящее время выявление факторов прогноза и риска развития рака предстательной железы и мочевого пузыря возможно лишь с применением комплексного подхода к разработке панелей неспецифических и специфических иммуногистохимических маркеров.
Применение автоматизированной комбинированной системы анализа цифровых изображений Ariol SL50 (Genetix, Великобритания, 2009) для морфометрического анализа позволяет достигнуть повышения точности результатов иммуногистохимического исследования, объективизации оценки его результатов и освобождения врача-морфолога от ведения рутинных подсчетов и вычислений.
Список литературы Применение метода автоматизированной морфометрической оценки экспрессии иммуногистохимических маркеров в диагностике рака предстательной железы и мочевого пузыря
- Клиническая онкоурология/Б.П. Матвеев [и др.]: под ред. проф. Б.П. Матвеева. М., 2003. С. 1-18.
- Давыдов М.И., Аксель Е.М. Злокачественные новообразования в России и странах СНГ в 2003 г. М.: Мед. информ. агентство, 2005. 235 с.
- Микич Д.Х. Органосохраняющее лечение при инвазив-ном раке мочевого пузыря//Онкоурология. 2005. № 2. С. 27-31.
- Prognostic markers for bladder cancer: International Consensus Panel on bladder tumor markers/T. Habuchi, M. Marberger, M.J. Droller [et al.]//Urology. 2005. Vol. 66, Issue 6. Suppl. I. P. 64-74.
- Магер B.O., Казанцева H.B. Прогностическое значение биологических маркеров у больных поверхностным и инвазивным раком мочевого пузыря//Онкоурология. 2006. № 4. С. 30-35.
- Матвеев Б.П., Фигурин К.М., Карякин О.Б. Рак мочевого пузыря. М.: Вердана, 2001. 243 с.
- Lawson D.A., Witte O.N. Stem cells in prostate cancer initiation and progression//J. Clin. Invest. 2007. Vol. 117 (8). P. 2044-2050.


