Применение метода твердофазной экстракции при исследовании органического вещества в гидротермальных системах Дальнего Востока России
Автор: Потурай В.А.
Журнал: Региональные проблемы @regionalnye-problemy
Рубрика: Геология. Геоэкология
Статья в выпуске: 4 т.27, 2024 года.
Бесплатный доступ
В статье приводится описание процесса твердофазной экстракции как метода пробоподготовки природных, в частности термальных, вод к последующему инструментальному анализу органического вещества средней летучести. Излагаются основные этапы этого процесса, заключающиеся в концентрировании интересующих исследователя целевых компонентов, их очистке от примесей и смене исходной матрицы на более подходящую среду для хроматографического анализа. Отмечаются основные преимущества этого метода пробоподготовки в сравнении с традиционной жидкостно-жидкостной экстракцией, которые сводятся к эффективной адсорбции большого количества органических соединений, способности сохранять их до анализа длительное время без изменения состава и концентрации и возможности использовать при этом малые объемы проб и органических растворителей. Твердофазная экстракция подходит для применения как в лабораторных условиях, так и на месте отбора проб воды, что значительно упрощает полевые исследования труднодоступных горячих источников. Для проведения этого метода пробоподготовки используются лабораторная и полевая установки, а также оборудование для кондиционирования и элюирования сорбентов, описание которых приводится в настоящей работе. Кроме этого, излагаются основные результаты многолетнего исследования органического вещества средней летучести в термальных и холодных водах районов геотермальных месторождений Дальнего Востока, анализ которых проводился методом твердофазной экстракции с использованием картриджей с сорбентом на основе силикагеля (С18) и газовой хроматомасс-спектрометрии. Впервые для этих месторождений были установлены разнообразные органические соединения, среди которых преобладают предельные и ароматические углеводороды, карбоновые кислоты и их эфиры в горячих водах. Происхождение этих компонентов связано с термокаталитическими процессами преобразования органических остатков биогенного происхождения. В холодных водах районов геотермальных месторождений широко распространены биогенные терпены и стероиды.
Твердофазная экстракция, картридж dsc-18, органическое вещество, гидротермальная система, углеводороды, генезис
Короткий адрес: https://sciup.org/143184049
IDR: 143184049 | УДК: 543.38:556.31:550.461(571.6) | DOI: 10.31433/2618-9593-2024-27-4-30-48
Текст научной статьи Применение метода твердофазной экстракции при исследовании органического вещества в гидротермальных системах Дальнего Востока России
Институт комплексного анализа региональных проблем ДВО РАН, ул. Шолом-Алейхема 4, г. Биробиджан, 679016, e-mail: ,
В последние годы значительно вырос интерес к органической гидрогеохимии гидротермальных систем. Увеличивается число публикаций, касающихся изучения органического вещества (ОВ) в подземных водах, в частности термальных и минеральных водах, как в России, так и за рубежом [1, 2, 6, 8, 9, 13, 16, 18, 21, 24, 27–35, 37, 39–42, и др.]. Такой рост интереса у научного сообщества связан в том числе с резко возросшими способностями аналитической химии. Как правило, в подземных термальных и минеральных водах, если речь не идет о нефте-газо-ме-сторождениях, концентрация растворенного ОВ невелика, а содержание отдельных органических соединений в этих водах еще намного ниже. То есть это микропримеси, которые имеют огромное значение в процессах взаимодействия в системе «вода–порода–газ–органическое вещество». Такие «следовые» количества весьма затрудняют их определение. Концентрация целевых соединений в большинстве образцов обычно находится около предела обнаружения самыми чувствительными инструментальными методами [25]. Наряду с анализом в лаборатории на высокоточном современном оборудовании, как правило, капиллярных газовых (ГХ-МС) и высокоэффективных жид- костных хроматомасс-спектрометрах (ВЭЖХ), требуются значительные усилия в процессе про-боподготовки. Разработка полного анализа ОВ в природных водах включает в себя ряд этапов, начиная с отбора проб и заканчивая оформлением результатов. Сюда же относятся: хранение проб, их транспортировка до места анализа, пробопод-готовка, разделение аналитов и их идентификация и т.д. (рис. 1) [23].
Все вышеперечисленные этапы важны и требуют немалых затрат времени и усилий. Однако пробоподготовка – это наиболее утомительный и трудоемкий процесс, который является источником значительного количества погрешностей и инструментального загрязнения. Процесс пробопод-готовки для последующего анализа ОВ сводится к концентрации аналитов и смене исходной матрицы на более подходящую для инструментального анализа (как правило, это соответствующий органический растворитель). При этом очистка, предварительное концентрирование и фракционирование проб – одни из самых трудоемких этапов аналитической процедуры, на которые в среднем приходится около 60% рабочего времени [19]. Для анализа качественного состава углеводородов (УВ) и их производных в природных водах используются различные методы пробоподготовки,
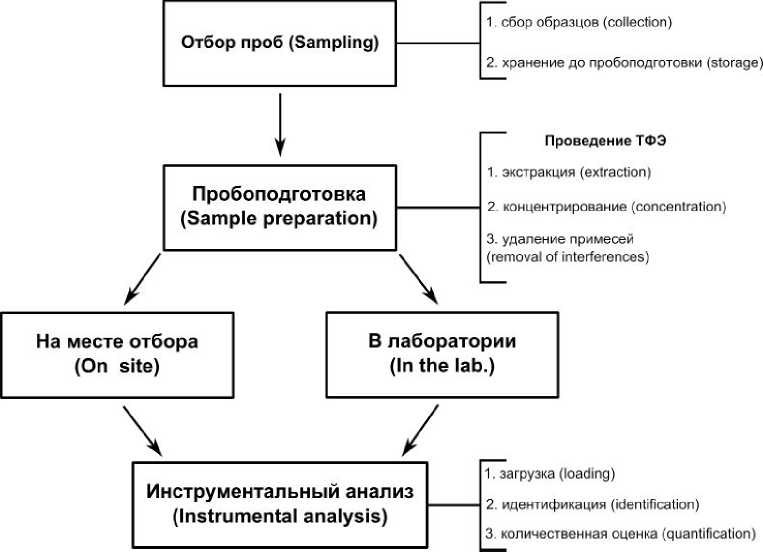
Рис. 1. Этапы анализа состава органического вещества в природных водах
Fig. 1. Stages of the organic matter composition analysis in natural waters
среди которых наиболее часто используемые – это жидкостно-жидкостная экстракция (ЖЖЭ) и твердофазная экстракция (ТФЭ). ЖЖЭ – популярный метод пробоподготовки, который сводится к «вытягиванию» аналитов из воды несмешивающимся с ней и нерастворимым в ней органическим растворителем (например, хлороформом). Он относительно прост и эффективен, однако обладает рядом недостатков:
-
1) необходимость отбирать большие объемы проб воды. Для отбора на анализ ОВ используется исключительно стеклянная посуда. Полевые экспедиции, как правило, довольно продолжительны и часто предполагают посещение труднодоступной местности пешим способом, поэтому перенос большого количества хрупкой и тяжелой посуды из стекла становится очень затруднителен;
-
2) использование токсичных органических растворителей в больших количествах при непосредственном контакте с ними аналитика;
-
3) необходимость применять сверхчистые «дорогие» реагенты. Так как ГХ-МС или ВЭЖХ – высокочувствительные методы анализа, даже самый небольшой «фон», который может создавать растворитель, приводит к затруднению в расшифровке полученных хроматограмм, не говоря уже о том, что пики, «идущие» из растворителя, затрудняют интеграцию искомых пиков;
-
4) образование эмульсий;
-
5) неэффективность при извлечении полярных соединений.
Твердофазная экстракция позволяет избежать или свести к минимуму вышеперечисленные недостатки ЖЖЭ. Для эффективного извлечения целевых компонентов нужны небольшие объемы образцов (50–250 мл). Для кондиционирования и элюирования картриджей ТФЭ хватает малого количества органических растворителей (2–3 мл). Этот способ пробоподготовки исключает образование эмульсий. Одно из основных преимуществ ТФЭ заключается в том, что удерживаемые сорбентом целевые компоненты не разлагаются и, таким образом, могут храниться в течение длительного периода времени без изменения. Кроме этого, транспортировка картриджей ТФЭ в полевых условиях гораздо удобнее, чем перевозка громоздкой стеклянной посуды. Еще одно важное преимущество ТФЭ перед ЖЖЭ заключается в том, что этот метод позволяет извлекать широкий спектр органических соединений – от неполярных компонентов до полярных веществ [20].
Метод ТФЭ впервые был применен в 1940-х годах, а к 1970-м приобрел популярность [22]. Он используется, в частности, для анализа ОВ природных вод, в том числе термоминеральных вод ,как у нас в России, так и за рубежом [8, 9, 29, 37, 41]. Описанию принципа действия ТФЭ, вариантов его проведения и особенностям, на которые нужно обратить внимание, посвящена настоящая работа. Кроме этого, приводятся результаты многолетнего исследования состава ОВ, полученные благодаря применению твердофазной экстракции с хроматомасс-спектрометрическим окончанием в термальных и холодных водах геотермальных месторождений континентальной части Дальнего Востока (ДВ) России.
Принцип действия ТФЭ
Улавливание микроконцентраций органических компонентов является актуальной, быстро развивающейся областью аналитической химии. Несмотря на высокую эффективность современных физико-химических методов обнаружения, определение ОВ нуждается в специальной подготовке пробы к анализу, так как точная идентификация соединений на следовых уровнях без предварительной обработки является очень сложной, часто невыполнимой задачей [26]. Несмотря на значительный технологический прогресс в аналитической области, приборы не могут напрямую работать с относительно сложными образцами, коими, безусловно, являются природные воды. В ТФЭ целевые компоненты, представляющие интерес для исследователя (органические соединения), разделяются между твердым телом (фазой) и жидкостью (а не между двумя несмешивающими-ся жидкостями, как в ЖЖЭ) [23, 36]. Происходит это в результате загрузки образца на твердую фазу (обычно картридж с сорбентом). При этом интересующие компоненты должны иметь большее «сродство» к твердой фазе, чем к матрице образца – природной воде (этап адсорбции). Соединения, удерживаемые на твердой фазе, могут быть переведены в органический растворитель, который, в свою очередь, обладает большим «сродством» к аналитам (этап элюирования или десорбции).
Картриджи являются наиболее распространенным одноразовым форматом, который появился более 40 лет назад (первые картриджи датируются 1978 годом) [19]. В современном методе ТФЭ сорбент, способный удерживать аналиты, упакован между двумя пористыми дисками (фриттами) в полипропиленовом или полиэтиленовом тубусе. Количество сорбента варьируется от миллиграмма до нескольких граммов в зависимости от применяемого объема образца. Жидкая фаза (вода) проходит через картридж либо за счет положительного давления (например, давление газа), либо за счет отрицательного давления (разрежение, создаваемое вакуумным насосом). ТФЭ может удерживать приблизительно 5% от массы сорбента без значительного прорыва. Таким образом, наиболее популярными конфигурациями являются картриджи ТФЭ массой 500 мг, упакованные в тубусы объемом 3 и 5 мл, которые необходимы для очистки большого объема проб окружающей среды (ожидается, что в них сохранится ~ 25 мг аналитов). Однако картриджи меньшей массы (50 и 100 мг сорбента в тубусе объемом 1 мл) необходимы для более быстрого проведения пробоподготовки, повышения чувствительности анализа за счет уменьшения объема элюирования и уменьшения объемов пробы воды, необходимой для анализа [22]. Картриджи с меньшей массой сорбента более предпочтительны для исследования ОВ в гидротермальных системах, позволяя отбирать небольшие объемы воды и эффективно извлекать растворенные в них УВ и их производные.
Сам процесс состоит из 4 (5) последовательных этапов (рис. 2): 1) активация сорбента (этап кондиционирования) путем загрузки на него подходящего растворителя (или последовательно нескольких растворителей). В результате поверхность сорбента активируется, удаляется воздух – сорбент готов к работе. Следующий этап, который можно объединить с предыдущим, – удаление растворителей и подготовка сорбента к конкретной матрице. Это осуществляется путем загрузки жидкости, сходной по составу с матрицей образца (если речь идет о природных водах – это дистиллированная вода); 2) внесение образца в картридж. Органические соединения из исходной матрицы переходят на сорбент (удерживаются сорбентом); 3) промывка сорбента жидкостью, которая удаляет мешающие компоненты (примеси) и не удаляет аналиты из сорбента (дистиллированная вода); 4) последний этап – элюирование сорбента. Осуществляется путем загрузки в картридж подходящего растворителя, который адсорбирует аналиты, удерживаемые сорбентом, и сбора полученного экстракта в виалы.
Это классическая схема проведения процедуры ТФЭ. Однако под конкретные задачи возможны различные модификации этого процесса. Наиболее часто используемый вариант ТФЭ – включение в классическую схему этапов сушки сорбента. Это необходимо в том случае, когда при кондиционировании и элюировании используются реагенты, не смешивающиеся и не раство-
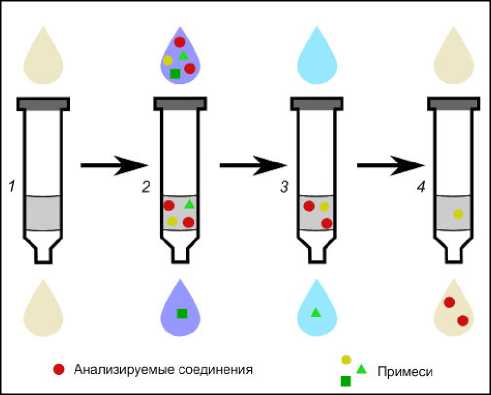
Рис. 2. Схема твердофазной экстракции, по [19]
1 – кондиционирование сорбента растворителями (и удаление растворителя дистиллированной водой); 2 – загрузка анализируемой воды (этап адсорбции); 3 – промывка сорбента и удаление мешающих компонентов (солей); 4 – элюирование растворителем целевых компонентов
Fig. 2. Solid phase extraction scheme, according to [19]
-
1 – solvent conditioning of the sorbent (and solvent removal with distilled water); 2 – analysed water loading (adsorption step); 3 – sorbent washing and removal of interfering components; 4 – elution of target components with solvent
римые в матрице образца (в воде). Микрокапли растворителя, которые остались после кондиционирования, будут мешать эффективному взаимодействию сорбента с образцом. И наоборот, остатки матрицы будут мешать извлечению аналитов элюентом. Необходимо удалять следы жидкости после этапов кондиционирования и адсорбции, то есть сушить сорбент в токе инертного газа. Сама схема проведения ТФЭ с сушкой сорбента представлена на рис. 3.
После кондиционирования через сорбент подается поток инертного газа (например, аргона) 5–10 минут до полного осушения. Давление, как правило, около 0.3–0.5 атмосферы. Далее вносится анализируемая вода, после чего картридж снова сушится в токе аргона 20–25 минут.
Еще одна из модификаций ТФЭ – перенос сорбента в стеклянный тубус. Стандартные полипропиленовые и полиэтиленовые картриджи могут давать примеси четных н-алканов состава
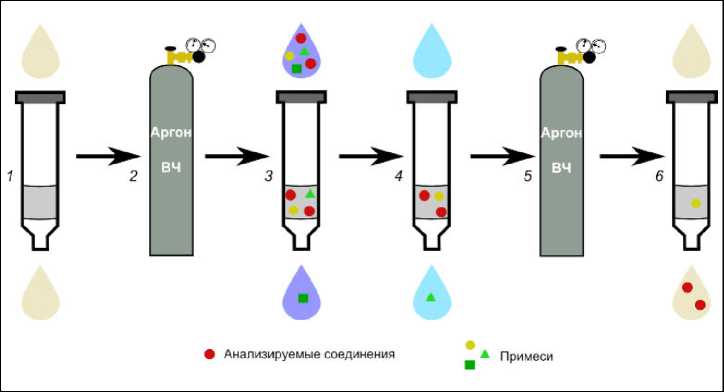
Рис. 3. Схема твердофазной экстракции с сушкой сорбента
1 – кондиционирование сорбента растворителями; 2 – сушка сорбента в потоке аргона и подготовка для внесения пробы; 3 – фильтрация анализируемой воды; 4 – промывка сорбента и удаление мешающих компонентов (солей); 5 – сушка сорбента в потоке аргона и подготовка для элюирования; 6 – элюирование растворителем целевых компонентов
Fig. 3 Scheme of solid-phase extraction with sorbent drying
1 – solvent conditioning of the sorbent; 2 – sorbent drying in an argon flow and preparation for sample introduction; 3 – analysed water loading; 4 – sorbent washing and removal of interfering components; 5 – sorbent drying in an argon flow and preparation for elution; 6 – elution of target components with solvent н-C12–20 (картриджи DSC-18), фталатов и алканов (картриджи Oasis), силоксанов и алканов (картриджи Strata), источником которых являются стенки тубуса, в котором находится сорбент. К сожалению, стеклянных картриджей для ТФЭ на рынке аналитической химии нет. Один из вариантов устранения этого эффекта заключается в переносе сорбента из полипропиленового картриджа в самодельный стеклянный тубус. Другим вариантом нивелирования этого инструментального загрязнения является вычитание площади пика примеси из площади пика соединения, установленного во время анализа (рис. 4). Кроме этого, при кондиционировании сорбента следует использовать 2–3 органических растворителя, один из которых гексан. Это помогает снизить интенсивность пиков четных алканов, поступивших из стенок картриджа. Природные воды, особенно термальные, как правило, содержат предельные УВ. Поступление этих компонентов из картриджей может исказить результаты исследования.
Для эффективного извлечения органических соединений из природных вод иногда может потребоваться регулировка pH перед проведением ТФЭ. Особенно это актуально для щелочных вод. Сорбент С-18 из картриджа DSC-18 работает луч- ше при pH анализируемой воды около 2–3, извлекая большее количество растворенных в воде органических компонентов. На рис. 5 представлены диаграммы гомологических рядов органических соединений, установленных в термальной воде из
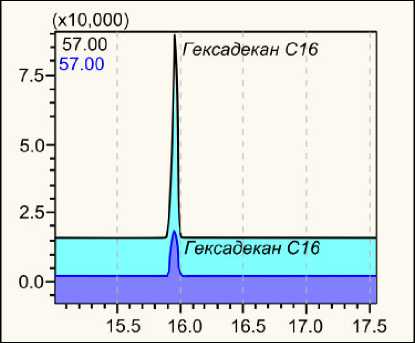
Рис. 4. Отрезок хроматограммы картриджа DSC-18 (снизу) и хроматограммы природной воды (сверху)
Fig. 4. Plot of DSC-18 cartridge chromatogram (bottom) and natural water chromatogram (top)
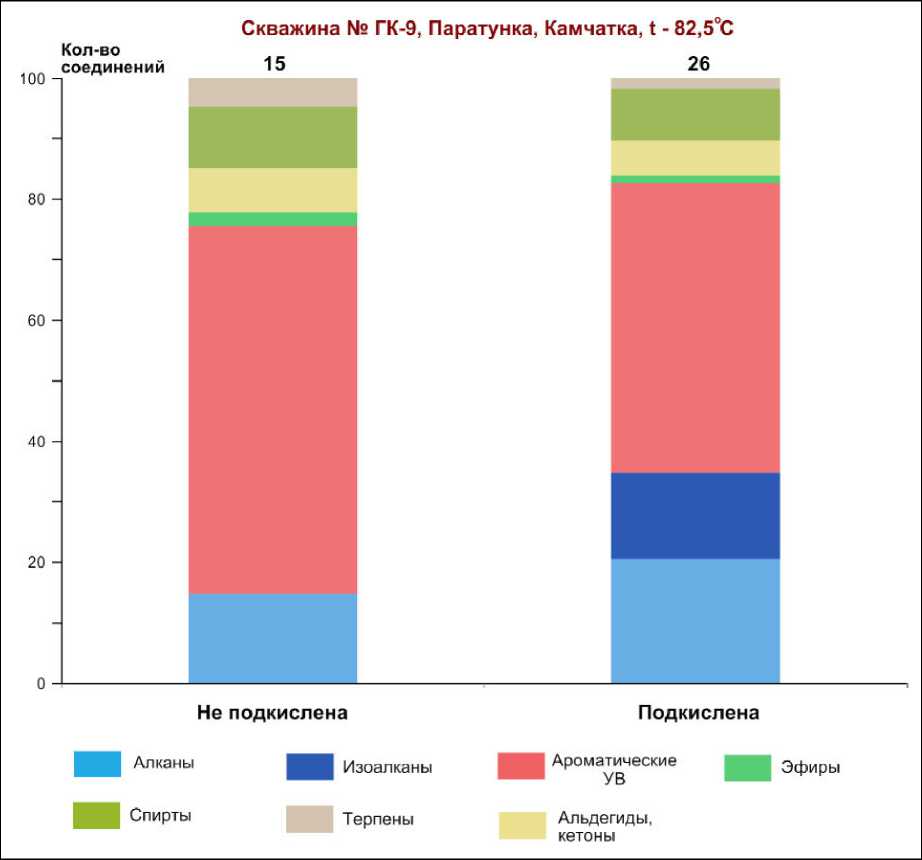
Рис. 5. Диаграммы гомологических рядов органических соединений из Паратунских терм.
Слева – исходная вода с pH 8, справа – подкисленная соляной кислотой до pH 3
Fig. 5. Diagrams of homological series of organic compounds from the Paratunka thermal waters. Left – original water with pH 8, right – acidifi ed with hydrochloric acid to pH 3
скважины № ГК-9 Паратунского геотермального месторождения на Камчатке (температура воды 82.5 ºС, pH 8). Столбец слева – это исходная проба анализируемой воды с pH 8, а справа – та же вода, но подкисленная соляной кислотой до pH 3. Как видно из приведенных данных, количество соединений установлено больше именно в подкисленной пробе (на 11 компонентов). «Новые» соединения – изоалканы, а состав и характер распределения остальных установленных соединений одинаков. Регулировка pH не оказывает влияния на состав органического вещества (он остался без изменения), а позволяет «вытягивать» больше соединений. Кроме этого, подкисление не приводит к изомеризации нормальных алканов, так как их состав в подкисленной и неподкисленной пробах одинаков.
Проведение ТФЭ в лабораторных условиях
Процесс пробоподготовки методом твердофазной экстракции в лаборатории является более удобным и не менее эффективным способом, чем проведение ТФЭ «оn site», при соблюдении ряда условий. Во-первых, как уже писалось ранее, пробы должны быть отобраны в стеклянную посуду. Во-вторых, образцы нужно хранить в холодном месте. В-третьих – исключить попадание солнечных лучей. Последнее, но одно из важнейших условий, – после отбора и до проведения ТФЭ должно пройти не более 3 дней (руководствуясь принципом «чем меньше – тем лучше»).
Для исследования ОВ в гидротермальных системах использовались картриджи с сорбентом DSC-18 (50 мг), на основе силикагеля. Этот сорбент показал хорошую эффективность при извлечении большого числа органических компонентов. Пробы отбирались непосредственно из самих скважин, вскрывающих термальные воды, в бутыли из темного стекла с притертой крышкой. Объем образца, необходимый для анализа, – 100 мл. Сразу после отбора бутыли с водой помещались в холодное место (переносной холодильник) и транспортировались до лаборатории. Срок хранения до экстракции не превышал 2 суток с момента отбора. В лаборатории картриджи для ТФЭ последовательно кондиционировались 2 мл гексана, метанола и хлористого метилена. Кондициони- рование осуществлялось с помощью установки, показанной на рис. 6. При помощи стеклянного шприца растворитель вносился в стеклянную пипетку, к которой подсоединен картридж ТФЭ. Сверху устанавливался шприц для создания избыточного давления. При помощи этой же установки осуществлялось элюирование сорбента.
Сушка сорбента производилась в лабораторной установке для проведения ТФЭ, показанной на рис. 7, при помощи которой можно экстрагировать одновременно три пробы воды. Картриджи устанавливались на пипетку Мора, а сверху подводился газ аргон. Давление на манометре выставлялось 0.8–0.9 атмосферы (учитывая одновременную сушку трех картриджей). После кондиционирования сорбент сушился в токе аргона 5–10 минут.
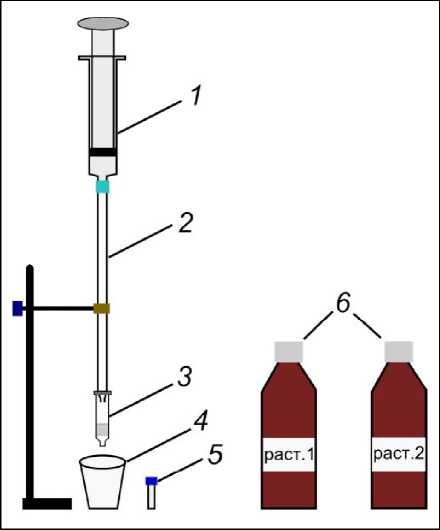
Рис. 6. Установка для кондиционирования / элюирования картриджа ТФЭ
1 – быстросъемный шприц для создания избыточного давления; 2 – градуированная пипетка на 2 мл; 3 – картридж DSC-18; 4 – стакан для слива растворителя; 5 – виала для сбора экстракта на 1.5 мл; 6 – растворители, используемые при кондиционировании и элюировании
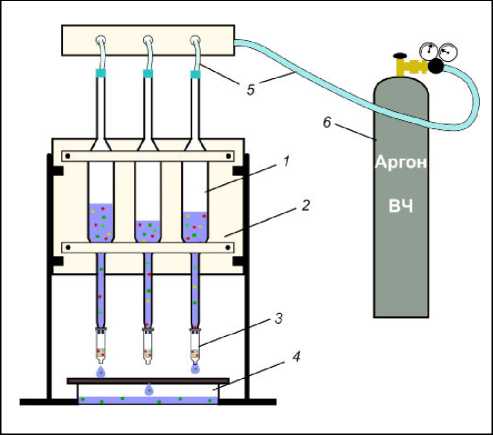
Рис. 7. Лабораторная установка для проведения ТФЭ
1 – пипетка Мора на 200 мл с анализируемой водой (красные кружочки – целевые компоненты, остальные значки – примеси); 2 – планшет на штативах для крепления пипеток; 3 – картридж с сорбентом DSC–18; 4 – емкость для слива воды; 5 – силиконовые шланги для подвода газа; 6 – баллон с аргоном, оборудованный манометром, для создания избыточного давления
Fig. 6. SPE cartridge conditioning / elution unit
-
1 – quick-release syringe for overpressurisation; 2 – graduated pipette for 2 ml; 3 – DSC-18 cartridge; 4 – beaker for draining solvent; 5 – 1.5 ml vial for extract collection; 6 – Solvents used for conditioning and elution
-
Fig. 7. Laboratory unit for SPE
1 – 200 ml Mohr pipette with analysed water (red circles are target components, other symbols are impurities); 2 – Tablet on stands for fixing pipettes; 3 – DSC-18 sorbent cartridge; 4 – water tank; 5 – silicone hoses for gas supply; 6 – argon cylinder with pressure gauge to generate overpressure
После высушивания сорбента в токе аргона, не снимая картриджа, последовательно вносились 2 мл дистиллированной и 100 мл анализируемой воды. На манометре выставлялось значение 0.3–0.6 атмосферы, что обеспечивало постоянную скорость потока 1 мл в минуту. Такая скорость обеспечивает высокую эффективность при экстракции аналитов. После «выдувания» анализируемой воды через картридж снова вносилось 2 мл дистиллята для удаления примесей, и сорбент сушился в токе аргона 20–25 минут. Удержанные органические соединения снимались с сорбента (элюировались) 500 мкл хлористого метилена. Далее на водяной бане с дефлегматором полученный экстракт упаривался до 50 мкл, что позволяло сконцентрировать органические компоненты в 1000 раз по сравнению с исходной пробой воды. Качественный анализ органических соединений полученных экстрактов осуществляли методом капиллярной газовой хроматографии в сочетании с масс-спектрометрией [3, 38] на газовом хрома-томасс-спектрометре Shimadzu GCMS-QP2010S в лаборатории КЦЭМП (аналитик В.Л. Рапопорт) и на Shimadzu GCMS-QP2010 ultra в лаборатории ИКАРП ДВО РАН (аналитик В.А. Потурай). Этот метод позволяет анализировать сложные многокомпонентные смеси, разделяя и регистрируя индивидуальные органические соединения, даже имеющие очень близкую структуру [5].
Проведение ТФЭ в полевых условиях
Иногда при проведении исследования гидротермальных систем бывает трудно выполнить некоторые условия, необходимые для эффективной экстракции методом ТФЭ в лаборатории. В основном трудности возникают или в процессе хранения проб воды (не всегда удается доставить их в лабораторию в течение 3 суток, еще и поместив в холодное место) или в результате транспортировки (перевозка большого количества стеклянных бутылей в полевых условиях зачастую практически невозможна). Тогда процедуру ТФЭ можно осуществлять непосредственно на месте отбора, в полевых условиях. Это избавляет от необходимости переносить большое количество стеклянной посуды с одной стороны и позволяет зафиксировать именно тот состав ОВ, который есть непосредственно в источнике, с другой. Кроме этого, уже сорбированные в картридже ТФЭ вещества остаются стабильными и не разлагаются в течение длительного периода времени. В работе Аndrade-Eiroa A. с соавторами [20] отмечалось, что в течение 100 дней с момента проведения ТФЭ органические вещества, удержанные сорбентом, остаются стабильными и не подвергаются бактериальной деградации. Именно поэтому лучше проводить элюирование картриджа непосредственно перед инструментальным анализом в лаборатории.
Сама схема проведения ТФЭ в полевых и лабораторных условиях не отличается. Последовательно проводились все 4 (5) этапов ТФЭ. Этапы кондиционирования картриджей и сушка сорбентов осуществлялись до выезда в поле, в лабораторных условиях. Далее высушенные картриджи помещались в индивидуальные пакетики с застежкой. На месте отбора проб воды была использована полевая установка для проведения ТФЭ [17], представленная на рис. 8.
В качестве резервуара для анализируемой воды использовались стеклянные шприцы на 100 мл. Отличие от лабораторной установки заключается в том, что здесь вода проходит через сорбент не в результате положительного (потоком газа), а за счет отрицательного давления (разрежения). Для этого использовался ресивер, представляющий собой колбу Бунзена с резиновой пробкой, в которую вставлена стеклянная трубка с силиконовым шлангом и ручной вакуумный насос, оборудованный манометром. Анализируемая вода вносилась в резервуар (можно использовать несколько стеклянных тубусов, соответственно делать несколько проб одновременно) и за счет создания вакуума проходила через картридж с сорбентом (как и в лабораторном методе ТФЭ, перед внесением пробы и сразу после нее добавлялась дистиллированная вода). Далее картриджи снимались с установки, маркировались и помещались в пакетики. В таком виде они, вместе с удержанными сорбентом веществами, хранились до последующего анализа. В лаборатории картриджи сушились в токе аргона и, непосредственно перед инструментальным анализом, проводился этап элюирования.
Еще одним вариантом полевой установки для ТФЭ является пипетка Мора в качестве приемного резервуара (так же, как и в лаборатории). В этой установке создается не отрицательное, а положительное давление. Для этого используется обычная камера из футбольного мяча (предварительно надутая). Воздух из камеры будет давить на воду, позволяя ей с нужной скоростью пройти через картридж. Вещества, которые могут «лететь» вместе с потоком воздуха из камеры, не учитываются, так как методом ГХ-МС не улавливаются. Такой установкой мы пользовались в 2009 году при обследовании геотермальных месторождений
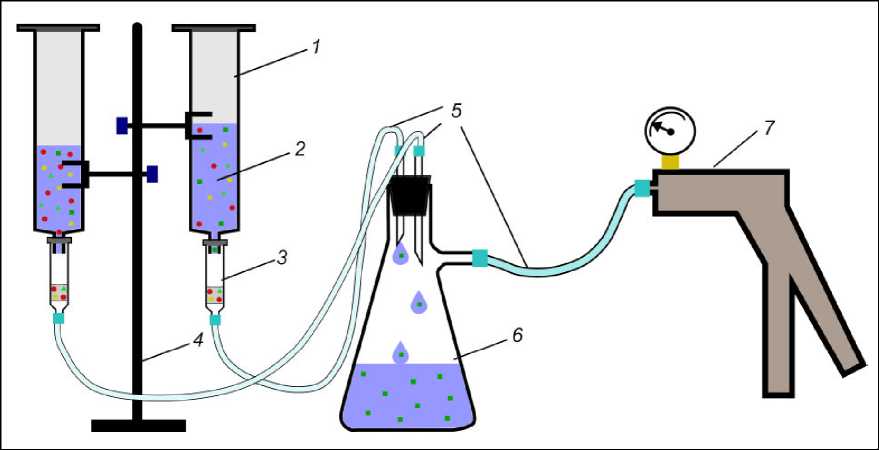
Рис. 8. Установка для проведения ТФЭ в полевых условиях
1 – стеклянный шприц (тубус) на 100 мл; 2 – анализируемая вода с растворенными целевыми и мешающими компонентами; 3 – картридж DSC-18; 4 – штатив; 5 – силиконовые шланги; 6 – колба Бунзена на 500 мл с резиновой пробкой; 7 – ручной вакуумный насос с манометром
-
Fig. 8. Unit for performing SPE in the fi eld
1 – 100 ml glass syringe (tube); 2 – analysed water with dissolved target and interfering components; 3 – DSC-18 cartridge; 4 – tripod; 5 – silicone hoses; 6 – 500 ml Bunsen flask with rubber stopper; 7 – hand vacuum pump with pressure gauge на Камчатке. Единственный недостаток этого способа заключается в том, что стабильный поток с нужной скоростью фильтрации пробы через картридж поддерживать неудобно. Кроме этого, сама установка немного громоздка, учитывая, что пипетка Мора на 100 мл представляет собой довольно сильно вытянутую трубку из хрупкого стекла.
Органическое вещество в гидротермальных системах континентальной части ДВ России
С 2007 по 2017 годы проводилось исследование ОВ на геотермальных месторождениях, которые располагаются на юге континентальной части ДВ (рис. 9). Были выбраны три наиболее мощных и высокотемпературных термопроявления в этой части ДВ – Кульдурское геотермальное месторождение, расположенное в северо-западной части Еврейской автономной области, Анненское и Тумнинское термальные поля, вытянутые цепочкой вдоль Татарского пролива в пределах Хабаровского края. В ходе проведения исследования неоднократно, в разные годы, отбирались пробы термальных вод, а также холодных подземных и поверхностных вод, расположенных в районе выходов исследуемых горячих источников.
В табл. 1 приведено краткое описание точек отбора проб горячих и холодных вод с указанием даты отбора для анализа на состав органического вещества. Всего было проведено 16 опробований в районе Кульдурского геотермального месторождения, 7 опробований в пределах Анненского термального поля и 9 проб воды было отобрано в районе Тумнинских терм. Полевые маршруты были выстроены таким образом, чтобы отобранные пробы хранились до ТФЭ в лаборатории не более 2 суток в холодном месте (переносной холодильник).
Результаты 10-летнего исследования состава ОВ в горячих и холодных водах районов геотермальных месторождений континентальной части ДВ более подробно можно посмотреть в работах [9–15]. Всего в горячих и холодных водах было установлено 249 соединений органической природы, которые были отнесены к 20 гомологическим рядам (табл. 2). При этом в термальных водах зафиксировано 245 соединений / 20 гомологических рядов, а в холодных – 79 компонентов и 13 гомологических рядов. Наиболее широко представлены по количеству соединений – гомологи-
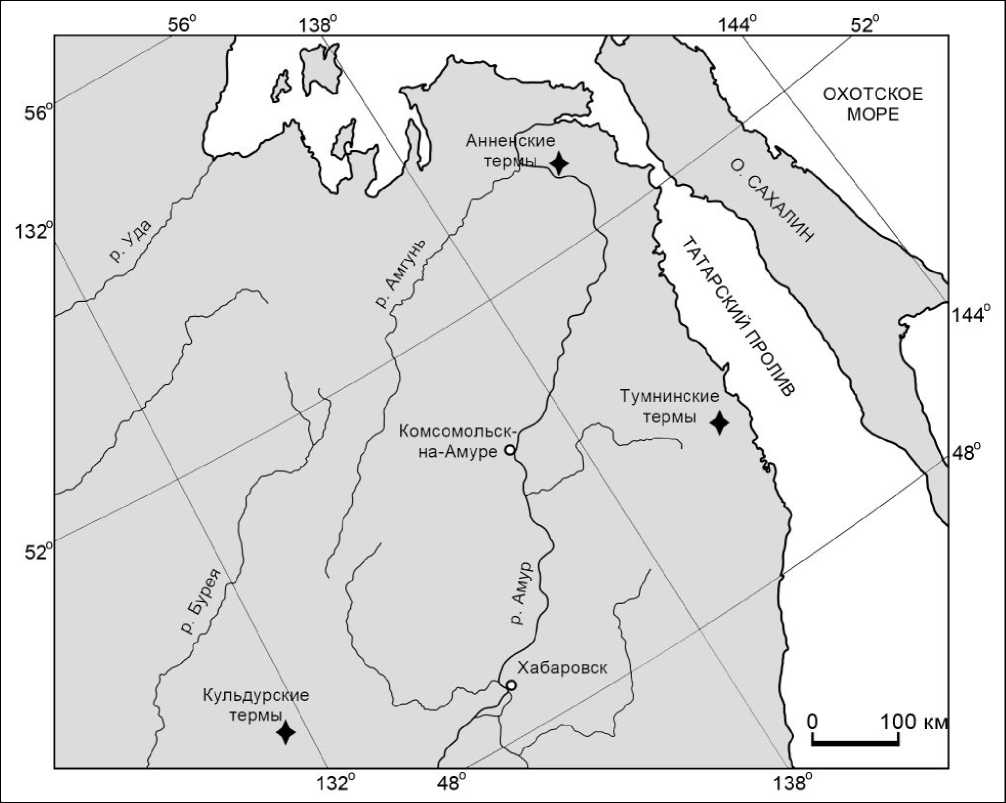
Рис. 9. Обзорная карта с месторасположением исследуемых геотермальных месторождений
Fig. 9. Overview map showing the location of the studied geothermal fi elds ческие ряды эфиров и карбоновых кислот (40 и 21 соединение соответственно), а также нормальных и изоалканов (27 и 29 соединений соответственно) и ароматических УВ – 40 компонентов. Если рассматривать отдельно по термальным полям, то здесь наиболее распространены нормальные алканы, количество которых колеблется от 23 в Тумнинских термах до 26 в Анненских и Кульдур-ских и эфиры, количество которых варьируется от 13 соединений в Анненских источниках до 23 в Кульдурских. На долю алифатических, ароматических и кислородсодержащих УВ приходится 220 компонентов из 249. При этом алифатические УВ насчитывают 77 соединений, ароматические УВ – 42 соединения (40 из них в термах) и кислородсодержащие УВ – 105 веществ (103 из них в горячих водах).
В табл. 3 представлены данные по отно- сительным концентрациям установленных органических соединений в исследуемых водах. Как видно из приведенных данных, максимальных относительных концентраций в горячих и холодных водах достигают предельные УВ (н-алка-ны) – 16.9%, терпены (тритерпеноиды) – 19.1% и эфиры карбоновых кислот – 17.4%. При этом исключительно в термальных водах список гомологических рядов доминирующих соединений изменяется. Здесь преобладают предельные и ароматические УВ (16.5% и 19.8% соответственно), карбоновые кислоты и их эфиры (12.7% и 24.5% соответственно). Учитывая высокую температуру воды – на выходе от 46 до 72 ºС, а в глубинном резервуаре выше 120 ºС [4, 7]; характер доминирующих компонентов – ароматические УВ не типичны для природных вод, живыми организмами практически не синтезируются, а геохимические
Таблица 1
Краткая характеристика точек опробования термальных и холодных вод континентальной части Дальнего Востока и даты отбора образцов воды для анализа на состав органического вещества
Brief characteristics of thermal and cold water sampling sites in the continental Far East, and dates of water sampling for organic matter analysis
Table 1
|
Место отбора |
Дата отбора |
Температура, ºС |
pH |
Глубина, м |
|
Кульдурское геотермальное месторождение |
||||
|
Скважина 1-87 |
11.07.2007 |
72.6 |
9.5 |
100 |
|
07.10.2008 |
||||
|
22.09.2011 |
||||
|
16.10.2013 вечер |
||||
|
17.10.2013 утро |
||||
|
17.10.2013 вечер |
||||
|
Скважина 2-87 |
22.09.2011 |
71.4 |
9.5 |
100 |
|
Скважина 3-87 |
22.09.2011 |
59.3 |
9.6 |
100 |
|
Скважина 3 |
07.10.2008 |
54.8 |
9.5 |
116.7 |
|
22.09.2011 |
||||
|
Скважина 5 |
07.10.2008 |
22 |
9.5 |
126.5 |
|
22.09.2011 |
||||
|
Скважина 4 |
22.09.2011 |
45.5 |
9.11 |
142.5 |
|
Скважина 10-1 (холодная) |
01.06.2010 |
5.6 |
7 |
53 |
|
Скважина 10-4 |
01.06.2010 |
5.4 |
6.5 |
25 |
|
р. Кульдур (выше по течению термального поля на 100 м) |
22.09.2011 |
3.2 |
7.1 |
– |
|
Анненское геотермальное месторождение |
||||
|
Скважина 2 |
19.09.2012 |
54.0 |
9.0 |
43.8 |
|
19.09.2012 10 мин |
||||
|
27.08.2014 |
||||
|
Скважина 21 |
19.09.2012 |
54.0 |
9.0 |
201.6 |
|
27.08.2014 |
||||
|
Скважина 30-460 (холодная) |
26.08.2014 |
9.0 |
7.8 |
90 |
|
руч. Амурчик (выше по течению термального поля на 700 м) |
26.08.2014 |
– |
– |
– |
|
Тумнинское геотермальное месторождение |
||||
|
Скважина 8 |
08.06.2010 |
46.0 |
9.53 |
532 |
|
12.09.2011 |
||||
|
22.06.2017 |
||||
|
22.06.2017 30 мин |
||||
|
29.06.2017 |
||||
|
29.06.2017 30 мин |
||||
|
Скважина 9 |
08.06.2010 |
43.0 |
9.43 |
300 |
|
12.09.2011 |
||||
|
руч. Чопэ |
12.09.2011 |
– |
– |
– |
Гомологические ряды и количество органических компонентов, установленных в термальных и холодных водах континентальной части Дальнего Востока
Table 2
Homologous series and abundance of organic constituents in thermal and cold waters of the continental Far East
Table 3
|
№ п/п |
Наименование гомологического ряда |
Доля, % |
|||||
|
Термальные воды |
Холодные |
Общее термы |
Общий список |
||||
|
Кульдур |
Аннен. |
Тумнин |
|||||
|
1 |
Н-Алканы |
17.3 |
18.5 |
13.7 |
17.3 |
16.5 |
16.9 |
|
2 |
Изоалканы |
1.4 |
0.5 |
5.2 |
0.0 |
2.4 |
1.2 |
|
3 |
Диэтоксиалканы |
0.6 |
– |
– |
– |
0.2 |
0.1 |
|
4 |
Циклоалканы |
0.1 |
– |
1.2 |
– |
0.4 |
0.2 |
|
5 |
Диоксаалканы |
0.5 |
1.3 |
– |
1.6 |
0.6 |
1.1 |
|
6 |
Н-Алкены и изоалкены |
0.1 |
0.2 |
3.9 |
– |
1.4 |
0.7 |
|
7 |
Терпены |
6.8 |
2.9 |
23.5 |
27.0 |
11.1 |
19.1 |
|
Алифатические УВ |
26.8 |
23.4 |
47.5 |
45.9 |
32.6 |
39.3 |
|
|
8 |
Арены |
4.0 |
2.7 |
4.3 |
1.9 |
3.7 |
2.8 |
|
9 |
ПАУ |
16.8 |
1.7 |
3.0 |
след |
7.2 |
3.6 |
|
10 |
Гетероароматические УВ |
– |
22.3 |
4.4 |
4.6 |
8.9 |
6.7 |
|
Ароматические УВ |
20.8 |
26.7 |
11.7 |
6.5 |
19.8 |
13.1 |
|
|
11 |
Карбоновые кислоты |
30.4 |
5.9 |
2.0 |
7.5 |
12.7 |
10.1 |
|
12 |
Эфиры |
7.0 |
34.5 |
32.0 |
10.2 |
24.5 |
17.4 |
|
13 |
Альдегиды |
3.0 |
2.7 |
3.6 |
7.5 |
3.1 |
5.3 |
|
14 |
Кетоны |
1.3 |
0.5 |
0.9 |
3.3 |
0.9 |
2.1 |
|
15 |
Спирты |
1.0 |
3.2 |
2.0 |
2.9 |
2.1 |
2.5 |
|
16 |
Моноглицериды |
1.0 |
– |
– |
– |
0.3 |
0.2 |
|
Кислородсодержащие УВ |
43.7 |
46.8 |
40.5 |
31.4 |
43.6 |
37.6 |
|
|
17 |
Азотсодержащие УВ |
0.4 |
1.6 |
0.1 |
– |
0.7 |
0.3 |
|
18 |
Серосодержащие УВ |
– |
– |
0.2 |
– |
0.1 |
0.1 |
|
19 |
Хиноны |
0.1 |
0.7 |
– |
– |
0.2 |
0.1 |
|
20 |
Стероиды |
8.2 |
0.8 |
след |
16.2 |
3.0 |
9.5 |
|
Итого |
100.0 |
100.0 |
100.0 |
100.0 |
100.0 |
100.0 |
|
Гомологические ряды органических соединений и их относительное содержание в термальных и холодных водах континентальной части Дальнего Востока
Homologous series of organic compounds and their relative content in thermal and cold waters of the continental Far East
Распределение ОВ по геотермальным месторождениям следующее: в Кульдурских термах преобладают предельные, ароматические УВ и карбоновые кислоты, в Анненских горячих источниках доминируют также предельные и ароматические УВ, но вместо карбоновых кислот (как в Кульдурских водах) здесь преобладают эфиры.
Тумнинские термы, наименее горячие из обследованных (температура 46 ºС), характеризуются уже более типичными для холодных природных вод биогенными терпенами, а также эфирами карбоновых кислот. Относительная концентрация н-ал-канов здесь ниже, чем в Кульдурских и Анненских источниках, и достигает 13.7%. Содержание аро- матических УВ здесь также заметно ниже (11.7% против 20.8–26.7% в Кульдурских и Анненских водах). В целом заметно снижение доли термокаталитического ОВ в Тумнинских термах и преобладание биогенных соединений.
Холодные воды районов геотермальных месторождений характеризуются биогенным составом ОВ. Здесь преобладают терпены, стероиды, альдегиды и эфиры. Доля н-алканов достигает 17.3%, но их молекулярно-массовое распределение указывает на биогенное, преимущественно растительное, происхождение ОВ (значение CPI более 2). Ароматические УВ, типичные для горячих вод, здесь установлены в невысоких относительных содержаниях (6.5%). Кроме характера распределения доминирующих компонентов и особенностей молекулярно-массового распределения н-алканов, к основным отличиям холодных вод от горячих относится незначительное распространение или полное отсутствие изомеров предельных УВ в холодных водах, которые являются характерными для термальных вод.
Заключение
Твердофазная экстракция как метод пробо-подготовки природных (термальных) вод для последующего анализа состава ОВ является одним из наиболее эффективных методов концентрирования и очистки целевых компонентов и смены исходной матрицы на более подходящую для последующего инструментального анализа. Этот способ позволяет быстро и результативно извлечь интересующие органические соединения, предварительно их сконцентрировав в 100–1000 раз, и используя при этом малые объемы исходной пробы и органических растворителей. Картриджи ТФЭ хорошо подходят для хранения сорбированных органических веществ до анализа в лаборатории в течение длительного времени без изменения их концентрации и состава. Сорбент С-18 показал свою эффективность при исследовании ОВ в гидротермальных системах, экстрагируя значительное количество разнообразных органических соединений. Разработанные установки для ТФЭ и кондиционирования картриджей позволяют успешно проводить эту процедуру для большого количества проб как в полевых условиях, так и в лаборатории.
В результате многолетнего исследования состава ОВ в горячих (температура 46–73 ºС) и холодных водах районов геотермальных месторождений континентальной части Дальнего Востока методом твердофазной экстракции с газовым хроматомасс-спектрометрическим окончанием установлено 249 соединений, которые относятся к 20 гомологическим рядам. Из них в термальных водах зафиксировано 245 компонентов, среди которых преобладают предельные и ароматические УВ (16.5% и 19.8% соответственно), а также карбоновые кислоты и их эфиры (12.7% и 24.5% соответственно). Происхождение предельных и ароматических УВ связано, вероятно, с термокаталитическими процессами преобразования органических остатков.
В холодных водах найдено 79 соединений, принадлежащих к 13 гомологическим рядам. Здесь доминируют явно биогенные соединения: терпены и стероиды. Молекулярно-массовое распределение предельных УВ свидетельствует о растительном источнике ОВ, а ароматические УВ здесь представлены незначительно.
Исследование выполнено в рамках государственного задания Института комплексного анализа региональных проблем ДВО РАН.
Список литературы Применение метода твердофазной экстракции при исследовании органического вещества в гидротермальных системах Дальнего Востока России
- Абрамов В.Ю. Формирование органического химического состава углекислых минеральных вод Ессентукского и Нагутского месторождений // Разведка и охрана недр. 2014. № 5. С. 47-51.
- Галимов Э.М., Севастьянов В.С., Карпов Г.А., Камалеева А.И., Кузнецова О.В., Коноплева И.В., Власова Л.Н. Углеводороды из вулканического района. Нефтепроявления в кальдере вулкана Узон на Камчатке // Геохимия. 2015. № 12. С. 1059-1068. DOI: 10.7868/ S0016752515120043.
- Другов Ю.С. Пробоподготовка в экологическом анализе / Ю.С. Другов, А.А. Родин. СПб.: Анатолия, 2002. 755 с.
- Зиппа Е.В., Брагин И.В. Оценка температуры азотных термальных вод на глубине циркуляции, Сихоте-Алинь // Геологическая эволюция взаимодействия воды с горными породами: материалы IV Всерос. конф. / под ред. А.М. Плюснина. Улан-Удэ: БНЦ СО РАН, 2020. С. 61-64. DOI: 10.31554/978-5-79250584-1-2020-61-64.
- Клюев Н.А., Бродский Е.С. Современные методы масс-спектрометрического анализа органических соединений // Российский химический журнал. 2002. Т. 46, № 4. С. 57-63.
- Конторович А.Э., Бортникова С.Б., Карпов Г.А., Каширцев В.А., Костырева Е.А., Фомин А.Н. Кальдера вулкана Узон (Камчатка) - уникальная природная лаборатория современного нафтидогенеза // Геология и геофизика. 2011. Т. 52, № 8. С. 986-990.
- Лямина Л.А., Харитонова Н.А., Расторгуев А.В., Челноков Г.А., Брагин И.В. Концептуальная модель формирования азотных термальных вод в кристаллических массивах пород (на примере месторождения Кульдур) // Вестник МГУ. Серия 4. Геология. 2022. № 2. С. 78-90.
- Плюснин А.М., Украинцев А.В., Чернявский М.К. Органическое вещество в углекислых минеральных водах Витимского плоскогорья и Восточного Саяна // Геологическая эволюция взаимодействия воды с горными породами: материалы III Всерос. конф. / под ред. Л.В. Заманы, С.Л. Шварцева. Улан-Удэ: БНЦ СО РАН, 2018. С. 68-71. DOI: 10.31554/978-57925-0536-0-2018-68-71.
- Потурай В.А. Органическое вещество в гидротермальных системах разных типов и обстановки // Известия ТПУ. Инжиниринг георесурсов. 2018. Т. 329, № 11. С. 6-16. DOI: 10.18799/24131830/2018/11/204.
- Потурай В.А. Органическое вещество в подземных и поверхностных водах района Анненского геотермального месторождения (Дальний Восток) // Геохимия. 2017. № 4. С. 372-380. DOI: 10.7868/S0016752517020054.
- Потурай В.А. Органическое вещество в подземных и поверхностных водах района Куль-дурского месторождения термальных вод, Дальний Восток России // Вестник КРАУНЦ. Науки о Земле. 2013. № 1 (21). С. 169-182.
- Потурай В.А. Органическое вещество и молекулярно-массовое распределение углеводородов в Анненских термальных водах (Дальний Восток, Россия) // Геология и Геофизика. 2022. Т. 63, № 10. С. 1352-1368. DOI: 10.15372/ GiG2021150.
- Потурай В.А. Состав и распределение н-ал-канов в азотных термах Дальнего Востока России // Тихоокеанская геология. 2017. Т. 36, № 4. С. 109-119.
- Потурай В.А. Сравнение химического состава термальных, сточных и грунтовых вод Куль-дурского района // Региональные проблемы. 2010. Т. 13, № 2. С. 92-96.
- Потурай В.А., Строчинская С.С., Компаниченко В.Н. Комплексная биогеохимическая характеристика термальных вод Тумнинского месторождения // Региональные проблемы. 2018. Т. 21, № 1. С. 22-30.
- Разницин Ю.Н., Савельева Г.Н., Федонкин М.А. Углеводородный потенциал палео-и современных надсубдукционных областей: тектонический, геодинамический, минералого-геохимический и биохимический аспекты // Тихоокеанская геология. 2018. Т. 37, № 2. С. 3-16. DOI: 10.30911/0207-4028-2018-37-23-16.
- Украинцев А.В., Плюснин А.М. Применение метода твердофазной экстракции для анализа состава растворенных органических веществ в углекислых минеральных водах // Байкальская молодежная научная конференция по геологии и геофизике: материалы V Всерос. мо-лодеж. науч. конф. Улан-Удэ, 2019. С. 90-92.
- Шульга Н.А., Пересыпкин В.И. О генезисе углеводородов в гидротермальных отложениях полей Лост Сити и Рэйнбоу (Срединно-Ат-лантический хребет) // Доклады Академии наук. 2012. Т. 445, № 2. С. 196-199.
- Andrade-Eiroa A., Canle M., Leroy-Cancel-lieri V., Cerda V. Solid phase extraction of organic compounds: a critical review. Part I // Trends in Analytical Chemistry. 2016. Vol. 80. P. 641. DOI: 10.1016/j.trac.2015.08.015.
- Andrade-Eiroa A., Canle M., Leroy-Cancellieri V., Cerda V. Solid phase extraction of organic compounds: a critical review. Part II // Trends in Analytical Chemistry. 2016. Vol. 80. P. 655. DOI: 10.1016/j.trac.2015.08.014.
- Aubrey A., Cleaves H., Bada J. The role of submarine hydrothermal systems in the synthesis of amino acids // Origin of Life and Evolution of Biospheres. 2009. Vol. 39. P. 91-108. DOI: 10.1007/s11084-008-9153-2.
- Badawy M.E.I., El-Nouby M.A.M., Kimani P.K., Lim L.W., Rabea E.I. A review of the modern principles and applications of solid-phase extractiontechniques in chromatographic analysis// Analytical Sciences. 2022. Vol. 38. P. 1457-1487. DOI: 10.1007/s44211-022-00190-8.
- Berrueta L.A., Gallo B., Vicente F. A Review of Solid Phase Extraction: Basic Principles and New Developments // Chromatographia. 1995. Vol. 40, N 7/8. P. 474-483.
- Boschetti T., Etiope G., Toscani L. Abiotic methane in the hyperalkaline springs of Genova, Italy // Procedia Earth and Planetary Science. 2013. Vol. 7. P. 248-251. DOI: 10.1016/j. proeps.2013.02.004.
- Faraji M., Yamini Y., Gholami M. Recent Advances and Trends in Applications of Solid-Phase Extraction Techniques in Food and Environmental Analysis // Chromatographia. 2019. Vol. 82. P. 1207-1249. DOI: 10.1007/s10337-019-03726-9.
- Fedotov P.S., Malofeeva G.I., Savonina E.Yu., Spivakov B.Ya. Solid-Phase Extraction of Organic Substances: Unconventional Methods and Approaches // Journal of Analytical Chemistry. 2019. Vol. 74, N 3. P. 205-212. DOI: 10.1134/ S1061934819030043.
- Fiebig J., Woodland A.B., Spangenberg J., Oschmann W. Natural evidence for rapid abiogenic hydrothermal generation of CH4 // Geochimica et Cosmochimica Acta. 2007. Vol. 71. P. 30283039. DOI: 10.1016/j.gca.2007.04.010.
- Fu Q., Socki R.A., Niles P.B. Evaluating reaction pathways of hydrothermal abiotic organic synthesis at elevated temperatures and pressures using carbon isotopes // Geochimica et Cosmochimica Acta. 2015. Vol. 154. P. 1-17. DOI: 10.1016/j. gca.2015.01.027.
- Garcia-Sanchez B.E., Vara-Castro G.M., Kretzschmar Th., Sanchez-Avila J.I. Organic compounds in surface and groundwaters in the surrounding of a Mexican geothermal reservoir; case study Los Humeros, Puebla // Applied Geochemistry. 2022. Vol. 147. 105442. DOI: 10.1016/j.apgeochem.2022.105442.
- Gonsior M., Hertkorn N., Hinman N., Dvorski S.E.-M., Harir M., Cooper W.J., Schmitt-Kop-plin P. Yellowstone Hot Springs are Organic Chemodiversity Hot Spots // Scientific Reports. 2018. Vol. 8. 14155. DOI: 10.1038/s41598-018-32593-x.
- Gonzalez-Barreiro C., Cancho-Grande B., Arau-jo-NespereiraP., Cid-Fernandez J.A., Simal-Gandara J. Occurrence of soluble organic compounds in thermal watersby ion trap mass detection // Chemosphere. 2009. N 75. P. 34-47. DOI: 10.1016/j.chemosphere.2008.11.067.
- Konn C., Charlou J.L., Holm N.G., Mousis O. The production of methane, hydrogen, and organic compounds in ultramafic-hosted hydrothermal vents of the Mid-Atlantic Ridge // Astrobiology. 2015. Vol. 15, N 5. P. 381-399. DOI: 10.1089/ ast.2014.1198.
- Leins A., Bregnard D., Vieth-Hillebrand A., Junier P., Regenspurg S. Dissolved organic compounds in geothermal fluids used for energy production: a review // Geothermal Energy. 2022. Vol. 10. 9. DOI: 10.1186/s40517-022-00220-8.
- Nye J.J., Shock E.L., Hartnett HE. A novel PARA-FAC model for continental hot springs reveals unique dissolved organic carbon compositions // Organic Geochemistry. 2020. Vol. 141. 103964. DOI: 10.1016/j.orggeochem.2019.103964.
- Ong C., Fowler A.P.G., Seyfried Jr. W.E., Sun T., Fu Q. Organic compounds in vent fluids from Yellowstone Lake, Wyoming // Organic Geochemistry. 2021. Vol. 159. 104275. DOI: 10.1016/j. orggeochem.2021. 104275.
- Pourshamsi T., Amri F., Abniki M. A comprehensive review on application of the syringe in liquidand solid-phase microextraction methods // Journal of the Iranian Chemical Society. 2021. Vol. 18. P. 245-264. DOI: 10.1007/s13738-020-02025-7.
- Sanchez-Avila J.I., Garcia-Sanchez B.E., Vara-Castro G.M., Kretzschmar T. Distribution and origin of organic compounds in the condensates from a Mexican high-temperature geothermal field // Geothermics. 2021. Vol. 89. 101980. DOI: 10.1016/j.geothermics.2020.101980.
- Soniassy R. Water analysis: Organic micropollut-ants / R. Soniassy, P. Sandra, C. Schlett. Germany: Hewlett-Packard Company, 1994. 278 p.
- Sunguti A.E., Kibet J.K., Kinyanjui T.K. A review of the status of organic pollutants in geothermal waters // Journal of Nature, Science & Technology. 2021. Vol. 4. P. 19-28. DOI: 10.36937/ janset.2021.004.005.
- Szabo I., Varga C. Finding possible pharmacological effects of identified organic compounds in medicinal waters (BTEX and phenolic compounds) // International Journal of Biometeorol-ogy. 2019. Vol. 64. P. 989-995. DOI: 10.1007/ s00484-019-01808-9.
- Ukraintsev A.V., Plyusnin A.M., Chernyavskii M.K. Ferruginous mineral waters of Western Transbaikalia: formation of gas, trace elements, and dissolved organic matter composition // Geochemistry International. 2024. Vol. 62, N 6. P. 659-673. DOI: 10.1134/S0016702924700307.
- Umoh U.U., Li L., He J., Chen L., Dong L., Jia G., Lahajnar N., Massoth G., Schwarz-Schampera U. Unusual aliphatic hydrocarbon profiles at hydrothermal vent fields of the Central and Southeast Indian Ridges and Mid-Indian Basin // Deep-Sea Research Part II. 2021. Vol. 194. 104996. DOI: 10.1016/j.dsr2.2021.104996.


