Применение методов биотехнологии в безвирусном семеноводстве картофеля
Автор: Ким Ирина Вячеславовна, Шищенко Елена Васильевна, Фисенко Петр Викторович, Чибизова Алена Сергеевна, Клыков Алексей Григорьевич
Журнал: Овощи России @vegetables
Рубрика: Селекция, семеноводство и биотехнология растений
Статья в выпуске: 5 (67), 2022 года.
Бесплатный доступ
Актуальность. Растения сортов картофеля являются носителями вирусных патогенов в латентной форме, которые передаются клоновому потомству. Освобождение семенного картофеля от вирусной инфекции и сохранение высокопродуктивных качеств сортов обеспечивается системой безвирусного семеноводства картофеля. Цель исследований - разработать схему оздоровления картофеля с использованием методов биотехнологии и применить ее в без-вирусном семеноводстве в условиях Приморского края. Материал и методика. В качестве объекта исследования был взят перспективный сорт картофеля Моряк (селекционный номер При-08-11-1), созданный в ФГБНУ «ФНЦ агробиотехнологий Дальнего Востока им. А.К. Чайки». Средняя урожайность нового генотипа - 34,1 т/га, потенциальная - 40,1 т/га. Содержание сухого вещества - 18,13...23,85 %, крахмала - 12,10...17,24%, витамина С -17,46...23,12 мг/100 г. Обладает устойчивостью к переувлажнению почвы, характеризуется высокой лежкоспособностью (92,2.94,4%). В процессе оздоровления применяли метод культуры ткани in vitro с химиотерапией, используя противовирусные препараты рибавирин (концентрация 0,02.0,03 %) и хитозан (0,01.0,1%). Проростки исходных клубней и микрорастения тестировали методами ИФА и ПЦР анализа RQ/Ct на скрытую зараженность такими хозяйственно значимыми вирусами, как PVX, PVY, PVA, PVS, PVM, PLRV. Результаты. Последовательное увеличение концентрации противовирусных препаратов рибавирина (с 0,02 до 0,03%) и хитозана (с 0,01 до 0,1%) и их чередование в разных пассажах - эффективный прием в оздоровлении микрорастений. В результате исследований разработана и применена схема по освобождению картофеля от хозяйственно значимых вирусов и получен оздоровленный материал.
Картофель, сорт, оздоровление, пцр, культура ткани, in vitro
Короткий адрес: https://sciup.org/140295698
IDR: 140295698 | УДК: 635.21:573.6:631.53 | DOI: 10.18619/2072-9146-2022-5-29-34
Текст научной статьи Применение методов биотехнологии в безвирусном семеноводстве картофеля
Оригинальные статьи / Originalarticles
К ачество семенного материала картофеля является одним из главных факторов, определяющих его урожайность. Распространенность инфекционных болезней вирусной природы в агроценозах приобретает все более широкий масштаб. Освобождение семенного картофеля от вирусной и бактериальной инфекций, а также от других болезней, сохранение высокопродуктивных качеств сортов обеспечивается системой безвирусного семеноводства картофеля. Основная её задача – это оздоровление и ускоренное размножение безвирусного материала с последующим включением в процесс репродуцирования [1].
Для обеспечения стабильного объема потребления картофеля в стране, в рамках реализации утвержденной Правительством Подпрограммы «Развитие селекции и семеноводства картофеля в Российской Федерации» предусматривается повышение урожайности картофеля за счет создания и быстрого продвижения новых высоко- продуктивных сортов в производство на основе современных эффективных технологий выращивания качественного семенного материала [2, 3].
На Дальнем Востоке пораженность картофеля вирусами отмечается в большинстве областей и краев региона, этому способствуют специфические погодные условия, изобилие различных насекомых – переносчиков [4]. Вирусные болезни обусловливают снижение урожайности, ухудшается качество клубней. На юге Приморского края более 40 лет ведется мониторинг основных фитопа-тогенных вирусов и вирусоподобных организмов на картофеле. Многолетняя оценка фитосанитарного состояния показала, что на рядовых посевах картофеля во многих хозяйствах распространен комплекс вирусов, вироидов и фитоплазм, который влияет на качество, товарный вид и урожайность этой культуры. Последние десятилетние наблюдения показали, что наибольшее распространение имеет S-вирус картофеля (SВК). Достаточно велик уровень зараженности Y-вирусом картофеля (YВК), причем наблюдается значительное разнообразие штаммов. Процент зараженности вирусными заболеваниями в рядовых посевах картофеля колеблется в разные годы. Некоторые сорта могут служить резервуаром комплекса вирусных инфекций для окружающих посадок картофеля. Степень зараженности зависит от посадочного материала и может варьировать от 10-30% [5, 6]. Проблема усугубляется тем, что в настоящее время более 80% картофеля производится в личных подсобных хозяйствах, что усложняет возможность применения агротехнических приемов с элементами защиты растений от болезней и вредителей. В связи с этим крайне важно для Дальневосточного региона усовершенствовать процесс производства оригинальных семян на безвирусной основе и вести семеноводство с элементами оздоровления исходного материала.
Получение качественного исходного материала картофеля включает процесс освобождения сортов картофеля от вирусной инфекции с применением методов биотехнологии [7-9]. Зарубежные и отечественные коллеги рекомендуют использовать при оздоровлении картофеля биохимический метод с применением рибавирина [10-12].
В настоящее время в качестве способов оздоровления растений от вирусов используют различные методы терапии: культуры апикальных меристем, термотерапию, химиотерапию, криотерапию, электротерапию, а также комплексную (комбинированную) терапию, включающую комбинацию приемов различных методов. При проведении исследований, основанных на методах культуры апикальных меристем и криотерапии выявлена их эффективность в отношении вирусов PVY, PVA, PVM, однако в случае множественной инфекции необходимо комбинировать элементы различных протоколов оздоровления для повышения эффективности процедуры оздоровления [13].
Термотерапия in vivo и in vitro растений основана на снижении титра вирусов в зараженных тканях вследствие нарушения синтеза вирусных РНК при повышенных температурах - 36...40 С [14]. Способ менее эффективен в отношении сферических вирусов, поэтому при смешанных инфекциях его рекомендуют сочетать с другими технологиями [15].
Метод апикальных меристем в сочетании с химиотерапией позволяет оздоровить от вирусной инфекции растения регенеранты в культуре in vitro , полученные при оздоровлении методом апикальной меристемы в сочетании с термотерапией и имеющих положительную реакцию на вирусы по результатам ИФА, а также меристем, взятых с клубня растения, пораженного вирусами в латентной форме [16,17].
Метод электротерапии основан на пропускании электрического тока через растительные ткани, в результате чего происходит деградация вирусного нуклеопротеина и патоген утрачивает вирулентность [18, 19].
В Дальневосточном регионе в 2021 г. организован селекционно-семеноводческий центр по картофелю на базе ФГБНУ «ФНЦ агробиотехнологий Дальнего Востока им. А.К. Чайки» в целях создания новых конкурентоспособных сортов, оздоровления их и включения в семеноводческий процесс.
В связи с этим исследования по этим направлениям имеют актуальность и первостепенное значение в развитии картофелеводства Дальнего Востока.
Цель исследований – разработать схему оздоровления картофеля с использованием методов биотехнологии и внедрить безвирусный материал в схему семеноводства.
Материал и методы
В качестве объекта исследования был взят перспективный сорт картофеля Моряк (селекционный номер При-08-11-1), полученный в ФГБНУ «ФНЦ агробиотехнологий Дальнего Востока им. А.К. Чайки». Сорт среднеспелый с физиологической спелостью (от посадки до уборки) 98107 дней, столового назначения. Средняя урожайность – 34,1 т/га, потенциальная – 40,1 т/га. Содержание сухого вещества – 18,13-23,85%, крахмала – 12,10-17,24%, витамина С – 17,46-23,12 мг/100 г. Обладает устойчивостью к переувлажнению почвы, характеризуется высокой лежко-способностью (92,2-94,4%).
Испытание клубневых репродукций сеянцев и сортоиспытание гибридов проводили в полевых условиях в селекционно-семеноводческом севообороте в с. Пуциловка Уссурийского района Приморского края. Картофель выращивали в соответствии с принятой для Приморского края технологией [20].
В эксперименте исходный материал клубней отбирался в полевых условиях из внешне здоровых кустов. Требования, предъявляемые к материалу, намеченному к отбору: растение – типичное по морфологическому строению для данного сорта, абсолютно здоровое по внешнему виду, нормально развитое, с характерным для сорта количеством стеблей. Клубни – типичные по морфологическим признакам для данного сорта без признаков веретеновид-ности, здоровые, по визуальной оценке [7, 21].
Оздоровление сортообразцов картофеля и выявление скрытых вирусных инфекций. В процессе оздоровления сорта Моряк совмещали метод культуры ткани in vitro с химиотерапией, используя противовирусные препараты рибавирин (концентрация 0,02-0,03%) и хитозан (0,01-0,1%). Проростки исходных клубней и микрорастения тестировали методами ИФА [22, 23] и ПЦР анализа RQ/Ct (метод определения относительного количества в реальном времени) на скрытую зараженность хозяйственно значимыми вирусами: PVX, PVY, PVA, PVS, PVM, PLRV [24, 25].
В культуру in vitro изолировали верхушечные (апексы) и пазушные почки, взятые от клубней с наименьшей вирусной нагрузкой. Пробирки с эксплантами культивировали в климатической камере MLR-352H (Sanyo) при температуре – 23±1°C, освещенности – 4000 лк, световом дне – 16 час, влажности воздуха – 60-70%. Питательную среду для культивирования растений картофеля готовили по прописи Мурасиге-Скуга (МС) с модификацией содержания компонентов [25], стерилизацию осуществляли при 0,9 атм в течение 20 минут в стерилизаторе паровом ГК-100-3. Инструменты (пинцеты и скальпели) стерилизовали сухим жаром в сухожаровом шкафу FD 240 (Binder) в течение 2 ч при температуре 200°С. Микроклонирование (микрочеренкование) пробирочных растений картофеля проводили в стерильных условиях ламинар-бокса (БАВнп-01-«Ламинар-С»)-1,5.
Результаты исследования
Современная система безвирусного семеноводства картофеля должна основываться на оздоровлении перспективных сортов. Передача в Государственное сортоиспытание оздоровленного от вирусов нового сорта ускоряет процесс сортосмены. При процедуре оздоровления растений картофеля широко распространено использование методов биотехнологии с химиотерапией, основанное на добавлении в питательную среду веществ ингибиторов вирусов: рибавирина (виразола) [26] и хитозана [27]. Для усиления эффекта получило распространение включение в схему при оздоровлении сочетания нескольких ингибиторов вирусов, например, – виразол + интерферон + хитозан, интерферон + хитозан [1], ацетилсалициловая кислота + рибавирин [28].
Для выявления вирусов используют следующие методы тестирования: иммуноферментный анализ (ИФА), имму-нохроматографический анализ (ИХА), ПЦР с обратной транскрипцией (ОТ-ПЦР) и ПЦР в реальном времени (RT-ПЦР) [29].
Для оздоровления картофеля перспективного сорта Моряк была применена схема, состоящая из 9 этапов c сопровождением иммуноферментного анализа (ИФА) и ПЦР в реальном времени (RT-ПЦР/ RQ/Ct) (рис.).
На первом этапе с целью введения в безвирусное семеноводство сорта картофеля Моряк перед началом процесса оздоровления, по визуальной оценке, отбирали клубни здоровых растений, в количестве 16 шт. Исходные линии (клубни in vivo с этиолированными 2Т, 3Т, 4Т, 5Т и световыми ростками 1С, 2С, 4С, 5С, 8С) тестировали методом ИФА. В работе Е.С. Беспаловой, М.М. Агаханова, С.Б. Архимандритовой и др. (2020) при оздоровлении сортов картофеля из коллекции ВИР от вирусов были получены результаты тестирования полевых образцов, где установлено, что наиболее встречаемыми вирусами являются: PVX (100%), PVS (100%) и PVA (88,8%). Иммунохимические исследования на сортовых посадках картофеля, проведенные на юге Дальнего Востока показали, что зараженность SВК составила от 33 до 75%; МВК – от 3 до 41%; УВК – от 34 до 50%. Скручивание листьев (ВСЛК) встречалось значительно реже (10-12%). Что свидетельствует о высоком инфекционном фоне в посадках картофеля в Приморском крае [6]. Проведенный нами ИФА-анализ показал наличие вирусной инфекции (PVY, PVS, PVM и PLRV) в различной степени. В результате анализа отобраны образцы с наименьшим количеством вирусов PVY (13,2 %), PVS (12,2 %), PVM (15,6 %) и PLRV (16,2%) для тестирования их методом ПЦР на последующих этапах оздоровления.
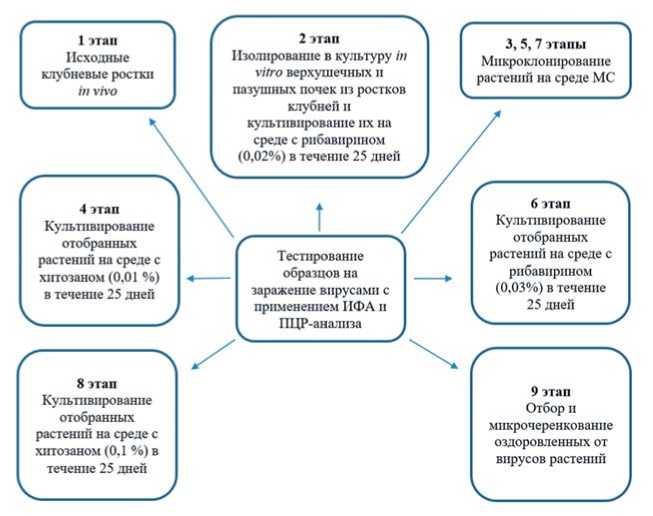
Рис. Схема оздоровления сорта картофеля Моряк с применением ИФА и ПЦР-анализа
Fig,Scheme ofimprovementofthe Marinerpotatovarietywith the use ofELISA and PCR analysis
Таблица 1. Результаты тестирования линий картофеля (in vivo и in vitro) после применения рибавирина (0,02%) ПЦР-анализом (RQ/Ct)
Table 1. Results of testing potato lines (in vivo and in vitro) after ribavirin administration (0.02%) by PCR analysis (RQ/Ct)
|
Линия |
PVX |
PVY |
PVA |
PVS |
PVM |
PLRV |
||||||
|
in vivo |
in vitro |
in vivo |
in vitro |
in vivo |
in vitro |
in vivo |
in vitro |
in vivo |
in vitro |
in vivo |
in vitro |
|
|
1С |
- |
- |
+ |
+ |
- |
- |
+ |
+ |
+ |
- |
+ |
- |
|
2С |
- |
- |
+ |
+ |
- |
- |
+ |
+ |
+ |
- |
+ |
- |
|
4С |
- |
- |
+ |
+ |
- |
- |
+ |
+ |
+ |
- |
+ |
- |
|
5С |
- |
- |
+ |
+ |
- |
- |
+ |
+ |
- |
- |
- |
- |
|
8С |
- |
- |
+ |
+ |
- |
- |
+ |
+ |
+ |
- |
+ |
+ |
|
2Т |
- |
- |
+ |
+ |
- |
- |
+ |
+ |
- |
- |
- |
- |
|
3Т |
- |
- |
+ |
+ |
- |
- |
+ |
+ |
+ |
- |
- |
- |
|
4Т |
- |
- |
+ |
+ |
- |
- |
+ |
+ |
+ |
- |
- |
- |
|
5Т |
- |
- |
+ |
+ |
- |
- |
+ |
+ |
+ |
- |
+ |
+ |
Примечание. - вирус не обнаружен; + вирус обнаружен С – клубни со световыми ростками
Т – клубни с этиолированными ростками
При проведении ПЦР-анализа выявили наличие в проростках исходных клубней вирусную инфекцию. Большинство из них были поражены вирусными комплексами PVY, PVS, PVM и PLRV.
На втором этапе работы использовали рибавирин (0,02%) на исходных образцах (in vivo) и микрорастениях ( in vitro ). Через 25 дней культивирования верхушечных изолятов проростков картофеля на питательной среде с рибавирином (0,02%) произвели микрочеренкование растений и перевели на стандартную среду МС без рибавирина. Эффективность применения рибавирина (0,02 %) после проведения повторного ПЦР-анализа подтверждена только против PVМ и PLRV, кроме линий 8С и 5Т. Не удалось получить побеги, полностью свободные от PVY и PVS
(табл. 1). На третьем этапе для размножения и поддержания растений произведено их микрочеренкование на стандартную среду МС без рибавирина.
На четвертом этапе процесса оздоровления использовали ингибитор вируса – хитозан (0,01 %) при выращивании микрорастений in vitro. В табл. 2 представлены результаты ПЦР-анализа и дана оценка вирусной нагрузки исследуемых линий.
ПЦР-анализ позволил выявить линии картофеля с относительно низкой вирусной нагрузкой. Наиболее зараженными оказались микрорастения 1.1 и 1.2, что составляло 33,3 % от линии 1С. С точки зрения вирусной нагрузки микрорастения линий 8С, 2Т, 3Т, 4Т, 5Т показали лучшие результаты – среднее значение RQ составило 0,076.
Таблица 2. Результаты тестирования микрорастений in vitro картофеля после применения хитозана (0,01%) ПЦР-анализом(RQ/Ct) Table 2. Results of in vitro testing of potato micro-plants after chitosan application (0.01%) by PCR analysis (RQ/Ct)
|
Линия |
микрорастения |
PVY |
PVS |
PVM |
PLRV |
||||
|
RQ |
Ct |
RQ |
Ct |
RQ |
Ct |
RQ |
Ct |
||
|
1С |
1.1 |
153,785 |
20,4599 |
0,021 |
32,8576 |
0,006 |
32,6354 |
0,029 |
32,7301 |
|
1.2 |
115,724 |
21,0639 |
0,014 |
33,5188 |
0,004 |
33,4761 |
0,025 |
33,2910 |
|
|
2С |
1.3 |
0,135 |
33,5039 |
0,006 |
35,4422 |
0 |
0 |
0,006 |
36,1334 |
|
1.4 |
0,319 |
31,8532 |
0,008 |
34,8405 |
0 |
0 |
0,026 |
33,5846 |
|
|
4С |
1.5 |
0,079 |
34,6356 |
0,009 |
34,8043 |
0 |
0 |
0,005 |
35,8905 |
|
5С |
1.6 |
0,117 |
33,6880 |
0 |
0 |
0,002 |
35,2812 |
0,008 |
35,5015 |
|
8С |
1.7 |
0,121 |
33,4658 |
0,018 |
33,1980 |
0,001 |
35,8849 |
0,023 |
33,6356 |
|
1.8 |
0,048 |
35,4256 |
0,004 |
35,8959 |
0 |
0 |
0,004 |
36,9644 |
|
|
2Т |
1.9 |
0,103 |
33,9941 |
0,014 |
33,8100 |
0,003 |
34,2647 |
0,017 |
34,1413 |
|
1.10 |
0,085 |
34,3482 |
0,008 |
34,7594 |
0 |
0 |
0 |
0 |
|
|
3Т |
1.11 |
0,095 |
33,9827 |
0,030 |
32,0294 |
0 |
0 |
0,008 |
35,4287 |
|
1.12 |
0,038 |
35,4120 |
0,035 |
31,8750 |
0,003 |
34,3529 |
0,014 |
34,4691 |
|
|
4Т |
1.13 |
0,087 |
34,2283 |
0,004 |
35,8505 |
0 |
0 |
0,013 |
34,5588 |
|
1.14 |
0,075 |
34,2844 |
0,019 |
32,8186 |
0,002 |
35,3392 |
0,015 |
34,3770 |
|
|
5Т |
1.15 |
0,094 |
34,0481 |
0,013 |
33,3438 |
0 |
0 |
0,014 |
34,5673 |
|
1.16 |
0,182 |
32,6048 |
0,008 |
34,6432 |
0 |
0 |
0,017 |
34,1860 |
|
Таблица 3. Результаты тестирования микрорастений in vitro картофеля после применения рибавирина (0,03 %) и хитозана (0,1%) Table 3. Results of in vitro testing of potato micro-plants after the use of ribavirin (0.03%) and chitosan (0.1%)
|
Линия |
Микрорастения |
PVХ |
PVY |
PVМ |
PLRV |
PVS |
PVA |
|
рибавирин (0,03 %) |
|||||||
|
2Т |
1.8 |
- |
+ |
+/- |
- |
+ |
- |
|
1.10 |
- |
- |
+ |
- |
+ |
- |
|
|
3Т |
1.12 |
- |
+ |
- |
+ |
+/- |
- |
|
хитозан (0,1 %) |
|||||||
|
2Т |
1.8 |
- |
- |
- |
- |
- |
- |
|
3Т |
1.12 |
- |
- |
- |
- |
- |
- |
Примечание: - вирус не обнаружен; + вирус обнаружен; +/- недостоверный результат (неправильная форма кривой/начало детекции сигнала на последних циклах амплификации)
Микрорастения 1.8, 1.10 и 1.12 показали самый низкий уровень выявленных инфекций и были отобраны для дальнейшего оздоровления. Вирусы PVМ и PLRV в низких концентрациях вновь были обнаружены почти во всех линиях
Ранее проведенные исследования показали, что последовательное культивирование побегов картофеля сорта Моряк на средах с рибавирином в концентрации 0,02 % и хитозаном 0,01 % не позволило полностью устранить вирусные инфекции [24]. Поэтому, на шестом и восьмом этапах, процедуру оздоровления продолжили с применением противовирусных препаратов с увеличенной концентрацией – рибавирин (0,03 %) и хитозан (0,1 %). В результате для дальнейшего эксперимента были отобраны линии 2Т (микрорастения 1.8, 1.10) и 3Т (1.12), у которых отмечено самое низкое содержание исследуемых вирусов (табл. 3)..
Исследования по введению в питательную среду рибавирина в концентрации 0,03% не обеспечило полного освобождения материала от вирусов. Поэтому на 8-м этапе микрорастения 1.8 и 1.12 пассировали на среду с хитозаном в концентрации 0,1% в течение 25 дней. Результаты ПЦР-анализа исследуемых образцов сорта картофеля Моряк показали, что последовательное применение ингибиторов вирусов рибавирина (0,03%) на 6-м этапе и хитозана (0,1%) на 8-м этапе позволило полностью освободить микрорастения картофеля от вирусов и завершить оздоровление сорта Моряк.
В результате исследований разработана схема по освобождению картофеля от хозяйственно значимых вирусов, состоящая из 9-ти этапов. Установлено, что последовательное увеличение концентрации противовирусных препаратов рибавирина (с 0,02 до 0,03%) и хитозана (с 0,01 до 0,1%) является эффективным приемом в оздоровлении микрорастений.
Выводы
Таким образом, применение методов биотехнологии (метод культуры тканей в комплексе с химиотерапией) и тестирование наличия вирусной нагрузки (ИФА и ПЦР анализами) на всех этапах работы позволяет эффективно проводить оздоровление перспективных сортов картофеля. Внедрена схема оздоровления картофеля в процесс производства безвирусных семян ФГБНУ «ФНЦ агробиотехнологий Дальнего Востока им. А.К. Чайки».
Об авторах:
Irina V. Kim – Cand. Sci. (Agriculture), Leading Researcher, ,
Elena V. Shischenko – Junior Researcher at the
Laboratory of Agricultural Biotechnology,
Petr V. Fisenko – Cand. Sci. (Biology),
Leading Researcher, Acting Head of the Laboratory of Breeding and Genetic Research of Field Crops,
Alena S. Chibizova – Junior Researcher at the
Laboratory of Agricultural Biotechnology,
Alexey G. Klykov – Head of the Department of Breeding and
Biotechnology of Agricultural Crops, Doctor Sci. (Biology), Academician of the Russian Academy of Sciences,
Результаты отбора базовых клонов картофеля в условиях европейского севера и высокогорья Северного Кавказа. Земледелие. 2020;(4):29-32.
-
• References (In Russ.)
Список литературы Применение методов биотехнологии в безвирусном семеноводстве картофеля
- Рябцева Т.В., Куликова В.И., Илькевич О.Г. Оздоровление картофеля методом химиотерапии в культуре in vitro. Международный научноисследовательский журнал. 2015;10(41)3:66-68. https://doi.org/10.18454/IRJ.2015.41.127
- Симаков Е.А., Анисимов Б.В., Жевора С.В., Митюшкин А.В., Журавлев А.А., Митюшкин А.В., Гайзатулин А.С. Актуальные направления развития селекции и семеноводства картофеля в России. Картофель и овощи. 2020;(12):22-26. https://doi.org/10.25630/PAV.2020.49.70.005
- Ким И.В., Клыков А.Г. Результаты и направления исследований по картофелеводству на Дальнем Востоке России. Достижения науки и техники АПК. 2017;(10):36-39.
- Гнутова Р.В. Разнообразие вирусов растений в Восточно-азиатском регионе России: итоги 50-летнего изучения. Сельскохозяйственная биология. 2014;(5):16-27. https://doi.org/10.15389/agrobiology.2014.5.16rus
- Volkov Y.G., Kakareka N.N., Kozlovskaya Z.N., Balabanova L.A., Sapotskij M.V. Characterization of a Novel Far Eastern Potato Virus Y. Isolates. Plant Pathology Journal. 2009;8(2):62-67.
- Плешакова Т.И. Мониторинг вирусных инфекций картофеля на юге Приморского края / Материалы II Международной научной конференции «Современные исследования в естественных науках», Владивосток, 26-28 августа 2015 г. [Электронный ресурс] / под общ. ред. В.А. Семаль ; Электрон. дан. Владивосток: Изд-во Дальневост. ун-та, 2015. С.186-189. ISBN 978-5-906739-79-7
- Овэс Е.В., Гаитова Н.А. Новые элементы технологии оздоровления и получения базовых клонов перспективных сортов и гибридов картофеля. Достижения науки и техники АПК. 2016;30(11):60-62.
- Жевора С.В., Анисимов Б.В., Симаков Е.А., Овэс Е.В., Зебрин С.Н. Картофель: проблемы и перспективы. Картофель и овощи. 2019;(7):2-7.
- Овэс Е.В., Гаитова Н.А., Шишкина О.А., Фенина Н.А. Результаты отбора базовых клонов картофеля в условиях европейского севера и высокогорья Северного Кавказа. Земледелие. 2020;(4):29-32.
- Yang L., Nie B., Liu J., Song B. A Reexamination of the effectiveness of ribavirin on eradication of viruses in potato plantlets in vitro using ELISA and quantitative RTPCR. Am. J. Potato Res. 8 p. (published online 15 November 2013).
- Gong H., Igiraneza C., Dusengemungu L. Major In Vitro Techniques for Potato Virus Elimination and Post Eradication Detection Methods. A Review. Am. J. Potato Res. 2019;(96):379-389. https://doi.org/10.1007/s12230-019-09720-
- Яловик А.В., Федорова Ю.Н., Яловик Л.И. Эффективность действия химиотерапии на растениях картофеля в условиях in vitro. Вестник Алтайского государственного аграрного университета. 2019;10(180):28-33. EDN SWVPLP.
- Беспалова Е.С., Агаханов М.М., Архимандритова С.Б., Ерастенкова М.В., Ухатова Ю.В. Оздоровление сортов картофеля из коллекции ВИР от вирусов. Труды по прикладной ботанике, генетике и селекции. 2020;181(4):164-172. https://doi.org/10.30901/2227-8834-2020-4-164-172
- Cassells A.C., Long R.D. The elimination of potato viruses X, Y, S and M in meristem and explant cultures of potato in the presence of Virazole. Potato Res. 1982;(25):165-173.
- Власов Ю.И., Ларина Э.И., Трускинов Э.В. Сельскохозяйственная фитовирусология СПб.- Пушкин: ВИЗР, 2016. 236 с.
- Лапшинов Н.А., Куликова В.И., Рябцева Т.В. и др. Технология оздоровления и ускоренного размножения картофеля (методическое пособие). ФГБНУ «Кемеровский НИИСХ». Кемерово, 2014. 44 с.
- Овэс Е.В., Гаитова Н.А. Новые элементы технологии оздоровления и получения базовых клонов перспективных сортов и гибридов картофеля. Достижения науки и техники АПК. 2016;30(11):60-62.
- Mahmoud S.Y.M., Hosseny M.H., Abdel-Ghaffar M.H. Evaluation of some therapies to eliminate Potato Y potivirus from potato plants. Int. J. Virol. 2009;5(2):64-76. https://doi.org/10.3923/ijv.2009.64.76
- Bădărău C.L., Chiru N. Effect of some therapies on potato plantlets infected with potato virus X (PVX). Journal of EcoAgriTourism. 2014;10(1/28):11-17.
- Система ведения агропромышленного производства Приморского края. РАСХН, ДВ НМЦ, ПримНИИСХ. Новосибирск. 2001. 364 с.
- ГОСТ 33996-2016 Картофель семенной. Технические условия и методы определения качества. Введ. 2018.01-01. М.: Стандартинформ. 2017. 41 с.
- Диагностика вирусов и бактериозов в процессе оздоровления и размножения семенного картофеля в оригинальном семеноводстве: метод. рекомендации. сост. В.И. Куликова и др. ; Кемеровский НИИСХ. Кемерово, 2008. 36 с.
- Bekesiova I., Nap J.-P., Mlynarova L. Isolation of high quality DNA and RNA from leaves of the carnivorous plant Drosera rotundifolia. Plant Mol. Biol. Rep. 1999;(17):269-277.
- Барсукова Е.Н., Чекушкина Т.Н., Ким И.В. Оздоровление и микроразмножение in vitro сортов картофеля для безвирусного семеноводства. Дальневост. аграр. вестн. 2018;4(48):20-26.
- Юрьева Н.О., Воронкова Е.В., Терешонок Д.В. и др. Введение в асептическую культуру дигаплоидов картофеля с использованием адвентивных побегов и химиотерапии. Защита картофеля. 2017;(2):23-27.
- Рябцева Т.В., Куликова В.И., Ходаева В.П. Оценка питательных сред при размножении сортов картофеля в культуре in vitro. Международный научно-исследовательский журнал. 2018;12(66)3:134-137. https://doi.org/10.23670/IRJ.2017.66.099
- Dhital S.P., Sakha B.M., Lim H.T. Utilization of shoot cuttings for elimination of PLRV and PVY by thermotherapy and chemotherapy from potato (Solanum tuberosum L.). Nepal J. Sci. Technol. 2006;(7):1-6.
- Беспалова Е.С., Агаханов М.М., Архимандритова С.Б., Ерастенкова М.В., Ухатова Ю.В. Оздоровление сортов картофеля из коллекции ВИР от вирусов. Труды по прикладной ботанике, генетике и селекции. 2020;181(4):164-172. https://doi.org/10.30901/2227-8834-2020-4-164-172
- Kim I.V., Chibizova A.S., Shischenko E.V., Fisenko P.V., Chekushkina T.N., Barsukova E.N., Volkov D.I., Klykov A.G. Methods of biotechnology in the improvement of promising potato hybrids (Solanum tuberosum L.). Research on Crops. 2021;(22):96-99. https://doi.org/10.31830/2348-7542.2021.023.


