Применение наноструктурных оксидов для направленного изменения рН микроокружения опухолевых клеток
Автор: Ложкомоев Александр Сергеевич, Бакина Ольга Владимировна, Фоменко Алла Николаевна, Августинович Александра Владимировна, Афанасьев Сергей Геннадьевич, Добродеев Алексей Юрьевич, Спирина Людмила Викторовна, Тарасова Анна Сергеевна, Урмонов Умиджон Бутабекович
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 3 т.18, 2019 года.
Бесплатный доступ
Цель исследования - установить взаимосвязь между кислотно-основными характеристиками наноструктур на основе оксидов алюминия и/или магния и их противоопухолевой активностью в экспериментах in vitro. Материал и методы. Для синтеза наноструктур на основе оксидов алюминия и/или магния с различными кислотно-основными характеристиками поверхности был использован метод гидролиза алкоголятов металлов и их смесей. Морфологию наноструктур исследовали методом просвечивающей электронной микроскопии с интегрированной системой энергодисперсионного анализа. Фазовый состав частиц определяли методом рентгеновской дифракции. Влияние синтезированных наноструктур на жизнеспособность клеточных линий определяли при помощи MTT-теста на культурах клеток MDA, PyMT и Neuro-2a. Результаты. В работе методом гидролиза алкоголятов алюминия и магния, а также их смеси были синтезированы наноструктуры оксида алюминия AlOOH, оксида магния MgO, композитные частицы AlOOH/MgO, эффективно подавляющие жизнедеятельность опухолевых клеток. Показано, что наибольшей цитотоксичностью обладает MgO, наименьшей - AlOOH. Анализ физико-химических характеристик синтезированных наноструктур показал, что основными факторами, обусловливающими их противоопухолевую активность, являются кислотно-основные свойства поверхности. Установлено, что MgO повышает рН клеточной питательной среды до 9,4, AlOOH - до 7,7, AlOOH/MgO - до 8,8. При этом наблюдается корреляция между количеством живых клеток при контакте питательной среды с наноструктурами и клеток, инкубированных в среде при повышенном рН, не содержащей наноструктуры. Данный подход может быть использован для синтеза материалов, способных изменять кислотность микроокружения опухолевых клеток в заданном диапазоне для противоопухолевой терапии, в том числе потенцируя действие стандартных химиопрепаратов за счет снижения внеклеточной кислотности. Заключение. Анализ характеристик синтезированных наноструктур показал, что основными факторами, обусловливающими их противоопухолевую активность, являются кислотно-основные свойства поверхности. Данный подход может быть использован для синтеза материалов, способных изменять кислотность микроокружения опухолевых клеток в заданном диапазоне для противоопухолевой терапии, в том числе потенцируя действие стандартных химиопрепаратов за счет снижения внеклеточной кислотности.
Оксид алюминия, оксид магния, микроокружение опухолевых клеток, кислотность микроокружения, противоопухолевая активность
Короткий адрес: https://sciup.org/140254264
IDR: 140254264 | УДК: 576.32/.36:546.6:57.085.23 | DOI: 10.21294/1814-4861-2019-18-3-64-70
Текст научной статьи Применение наноструктурных оксидов для направленного изменения рН микроокружения опухолевых клеток
Поиск новых методов лечения злокачественных новообразований является актуальной задачей, несмотря на значительный прогресс в данном направлении в последнее десятилетие. Это связано с тем, что до сих пор не найдено идеальное решение для борьбы со злокачественными опухолями. Для реализации данной задачи широко применяются наноматериалы и нанотехнологии. В настоящее время для лечения рака используются различные системы на основе наночастиц, такие как носители лекарственных средств для целенаправленной терапевтической доставки, магнитоактивные препараты для гипертермии и термохимиотерапии [1–5]. Более того, наночастицы с заданным размером частиц, морфологией и другими физико-химическими свойствами могут влиять на жизнеспособность раковых клеток [6–8] и снижать их метастатический потенциал [9]. Для облегчения доставки лекарств в клетки используют рН-зависимые и pH-чувствительные системы
[10–12]. Перспективным в данном направлении является поиск новых способов воздействия на межклеточную среду с помощью регуляции параметров (кислотность, ионный баланс и др.) микроокружения клеток [13–14]. Это связано с тем, что ионное состояние внеклеточного пространства в значительной степени определяет жизнедеятельность и жизнеспособность клеток [15]. Комплексной характеристикой, отражающей ионное состояние биологических сред, в том числе межклеточных, является величина pH [16–18]. Например, опухолевые клетки вследствие измененного метаболизма создают вокруг себя кислую среду, характеризующуюся пониженной относительно нормальных клеток величиной рН [19]. Внеклеточная кислотность также снижает эффективность стандартных химиопрепаратов [20]. Повышение рН внеклеточной среды приводит к лучшему поглощению клетками слабо основных лекарственных средств, в том числе доксорубицина, и усилению их цитотоксического эффекта [21].
В настоящем исследовании были синтезированы наноструктуры оксидных фаз Al и Mg, способные в разной степени изменять и поддерживать рН микроокружения клеток. В экспериментах in vitro показана корреляция между повышением рН микроокружения клеток и эффективностью подавления жизнедеятельности опухолевых клеток.
Материал и методы
Синтез наноструктур осуществляли методом гидролиза бутилата Al, Mg и их смеси. Бутилаты металлов и их смеси синтезировали следующим образом: в конические колбы с объемом бутанола 200 мл добавляли по 2 г металлической стружки Al, Mg и смеси Al и Mg с массовым соотношением 1:1 и кипятили с обратным холодильником в течение 6 ч при постоянном перемешивании до полного растворения металлов. Полученные алкоголяты по каплям выливали в емкость с дистиллированной водой объемом 500 мл, нагретой до 60 °С при интенсивном перемешивании. Полученные в результате гидролиза гидроксиды отфильтровывали на мембране и сушили при 200 °С в течение 12 ч.
Полученные образцы исследовали методом рентгенофазового анализа (РФА) с помощью дифрактометра Shimadzu XRD 7000 (Shimadzu Corporation, Япония). Исследование структуры образцов проводили методом просвечивающей электронной микроскопии (ПЭМ) с помощью электронного микроскопа JEM-2100 (JEOL, Япония). Распределение элементов в частицах оценивали с помощью интегрированной в микроскоп системы энергодисперсионного анализа (ЭДС) X-Max (Oxford Instruments, United Kingdom). Размер частиц определяли с помощью дисковой центрифуги CPS DS24000 (CPS Instruments, США).
Токсическое действие синтезированных наноструктур определяли при помощи MTT-теста на культурах клеток MDA (эпителиальные клетки аденокарциномы), PyMT (первичные клетки, выделенные из опухоли мышей) и Neuro-2a (нейробластома мыши, клон линии клеток Neuro C-1300, фибробластоподобные и нейроноподобные клетки). Культура МDA получена из Американской коллекции типовых культур (ATCC). Культура Neuro-2a получена из ФБУН ГНЦ ВБ «Вектор». Предварительно проводили посев клеток в 96-луночные планшеты по 7500 клеток на лунку. Культивирование клеток проводили в течение 24 ч при температуре 37 ± 1 ºС и 5 % CO2 в питательной среде. После инкубирования питательную среду удаляли и два раза промывали клетки раствором DPBS.
Для определения цитотоксичности использовали суспензии наноструктур в клеточной среде в концентрациях: 10 мг/мл, 5 мг/мл, 1 мг/мл, 0,5 мг/мл, 0,1 мг/мл, 0,05 мг/мл, 0,01 мг/мл и 0,001 мг/мл. Клетки с наноструктурами инкубировали при температуре 37 ± 1 ºС и 5 % CO2 в течение 24 ч. Для проведения MTT-теста питательную среду удаляли и два раза промывали клетки раствором DPBS. Затем в каждую лунку добавляли по 100 мкл питательной среды и по 10 мкл раствора MTT с концентрацией 5 мг/мл. Инкубирование с раствором MTT проводили в течение 2 ч при температуре 37±1 ºС и 5 % CO2. По окончании инкубирования питательную среду удаляли и добавляли в каждую лунку по 100 мкл диметилсульфоксида. Через 15 мин определяли оптическую плотность на планшетном спектрофотометре Tecan Infinite M1000 PRO (Tecan, Австрия) при длине волны 570 нм. Далее вычисляли процент живых клеток по отношению оптических плотностей исследуемого и контрольного образцов.
Для оценки влияния синтезированных наноструктур на изменение кислотных свойств клеточной питательной среды EMEM (Minimum Essential Medium Eagle) оценивали изменение её рН во времени при концентрации синтезированных наноструктур 5,00 мг/мл с помощью рН-метра Multitest IPL-103 (Semico, Россия).
Статистическая оценка была проведена с использованием программных средств Microsoft Excel и Statistica 6. Достоверность полученных результатов оценивали по t-критерию Стьюдента. Различия считались достоверными при р<0,05.
Результаты и обсуждение
Синтез оксидов и гидроксидов металлов из ал-коголятов является одним из способов получения высокочистых веществ [22, 23], а также их смесей [24]. В результате гидролиза бутилата алюминия и магния были синтезированы пористые наноструктуры (рис. 1). При гидролизе бутилата Al образуются складчатые нанолистовые структуры

Рис. 1. ПЭМ изображение оксигидроксида Al (а), нанокомпозита на основе окисигидроксидов Al и Mg (б), оксида магния (в)
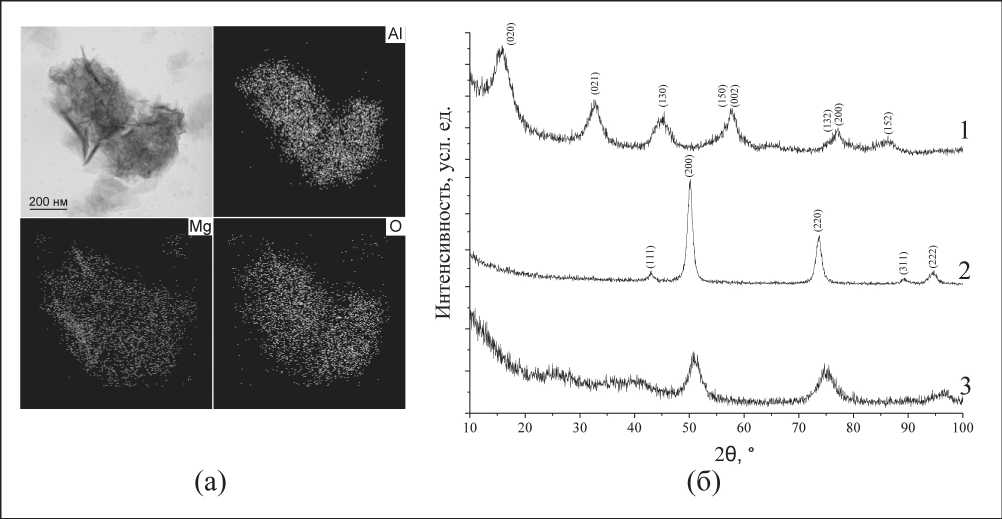
Рис. 2. ПЭМ изображение и элементный анализ в режиме картирования нанокомпозита на основе окисигидроксидов Al и Mg при соотношении масс металлов 1:1 (а); РФА продуктов гидролиза алкоголята алюминия (1), алкоголята магния (2), алкоголятов алюминия и магния (3) (б)
оксигидроксида алюминия размером до 1 мкм с толщиной нанолистов 2–5 нм (рис. 1а). В результате гидролиза смесей алкоголятов алюминия и магния с соотношением 1:1 образуется смесь пористых агломератов хаотично расположенных нанолистов толщиной 5–10 нм и нанопластинок размером до 200 нм и толщиной до 20 нм (рис. 1б). При гидролизе бутилата магния образуются нанопластинки размером до 500 нм и толщиной 10–30 нм (рис. 1в).
По данным EDS анализа в режиме картирования Mg и Al равномерно распределены по агломератам складчатых нанолистов. Пластинчатые структуры обогащены преимущественно магнием, при этом количественное содержание металлов в частицах соответствует их стехиометрии в смесях алко-голятов (рис. 2а). По данным ренгенофазового анализа (рис. 2б) продуктом гидролиза бутилата алюминия является псевдобемит, бутилата магния – оксид магния. При гидролизе смеси алкоголятов образуется смесь псевдобемита и оксида магния. Следует отметить, что на рентгенограмме продуктов гидролиза алкоголятов алюминия и магния с соотношением 1:1 наблюдается сильное уширение рефлексов AlOOH и MgO, а также снижение их интегральных интенсивностей, что свидетельствует об отсутствии дальнего порядка в расположении атомов и аморфной структуре образца.
Таким образом, в результате гидролиза алкоголя-тов алюминия и магния были получены наноструктуры псевдобемита и оксида магния. В результате гидролиза смеси алкоголятов образуются агломераты нанолистовых структур псевдобемита и оксида магния, при этом происходит равномерное распределение продуктов гидролиза по частицам.
В таблице представлены некоторые характеристики синтезированных наноструктур. Как видно, максимальная удельная поверхность (284 м2/г) и дзета-потенциал (+30,4 мВ), измеренный в воде при температуре 37 °С и рН 7,4, характерны для псевдобемита. Удельная поверхность нанопластинок оксида магния составила 93 м2/г, дзета-потенциал +20,6 мВ. Величина удельной поверхности смешанных наноструктур псевдобемита и оксида магния составила 256 м2/г, дзета-потенциал 25,3 мВ.
На рис. 3 представлены концентрационные зависимости синтезированных наноструктур на жизнеспособность опухолевых клеток MDA, PyMT и Neuro-2a. Цитотоксическое действие синтезированных наноструктур начинается при использовании концентраций от 1 мг/мл и увеличивается при использовании более высоких концентраций. При этом наибольшим цитотоксическим эффектом обладает оксид магния, а наименьшим – псевдобемит. При концентрации наноструктур от 1 мг/мл наблюдается зависимость между цитотоксичностью и количеством оксида магния в образцах для культур клеток PyMT и Neuro-2a. Для клеток MDA такая зависимость наблюдается при концентрации наноструктур 10 мг/мл.
Синтезированные наноструктуры обладают различными кислотно-основными свойствами и по-разному изменяют рН клеточной питательной среды (рис. 4a). При этом псевдобемит повышает рН среды с 7,2 до 7,7, смесь псевдобемита и оксида магния с соотношением масс металлов 1:1 повышает рН до 8,6, оксид магния – до 9,4. При экспериментальной оценке жизнеспособности опухолевых клеток Neuro-2a в питательной среде
Характеристики синтезированных наноструктур
Таблица
|
Образец |
SBET, м /г |
Дзета-потенциал, мВ |
Средний размер частиц, мкм |
|
AlOOH |
284 |
30,4 |
0,7 |
|
MgO |
93 |
20,6 |
0,4 |
|
AlOOH/MgO |
256 |
25,3 |
0,9 |
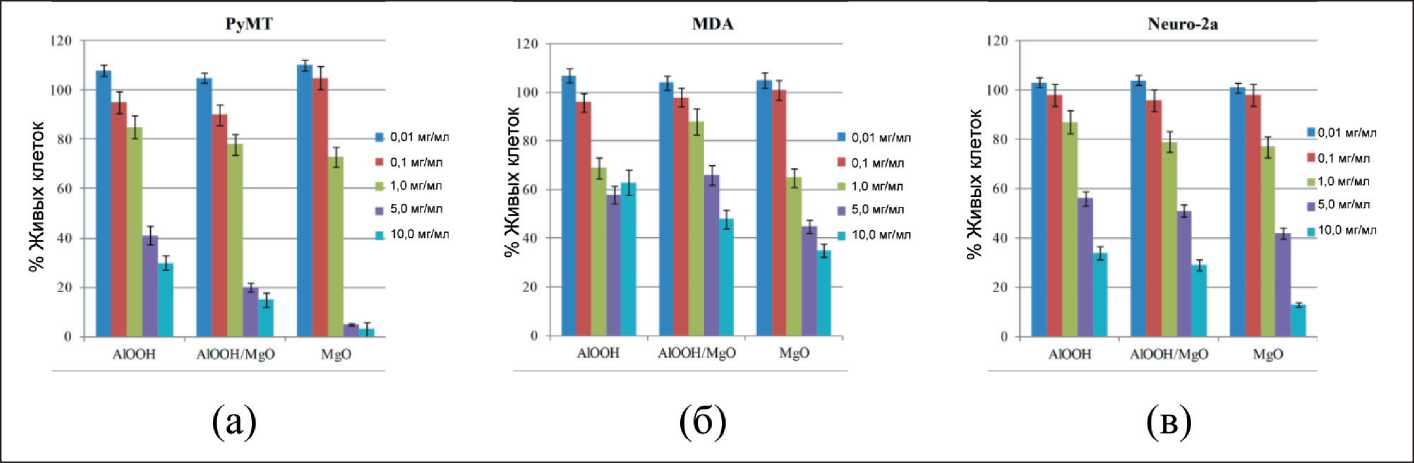
Рис. 3. Цитотоксичность MgO, AlOOH/MgO и AlOOH для клеточных линий PyMT (а), MDA (б) и Neuro-2a (в) относительно контроля (100 % жизнеспособных клеток)
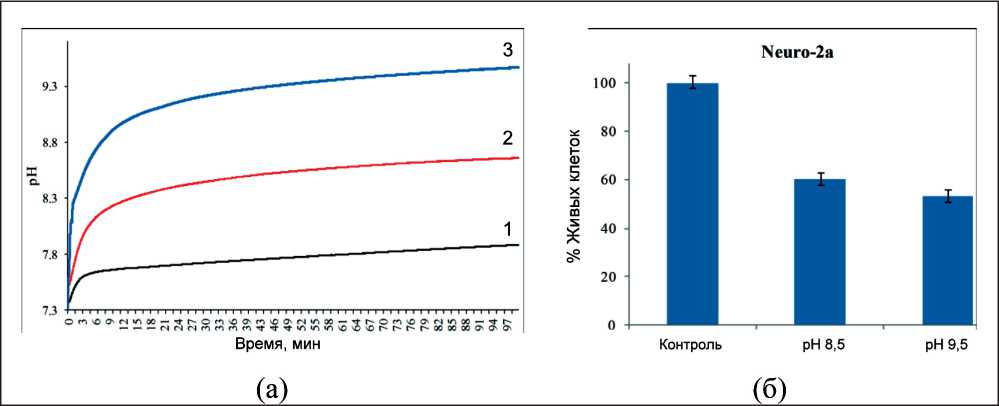
Рис. 4. Изменение рН среды EMEM в присутствии синтезированных наноструктур с концентрацией 5 мг/мл. Примечание: на рис (а) цифрами обозначено:
AlOOH – 1, смесь AlOOH и MgO – 2, MgO – 3
с повышенной щелочностью при pH 8,5 и рН 9,5 установлено, что повышение рН приводит к снижению жизнеспособности клеток (рис. 4б). Процент живых клеток при инкубировании в среде с рН 8,5 составил около 60 %, при инкубировании в среде с рН 9,5 – около 50 %. Полученный результат практически совпадает с результатом противоопухолевого действия синтезированных наноструктур. Таким образом, можно утверждать, что одним из ключевых факторов обусловливающих противоопухолевую активность синтезированных наноструктур является увеличение щелочности клеточной среды. Также следует отметить, что синтезированные наноструктуры имеют довольно крупные размеры, не позволяющие проникать им внутрь клетки [25, 26], и токсический эффект проявляется, прежде всего, за счет изменения параметров микроокружения клеток. Можно предположить, что основным механизмом цитотоксического действия синтезированных наноструктур является изменение мембранного потенциала клеток за счет повышения рН внеклеточной среды и как следствие нарушение обменных процессов в клетках.
Заключение
С помощью гидролиза алкоголятов алюминия и магния, а также их смесей были синтезированы 2D наноструктуры псевдобемита и оксида магния. Установлено, что при гидролизе смеси алкоголятов образуются агломераты нанолистовых структур с равномерным распределением Al и Mg по частицам, при этом массовое соотношение металлов в агломератах соответствует их массовому соотношению в смеси алкоголятов. На примере опухолевых клеточных культур PyMT, MDA и Neuro-2a установлено, что все синтезированные наноструктуры оказывают цитотоксическое действие при их концентрации более 1 мг/мл. Наименьшей цитотоксичностью обладает псевдобемит, наибольшей – оксид магния.
Показано, что синтезированные наноструктуры способны по-разному увеличивать рН клеточной питательной среды, рН увеличивается в ряду AlOOH, AlOOH/MgO, MgO, а их цитотоксическое действие напрямую связано с изменением кислотности среды.
Полученные результаты показывают, что, используя данный подход, можно синтезировать наноструктуры, способные изменять рН микроокружения клеток в заданном диапазоне, регулируя соотношение AlOOH и MgO. Синтезированные наноструктуры в перспективе могут быть использованы для противоопухолевой терапии как самостоятельно, так и в совокупности со стандартными химиопрепаратами, потенцируя их действие за счет снижения внеклеточной кислотности опухолевых клеток.
Список литературы Применение наноструктурных оксидов для направленного изменения рН микроокружения опухолевых клеток
- Lee H., Lytton-Jean A.K.R., Chen Y., Love K.T., Park A.I., Karagian-nis E.D., Sehgal A., Querbes W., Zurenko C.S., Jayaraman M., Peng C.G., Charisse K., Borodovsky A., Manoharan M., Donahoe J.S.,Truelove J., Nahrendorf M., Langer R., Anderson D.G. Molecularly self-assembled nucleic acid nanoparticles for targeted in vivo siRNA delivery. Nat Nan-otechnol. 2012 Jun 3; 7(6): 389-93. DOI: 10.1038/nnano.2012.73
- Mikhaylov G., Klimpel D., Schaschke N., Mikac U., Vizovisek M., Fonovic M., Turk V., Turk B., Vasiljeva O. Selective targeting of tumor and stromal cells by a nanocarrier system displaying lipidated cathepsin B inhibitor. Angew Chem Int Ed Engl. 2014 Sep 15; 53(38): 1007781. DOI: 10.1002/anie.201402305
- Mikhaylov G., Mikac U., Magaeva A.A., Itin V.I., Naiden E.P., Psa-khye I., Babes L., Reinheckel T., Peters C., Zeiser R., Bogyo M., Turk V., Psakhye S.G., Turk B., Vasiljeva O. Ferri-liposomes as an MRI-visible drug-delivery system for targeting tumours and their microenvironment Nat Nanotechnol. 2011 Aug 7; 6(9): 594-602. DOI: 10.1038/nnano.2011.112
- Peer D., Karp J.M., Hong S., Farokhzad O.C.,Margalit R., Langer R. Nanocarriers as an emerging platform for cancer therapy. Nat Nanotechnol. 2007 Dec; 2(12): 751-60. DOI: 10.1038/nnano.2007.387
- Shu Y., Shu D., Haque F., Guo P. Fabrication of pRNA nanoparticles to deliver therapeutic RNAs and bioactive compounds into tumor cells. Nat Protoc. 2013 Sep; 8(9): 1635-59. DOI: 10.1038/nprot.2013.097


