Применение низкотемпературной аргоновой плазмы в лечении гнойных ран
Автор: Суров Д.А., Сизоненко Н.А., Дымников Д.А., Цурупа П.С., Левченко Я.И., Воронина Л.А., Шостка К.Г.
Журнал: Вестник Национального медико-хирургического центра им. Н.И. Пирогова @vestnik-pirogov-center
Рубрика: Оригинальные статьи
Статья в выпуске: 3 т.19, 2024 года.
Бесплатный доступ
Обоснование. Хирургическая инфекция является актуальной проблемой медицины, так как до 40% пациентов хирургических стационаров госпитализируются по поводу гнойно-септических осложнений различных заболеваний. В конце XX века низкотемпературная аргоновая плазма или низкотемпературная плазма стали широко использоваться в медицине.Целью настоящей публикации является оценка эффективности и безопасности использования установки плазменно-дуговой «ПлазмоРан» (производство ООО «ПлазмоПром» (Россия)) в комплексном лечении хронических инфицированных ран, включая послеоперационные раны.Методы. Представлено исследование, в которое был включен 41 пациент. В основную группу составили 20 пациентов, у которых помимо комплексной терапии была применена терапия с использованием установки «ПлазмоРан». В контрольную группу был включен 21 пациент, которые получали стандартное лечение. Клиническими критериями оценки состояния пациентов являлись оценка по индексу коморбидности и тяжести хирургических осложнений. Критериями оценки раневого процесса являлись цитологическое исследование раневого экссудата, бактериологическое исследование, визуальная оценка сроков появления грануляционной ткани в ране. Динамики синдрома системного воспалительного ответа оценивалась по данным клинического анализа крови, биохимического анализа крови (С-реактивный белок), мониторирования термометрии, частоты дыхания и частоты сердечных сокращений.Результаты. Использование в комплексном лечении инфицированных ран установки плазменно-дуговой «ПлазмоРан» способствует сокращению сроков раневого процесса, раннему началу фазы регенерации, снижает проявления синдрома системного воспалительного ответа, что в настоящем исследовании позволило сократить сроки лечения пациентов.Заключение. Использование низкотемпературной плазмы - безопасный, безболезненный, простой в использовании и хорошо переносимый пациентами метод в комплексном лечении инфицированных ран, не препятствующий ранней активизации. Способствует быстрому очищению ран, их заживлению, снижению степени выраженности местных и общих симптомов инфекционного процесса
Установка плазменно-дуговая «плазморан», хирургическая инфекция, лечение гнойно-некротических ран, холодная плазма
Короткий адрес: https://sciup.org/140307886
IDR: 140307886 | DOI: 10.25881/20728255_2024_19_3_84
Текст научной статьи Применение низкотемпературной аргоновой плазмы в лечении гнойных ран
Хирургическая инфекция на протяжении всего времени существования медицины остается одной из актуальных проблем, поскольку до 40% пациентов, госпитализируемых в хирургический стационар, поступают с гнойно-септическими заболеваниями. Однако до сих пор не создан универсальный препарат или способ лечения инфицированных ран.
Проблема инфекционных осложнений актуальна в условиях современных вооруженных конфликтов, так как частота их встречаемости у тяжелораненых составляет около 25%, а в 70% случаев данные осложнения являются причиной летального исхода. Особенно часто раневая инфекция имеет место при минно-взрывной травме.
Осложненные гнойно-некротические раны представляют собой одну из самых обширных нозологических форм среди раненых военнослужащих. Восстановление их физического здоровья и дееспособности является первоочередной задачей в процессе реабилитации. Качество оказываемой медицинской помощи напрямую влияет на психоэмоциональное состояние участников боевых действий и их последующую социализацию [1].
Значительная частота развития инфекционных осложнений отмечается и в хирургии повреждений мирного времени. Имеющиеся противомикробные средства и алгоритмы их применения показывают недостаточную эффективность в связи с распространением антибиотико-резистентных микроорганизмов [2–5].

Известно множество различных методик физиотерапевтического лечения ран. В мировой практике для сокращения сроков заживления раневой поверхности активно используют ударно-волновую терапию, ультразвук, электростимуляцию, фотодинамическую терапию, стволовые клетки и многое другое. При этом у каждой методики есть свои преимущества и недостатки, но наиболее эффективной считается методика, которая комплексно воздействует на все 3 фазы раневого процесса. Наряду с вышеперечисленными методиками физиотерапевтического лечения ран применение низкотемпературной плазмы вызывает существенный интерес [6].
К концу ХХ в. низкотемпературная аргоновая плазма (НАП), или низкотемпературная плазма (НТП) стали находить свое практическое применение не только для многочисленных производственных технологий, но и в совершенно новых инновационных областях, таких как плазменная медицина [7].
НТП широко используется в хирургии, ее применение позволяет сократить продолжительность оперативных вмешательств, уменьшить операционную травму и кровопотерю, количество послеоперационных осложнений, сократить время пребывания пациентов в стационаре.
Таким образом, высокая лечебная эффективность НТП, наличие сертифицированной аппаратуры отечественного производства, минимальное количество противопоказаний к назначению данной методики, а также относительная простота выполнения процедур, позволяют применять ее в условиях стационаров, поликлиник и санаториев [8; 9].
Цель исследования
Оценить эффективность и безопасность использования медицинского изделия «Установка плазменно-дуговая хирургическая для лечения ран «ПлазмоРан» производства ООО «ПлазмоПром» (Россия) в комплексном лечении хронических, инфицированных (осложненных) ран (в т.ч. послеоперационных).
Объекты, материалы и методы исследования
В исследование был включен 41 пациент (29 мужчин и 12 женщин). Все пациенты были разделены на 2 группы. Рандомизация осуществлялась согласно таблицы случайных чисел, сгенерированных до начала исследования.
Основную группу составили 20 пациентов, у которых дополнительно к комплексной многокомпонентной терапии в зависимости от стадии раневого процесса и глубины раны использована установка «ПлазмоРан» (в режиме В2/В3).
Контрольная группа (21 пациент) получала комплексное лечение «традиционного» подхода – местное лечение ран с наложением асептических повязок (в т. ч. вакуумных (ВАК) систем) и использованием лекарственных средств в зависимости от стадии раневого процесса. Больные обеих групп были сопоставимы по полу, возрасту, тяжести сопутствующей патологии, коморбидности, тяжести осложнений, а также по локальному состоянию
Табл. 1. Клинико-демографическая характеристика пациентов, М±m
Все пациенты проходили стационарное лечение в клинике военно-морской хирургии Военно-медицинской академии имени С.М. Кирова в период с ноября 2023 г. по март 2024 г. включительно, и получали стандартное общее лечение (антибактериальная, противовоспалительная, деток-сикационая, инфузионная терапия), согласно действующих клинических рекомендаций (Б.Р. Гельфанд и др., 2015) [4].
Курс лечения завершался при следующих условиях: цель лечения достигнута; эффективность терапии очевидна (снижение объема раневого экссудата, уменьшение размеров раны), дно раны покрывается грануляциями, снижение микробной обсемененности до 103 и менее. Раннее выполнение пластического закрытия раны.
Клинические критерии оценки: оценка по индексу коморбидности (Charlson) и тяжести хирургических осложнений (Сlavien-Dindo), локальное состояние раны (площадь, некрозы, грануляции, глубина, болезненность при перевязках, частота и характер локальных, общих осложнений) в период исследования.
Критерии оценки раневого процесса:
– цитологическое исследование раневого экссудата (оценка динамики цитологической картины раны); мазки-отпечатки из раны;
– бактериологическое исследование (оценка динамики изменений микробной обсемененности раны (микробное число));
– визуальная оценка сроков появления грануляционной ткани в ране (начало фазы регенерации).
Оценка динамики синдрома системного воспалительного ответа (systemic inflammatory response syndrome – SIRS):
– клинический анализ крови (исследование уровня лейкоцитов, лейкоцитарной формулы, упрощенного

лейкоцитарного индекса интоксикации (уЛИИ) по В.К. Островскому [6]);
– биохимический анализ крови (оценка динамики маркеров воспаления (С-реактивный белок – СРБ));
– мониторирование термометрии, частоты дыхания, частоты сердечных сокращений.
Средние выборочные значения количественных признаков сравниваемых показателей в графических диаграммах представлены в виде медианы (М), в таблицах – М±m, где m – стандартное отклонение. Для статистической обработки полученных данных использованы параметрические и непараметрические методы статистики, выбор которых обусловлен характером распределения изучаемых признаков. Также проанализирована полнота реализации дизайна исследования в группах сравнения.
Результаты исследования
Сравнительный анализ течения раневого процесса
Цитологическое исследование раневого экссудата (мазки-отпечатки из раны)
Для контроля цитологической картины ран выполнялось взятие и анализ мазков-отпечатков во время перевязок из области дна или краев раны (перед обработкой раны Установкой) до начала апробации, на 3-и, 7-е и 10-е сутки от начала лечения/апробации. Взятие мазков-отпечатков осуществлялось после промывания раны физиологическим раствором и её осушения. Выполнялся соскоб с раневой поверхности с нанесением тонким слоем на предметное стекло.
Сравнительный анализ проведен в динамике между 1-ми и 3-ми, 1-ми и 7-ми, 1-ми и 10-ми сутками наблюдения между обеими группами. Установлено, что значимый эффект динамики лейкоцитарной инфильтрации раны достигался на 7-е сутки от начала использования Установки (снижение на 68,8 и 46,5%, соответственно), с сохранением аналогичной динамики между 7-ми и 10-ми сутками наблюдения (снижение на 90,5 и 63,4%, соответственно). При этом в период от начала апробации и до 3-х суток существенной статистической разницы в динамике лейкоцитарной инфильтрации раны не выявлено (снижение на 40,6 и 33,9%, соответственно), рисунок 1.
Бактериологическое исследование – оценка динамики изменений микробной обсемененности раны (общее микробное число)
Проведение качественного и количественного анализов микрофлоры раневого экссудата проводился во время перевязок из области дна или краев раны до начала апробации, на 3-и, 7-е и 10-е сутки от начала лечения/апробации. Бактериологическое исследование ран проводилось перед обработкой раны Установкой, так как это обеспечивает достоверную микробиологическую картину раны. Анализ динамики
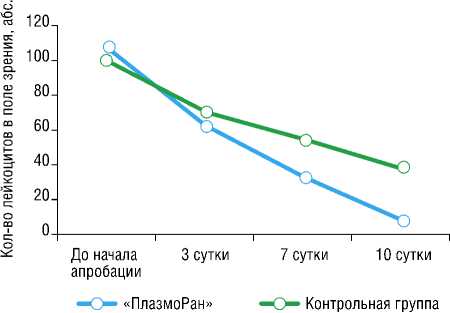
Рис. 1. Динамика лейкоцитарной инфильтрации ран (мазки-отпечатки).
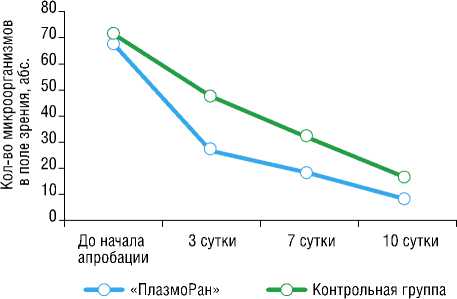
Рис. 2. Динамика бактериальной обсеменённости ран (общее микробное число).
снижения уровня бактериальной обсемененности ран продемонстрировал, что уже на 3-и сутки отмечалось почти двукратное снижение показателя в группе применения Установки по сравнению с контрольной группой (снижение на 60,3 и 32,4%, соответственно), с сохранением аналогичной динамики (но несколько меньшей выраженности) между 1-ми и 7-ми сутками наблюдения (снижение на 72,1 и 53,5%, соответственно). При этом между 1-ми и 10-ми сутками наблюдения существенной статистической разницы в динамике снижения уровня бактериальной обсемененности ран не выявлено (снижение на 86,8 и 76,1%, соответственно), рисунок 2.
При качественном анализе бактериальной обсе-менности ран в группах сравнения установлено, что в группе использования установки «ПлазмоРан» уровень микроорганизмов уже на 3-и сутки от начала использования составил 102–103 с преимущественным преобладанием сапрофитной микрофлоры ( Staphylococcus spp., St. epidermidis, Streptococcus spp. ), тогда как в контрольной группе аналогичного показателя удалось достичь только на 7–10-е сутки с сохранением в течение первой недели лечения культур Staphylococcus aureus, Bacteroides fragilis и др.

«ПлазмоРан» I ■ Контрольная группа
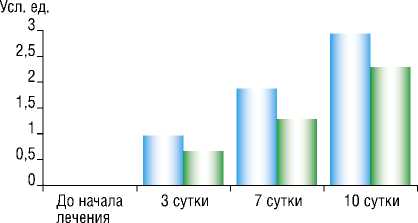
Рис. 3. Динамика появления грануляций в ране в группах сравнения.
Визуальная оценка сроков появления грануляционной ткани в ране (начало фазы регенерации)
Визуальная оценка ран проводилась для определения изменения площади ран и появления грануляционной ткани. За критерии оценки данных было принято, что 0 усл. ед. – отсутствие грануляционной ткани, от 1 до 3 усл. ед. – степень выраженности ее наличия в ходе лечения/апробации. Результат оценки представлен на рисунке 3.
Клиническое наблюдение 1. На рисунке 4 представлено наглядное визуальное стихание воспалительных явлений раны и появление грануляций у пациента, страдающего трофической язвой нижней конечности, в течение 5 суток использования Установки.
Клиническое наблюдение 2. На рисунке 5 представлено наглядное визуальное стихание воспалительных явлений раны, уменьшение площади и глубины раны, появление грануляций у пациента с пролежнем II–III степени крестцово-копчиковой области, в течение 17 суток использования Установки.
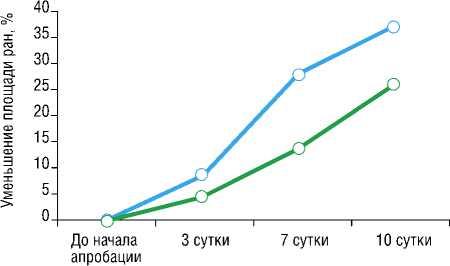
Оценка уменьшения площади раны проводилась с учетом площади ладони взрослого человека, равной примерно 200 см2. При этом, очевидно, что для достоверности результатов использована динамика уменьшения площади ран у больных обеих групп, а не абсолютные значения площади ран (Рис. 6).
Отчетливое уменьшения количества раневого отделяемого, уменьшение площади ран, появления сочных грануляций в 6 (30%) случаях в группе применения установки «ПлазмоРан» позволило на 6–10-е сутки от начала лечения/апробации безопасно прекратить дальнейшее использование Установки, выполнить ушивание раны с наложением вторичных швов или выполнение закрытия раневого дефекта расщепленным кожным лоскутом без последующих осложнений.
Оценка динамики синдрома системного воспалительного ответа (SIRS)
Оценка динамики SIRS проводилась на основе анализа уровня лейкоцитов, незрелых форм полиморфноядерных лейкоцитов, динамики СРБ, а также уровня температуры тела, частоты дыхания (ЧД) и частоты сердечных
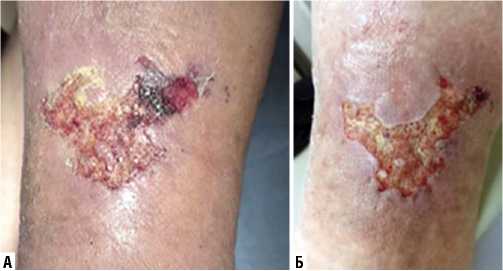
Рис. 4. Эффективность Установки при лечении пациента, страдающего трофической язвой нижней конечности: А – до использования Установки; Б – после 5 суток использования Установки.
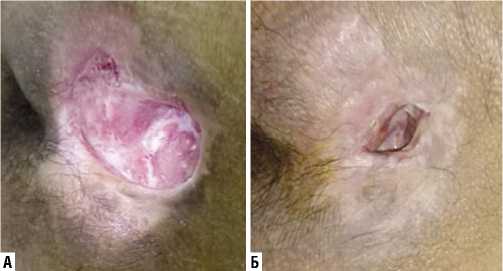
Рис. 5. Эффективность Установки при лечении пациента с пролежнем II–III степени крестцово-копчиковой области: А – до использования Установки; Б – после 17 суток использования Установки.
«ПлазмоРан»
Контрольная группа
Рис. 6. Динамика уменьшения размеров ран (от исходного значения).
сокращений (ЧСС). Полученные данные представлены в таблице 2 и на рисунках 7–10.
Наглядно продемонстрировано значимое снижения уровня палочкоядерных нейтрофилов уже на 3-и сутки лечения в группе использования установки «ПлазмоРан» с нормализацией их уровня на 7-е сутки лечения. Отчетливая положительная динамика лечения пациентов в группе использования Установки нашла отражение и в динамике снижения уровня СРБ, средний показатель которого был значимо ниже на протяжении всего периода наблюдения от

Табл. 2. Клинико-лабораторные показатели выраженности синдрома системной воспалительной реакции, М±m
|
Показатель |
Группа |
|||||||
|
«ПлазмоРан» |
контрольная |
|||||||
|
До начала лечения/ апробации |
3-и сут. |
7-е сут. |
10-е сут. |
До начала лечения/ апробации |
3-и сут. |
7-е сут. |
10-е сут. |
|
|
Лейкоциты, 109/л |
17,6±1,5 |
11,6±2,2 |
7,6±1,4 |
6,4±1,35 |
16,9±5,6 |
13,4±1,8 |
9,7±1,9 |
7,4±1,74 |
|
Палочко-ядерные нейтрофилы, % |
20,4±1,5 |
11,8±1,6 |
6,8±1,78 |
5,1±1,21 |
19,4±2,14 |
15,9±2,4 |
10,2±1,7 |
8,3±2,4 |
|
СРБ, г/л |
139±11,4 |
86±8,5 |
44±5,1 |
25±5,4 |
144±11 |
117±14,1 |
84±6,6 |
69±8,1 |
|
Температура тела, оС |
38,5±0,4 |
37,3±0,3 |
36,8±0,4 |
36,5±0,4 |
38,4±0,2 |
38±0,5 |
37,4±0,3 |
36,7±0,2 |
|
ЧСС, уд/мин. |
92±6,9 |
83±5,8 |
76±5,2 |
72±3,1 |
90±6,1 |
86±5,5 |
79±5,4 |
73±3,7 |
|
ЧД, раз/мин. |
21±2,15 |
17±2,39 |
15±1,7 |
14±2,44 |
23±3,41 |
16±2,87 |
14±2,21 |
14±1,44 |
20^
0 4---------------------------,---------------------------,---------------------------,-----------------------
До начала 3 сутки 7 сутки 10 сутки лечения
«ПлазмоРан»
Контрольная группа
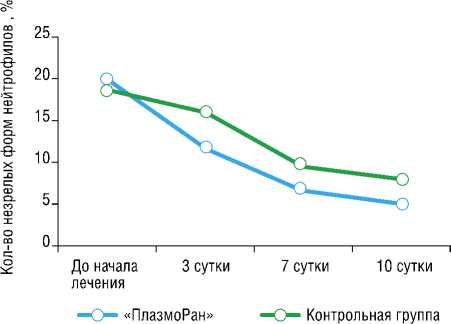
Рис. 8. Динамика уровня незрелых форм полиморфноядерных нейтрофилов в клиническом анализе крови.
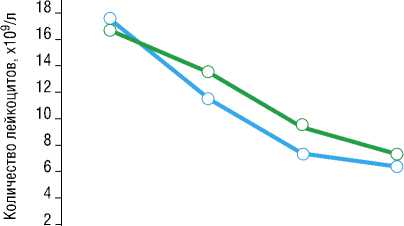
Рис. 7. Динамика уровня общего количества лейкоцитов в клиническом
анализе крови.
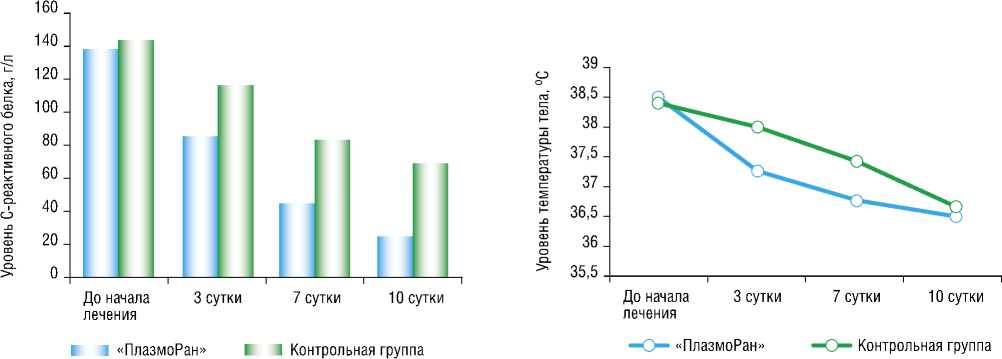
Рис. 10. Динамика температуры тела.
Рис. 9. Динамика уровня СРБ.
момента начала применения Установки. Динамика уровня температуры тела в группе использования Установки показала значимое снижение среднего показателя до субфебрильных значений на 3-и сутки, а нормализацию на 7-е сутки.
Таким образом, использование Установки продемонстрировало значимое улучшение лейкоцитарной формулы (начиная с 3-х суток лечения), снижения (нормализации) температуры тела и СРБ (р<0,05), тогда как абсолютные значения уровня лейкоцитов, ЧСС и ЧД в обеих группах статистически не отличались.
Обсуждение результатов
Данные многочисленных клинических и экспериментальных исследований свидетельствуют о безусловной целесообразности и эффективности применения НТП в широкой медицинской практике [8].
НАП активно применяется в лечении ран различной этиологии. Данная методика широко используется в лечении гнойно-некротических поражений мягких тканей нижних конечностей, гнойных заболеваний кожи и подкожной жировой клетчатки, нагноения послеоперационных ран, пролежней, рожистого воспаления. Преимущество НАП заключается в том, что в отличие от лечения антибактериальными препаратами или антисептическими средствами в большинстве случаев аллергических или токсических реакций не наблюдается [12].
Холодная плазма приводит к обратимому снижению клеточной адгезии, временному повышению проницаемости клеточной мембраны и стимуляции клеточного деления. При этом воздействие даже низких доз НТП достаточно для полного уничтожения бактериальных клеток. Селективность воздействия плазмы на клетки млекопитающих и бактерий связана с различиями на уровне клеточного метаболизма и более высокой организацией структуры клеток, что значительно лучше защищает их от воздействия внешних факторов. НТП обладает рядом принципиальных преимуществ, к которым относятся высокая неспецифическая бактерицидная активность, низкая вероятность появления устойчивых форм, отсутствие ионизирующих излучений и высокотоксичных веществ. Описанные преимущества вместе с комфортной температурой, относительной простотой и дешевизной методики, отсутствием специфических требований к обрабатываемой поверхности делают НТП перспективным методом лечения различных патологических состояний [6; 13–15].
Установка, плазменно-дуговая хирургическая для лечения ран «ПлазмоРан», предназначена для применения в комплексном лечении хронических, инфицированных и острых ран, которые представляют собой травматические и гнойно-некротические повреждения мягких и костных тканей различной этиологии, а также для рассечения и коагуляции тканей, деструкции и удалению нежизнеспособных и патологически измененных тканей в ходе хирургических операций в стационарных и амбулаторных медицинских учреждениях. Установка в среде аргона формирует электродуговой разряд, который ионизирует аргон, переводя его в состояние низкотемпературной плазмы. Вследствие электрон-ионных соударений кинетическая скорость ионов аргона сильно возрастает. Область ионизации практически совпадает с областью электрической дуги. После прохождения свободных электронов и ионов аргона, обладающих высокой кинетической энергией, области электрической дуги, и исчезновения внешних факторов ионизации, происходит рекомбинация ионов аргона со свободными электронами, которая сопровождается излучением, которое называется рекомбинационным. Рекомбинационное излучение имеет очень широкий спектр – от ближнего инфракрасного диапазона до области вакуумного ультрафиолета [16–19].
Таким образом, установка обеспечивает формирование потока инертного газа аргона с высокой температу- рой, обладающего высоким теплосодержанием, а также интенсивного рекомбинационного излучения.
Установка применяется в традиционном комплексном лечебном процессе совместно с используемыми в клинике антибактериальными, анестетическими, перевязочными средствами и материалами. Обработка раны с использованием Установки производится после снятия старой повязки и очистки раны антисептическим раствором (перекись водорода, хлоргексидин, мирамистин и пр.) и перед наложением новой стерильной [1; 17–19].
Выводы
-
1. Использование Набора в настоящем исследовании позволило на 3,2±1,3 суток уменьшить продолжительность лечения пациентов в стационаре.
-
2. Использование Установки отличает простота и безопасность, удобство для медперсонала, безболезненность для пациента.
-
3. Стоимость установки «ПлазмоРан» и отечественное производство позволяет избежать логистических препятствий в снабжении медицинских организаций.
-
4. Учитывая данные проведенного исследования, медицинское изделие «Установка плазменно-дуговая хирургическая для лечения ран «ПлазмоРан» производства ООО «ПлазмоПром» (Россия) может широко применяться в медицинских организациях (клиниках всех уровней) в комплексном лечении ран различной этиологии.
-
5. Медицинское изделие «Установка плазменно-дуговая хирургическая для лечения ран «ПлазмоРан» удобно в использовании, хорошо переносится пациентами, не препятствует ранней мобилизации и активизации пациентов, способствуют быстрому очищению ран и их заживлению, что в свою очередь способствует снижению продолжительности пребывания пациентов в стационаре и снижению сроков нетрудоспособности.
Список литературы Применение низкотемпературной аргоновой плазмы в лечении гнойных ран
- Интернет-ресурс: https://plazmoran.ru/ustanovka.
- Вакуумная терапия ран у детей и взрослых. Российский и международный опыт / Под ред. В.А. Митиша, Ю.С. Пасхаловой, Л.А. Блатуна и др. Сборник научных трудов международной научно-практической конференции. – Москва: Перо, 2018. – 128 с.
- Коскин В.С. Совершенствование системы профилактики раневой инфекции у раненых на этапах медицинской эвакуации: дис. … канд. мед. наук. – Санкт-Петербург, 2016.
- Суворов В.В. Послеоперационные инфекционные осложнения при традиционных и лапароскопических операциях холецистэктомии и аппендэктомии // Инфекции в хирургии. – 2014. – №12(3). – С.17-21.
- Цыбуляк Г.Н. Частная хирургия механических повреждений: руководство для врачей. – Санкт-Петербург: Гиппократ, 2011. – 576 с.
- Сигуа Б.В. История развития и возможности плазменной хирургии // Вестник экспериментальной и клинической хирургии. – 2021. – №14(3). – С.243-247.
- Васильева Т.М. Применение низкотемпературной плазмы пониженного давления в клинической медицине и фармацевтике // Наноиндустрия. – 2019. – №12(7-8). – 434-443.
- Герасименко М.Ю. Низкотемпературная плазма – перспективный метод реабилитации // Физическая и реабилитационная медицина, медицинская реабилитация. – 2019. – №3. – 79-89.
- Полушин Ю.С. Сепсис и менеджмент: как улучшить исходы лечения больных сепсисом // Вестник хирургии имени И.И. Грекова. – 2022. – №181(5). – 38-46.
- Гельфанд Б.Р. Хирургические инфекции кожи и мягких тканей: Российские национальные рекомендации. – Москва: Изд-во МАИ, 2015. – 10 с.
- Громов М.И. Лейкоцитарный индекс интоксикации по В.К. Островскому как критерий оценки бактериальной инфекции // Вестник хирургии имени И.И. Грекова. – 2023. – №182(2). – С.53-58.
- Heinlin J. Plasma medicine: possible applications in dermatology. J Dtsch Dermatol Ges. 2010; 8(12): 968-976.
- Сысолятина Е.В. Бактерицидные свойства низкотемпературной плазмы in vitro и in vivo: дис. ... канд. биол. наук. – Москва, 2013.
- Бадиков В.Д. Микробиология боевой хирургической травмы: автореф. дис. ... д-ра мед. наук. – Санкт-Петербург, 2000.
- Военно-полевая хирургия. Национальное руководство / Д.В. Тришкин, Е.В. Крюков, Д.Е. Алексеев и др. – 2-е изд., перераб. и доп. – Москва: ГЭОТАР-Медиа, 2024. – 1056 с.
- Методические рекомендации по лечению боевой хирургической травмы / Д.В. Тришкин, Е.В. Крюков, А.П. Чуприна и др. – Санкт-Петербург: ВМедА, 2022. – 373 с.
- Стойко Ю.М. Применение метода локального отрицательного давления в комплексном лечении пациентов с раневой инфекцией // Вестник СурГУ. – 2021. – №2(48). – С.9-14.
- Фролов С.А. Возможности применения низкотемпературной аргоновой плазмы в лечении послеоперационных и длительно незаживающих ран // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. – 2019. – №29(6). – С.15-21.
- Heinlin J. Plasma medicine: possible applications in dermatology. J Dtsch Dermatol Ges. 2010; 8(12): 968-976.


