Применение паракринных факторов мезенхимальных стволовых клеток в послеоперационном периоде кератопластика высокого риска в эксперименте
Автор: Трифаненкова И.Г., Темнов А.А., Булатова Ю.Д., Кодунов А.М., Кириленко И.Ю.
Журнал: Вестник Национального медико-хирургического центра им. Н.И. Пирогова @vestnik-pirogov-center
Рубрика: Оригинальные статьи
Статья в выпуске: 4S1 т.18, 2023 года.
Бесплатный доступ
Цель. Представить предварительные результаты применения паракринных факторов мезенхимальных стволовых клеток в послеоперационном периоде кератопластики высокого риска у животных на фоне предсуществующего неоангиогенеза. Материал и методы. В исследование, состоящее из двух этапов, были включены 12 кроликов (12 глаз) породы серая шиншилла весом от 2,5 до 3,2 кг. На первом этапе 8 животным (8 глаз) был смоделирован термический ожог роговицы в периферической зоне с захватом лимбальной зоны. Перед получением экспериментальной модели термического ожога роговицы выделяли стволовые клетки костного мозга кроликов и получали кондиционированную среду, содержащую паракринные факторы мезенхимальных стволовых клеток (КС-МСК). Затем на всех глазах с термическим ожогом проводилась сквозная кератопластика по стандартной технологии. В качестве доноров использовали 4 кролика (8 глаз). На втором этапе были сформированы контрольная (4 кролика, 4 глаза) и опытная группы (4 кролика, 4 глаза). В опытной группе в качестве послеоперационного лечения применяли инстилляции КС-МСК с 1-х по 14-е стуки четырехкратно. В контрольной группе лечение проводилось путем инстилляции антибиотиков (Офтаквикс) и кератопротекторов (Корнерегель) трехкратно в течение 14 дней. Сроки наблюдения составили 1-е, 3-и, 7-е, 14-е сутки. Выполняли офтальмоскопию переднего отрезка глаза с последующей фоторегистрацией, исследование на приборе Pentacam AXL.
Термический ожог роговицы, васкуляризация, кератопластика, паракринные факторы мезенхимальных стволовых клеток
Короткий адрес: https://sciup.org/140303513
IDR: 140303513 | DOI: 10.25881/20728255_2023_18_4_S1_76
Текст научной статьи Применение паракринных факторов мезенхимальных стволовых клеток в послеоперационном периоде кератопластика высокого риска в эксперименте
Актуальность
Ожоговая травма органа зрения составляет от 4,2% до 38,4% всех глазных травм, и, в большинстве случаев, происходит у молодого и трудоспособного населения [1]. В Российской Федерации ежегодно проводится около 2500–3000 кератопластик при бельмах, посттравмати-

Трифаненкова И.Г., Темнов А.А., Булатова Ю.Д. и др.
ПРИМЕНЕНИЕ ПАРАКРИННЫХ ФАКТОРОВ МЕЗЕНХИМАЛЬНЫХ СТВОЛОВЫХ КЛЕТОК В ПОСЛЕОПЕРАЦИОННОМ ПЕРИОДЕ КЕРАТОПЛАСТИКА ВЫСОКОГО РИСКА В ЭКСПЕРИМЕНТЕ ческих рубцах, дистрофиях роговицы, язвах роговицы различной этиологии, кератоконусе. По данным авторов, общие показатели выживаемости трансплантата через 10 лет после сквозной кератопластики составляют 79,3% [2]. Однако при кератопластиках высокого риска, например, у пациентов с постожоговыми бельмами, показатель прозрачного приживления роговичного трансплантата составляет от 20 до 45% [3].
Основными причинами отторжения трансплантата являются антигены гистосовместимости и васкуляризация роговицы реципиента. Роговица является уникальной «иммунопривелигированной» тканью вследствие ее аваскулярности [4]. Дисбаланс про- и антиангиогенных факторов, возникающий в результате ожоговой травмы, приводит к неоваскуляризации роговицы [5]. Одним из решений данной проблемы может быть использование в лечении и профилактике осложнений неоваскуляризации роговицы мезенхимальных стволовых клеток (МСК) [6–9].
В экспериментальных работах была продемонстрирована эффективность применения МСК в лечении ожоговых бельм роговицы [10–12]. Однако клиническое применение МСК ограничено законодательством РФ. Выходом в данной ситуации может стать применение кондиционированных сред, содержащих паракринные факторы МСК (КС-МСК).
Цель – представить предварительные результаты применения паракринных факторов мезенхимальных стволовых клеток в послеоперационном периоде кератопластики высокого риска у животных на фоне пред-существующего неоангиогенеза.
Материал и методы
В исследование, состоящее из двух этапов, были включены 12 кроликов (12 глаз) породы серая шиншилла весом от 2,5 до 3,2 кг. На первом этапе 8 животным (8 глаз) был смоделирован термический ожог роговицы в периферической зоне с захватом лимбальной зоны. Затем на всех глазах с термическим ожогом проводилась сквозная кератопластика по стандартной технологии. В качестве доноров использовали 4 кроликов (8 глаз).
На втором этапе были сформированы контрольная (4 кролика, 4 глаза) и опытная группы (4 кролика, 4 глаза). В опытной группе в качестве послеоперационного лечения применяли инстилляции КС-МСК. Инстилляции проводились с 1-х по 14-е стуки четырехкратно. В контрольной группе лечение проводилось путем инстилляции антибиотиков (Офтаквикс) и кератопротекторов (Корнерегель) трехкратно в течение 14 дней.
Сроки наблюдения составили 1-е, 3-и, 7-е, 14-е сутки, в которые выполняли офтальмоскопию переднего отрезка глаза щелевой лампе Topcon SL-2G с последующей фоторегистрацией на щелевой лампе Haag-Streit Diagnostics BP 900, исследование на приборе Pentacam AXL.
Перед получением экспериментальной модели термического ожога роговицы выделяли стволовые клетки костного мозга кроликов и по ранее описанной методике [10] получали препарат пептидов, который представлял собой прозрачную гомогенизированную жидкость малинового цвета.
На первом этапе эксперимента для создания модели термического ожога роговицы использовали специальное устройство с металлическим цилиндром, которое подключали к источнику переменного тока; максимальный пик температуры составлял 210 °С. Перед термическим воздействием в конъюнктивальную полость закапывали 0,5% раствор проксиметакаина. Ожог наносился путем установки основания данного цилиндра на периферическую область с захватом лимбальной зоны роговицы подопытных животных на 3 секунды [10].
В ранее проведенном исследовании было установлено, что используемая модель термического ожога позволяет к 7-м суткам получить обильное прорастание сосудов лимбальной сети в роговицу опытных животных, а к 14-м суткам получить формирование стойкого не-оваскулярного бельма роговицы [11; 12].
На 15-й день эксперимента проводилась сквозная кератопластика по стандартной технологии. Операция выполнялась под общим наркозом. Первоначально проводилась обработка операционного поля 0.5% раствором хлоргексидина дважды. У кролика-реципиента с помощью механического трепана выкраивался сквозной диск диаметром 8.0 мм и удалялся.
Донорская роговица выкраивалась из предварительно энуклеированного глаза донора при помощи трепана диаметром 8.25 мм и переносилась на подготовленное ложе пациента. Роговичный трансплантат фиксировался четырьмя узловыми швами 8-0. Далее накладывалось 16 узловых швов 10-0, после чего снимались узловые провизорные швы 8-0. Передняя камера восстанавливалась физиологическим раствором (NaCl 0,9%).
На втором этапе эксперимента на 1 сутки после проведенной кератопластики начиналось лечение в опытной и контрольной группах по вышеописанной схеме.
Результаты
Кератопластика проводилась на 15-е сутки после формирования неоваскулярного бельма роговицы. К этому моменту индуцированные неоваскулярные бельма у всех животных были сходны по площади, глубине, частоте новообразованных сосудов и денситометрии.
По данным офтальмоскопии, на 1-е сутки в опытной и контрольной группах наблюдалась умеренная светобоязнь, конъюнктивальная инъекция сосудов. Трансплантат роговицы был прозрачным, отечным, ушит узловыми швами. Швы чистые, состоятельные. Передняя камера средней глубины, влага прозрачная. Радужка структурная, зрачок 3 мм. В области зрачка визуализировалась экссудативная пленка. Хрусталик прозрачный. Рефлекс розовый, снижен за счет экссудативных мембран.
На 3-е сутки в опытной группе трансплантат роговицы был прозрачным, ушит узловыми швами. Шов

чистый, состоятельный. Передняя камера средней глубины, влага прозрачная. Радужка структурная, зрачок 3 мм, хрусталик прозрачный. Остатки экссудативной пленки по зрачковому краю. Рефлекс розовый. В контрольной группе отмечалось умеренное слизистое отделяемое, стромальный отек трансплантата роговицы в оптической зоне, трансплантат ушит узловыми швами, швы состоятельные. В зрачке визуализировалась экссудативная мембрана, которая частично закрывала просвет зрачка, с увеличением плотности.
На 7-е сутки в опытной группе трансплантат роговицы был прозрачный, ушит узловыми швами. Шов чистый, состоятельный. В контрольной группе – умеренное слизистое отделяемое, стромальный отек трансплантата роговицы, трансплантат ушит узловыми швами, швы провисали. Отмечалась неоваскуляризация трансплантата роговицы с 9 до 3 часов с прорастанием на 4 мм. Радужка структурная, зрачок 3 мм, остатков экссудативной мембраны не наблюдалось.
На 14-е сутки в опытной группе трансплантат роговицы был прозрачным, ушит узловыми швами (Рис. 1 А). Отмечались единичные стволы новообразованных сосудов с прорастанием в трансплантат не более 1 мм. Шов чистый, состоятельный. Передняя камера средней глубины, влага прозрачная. Радужка структурная, зрачок 3 мм, хрусталик прозрачный. Рефлекс розовый. В контрольной группе наблюдали умеренное слизистое отделяемое, стромальный отек трансплантата роговицы, швы провисали. Отмечалась неоваскуляризация роговицы с 9 до 3 часов с прорастанием на 4 мм (Рис. 1 Б).
Обсуждение
В настоящее время доказано, что активизация иммунных процессов является главным препятствием в достижении оптимальных результатов кератопластики при васкуляризированных бельмах роговицы. Новообразованные сосуды облегчают проникновение эффекторных Т-клеток в трансплантат, что и является причиной развития алло-отторжения [13]. Именно поэтому ангио- и лимфангиогенез при кератопластике требует особого внимания [5; 14–16].
Мезенхимальные стволовые клетки (МСК) являются самообновляющимися и способны дифференцироваться в другие типы клеток при определенных условиях.
Исследование Ма и соавт. продемонстрировало восстановление поврежденной роговицы крыс, обработанной человеческими МСК (чМСК). Это что позволило предположить, что чМСК ингибируют как воспаление, так и связанный с воспалением ангиогенез [9].
Учитывая ограниченное клиническое применение МСК в РФ, мы посчитали перспективным применение кондиционированных сред, содержащих паракринные факторы МСК (КС-МСК). В проведенных раннее исследованиях было показано, что терапевтический эффект МСК по крайней мере частично опосредован паракринными трофическими факторами, секретируемыми клетками.
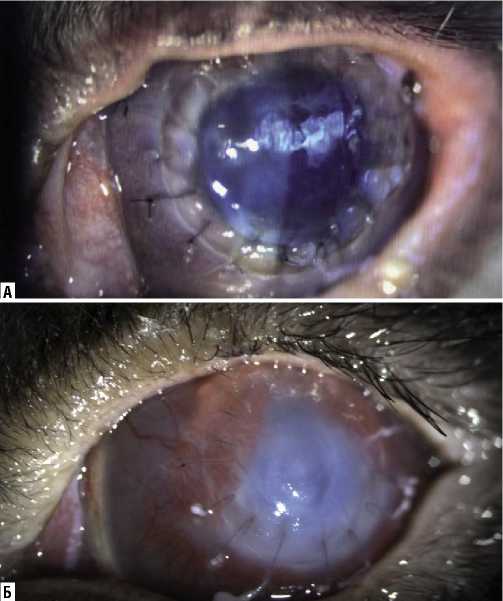
Рис. 1. Фотография переднего отрезка глаза кролика на 14-е сутки после кератопластики: А – опытная группа; Б – контрольная группа.
В свою очередь, различные факторы роста, цитокины и белки внеклеточного матрикса входят в состав питательных сред МСК, что тоже объясняет эффективность КС-МСК [17].
Проведенное нами на втором этапе эксперимента послеоперационное лечение с применением КС-МСК показало выраженный антиангиогенный эффект, что подтверждалось отсутствием выраженной васкуляризации донорской роговицы на 14-й день инстилляций препарата. В контрольной группе с 7-х суток фиксировались отек и помутнение роговицы, неоваскуляризация донорской роговицы. Учитывая имеющиеся данные, мы предполагаем, что именно ингибирование как воспаления, так и связанного с ним лифо- и ангиогенеза, может объяснять более качественное восстановление и приживление донорской роговицы у животных, получавших в качестве лечения КС-МСК.
Заключение
Применение раствора КС-МСК показало себя эффективным в послеоперационном периоде кератопластики высокого риска у животных в эксперименте на фоне предсуществующего неоангиогенеза. Необходимо проведение экспериментальных исследований на более длительных сроках для оценки отдаленных результатов, а также подтверждение полученных результатов данными инструментальных и гистологических исследований на всех сроках наблюдения.
Трифаненкова И.Г., Темнов А.А., Булатова Ю.Д. и др.
ПРИМЕНЕНИЕ ПАРАКРИННЫХ ФАКТОРОВ МЕЗЕНХИМАЛЬНЫХ СТВОЛОВЫХ КЛЕТОК В ПОСЛЕОПЕРАЦИОННОМ ПЕРИОДЕ КЕРАТОПЛАСТИКА ВЫСОКОГО РИСКА В ЭКСПЕРИМЕНТЕ
Исследование выполнено за счет гранта Российского научного фонда № 23-25-10091, https://rscf.ru/project/ 23-25-10091/.
Авторы заявляют об отсутствии конфликта интересов (The authors declare no conflict of interest).
Список литературы Применение паракринных факторов мезенхимальных стволовых клеток в послеоперационном периоде кератопластика высокого риска в эксперименте
- Пятышина О.В., Шалаева Е.Ю., Костив В.Я. Частота и исходы ожоговой травмы органа зрения // Современные технологии в офтальмологии. — 2022. — Т. 2. — № 42. — С. 254-259. [Pyatyshina OV, Shalaeva EYu, Kostiv VYa. Frequency and outcomes of burn injury to the organ of vision. Modern technologies in ophthalmology. 2022; 2(42): 254-259 (In Russ).]
- Inoue K, Amano S, Oshika T, Tsuru T. Risk factors for corneal graft failure and rejection in penetrating keratoplasty. Acta Ophthalmol Scand. 2001; 79(3): 251-255. doi: 10.1034/j.1600-0420.2001.790308.x. PMID: 11401633.
- Ситник Г.В. Особенности фармакотерапии после фемтокератопластики у больных с кератоконусом // Современные технологии в офтальмологии. — 2014.—Т.4.—С.65 [Sitnik GV. Features of pharmacotherapy after femtokeratoplasty in patients with keratoconus. Modern technologies in ophthalmology. 2014; 4: 65 (In Russ).]
- Niederkorn JY. Corneal transplantation and immune privilege. Int Rev Immunol. 2013; 32(1): 57-67. doi: 10.3109/08830185.2012.737877. PMID: 23360158; PMCID: PMC3885418.
- Chang JH, Gabison EE, Kato T, Azar DT. Corneal neovascularization. Curr Opin Ophthalmol. 2001; 12(4): 242-249. doi: 10.1097/00055735-200108000-00002. PMID: 11507336.
- Le Blanc K, Tammik C, Rosendahl K, et al. HLA expression and immunologic properties of differentiated and undifferentiated mesenchymal stem cells. Exp Hematol. 2003; 31(10): 890-896. doi: 10.1016/s0301-472x(03) 00110-3. PMID: 14550804.
- Ryan JM, Barry FP, Murphy JM, Mahon BP. Mesenchymal stem cells avoid allogeneic rejection. J Inflamm (Lond). 2005; 26(2): 8. doi: 10.1186/147 6-9255-2-8. PMID: 16045800; PMCID: PMC1215510.
- Yao L, Bai H. Review: mesenchymal stem cells and corneal reconstruction. Mol Vis. 2013; 7(19): 2237-2243. PMID: 24227919; PMCID: PMC3820430.
- Ma Y, Xu Y, Xiao Z, et al. Reconstruction of chemically burned rat corneal surface by bone marrow-derived human mesenchymal stem cells. Stem Cells. 2006; 24(2): 315-321. doi: 10.1634/stemcells.2005-0046. Epub 2005 Aug 18. PMID: 16109757.
- Терещенко А.В., Темнов А.А., Кодунов А.М., Трифаненкова И.Г. Профилактика и лечение постожоговой неоваскуляризации роговицы у животных в эксперименте [доступ от 2022]. Доступ по ссылке https://eyepress.ru/article.aspx?55874 [Tereshchenko AV, Temnov AA, Kodunov AM, Trifanenkova IG. Prevention and treatment of post-burn corneal neovascularization in animals in experiment [accessed 2022]. Access via the link https://eyepress.ru/article.aspx?55874 (In Russ).]
- Кодунов А.М., Терещенко А.В., Трифаненкова И.Г., и др. Влияние раствора пептидов на процессы ангиогенеза роговицы крыс в эксперименте // Саратовский научно-медицинский журнал. — 2021. — №2. — С. 314-318. [Kodunov AM, Tereshchenko AV, Trifanenkova IG, et al. The influence of a peptide solution on the processes of angiogenesis of the cornea of rats in an experiment. Saratov Journal of Medical Scientific Research. 2021; 2: 314-318. (In Russ).]
- Кодунов А.М., Темнов А.А., Терещенко А.В., и др. Механизмы влияния кондиционированной среды культивированных стволовых клеток на развитие патологического ангиогенеза роговицы глаза в эксперименте // Патогенез. — 2022. — Т.19. — № 4. — С. 41-52. https://doi.org/https://doi.org/10.25557/ 2310-0435.2021.04.41-52. [Kodunov A.M., Temnov A.A., Tereshchenko A.V., et al. Mechanisms of influence of the conditioned medium of cultured stem cells on the development of pathological angiogenesis of the cornea in an experiment // Pathogenesis. 2022; 19(4): 41-52. (In Russ).]
- Niederkorn JY. High-risk corneal allografts and why they lose their immune privilege. Curr Opin Allergy Clin Immunol. 2010; 10: 493–497. doi: 10.1097/ACI.0b013e32833dfa11.
- Chang JH, Garg NK, Lunde E, et al. Corneal neovascularization: an anti-VEGF therapy review. Surv Ophthalmol. 2012; 57: 415–429. doi: 10.1016/j.survophthal.2012.01.007.
- Cursiefen C, Chen L, Borges LP, et al. VEGF-A stimulates lymphangiogenesis and hemangiogenesis in inflammatory neovascularization via macrophage recruitment. J Clin Invest. 2004; 113: 1040–1050. doi: 10.1172/JCI20465.
- Cursiefen C, Chen L, Dana MR, Streilein JW. Corneal lymphangiogenesis: evidence, mechanisms, and implications for corneal transplant immunology. Cornea. 2003; 22: 273–281. doi: 10.1097/00003226-200304000-00021.
- Oh JY, Ko JH, Kim MK, et al. Effects of mesenchymal stem/stromal cells on cultures of corneal epithelial progenitor cells with ethanol injury. Invest Ophthalmol Vis Sci. 2014; 55: 7628–7635. doi: 10.1167/iovs.14-15424.


