Применение ПЦР-метода для маркирования сельскохозяйственных растений
Автор: Павловская Н.Е., Гагарина И.Н., Прудникова Е.Г.
Журнал: Вестник аграрной науки @vestnikogau
Рубрика: Биоресурсы и их использование в селекции и семеноводстве
Статья в выпуске: 3 (18), 2009 года.
Бесплатный доступ
В результате ПЦР анализа образцов фасоли установлены межсортовые различия по всем образцам фасоли при использовании праймеров Bare. При анализе образцов пшеницы установлены межвидовые различия по всем сортам пшеницы при использовании праймера Paw S6. Результаты изучения продуктов амплификации и полиморфизма могут быть использованы для идентификации и классификации указанных образцов методом ПЦР анализа.
Пцр анализ, фасоль, пшеница, амплификация, полиморфизм
Короткий адрес: https://sciup.org/147123401
IDR: 147123401 | УДК: 338.439:633.1:631.563(470.319)
Текст научной статьи Применение ПЦР-метода для маркирования сельскохозяйственных растений
Специфическое взаимодействие белков по принципу узнавания ими определенных участков в нуклеотидных последовательностях ДНК играет исключительно важную роль в генетической регуляции генома путем непосредственного блокирования и деблокирования его отдельных областей и локусов или через соответствующие структурные переходы в хромосомах [6].
Принципы и методы маркирования генетических систем организма по ДНК основаны на использовании самого высокоспецифичного ингредиента клетки , стоящего на вершине иерархии систем генетической информации . В то же время следует иметь в виду , что ДНК с ее биологической специфичностью формируется при непосредственном участии большого числа ферментов и других белковых факторов , многие из которых , кроме функциональной специфичности , наделены также видовой , сортовой и индивидуальной специфичностью . Можно себе представить , что ДНК с ее биологической и генетической специфичностью создается всей участвующей в репликации совокупностью множества белков . Последние разными путями механизма биосинтеза несут в формирующиеся дочерние нити ДНК информацию наследственных свойств , присущих данному виду , сорту и т . д . Ведущую роль белковым системам придается не только в репликации ДНК , но и в эволюции генома . Стабильность геному и медленному ходу его эволюции придает полуконсервативный матричный синтез [4, 6].
Белковые факторы репликации ДНК , возможно , являются основными агентами , доставляющими информацию на генетические сдвиги в онтогенезе и эволюции .
Главные по функциональному значению элементы генома представлены генами , кодирующими белки и все типы молекул РНК , участвующие в белковом синтезе . Суммарная длина их , выраженная числом пар нуклеотидов ( п . н .), составляет у высших растений , как и у млекопитающих , всего лишь 3…5 % протяженности всего генома . Остальная часть его представлена разными служебными и вспомогательными нуклеотидными последовательностями : ДНК - интронами в структурах самих генов , промоторами в начале считывания , то есть транскрибирования генов РНК - полимеразами , а также другими некодирующими межгенными участками , выполняющими регуляторные функции или имеющими интегрирующее значение для отдельных хромосом или всего генома [7].
Некодирующая часть геномной ДНК , часто используемая в маркировании , в основном организована в виде повторяющихся нуклеотидных последовательностей ( повторов ). Они могут быть рассыпаны по гену или собраны в связанные между собой последовательности , образуя тандемные повторы , с разным числом сцепленных друг с другом нуклеотидных пар [4, 6].
Повторяющиеся последовательности могут составлять у растений до 80% и более тотальной ДНК . Подавляющая часть тандемных повторов генома , однако , состоит из некодирующихся последовательностей ДНК . Из повторяющихся последовательностей состоят также прицентромерные участки ДНК хромосом [11].
Анализ ДНК , который напрямую характеризует геном , а не его фенотипические проявления , может дать устойчивые характеристики растения ( дескрипторы ), нейтральные по отношению к среде обитания и практически пригодные для идентификации и различения генотипов , регистрации сортов и маркирования хозяйственно ценных генов и признаков .
Совершенно иная ситуация возникла с открытием полиморфизма длины растительных фрагментов ДНК, а также с разработкой методов полимеразной цепной реакции, анализа маркеров случайным образом амплифицированной полиморфной ДНК. Эти подходы позволяют маркировать практически любой участок хромосомы и затем путем анализа последующих поколений установить их сопряженность с количественными и качественными признаками. Более того, появилась возможность быстро картировать гены, несущие определенные хозяйственные признаки, и затем их клонировать и перемещать в другие геномы с целью улучшения существующих сортов гибридов. Все эти методы широко используются в генетике человека, но в последние годы их применяют в решении задач генетики и селекции растений [4].
Существенно ускоряет и упрощает задачу выявления молекулярных маркеров использование методов , основанных на полимеразной цепной реакции ( ПЦР ). Широкое применение нашли варианты амплификации ДНК с произвольными праймерами . С их помощью можно быстро обнаружить вариабельность большого числа локусов по всему геному [1, 3, 10].
ДНК анализ с применением праймеров Paw5 и Paw8 позволили различить рожь , пшеницу и пырей (2). Причем различия между сортами пшеницы не обнаружены . Это объясняется их близкородственным происхождением . Наряду с этим проводится анализ ДНК - маркера , специфичного для G- генома пшеницы [8].
Широко применяются ДНК маркеры в селекции картофеля , в частности используется ДНК - маркер гена устойчивости к раку картофеля [2,3]. С использованием ДНК - маркеров проводится оценка устойчивости корейских сортов сои к соевой нематоде [10].
В исследованиях В . В . Соболева (2004) с успехом применяется метод ПЦР для генетического маркирования ремонтантной малины .
Исследованиями ряда авторов показана возможность использования ДНК - маркеров при анализе встречаемости компонентов RAPD- спектров у изучаемых сортов пшеницы и ячменя , различных мелкосеменных видов и подвидов просовидных культур [5].
Представительность стержнев o й коллекции фасоли (Phaseolus vulgaris) в генбанке CIAT (n = 23000) была испытана с использованием белковых и нескольких ДНК методов . Стержневую коллекцию фасоли перуанского происхождения сравнивали с образцами резервной коллекции . При этом , по данным полиморфизма белков , в 100 образцах стержневой коллекции обнаружено 95,7 % разнообразия , идентифицированного по спектрам полиморфных белков 382 образцов резервной коллекции . RAPD- анализ также подтвердил корректность формирования стержневой коллекции из 90 образцов для фасоли перуанского происхождения .
Достижения в молекулярной биологии , в частности , развитие таких технологий , как полимеразная цепная реакция ( ПЦР ) – амплификация ДНК , сиквенс ДНК – определение последовательности ДНК , современные методы анализа и обработки данных значительно повысили возможности молекулярных технологий в скрининге и оценке генетического разнообразия [7].
В настоящее время существует много современных подходов ( технологий ) выявления полиморфизма на уровне ДНК , среди которых можно выделить следующие : анализ полиморфизма длины рестриктных фрагментов ДНК ; « целенаправленная » ПЦР ; ДНК – сиквенс .
Метод ПЦР предполагает использование специфических праймеров и получение дискретных ДНК – продуктов . Большое число родственных технологий построено на этом принципе . Полиморфизм определяется как присутствие – отсутствие в электрофоретических спектрах специфических фрагментов ДНК , обусловленных различиями последовательностей ДНК в местах посадки праймеров . Подход методически относительно прост и может применяться для изучения разнообразия на внутривидовом уровне , включая популяционные исследования . Только анализ ДНК , который напрямую характеризует геном , а не его фенотипические проявления , может дать устойчивые характеристики растения , нейтральные по отношению к среде обитания и практически пригодны для идентификации и различения генотипов , регистрации сортов и маркирования хозяйственно ценных генов и признаков [2].
В связи с вышеизложенным , целью представленной работы является выявление полиморфизма образцов фасоли и пшеницы на различных праймерах . Изучали полиморфизм образцов фасоли и пшеницы . Для амплификации геномной ДНК использовали праймеры : Bare, Paw S5, Paw S6, Paw S11, Paw S16, P21, P27, P54, P191, P196, P198, P200. Праймеры применяли в различной комбинации попарно и по одному . В результате ПЦР анализа образцов фасоли установлены межсортовые различия при использовании праймеров Bare. В результате ПЦР анализа образцов пшеницы установлены межвидовые различия по всем сортам пшеницы при использовании праймера Paw S6.
М атериал и методы
С целью изучения полиморфизма в работе анализировались образцы фасоли (15 сортов ) и пшеницы (13 сортов ) из коллекции ВИР , селекции Всероссийского научно - исследовательского института зернобобовых и крупяных культур РАСХН ( Орел ) и Института биохимической физики им . Н . М . Эмануэля РАН ( Москва ), отличающиеся морфобиологическими и биохимическими особенностями . Выделение ДНК проводили из молодых листьев с помощью набора реагентов DIAtomTMTMA Prep 100.
Для амплификации геномной ДНК использовали праймеры : Bare, Paw S5, Paw S6, Paw S11, Paw S16, P21, P27, P54, P191, P196, P198, P200. Праймеры применяли в различной комбинации попарно и по одному . ПЦР проводили в амплификаторе производства « БиоКом » с помощью сухого набора реагентов для ПЦР амплификации GenePak Universal. Амплификация включала 1 цикл продолжительностью 2 мин денатурации при +94° С , 30 циклов (1 мин денатурации цепей ДНК при +94° С , 40 с отжима праймеров с матрицей при +50° С , 100 с синтеза комплементарных цепей ДНК при +72° С ) и завершающего синтеза в течение 7 мин при +72° С . Для разделения продуктов амплификации использовали электрофорез в 1,5%- ном агарозном геле .
Результаты
В результате ПЦР анализа образцов фасоли установлены межсортовые различия по всем образцам фасоли при использовании праймеров Bare.
Выявлено , что образцы фасоли имеют основные фрагменты , которые находятся в зоне работы маркера от 600 до 1000 п . н . Для большинства исследованных образцов характерно наличие фрагмента в зоне около 34
600 п . н . у трех образцов : Л 179, Шоколадница , К 15196 таких фрагментов нет ( рисунок 1). Вторым характерным моментом является наличие фрагмента в зоне около 450550 п . н . Во всех образцах имеются фрагменты около 150 н . п . Таким образом , методом Полимеразной цепной реакции установлены фрагменты продукта амплификации ДНК , соответствующие 600, 450 – 550 и 250 п . н ., характерные для всех сортов фасоли , а в зоне от 100 до 550 п . н . обнаружены фрагменты ДНК , дающие возможность выявлять межсортовой полиморфизм по ДНК – маркерам .
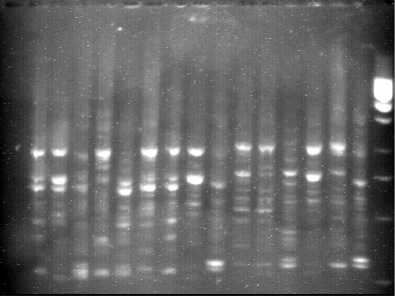
1000 п . н .
500 п . н .
400 п . н .
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17
Рисунок 1 – Продукты амплификации ДНК образцов фасоли с праймером Bare (1- Контроль , 2- Оран , 3- Рубин , 4- Л 543/84, 5- Ока , 6- Неруса , 7- Л 202, 8- Л 714, 9- Л 179, 10- Шоколадница , 11- К 15038, 12- К 15077, 13- К 13627, 14- К 15196, 15- К 15127, 16- Бельская , 17- Маркер )
В результате ПЦР анализа образцов пшеницы установлены межвидовые различия по всем сортам пшеницы при использовании праймера Paw S6.
Выявлено , что сорта пшеницы имеют основные фрагменты , которые находятся в зоне работы маркера от 100 до 800 п . н . ( рисунок 2).
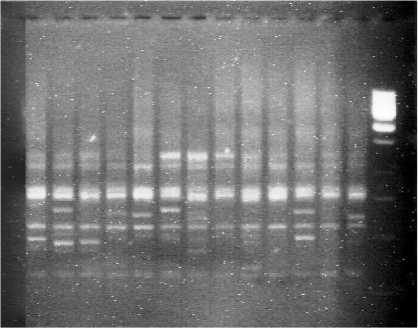
1000 п . н .
900 п . н .
800 п . н .
700 п . н .
500 п . н .
400 п . н .
100 п . н .
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
Рисунок 2 – Продукты амплификации ДНК сортов пшеницы с праймером Paw S6 (1- Контроль , 2- Ритза , 3- Беседа , 4- Ботовская 1, 5- Сибирская нива , 6- Имени Рапопорта , 7- Белая , 8- Волжанка Елена , 9- Булава , 10- Московская 39, 11- Бешкиль 500, 12- Мироновская 808, 13- Крестьянка , 14- Труженица , 15- Маркер )
У всех сортов пшеницы имеются фрагменты около 500-700 п.н. Для большинства исследованных сортов пшеницы характерно наличие фрагмента в зоне 750 п.н., у четырех сортов: Сибирская нива, Имени Рапопорта, Бешкиль 500, Мироновская 808 таких фрагментов нет. Вторым характерным моментом является наличие фрагмента в зоне около 450-500 п.н. у сортов пшеницы Беседа, Сибирская нива, Имени Рапопорта, Белая, Мироновская 808, Труженица. Фрагмент в зоне около 250-400 п.н. только у сортов Ритза, Беседа, Ботовская 1, Волжанка Елена, Мироновская 808, Московская 39. Таким образом, методом Полимеразной цепной реакции установлены фрагменты продукта амплификации ДНК, соответствующие 500-700, 200 п.н., характерные для всех сортов пшеницы, а в зоне 750, 250 - 450 п.н. обнаружены фрагменты ДНК, дающие возможность выявлять межсортовой полиморфизм по ДНК-маркерам.
При использовании других праймеров не удалось обнаружить существенных различий межу образцами фасоли и пшеницы .
Таким образом , данные , полученные в результате изучения продуктов амплификации и полиморфизма , могут быть использованы для идентификации и классификации указанных образцов методом ПЦР анализа .
Список литературы Применение ПЦР-метода для маркирования сельскохозяйственных растений
- Гостимский, С.А. Изучение организации и изменчивости генома растений с помощью молекулярных маркеров/С.А. Гостимский, З.Г. Кокаева, Ф.А.Коновалов//Генетика. -2005. -Т. 41. -№ 4. -С.480-492.
- Зайцев, В.С. ДНК-маркеры гена устойчивости к раку картофеля/В.С.Зайцев, Э.Е.Хавкин//Актуальные проблемы генетики. -М., 2003.-Т. 2.-С.127-128.
- Конарев, А.В. Использование молекулярных маркеров в работе с генетическими ресурсами растений/А.В. Конарев//Сельскохозяйственная биология. -1998. -№ 5, с.36-42.
- Конарев, А.В. Белки семян как маркеры/А.В. Конарев//Вестник семеноводства в СНГ. -2000. -№ 2. -С.24-25.
- Савельев, Н.И. Применение ДНК-маркеров для оценки генетического полиморфизма яблони/Н.И.Савельев, Д.Б.Дорохов; Рос. акад. с.-х. наук. -Мичуринск -Наукоград. -Изд-во ГНУ ВНИИГ и СПР им. И.В. Мичурина, 2004. -111 с.
- Созинов, А.А. Генетические маркеры у растений/А.А.Созинов//Цитология и генетика. -1993. -Т. 27, № 5. -С.15-23.
- Стрельченко, П.П. Молекулярные маркеры в изучении генофонда растений/П.П.Стрельченко, Л.А.Малышев//Генетические ресурсы культурных растений: международная науч.-практ. конф.: тез. докл. -СПб., 2001. -С.169-171.
- Щербань, А.Б. Анализ ДНК-маркера, специфичного для G-генома пшеницы/А.Б.Щербань, Е.К. Хлесткина, Е.А. Салина//Генетика. -2004. -Т. 40, № 3. -С.372-379.
- Bonierable, M. Molecular genetic techniques in relation to sampling strategies and the development of core collections/M. Bonierable, S. Beebs, J.e.a. Tohme//Molecular genetic techniques for plant genetic resources: Report of an IPGRI Worhshop, october 1995. Rome, Italy, 1997. -P.98-102.
- Poulsen, G.B. Oligonucleotide fingerprinting of resynthesized Brassica napus/G.B. Poulsen, G. Kahl, K. Wesing//Eupytica.-1993.-V.70,№ ½.-P.53-59.
- Weising, K. Foreign genes in plants transfer, structure, expression, and applications/K. Welsing, J. Schell, G. Kahl//Ann Pev. Genet. Palo Alto, Galif, 1988. -V.22 -P.421-477.


