Применение прямой мышцы живота в реконструктивно-восстановительной хирургии дефектов грудной стенки
Автор: Медведчиков-ардия М. А., Корымасов Е. А., Бенян А. С.
Журнал: Вестник медицинского института "РЕАВИЗ": реабилитация, врач и здоровье @vestnik-reaviz
Рубрика: Клиническая медицина
Статья в выпуске: 6 т.13, 2023 года.
Бесплатный доступ
Введение. При реконструкции дефектов грудной стенки при инфекционно-воспалительных её заболеваниях предпочтительными являются аутологичные пластические ткани (мышцы и большой сальник). Протяжённые и глубокие дефекты могут быть устранены лоскутами прямой мышцы живота.Цель исследования: оценка эффективности различных вариантов применения лоскутов прямой мышцы живота в пластике дефектов грудной стенки инфекционно-воспалительного генеза.Объект и методы. Проведён ретроспективный анализ результатов лечения 34 пациентов с остеомиелитом грудины и рёбер различной этиологии за период с 1 января 2012 г. по 30 мая 2023 г. У 32 пациентов основным диагнозом был постстернотомный медиастинит, у 2 пациенток был постлучевой остеомиелит грудины и рёбер после комбинированного лечения рака молочной железы. Большинству пациентов (n = 29) был применён двухэтапный подход в лечении с применением вакуум-терапии на этапе купирования острого воспаления. Всем пациентам выполнена пластика лоскутом прямой мышцы живота. Изучены варианты оперативного вмешательства и исход лечения.Результаты. Площадь устраняемого дефекта у пациентов была от 50 до 270 см2 (в среднем 143,1 ± 15,3 см2). Интраоперационных осложнений у пациентов не было. Послеоперационный период осложнился различными раневыми осложнениями у 9 пациентов. У 3 пациентов с пластикой полнослойным лоскутом ПМЖ был выявлен краевой некроз кожной части трансплантата. У 3 пациентов, несмотря на дренирование раны, выявлены послеоперационные серомы. Повторные операции выполнены у 2 пациентов: в одном случае остановка кровотечения из вены полнослойного лоскута, в другом - выявлен частичный некроз полнослойного лоскута, что потребовало выполнения повторной операции и ревизии лоскута. У 1 пациента через 3-е суток после операции опорожнена гематома. Средний срок стационарного лечения пациентов был 19,3 ± 2,8 суток (диапазон от 17 до 38 суток). Летальных исходов у пациентов с мышечной пластикой лоскутом прямой мышцы живота не было. У 1 пациентки в области передней брюшной стенки сформировалась послеоперационная грыжа. Рецидив остеомиелита рёбер диагностирован у 1 человека через 16 месяцев после операции.Выводы. Прямая мышца живота в качестве изолированного и полнослойного лоскута является оптимальным пластическим материалом для устранения дефектов как нижней части грудины, так и обширных дефектов передней и боковой поверхностей грудной стенки.
Остеомиелит грудины, остеомиелит ребер, пластика грудной стенки, мышечные лоскуты, прямая мышца живота
Короткий адрес: https://sciup.org/143181107
IDR: 143181107 | УДК: 616-089.87 | DOI: 10.20340/vmi-rvz.2023.6.CLIN.5
Текст научной статьи Применение прямой мышцы живота в реконструктивно-восстановительной хирургии дефектов грудной стенки
ОРИГИНАЛЬНАЯ СТАТЬЯ ORIGINAL ARTICLE УДК 616-089.87
Competing interests. The authors declare no competing interests.
Funding. This research received no external funding.
Compliance with ethical principles. The authors confirm that they respect the rights of the people participated in the study, including obtaining informed consent when it is necessary.
Cite as: Medvedchikov-Ardiya M.A., Korymasov E.A., Benyan A.S. Application of the rectus abdominal muscle in reconstructive and recovery surgery of chest wall defects. Bulletin of the Medical Institute “REAVIZ”. Rehabilitation, Doctor and Health. 2023;13(6).
Актуальность
Хирургическое лечение инфекционно-воспалительных заболеваний грудной стенки (флегмоны и абсцессы мягких тканей, остеомиелит грудины, рёбер и грудинноключичных сочленений) традиционно заключается в двух этапах: 1-й этап – вскрытие гнойника, дебридмент и дренирование гнойной полости до полного купирования воспаления; 2-й этап – ликвидация остаточной полости и дефекта передней грудной стенки. Безусловное предпочтение при реализации 2-го этапа имеют аутологичные ткани [1]. Выбор того или иного способа пластики зависит от локализации, протяжённости и площади дефекта [2]. Использование больших грудных мышц в этом плане связано с их хорошим кровоснабжением из нескольких артерий, относительно малотравматичной мобилизацией в пределах только одной грудной стенки. Применение прямой мышцы живота с этой точки зрения пока не находит рационального конформизма, вызывает дискуссию относительно травматичности и проблем с кровоснабжением лоскута при его перемещении в другую часть тела. Имеющиеся публикации свидетельствуют об эффективности прямой мышцы живота в ряде клинических ситуаций и побуждают к накоплению коллективного опыта [3–5].
Цель исследования: оценка эффективности различных вариантов применения лоскутов прямой мышцы живота в пластике дефектов грудной стенки инфекционно-воспалительного генеза.
Материал и методы
Проведён ретроспективный анализ результатов лечения 34 пациентов с остеомиелитом грудины и рёбер различной этиологии за период с 1 января 2012 г. по 30 мая 2023 г., оперированных в хирургическом торакальном отделении ГБУЗ «Самарская областная клиническая больница им. В.Д. Середавина» и гнойном хирургическом отделении ГБУЗ «Самарская городская клиническая больница № 1 им. Н.И. Пирогова». Всем пациентам выполнялась мышечная пластика дефекта грудной стенки лоскутом прямой мышцы живота. Мужчин было 21, женщин – 13. Средний возраст пациентов 60,5 ± 4,2 года (от 58 до 77 лет).
Предоперационное обследование во всех случаях включало компьютерную томографию (КТ) с 3D моделированием. Основной патологией у 32 пациентов был пост-стернотомный медиастинит (ПСМ) – глубокая стернальная инфекция с поражением переднего средостения, грудины и хрящей рёбер, развившаяся после стернотомии в кардиохирургическом стационаре (табл . 1). У 2 пациенток был постлучевой остеомиелит грудины и ребер после комбинированного лечения рака молочной железы.
Таблица 1. Распределение пациентов с ПСМ по типам согласно классификации Oackley-Wright (1996)
Table 1. Distribution of patients with oststernotomic mediastinitis by type according to the classification of Oackley-Wright (1996)
|
Тип ПСМ |
Количество пациентов (%) |
|
I |
2 (5,9) |
|
II |
6 (17,6) |
|
IIIa |
14 (41,2) |
|
IIIb |
6 (17,6) |
|
IVa |
1 (2,9) |
|
IVb |
2 (5,9) |
|
V |
3 (8,9) |
|
всего |
34 (100) |
Фоновыми заболеваниями у пациентов с ПСМ были: сахарный диабет – у 15 пациентов, хроническая обструктивная болезнь лёгких – у 3 пациентов, ожирение – у 10 пациентов. Объём оперативного вмешательства у пациентов в кардиохирургическом стационаре был различным: аортокоронарное шунтирование (АКШ) выполнено у 12 пациентов, сочетание АКШ и маммарно-коронарного шунтирования (МКШ) – у 18 пациентов, протезирование клапанов сердца и дуги аорты – у 4 пациентов. У 3 пациентов до поступления в стационар были одна или несколько попыток лечения ПСМ.
Хирургический подход в лечении у 3 пациентов с ПСМ V типа и у 2 пациенток с постлучевым остеомиелитом грудины был одноэтапный. После резекции грудины и рёбер им выполнена пластика дефекта грудной стенки.
Основными показаниями к одноэтапному лечению были хронический остеомиелит (длительность существования свища грудной стенки более 6 недель), отсутствие проявлений системной воспалительной реакции, уровень патогенной микрофлоры не более 103 КОЕ/г.
Двухэтапный подход в лечении был применён у 29 пациентов. На первом этапе дебридмент раны сочетали с ва-куум-ассистированными повязками: у 8 пациентов выполнена одна замена повязки, у 14 пациентов – две замены, у 7 пациентов – три замены повязки. Режим вакуумного воздействия в первые 2-е суток был постоянный на уровне –125 мм рт. ст., затем в переменном режиме –130 и –90 мм рт. ст. с интервалом по 3 минуты. Пластику предпринимали после очищения раны и достижения уровня микробного числа 102–103 КОЕ/г. У 8 пациентов контрольный посев перед операцией был стерильный. Средний срок до начала второго этапа составил 12 ± 4,2 дня (от 5 до 13 дней).
Всем 34 пациентам на реконструктивно-восстановительном этапе была выполнена пластика различными вариантами прямой мышцы живота (ПМЖ). В зависимости от локализации дефекта применены либо изолированные, либо полнослойные лоскуты (рис. 1). Источником артериального кровоснабжения всех лоскутов была верхняя надчревная артерия. Гемодинамические показатели её оценивали до операции, в первые сутки после операции и через 1 месяц после выписки из стационара. У 15 пациентов проводили интраоперационную ультразвуковую допплерографию (УЗДГ) верхней надчревной артерии. Интраоперационно же пациентам определяли площадь раны планиметрическим методом с помощью прозрачной масштабной пленки.
Изолированная пластика ПМЖ была показана пациентам либо с дефектами нижней части тела грудины, либо при субтотальной её резекции (с оставлением рукоятки), либо после стернумэктомии. Важным условием для выполнения данного вида пластики было отсутствие дефицита кожных краёв для ушивания раны без натяжения. Во время операции выполняли мобилизацию лоскута ПМЖ необходимой длины от переднего и заднего листков её влагалища, визуализировали кровоснабжающую артерию и перемещали лоскут в дефект грудной стенки (рис. 2). Данный способ устранения дефекта передней грудной стенки лоскутом прямой мышцы живота применён у 5 пациентов (патент на изобретение № 2715990 от 04 марта 2020 г.).
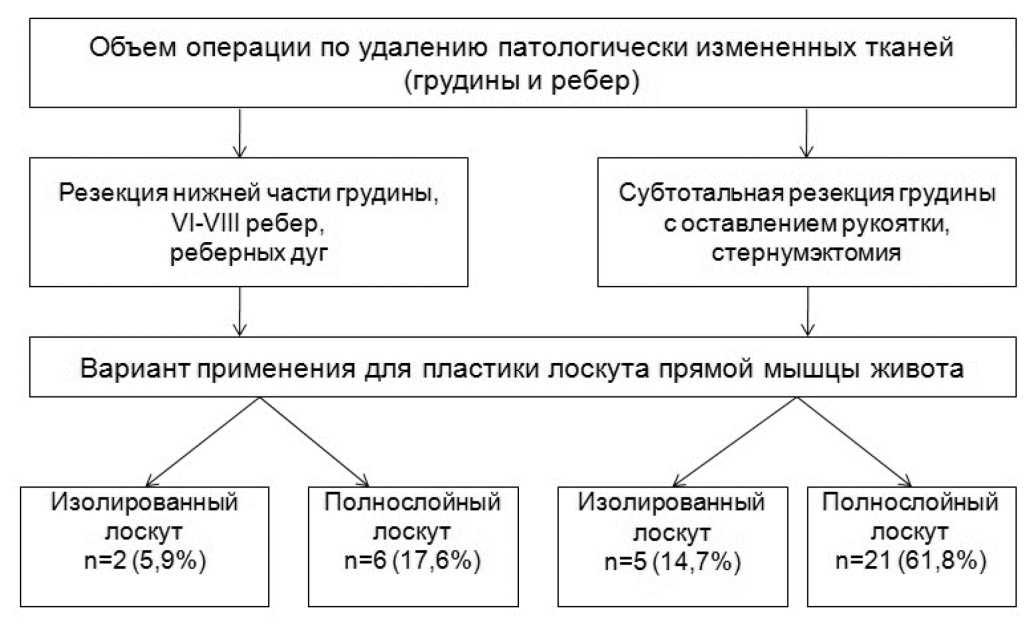
Рисунок 1. Варианты использования пластики прямой мышцы живота в зависимости от локализации дефекта грудной стенки и объема удаленных тканей
Picture 1. Options for the use of plasty of the rectus abdominis muscle depending on the localization of the chest wall defect and the volume of removed tissues
У 27 пациентов после дебридмента раны в силу большого дефекта не было возможности сшить края кожной раны без риска её ишемии. Им выполнена пластика полнослойным кожно-подкожно-фасциально-мышечным лоскутом (рис. 3) (патент на изобретение № 2765632 от 01 февраля 2022 г). Формирование полнослойного лоскута начинали с рассечения кожи и подкожной жировой клетчатки по средней линии до апоневроза на 10 см ниже пупка, а также в проекции латерального края правой ПМЖ. После пересечения и перевязки нижней надчревной артерии и вены и всех перфорантных сосудов к заднему листку влагалища ПМЖ, сформированный полнослойный кожно-подкожно-фасциально-мышечный лоскут перемещался в дефект грудной стенки. Края апоневроза в нижней части живота сшивались между собой отдельными швами 3-0 нерассасывающейся нитью. Таким образом оперировано 10 пациентов. У 17 пациентов в дефект апоневроза передней брюшной стенки устанавливался сетчатый полипропиленвый имплант. Длина полнослойного лоскута составляла от 15 до 22 см, а ширина – от 8 до 12 см.
В послеоперационном периоде пациенты получали антикоагулянтную и антиагрегантную терапию, проводилась гипербарическая оксигенация.
Результаты
Площадь устраняемого дефекта у пациентов была от 50 до 270 см2 (в среднем 143,1 ± 15,3 см2). Интраоперационных осложнений у пациентов не было.
Послеоперационный период осложнился различными раневыми осложнениями у 9 пациентов. У 3 пациентов с пластикой полнослойным лоскутом ПМЖ был выявлен краевой некроз кожной части трансплантата. Площадь раневого струпа в среднем составляла 14,6 см2. При этом кровоснабжение в верхней надчревной артерии было сохранено на достаточном уровне. До операции показатели кровотока у этих пациентов были: V лин = 53,1 см/с, V об = 7,0 мл/мин; на 1-е сутки после операции – V лин = 53 см/с, V об = 6,2 мл/мин. Ультразвуковое исследование области операции не выявило жидкостных скоплений под трансплантатом. Проявлений системной воспалительной реакции не отмечено. Раневой струп был удалён на 3-й неделе после операции.
У 3 пациентов, несмотря на дренирование раны, выявлены послеоперационные серомы. Средний объём составил 13 см3. Серомы ликвидированы без дополнительной операции.
У 1 пациента на 4-е сутки после операции возникло венозное кровотечение; объём кровопотери по дренажу составил 80 мл. Во время повторной операции оказалось, что источником кровотечения являлась вена в подкожножировой клетчатке полнослойного лоскута; она была прошита рассасывающейся лигатурой на колющей игле. У 1 пациента через 3-е суток после операции опорожнена гематома до 30 мл в области швов краниальной части лоскута в проекции яремной вырезки.
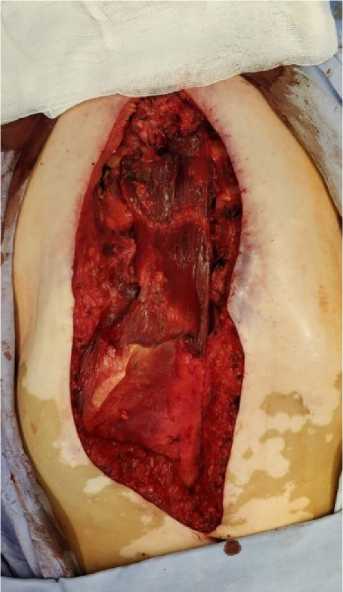
Рисунок 2. Интраоперационное фото. Изолированный лоскут прямой мышцы живота перемещён в дефект грудной стенки
Picture 2. Intraoperative photo. An isolated flap of the rectus abdominis muscle was moved into the defect of the chest wall
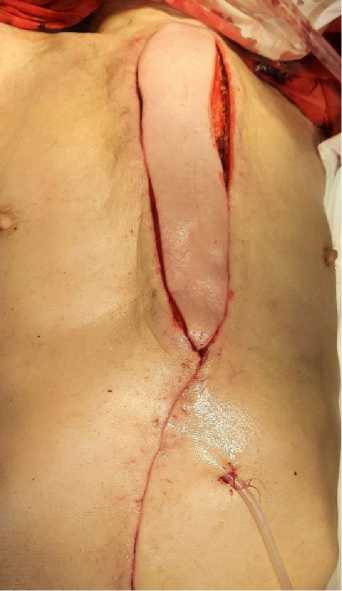
Рисунок 3. Интраоперационное фото. Полнослойный лоскут перемещён в дефект грудной стенки
Picture 3. Intraoperative photo. Full-thickness flap moved into chest wall defect
У 1 пациента на 5-е сутки выявлен частичный некроз полнослойного лоскута, что потребовало выполнения повторной операции и ревизии лоскута. Интраоперационно отмечено сохранение кровоснабжения мышечной части, некроз дистальной части подкожно-жировой клетчатки и кожи. Выполнена некрэктомия нежизнеспособных тканей, установлена вакуум-ассистированная повязка (длительность вакуум-терапии – 10 суток). Срок окончательного заживления раны составил 38 суток.
Средний срок стационарного лечения пациентов был 19,3 ± 2,8 суток (диапазон от 17 до 38 суток). Летальных исходов у пациентов с мышечной пластикой лоскутом ПМЖ не было. УЗДГ не выявило статистически значимых отличий в линейной и объёмной скоростях кровотока в верхней надчревной артерии в 1-е сутки после операции по сравнению с дооперационными показателями. Через 1 месяц данные показатели статистически значимо не отличались от исходных (табл. 2).
Таблица 2. Динамика изменений показателей кровотока в верхней надчревной артерии
Table 2. Dynamics of changes in blood flow in the upper epigastric artery
|
Показатели кровотока в верхней надчревной артерии |
Срок оценки кровотока по верхней надчревной артерии |
||
|
До операции |
Через 1 сутки после операции |
Через 1 месяц после операции |
|
|
Линейная скорость кровотока V лин , см/с |
53,3 ± 2,4 |
50,2 ± 1,6 (t = 1,86; p > 0,2) |
55,1 ± 2,0 (t = –0,99; p > 0,2) |
|
Объёмная скорость кровотока V об , мл/мин |
7,5 ± 0,8 |
6,4 ± 1,2 (t = 1,32; p > 0,2) |
7,6 ± 2,1 (t = –0,07; p > 0,5) |
У всех пациентов с ПСМ полнослойный лоскут в случаях субтотальной резекции грудины и стернумэктомии позволил достичь стабильности грудной клетки без признаков дыхательной недостаточности.
Отдалённые результаты в срок от 6 месяцев до 10 лет изучены у 26 пациентов.
У 24 пациентов отмечен хороший результат: жалоб нет, нарушения каркасности грудной клетки нет, пациенты довольны результатом и качеством жизни.
У 1 пациентки в области передней брюшной стенки сформировалась послеоперационная грыжа, которая в последующем была устранена путём установки полимерно-композитного эндопротеза лапароскопическим доступом. Рецидив остеомиелита рёбер диагностирован у 1 человека через 16 месяцев после операции. Ему выполнена резекция VI и VII рёбер слева и пластика дефекта мобилизованным лоскутом большой грудной мышцы с хорошим результатом.
Обсуждение
Прямая мышца живота относится к мышцам III типа, то есть имеет два равнозначных доминантных артериальных источника кровоснабжения – верхняя и нижняя надчревные артерии [6]. При этом некоторые авторы считают, что доминирующей является все-таки нижняя надчревная артерия. В связи с этим при планировании использования полнослойных лоскутов ПМЖ для устранения дефектов грудной стенки Л.В. Соцкий и др. предлагает выполнять «тренировку» верхней надчревной артерии путём лапароскопического клипирования нижней надчревной артерии за 2 недели до пластической операции [7].
Зная принципы кровоснабжения ПМЖ, в частности, наличие у надчревных артерий перфорантных ветвей, снабжающих артериальной кровью подкожную клетчатку и кожу в проекции ПМЖ, а также наличие густой артериальной сети анастомозов в околопупочной области между двумя артериями, были разработаны технические и оперативные приёмы формирования различных лоскутов ПМЖ, начиная от частичных изолированных и заканчивая протяженными полнослойными [2, 8].
Скрупулезное и аккуратное выделение и формирование полнослойного лоскута на верхней надчревной артерии сохраняет адекватное кровоснабжение всех слоёв лоскута. Проводимое нами интраоперационное ультразвуковое исследование сосудистой ножки подтверждает хороший артериальный кровоток по ней.
Согласно данным литературы, дефекты нижней части грудины, а также рёберных дуг целесообразно устранять изолированными мышечными лоскутами ПМЖ или в комбинации с большой грудной мышцей [9]. В нашем исследовании у 8 пациентов с дефектами нижней части грудины была применена пластика лоскутами ПМЖ, причём в связи с дефицитом кожи в области раны у 6 пациентов был использован полнослойный лоскут с хорошим клиническим исходом.
По нашим данным, ПМЖ у мужчин, в силу физической активности, хорошо развита. У женщин, несколько наоборот, более развит подкожно-жировой слой.
Полнослойные лоскуты ПМЖ позволяют полностью устранить остаточную полость в переднем средостении при ПСМ [1, 4, 5]. Длины и ширины такого лоскута практически всегда достаточно для ликвидации не только глубокой, но и протяжённой раны. В нашем исследовании максимальная длина полнослойного лоскута ПМЖ достигала 22 см, а ширина – 12 см. В случаях, когда даже максимально возможного сформированного полнослойного лоскута недостаточно, чтобы полностью устранить дефект, M.R. Zenn и C. Heitmann предлагают осуществлять пересечение рёберной дуги и выделение внутренней грудной артерии на протяжении, что позволяет увеличить дугу разворота лоскута и удлинить расстояние его перемещения [10].
В литературе до сих пор нет единого алгоритма пластической реконструкции дефектов грудной стенки после резекции грудины и рёбер. Ряд авторов отдают предпочтение применению большого сальника в лечении ПСМ и постлучевого остеомиелита грудины и рёбер, делая акцент на его мобильность, объёмность и иммунологические свойства [11, 12]. По нашему мнению, большой сальник возможно и даже целесообразно применять в случаях протезной инфекции в средостении после операции на дуге аорты. Однако большой сальник, даже хорошо развитый, не позволяет добиться стабилизации грудной стенки при постстернотомном медиастините, особенно после субтотальной резекции грудины или стернумэкто-мии. В то время как полнослойный лоскут ПМЖ за счёт своего объёма и характера тканей в значительной степени осуществляет эту функцию.
В нашем исследовании представлены пациенты, у которых после кардиохирургических операций была сохранена правая внутренняя грудная артерия. Данное обстоятельство было решающим в выборе способа пластики дефекта грудной стенки, особенно в тех случаях, когда была необходимость применения полнослойного лоскута. В случаях бимаммарного коронарного шунтирования или перенесённых ранее пациентом оперативных вмешательств на грудной или брюшной стенках, когда пересечены или внутренние грудные артерии (ранение, поперечная стернотомия), или верхние надчревные артерии (подреберные доступы в брюшную полость), применение пластики полнослойным лоскутом ПМЖ вряд ли целесообразно, так как отсутствует соответствующее артериальное кровоснабжение, а ПМЖ кровоснабжается при этом только за счёт нижней надчревной артерии. Хотя в литературе есть публикации, в которых описывается возможность сохранения питания по верхней надчревной артерии при маммарно-коронарном шунтировании за счёт мышечно-диафрагмальной и VIII-й межреберной артерии [3].
Краевой некроз кожи трансплантата не считается опасным осложнением, так как не влияет в целом на результат лечения [13]. В нашем исследовании три случая краевого некроза кожи закончились полным выздоровлением пациентов без повторного оперативного вмешательства. Причиной такого состояния следует считать тромбоз дистальных кожный сосудов за счёт снижения скорости кровотока по ним в послеоперационном периоде.
По нашему мнению, в случае формирования полнослойного лоскута ПМЖ нужно стремиться не только сохранить зону сосудистых анастомозов в околопупочной области, но и иметь в составе лоскута ткани, кровоснаб-жающиеся преимущественно ветвями нижней надчревной артерии. Поэтому для того, чтобы получить протяжённый лоскут для замещения всей грудины, дистальная часть лоскута должна быть сформирована ниже пупка не менее, чем на 5–7 см. Наличие в дистальной части хорошо развитых ветвей нижней надчревной артерии будет способство- вать более полному охвату площади ткани и, соответственно, артериальному кровоснабжению, что позволит снизить риск ишемии и краевого некроза.
Все пластические операции, связанные с перемещением несвободных лоскутов, могут сопровождаться развитием сером и гематом. Частота этих осложнений составляет до 26,4 % [14]. В нашем исследовании частота их составила 11,7 %.
Постлучевой остеомиелит грудины и рёбер в комбинированном лечении рака молочной железы является нередким показанием к повторному оперативному вмешательству [1]. У двух наших пациенток после резекции тела грудины и рёбер образовавшиеся дефекты 84 см2 и 110 см2 были устранены полнослойными лоскутами ПМЖ на правой верхней надчревной артерии с хорошим клиническим и косметическим эффектом.
Одной из проблем применения лоскутов с передней брюшной стенки является развитие послеоперационных вентральных грыж. Частота их достигает 16,7 % [15]. В нашем исследовании данное осложнение было у одной пациентки, что составило 3,7 % среди всех пациентов с пластикой полнослойным лоскутом ПМЖ. После факта данного события мы пересмотрели свой подход к способу закрытия раны передней брюшной стенки после забора полнослойного лоскута. С тех пор и по настоящее время всем пациентам мы укрепляем переднюю брюшную стенку путём установки полипропиленового сетчатого импланта в дефект переднего листка влагалища ПМЖ.
Заключение
Прямая мышца живота в качестве изолированного и полнослойного лоскута является оптимальным пластическим материалом для устранения дефектов как нижней части грудины, так и обширных дефектов передней и боковой поверхностей грудной стенки. Хорошее кровоснабжение, существенный объём тканей позволяют использовать её полнослойные лоскуты для замещения большей части грудины, создавая стабилизацию грудной стенки. Знание топографической анатомии передней брюшной стенки, прямой мышцы живота и её сосудистой системы, аккуратное формирование лоскутов, мануальный и инструментальный контроль за сохранением адекватного их кровоснабжения определяют успех хирурга в выполнении реконструктивно-восстановительной операции при дефектах грудной стенки инфекционно-воспалительной природы.
Список литературы Применение прямой мышцы живота в реконструктивно-восстановительной хирургии дефектов грудной стенки
- Malathi L, Das S, Nair JTK, Rajappan A. Chest wall reconstruction: success of a team approach-a 12-year experience from a tertiary care institution. Indian J Thorac Cardiovasc Surg. 2020 Jan;36(1):44-51. https://doi.org/10.1007/s12055-019-00841-y. Epub 2019 Jul 9. PMID: 33061093; PMCID: PMC7525737
- Al-Ebrahim KE. Management of Deep Sternal Wound Infection: Complete Sternal Osteomyelitis. Heart Surg Forum. 2020 May 5;23(3):E281 -E284. https://doi.org/10.1532/hsf.2805. PMID: 32524983
- Netscher DT, Eladoumikdachi F, Goodman CM. Rectus abdominis muscle flaps used successfully for median sternotomy wounds after ipsilateral internal mammary artery ligation. Ann Plast Surg. 2001 Sep;47(3):223-8. https://doi.org/10.1097/00000637-200109000-00001. PMID: 11562023
- Медведчиков-Ардия М.А., Корымасов Е.А., Бенян А.С. Вертикальный лоскут прямой мышцы живота в реконструкции дефекта передней грудной стенки. Новости хирургии. 2022;30(1):112-118. https://doi.org/https://doi.org/ 10.18484/2305-0047.2022.1.112 [Medvedchikov-Ardiia M.A., Korymasov E.A., Benyan A.S. Vertical flap of the rectus abdominis muscle in the reconstruction of an anterior chest wall defect. Novostihirurgii. 2022;30(1):112-118. https://doi.org/https://doi.org/ 10.18484/2305-0047.2022.1.112 (In Russ)].
- Медведчиков-Ардия М.А., Корымасов Е.А., Бенян А.С. Применение кожно-подкожно-фасциально-мышечного лоскута на верхней надчревной артерии для закрытия дефекта передней грудной стенки. Вестник хирургии имени И. И. Грекова. 2022; 181(3):76—80. https://doi.org/10.24884/0042-4625-2022-181-3-76-80 [Medvedchikov-Ardiya M.A., Korymasov E.A., Benyan A.S. Application of a skin-subcutaneous-fascio-muscular flap on the superior epigastric artery to close an anterior chest wall defect. Vestnik hirurgii imeni I.I. Grekova. 2022;181(3):76-80. https://doi.org/10.24884/0042-4625-2022-181-3-76-80 (In Russ)].
- Mathes SJ, Nahai F. Classification of the vascular anatomy of muscles: experimental and clinical correlation. Plast Reconstr Surg. 1981 Feb;67(2):177-87. PMID: 7465666
- Соцкий Л. В., Карташева А. Ф., Матвеев Н. Л. Оценка кровоснабжения TRAM-лоскута при проведении предварительного клипиро-вания глубоких нижних эпигастральных артерий. Вопросы реконструктивной и пластической хирургии. 2014;2(49):39-42. [Sockij L.V., Kartasheva A.F., Matveev N.L. Evaluation of the blood supply of the TRAM flap during preliminary clipping of the deep lower epigastric arteries. Voprosy rekonstruktivnojiplasticheskojhirurgii. 2014;2(49):39-42 (In Russ)].
- Pantelides NM, Young SS, Iyer S. The rectus abdominis muscle advancement flap as a salvage option for chest wall reconstruction. Ann R Coll Surg Engl. 2017 May;99(5):e142-e144. https://doi.org/10.1308/rcsann.2017.0044. PMID: 28462651; PMCID: PMC5449708
- Davison SP, Clemens MW, Armstrong D, Newton ED, Swartz W. Sternotomy wounds: rectus flap versus modified pectoral reconstruction. Plast Reconstr Surg. 2007 Sep 15;120(4):929-934. https://doi.org/10.1097/01.prs.0000253443.09780.0f. PMID: 17805121
- Zenn MR, Heitmann C. Extended TRAM flap: feasibility study on fresh human cadavers. Ann Plast Surg. 2003 Mar;50(3):256-62. https://doi.org/10.1097/01.sap.0000046786.54698.02. PMID: 12800901
- Вишневский А.А., Даньков Д.В., Печетов А.А., Луцай В.И. Оментопластика в хирургической реабилитации больных с хроническим послеоперационным стерномедиастинитом. Анналы пластической, реконструктивной и эстетической хирургии. 2011;1:56-62. [Vishnevskij A.A., Dan'kov D.V., Pechetov A.A., Lucaj V.I. Omentoplasty in the surgical rehabilitation of patients with chronic postoperative sternomediastinitis. Annalyplasticheskoj, rekonstruktivnojiesteticheskojhirurgii. 2011 ;1:56-62. (In Russ)].
- Kreutz-Rodrigues L, Gibreel W, Moran SL, Mardini S, Bite U, Stulak JM, Wigle D, Pochettino A, Bakri K. The Utility of the Omentum Flap for Complex Intrathoracic Problems. Plast Surg (Oakv). 2023 Feb;31(1):17-23. https://doi.org/10.1177/22925503211024745. Epub 2021 Oct 26. PMID: 36755825; PMCID: PMC9900042
- Yu CM, Yu CM, Yao WT, Chen YF, Lee AL, Liu YC, Tu CP, Huang WC, Tung KY, Tsai MF. Efficacy and safety of pectoralis muscle flap combined rectus abdominis muscle sheath fasciocutaneous flap for reconstruction of sternal infection. Int Wound J. 2022 Nov;19(7):1829-1837. https://doi.org/10.1111/iwj.13788. Epub 2022 Mar 15. PMID: 35289489; PMCID: PMC9615267
- Patel AA, Arquette CP, Rowley MA, Borrelli MR, Lee GK, Nazerali RS. Comparing Outcomes of Flap-Based Salvage Reconstructions in the Radiated Breast. Ann Plast Surg. 2021 May 1;86(5S Suppl 3):S403-S408. https://doi.org/10.1097/SAP.0000000000002761. PMID: 33976069
- Kim E, Fernando C, McCombie A, Bailey W, Frizelle F, Glyn T, Porter C, Wakeman C, Creagh T. Abdominal and perineal hernia rates following vertical rectus abdominis myocutaneous (VRAM) flap reconstruction - a supraregional experience. J Plast Reconstr Aesthet Surg. 2022 Mar;75(3):1158-1163. https://doi.org/10.1016Zj.bjps.2021.11.002. Epub 2021 Nov 12. PMID: 34895852


